Introducción
El propofol es un fármaco intravenoso ampliamente usado como sedante y como agente inductor y de mantenimiento anestésico; su mecanismo de acción no ha sido cabalmente descrito, aunque se sabe que actúa sobre el receptor GABAA, como agonista y/o modulador alostérico, interactuando con la actividad corticotalámica, y modificando la actividad electroencefalográfica en diferentes redes neuronales y centros cerebrales, y la actividad cerebral, con la consecuente pérdida de la conciencia1. JB Glen describió los efectos de la molécula en 1980; ese descubrimiento le valió el premio Lasker en 2018, un indicador de la relevancia y actualidad del propofol. Siendo insoluble en agua, se le comercializa en suspensiones al 1 y 2%, con aceite de soya y fosfolípidos de huevo como emulsificantes (al 10 y 1.2%, respectivamente), y glicerol para ajustar la tonicidad. Esos componentes pueden servir como sustrato para el crecimiento de microorganismos2,3, si la suspensión se llegara a contaminar en cualquier momento entre la toma con jeringa desde la ampolleta, hasta la introducción intravenosa al torrente sanguíneo. Si la suspensión contaminada permanece varias horas antes de ser aplicada, los microorganismos se multiplican y, al entrar a la sangre, el inóculo masivo puede causar una grave infección generalizada4. Por esta razón, algunas formulaciones contienen sales de ácido etilendiaminotetraacético (EDTA, 0.005%), un quelante de cationes divalentes que captura, entre otros, los iones de hierro necesarios para la proliferación microbiana; otras formulaciones contienen metabisulfito de sodio o alcohol bencílico, con el mismo propósito5,6.
Hay al menos dos trabajos previos que exploran la eficacia del EDTA como inhibidor del crecimiento de microorganismos en suspensiones de propofol. Uno, realizado en Japón7, compara el crecimiento de cuatro aislamientos clínicos de bacterias Gram-negativas (Pseudomonas aeruginosa, Escherichia coli, Klebsiella pneumoniae y Serratia marcescens, sin mayores detalles de sus características) y dos de Staphylococcus aureus, uno sensible y otro resistente a meticilina. Las enterobacterias y P. aeruginosa crecen abundantemente en la suspensión sin EDTA, y fueron inhibidas en diferente grado por la presencia del quelante (el crecimiento de E. coli y K. pneumoniae resultó abatido, y el de S. marcescens y P. aeruginosa disminuido); los aislamientos de S. aureus crecen menos, y el EDTA abate ese crecimiento. El otro estudio, previo y realizado en México8, se realizó con cepas estandarizadas (de la American Type Culture Collection, ATCC) de las mismas especies bacterianas, excepto S. marcescens, y añadiendo Acinetobacter baumannii, Enterobacter aerogenes y Enterococcus faecalis; y la levadura Candida albicans. Aunque en el texto se describe un efecto inhibitorio similar en la formulación con EDTA, la forma en que los resultados fueron presentados no resulta inteligible. Aquí se reporta un ensayo de crecimiento de microorganismos que aborda algunos aspectos no cubiertos por estudios previos: (a) el crecimiento de aislamientos clínicos multirresistentes, que suponen un mayor riesgo a la salud; (b) la inclusión de otras levaduras (C. krusei, C. glabrata) menos sensibles a fluconazol; (c) la comparación de diferentes formulaciones disponibles comercialmente en México. En términos generales, los microorganismos ensayados crecen menos en la formulación con EDTA, con diferencias menores entre las formulaciones sin EDTA, que sugieren composiciones distintas de los vehículos de la emulsión.
Material y métodos
Propofol. Se ensayaron cuatro marcas de propofol, comercializadas en México: Fresofol (Fresenius Kabi), Recofol (PiSA), Xenoprof (Laboratorios JAYOR) y Siltafel (Vitalis). Las cuatro son emulsiones con 200 mg de propofol en 20 mL de vehículo; todas menos Xenoprof son ampolletas selladas de vidrio (Xenoprof es frasco ámpula); y todas menos Siltafel manifiestan sólo «vehículo cbp», mientras que éste indica que el fármaco está «en suspensión con edetato disódico (dihidratado)». El contenido de las ampolletas se alicuotó en tubos de cultivo estériles desechables (para evitar contaminantes, especialmente iones de hierro, en cristalería reusada), a razón de 2 mL por tubo, en una campana de flujo laminar.
Cepas. Se utilizaron los siguientes organismos de prueba: (a) cepas bacterianas estandarizadas, Escherichia coli ATCC 25922, Staphylococcus aureus ATCC 25923 y Staphylococcus epidermidis ATCC 12228; (b) aislamientos clínicos bacterianos, organismos multirresistentes, previamente incluidos en otros estudios in vitro de resistencia bacteriana9, Pseudomonas aeruginosa, Klebsiella pneumoniae y Acinetobacter baumannii, resistentes a carbapenémicos y otros antibióticos, y S. aureus meticilino-resistente (MRSA); y (c) aislamientos clínicos de levaduras, previamente incluidos en estudios de sensibilidad a antifúngicos10, Candida albicans, C. glabrata y C. krusei. Todas las cepas provienen de un cepario mantenido en crioviales bajo nitrógeno líquido.
Inóculo e incubación. Los tubos con 2 mL de emulsión de propofol fueron inoculados con aproximadamente 10,000 UFC/mL de cada uno de los microorganismos descritos, por separado. El inóculo se preparó centrifugando a 15,000 rpm un cultivo fresco en caldo Mueller-Hinton, y resuspendiendo las células precipitadas en solución salina amortiguada (pH 7.2), para minimizar el arrastre de nutrientes del medio de cultivo. Se incubaron a tres temperaturas: ambiente (de la Ciudad de México en otoño, 20 oC en promedio), 35 y 42 oC, sin agitación.
Conteo de microorganismos. A seis, 12, 24 y 48 horas de incubación (para las levaduras se omitió el muestreo a las 6 h), se tomaron muestras para siembra directa y dilución seriada en solución salina amortiguada. Alícuotas de 10 µL se platearon en agar para cuenta en placa, que se incubaron a 35 oC por 24 h. Los plateos con entre 25 y 250 colonias se consideraron para el conteo. Todos los experimentos se realizaron por triplicado.
Análisis estadístico. Los promedios de las tres determinaciones de cada microorganismo/temperatura/tiempo para la formulación con EDTA se compararon con los más cercanos de las formulaciones sin EDTA, aplicando una prueba t de Student pareada.
Resultados
Sin excepción, el crecimiento en la formulación con EDTA fue menor, para todas las temperaturas y todos los organismos, que en cualquiera de las tres formulaciones sin EDTA. Debido a la profusión de datos generados por el estudio (148 promedios), se mostrarán algunos resultados representativos, algunos excepcionales, y un «promedio de promedios» sin evaluación estadística.
Temperatura ambiente. Las bacterias Gram-negativas, exceptuando A. baumannii, pudieron multiplicarse en las suspensiones de propofol sin EDTA, en 12 horas, hasta alrededor de 10 veces el número de UFC inoculado inicialmente; los estafilococos y las levaduras mostraron un crecimiento menor. Por su lado, el crecimiento de microorganismos resultó consistentemente inhibido en la formulación de propofol con EDTA: caídas a la mitad o menos del inóculo inicial en las primeras horas, en los Gram-negativos y C. krusei; mantenimiento sin aumento ni descenso, en los Gram-positivos y C. glabrata; sólo C. albicans mantuvo una tasa de crecimiento, menor que en las formulaciones sin propofol, pero sostenida a lo largo de las 48 horas de incubación. Al cabo de las 48 horas, los microorganismos ensayados crecieron en las formulaciones sin EDTA entre 5-10 veces el inóculo inicial (Gram-positivos y C. krusei), hasta alrededor de 1,000 veces (E. coli y P. aeruginosa); en el caso de la suspensión con EDTA, el rango fue desde una leve caída en el número de UFC (S. aureus ATCC 25923), hasta un incremento de 10 veces el inóculo inicial (E. coli). Aunque sin excepción el crecimiento en la formulación con EDTA fue menor al observado en las tres sin EDTA, en el caso de C. glabrata en Xenoprof, la diferencia no fue estadísticamente significativa a ningún tiempo. La Figura 1 muestra las curvas de crecimiento de tres organismos representativos de los patrones descritos.
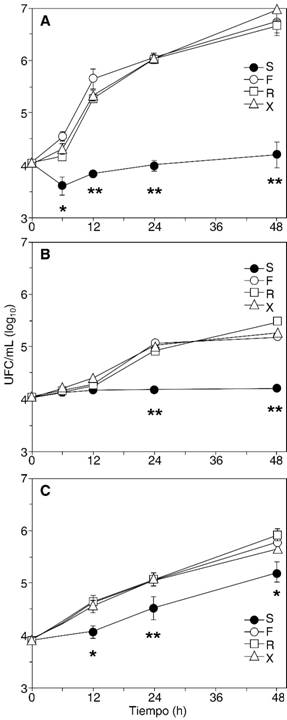
Figura 1: Curvas de crecimiento representativas, a temperatura ambiente. Se muestran las curvas de P. aeruginosa (A), con un descenso inicial e inhibición sostenida; S. epidermidis (B), con inhibición sostenida; y C. albicans (C), con inhibición parcial. S, Siltafel (con EDTA), F, Fresofol, R, Recofol, X, Xenoprof. * p < 0.05; ** p < 0.01 (comparando la formulación con EDTA [S], y la más cercana de las formulaciones sin EDTA).
35 oC. El crecimiento de todos los microorganismos ensayados, en suspensiones de propofol sin EDTA, fue más rápido y abundante que a temperatura ambiente. Nuevamente, en la formulación con EDTA, el crecimiento microbiano fue menor, desde disminuciones iniciales leves en la cuenta bacteriana (E. coli, P. aeruginosa y, en menor medida, S. aureus ATCC 25923), hasta reducciones de 5-20 veces en el crecimiento observado en ausencia de EDTA. Para las levaduras, y para K. pneumoniae, el crecimiento en la formulación con EDTA fue sólo más lento, comparado con el observado en formulaciones sin EDTA; pero se mantuvo en ascenso continuo a lo largo de las 48 horas. La Figura 2 muestra las curvas de crecimiento de tres organismos representativos de los patrones descritos.
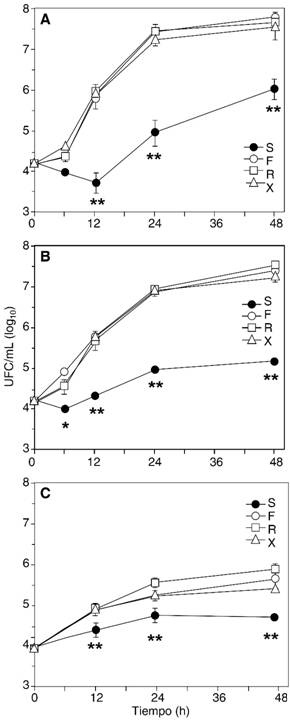
Figura 2: Curvas de crecimiento representativas, a 35 oC. Se muestran las curvas de E. coli (A), con un descenso inicial e inhibición sostenida; MRSA (B), con muy leve descenso inicial e inhibición sostenida; y C. krusei (C), con inhibición parcial. S, Siltafel (con EDTA), F, Fresofol, R, Recofol, X, Xenoprof. * p < 0.05; ** p < 0.01 (comparando la formulación con EDTA [S], y la más cercana de las formulaciones sin EDTA).
42 oC. El crecimiento a temperatura elevada mostró conductas muy divergentes entre los microorganismos seleccionados, aunque siempre creciendo menos en la suspensión con EDTA. Los estafilococos de la ATCC, S. aureus y S. epidermidis, no se multiplicaron a esta temperatura en ninguna de las formulaciones de propofol, y el MRSA lo hizo muy levemente, aunque fue inhibido en la formulación con EDTA. El crecimiento de C. glabrata y C. krusei también fue casi completamente inhibido a esta temperatura (excepto para C. glabrata en una formulación en particular), nuevamente con mayor inhibición en la formulación con EDTA. Las bacterias Gram-negativas se multiplicaron entre dos y tres órdenes de magnitud, pero en la formulación con EDTA se observó un claro efecto inhibitorio, aun más sostenido que a 35 oC. La Figura 3 muestra las curvas de crecimiento de tres organismos representativos de los patrones descritos.
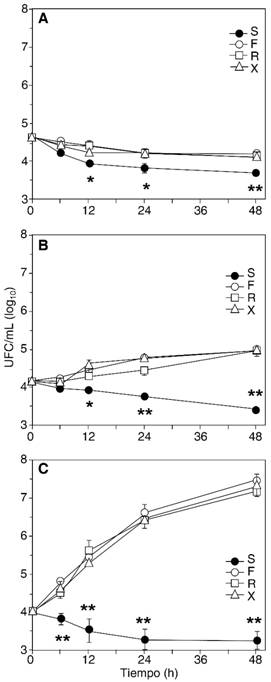
Figura 3: Curvas de crecimiento representativas, a 42 oC. Se muestran las curvas de S. aureus ATCC 25923 (A), con disminución sostenida de la población en todas las formulaciones, pero más acentuada en la que contiene EDTA; MRSA (B), con muy leve crecimiento en ausencia de EDTA, y decrecimiento en su presencia; y K. pneumoniae (C), con crecimiento sostenido en ausencia de EDTA, y decrecimiento en su presencia. S, Siltafel (con EDTA), F, Fresofol, R, Recofol, X, Xenoprof. * p < 0.05; ** p < 0.01 (comparando la formulación con EDTA [S], y la más cercana de las formulaciones sin EDTA).
No hubo diferencias significativas en el crecimiento entre las tres formulaciones de propofol sin EDTA, de ningún microorganismo a ninguna temperatura, con tres excepciones: (a) A. baumannii creció sustancialmente menos en Fresofol a 35 oC que en las otras dos formulaciones sin EDTA, y (b) sustancialmente más en Xenoprof a temperatura ambiente; y (c) C. glabrata creció sustancialmente más en Fresofol a 42 oC que en cualquier otra formulación. La Figura 4 muestra estas excepciones.
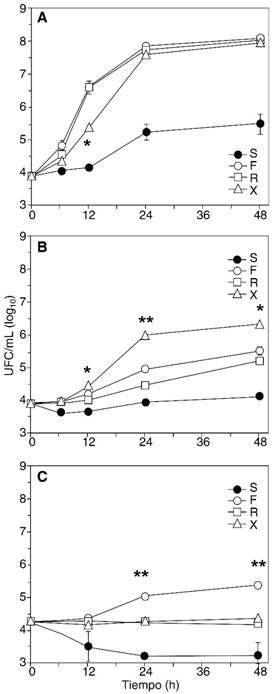
Figura 4: Curvas de crecimiento con diferencias entre formulaciones sin EDTA. Se muestran las curvas de A. baumannii a 35 oC (A), con menor crecimiento en Xenoprof a las 12 horas; A. baumannii a temperatura ambiente (B), con mayor crecimiento en Xenoprof a lo largo del ensayo; y C. glabrata a 42 oC (C), con mayor crecimiento en Fresofol a lo largo del ensayo. S, Siltafel (con EDTA), F, Fresofol, R, Recofol, X, Xenoprof. * p < 0.05; ** p < 0.01 (comparando el valor marcado y el más cercano de los valores de otra formulación sin EDTA).
Promediando los promedios de crecimiento de las tres formulaciones sin EDTA, y comparando con el crecimiento en el que sí tiene el quelante, se presentan en el Cuadro I las diferencias. La menor disminución de crecimiento en propofol con EDTA, fue -6.7% (S. epidermidis, seis horas a temperatura ambiente) y la mayor, -99.99% (C. albicans y K. pneumoniae, 48 horas a 42 oC). En términos globales, la inhibición fue similar para bacterias y para levaduras; pero las bacterias Gram-negativas fueron consistentemente más inhibidas que las Gram-positivas.
Cuadro I: Reducción porcentual de las cuentas de colonias, en suspensión de propofol con EDTA vs el promedio de suspensiones sin EDTA.
| Temp. amb. | 35 oC | 42 oC | |
|---|---|---|---|
| A. baumannii | |||
| 6 h | -52.1 | -69.8 | -84.9 |
| 12 h | -71.8 | -99.1 | -97.1 |
| 24 h | -93.8 | -99.7 | -99.6 |
| 48 h | -97.2 | -99.7 | -99.8 |
| E. coli | |||
| 6 h | -71.2 | -65.3 | -84.5 |
| ;12 h | -77.1 | -99.3 | -98.7 |
| 24 h | -96.4 | -99.6 | -99.4 |
| 48 h | -98.4 | -97.7 | -99.1 |
| K. pneumoniae | |||
| 6 h | -80.5 | -64.5 | -85.2 |
| 12 h | -83.4 | -87.1 | -98.9 |
| 24 h | -89.8 | -84.9 | -99.9 |
| 48 h | -81.8 | -90.9 | -99.99 |
| P. aeruginosa | |||
| 6 h | -80.9 | -94.5 | -97.2 |
| 12 h | -97.4 | -99.1 | -99.3 |
| 24 h | -99.1 | -98.3 | -99.0 |
| 48 h | -99.7 | -97.8 | -99.3 |
| S. aureus ATCC 25923 | |||
| 6 h | -12.9 | -62.0 | -41.1 |
| 12 h | -10.9 | -57.3 | -59.3 |
| 24 h | -72.5 | -94.8 | -60.2 |
| 48 h | -96.8 | -97.3 | -63.7 |
| MRSA | |||
| 6 h | -25.9 | -78.1 | -35.4 |
| 12 h | -63.7 | -96.5 | -71.2 |
| 24 h | -76.6 | -98.9 | -87.7 |
| 48 h | -88.5 | -99.4 | -97.1 |
| S. epidermidis | |||
| 6 h | -6.7 | -48.7 | -33.9 |
| 12 h | -29.2 | -83.8 | -32.4 |
| 24 h | -84.9 | -97.4 | -27.6 |
| 48 h | -92.4 | -99.3 | -74.9 |
| C. albicans | |||
| 12 h | -71.2 | -66.1 | -98.0 |
| 24 h | -71.2 | -80.1 | -99.6 |
| 48 h | -73.7 | -91.5 | -99.99 |
| C. glabrata | |||
| 12 h | -49.9 | -78.6 | -82.6 |
| 24 h | -45.0 | -78.1 | -94.6 |
| 48 h | -78.1 | -87.7 | -95.9 |
| C. krusei | |||
| 12 h | -74.9 | -68.4 | -71.8 |
| 24 h | -63.7 | -75.5 | -72.5 |
| 48 h | -66.1 | -88.8 | -69.8 |
Discusión
En una carta al editor11, DB Craig discute sobre la inconveniencia de añadir agentes «preservativos» al propofol, con el argumento de que hacerlo podría propiciar el relajamiento de la técnica aséptica al usarlo, y el mantenimiento extendido de las suspensiones fuera del vial original; en opinión de ese autor, resulta correcto que Canadá no haya, al igual que EUA, hecho obligatoria la adición de EDTA a las formulaciones de propofol. En EUA, entre 1990 y 1993, se documentaron brotes de bacteremia y otras infecciones después de procedimientos quirúrgicos; en un estudio retrospectivo de 62 casos durante esos brotes, se demostró la asociación con el uso de propofol. Aunque no existía contaminación en los viales cerrados, sí se cultivaron microorganismos del propofol en jeringas. Los organismos aislados incluían bacterias Gram-positivas y Gram-negativas, y levaduras4. Si bien es cierto que, usado bajo condiciones asépticas, las posibilidades de contaminación son mínimas, muy diversos factores hacen que, en México, el manejo del propofol no se apegue a la técnica aséptica. Eso añade riesgos para el paciente que, con la proliferación de patógenos multirresistentes, pueden ser mortales. El riesgo de contaminación y de infección al penetrar barreras naturales se ha asociado con la reutilización de jeringas y viales, y a fallas en las medidas asépticas durante la preparación y manejo de las jeringas y perfusiones intravenosas. Es prioritaria la educación y capacitación del personal involucrado en el manejo del propofol12,13.
En este estudio, se compararon tres marcas comerciales de propofol sin EDTA, con una que sí lo contiene, todas disponibles en México; se inocularon con diversos organismos patógenos e incubaron a tres temperaturas por hasta 48 horas. El inóculo seleccionado, ~10,000 UFC/mL, fue arbitrario y derivado del que se emplea en otros métodos microbiológicos clínicos. Es importante señalar que, en un escenario de vida real, el inóculo puede ser tan pequeño como unas cuantas células, por ejemplo, por contacto accidental de la aguja hipodérmica con la piel del operador o del paciente; o tan grande como varios millones de células, si la contaminación proviene de un fluido corporal con fuerte carga microbiana. Por lo que hace a las temperaturas ensayadas, probablemente la incubación a temperatura ambiente sea la que resulte más equiparable a las condiciones que, en la vida real, puede tener una suspensión de propofol ya extraída de su envase original. Con un 70.8% de reducción global de crecimiento a esta temperatura, de todos los microorganismos a todos los tiempos de muestreo, resulta claro que, ante la contaminación con un germen patógeno, la presencia de EDTA disminuye la proliferación bacteriana que es posible en el vehículo lipídico de las emulsiones de propofol. Este efecto fue más notorio en las bacterias capaces de mayor proliferación a temperatura ambiente: se inhibió en 85.7% el crecimiento de Gram-negativos, pero sólo en 55.1% el de Gram-positivos, que no crecen bien a esta temperatura.
Incubando a 35 oC, una situación en la que puede encontrarse el propofol extraído de su envase en diversas circunstancias (e.g., en jeringas transportadas en zonas cálidas sin aire acondicionado o en cercanía estrecha con una persona u otra fuente de calor), el crecimiento de todos los microorganismos ensayados, en suspensiones de propofol sin EDTA, fue más rápido y abundante que a temperatura ambiente. El efecto inhibitorio del EDTA fue, igualmente, más notable: 85.8% de disminución global del crecimiento a esta temperatura. Con las bacterias Gram-positivas y Gram-negativas alcanzando tasas de reproducción similares, la inhibición por EDTA fue también similar: 84.5 y 90.5%, respectivamente. La incubación a 42 oC se hizo para simular condiciones extremas de manejo de suspensiones de propofol en la vida real: jeringas cargadas con el fármaco y mantenidas en vehículos expuestos al sol, o en cercanía a equipos que irradien calor intenso. A esta temperatura, los Gram-positivos, C. glabrata y C. krusei, no se multiplican eficientemente en la suspensión de propofol, aunque lo hacen aún menos en la que contiene EDTA. Los Gram-negativos y C. albicans sí pueden reproducirse, aunque menos que a 35 oC, y el efecto inhibitorio del EDTA es más evidente. Así, mientras el crecimiento de Gram-negativos fue inhibido en un 96.4%, el de Gram-positivos lo fue sólo en 57.0%.
Además del riesgo principal que conlleva la contaminación y proliferación de microorganismos en un medicamento que será inyectado por vía intravenosa, que es el de causar una infección grave, sería importante analizar también la naturaleza (y las consecuencias de su aplicación IV) de los metabolitos microbianos que se acumulan luego de esa proliferación. Es claro que los microorganismos emplean los compuestos oleosos y/o el glicerol como nutrimentos, habiendo entonces productos de su degradación en la suspensión contaminada. La potencial toxicidad de esos productos es también un riesgo para el paciente.
El crecimiento de microorganismos en las suspensiones de propofol sin EDTA, de las tres marcas empleadas, no mostró diferencias significativas, salvo las excepciones mencionadas en la sección de resultados. Esto sugiere sutiles diferencias en la composición de los vehículos de la suspensión; el posible impacto clínico de estas diferencias debería dilucidarse, dada la laxitud regulatoria de los medicamentos inyectables.
Conclusiones
La adición de EDTA a las suspensiones de propofol no es un sustituto de la técnica aséptica, ni permite su mantenimiento extendido fuera de los viales, sin una adecuada técnica de preparación, manejo transoperatorio y desecho del fármaco. El EDTA actúa retardando el crecimiento de microorganismos, no como un desinfectante. Sin embargo, ante las diversas situaciones que puede propiciar el manejo subóptimo (no aséptico) de suspensiones de propofol, y el riesgo que estas situaciones conllevan de causar contaminación biológica, el EDTA añadido sirve como una medida preventiva para disminuir el riesgo de una infección nosocomial causada por la aplicación de propofol.











 nueva página del texto (beta)
nueva página del texto (beta)


