Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista latinoamericana de química
versión impresa ISSN 0370-5943
Rev. latinoam. quím vol.40 no.2 Naucalpan de Juárez ago. 2012
Actividad antibacteriana y antifúngica de Justicia Spicigera
Elisa Vega-AvilaA*, Rafaela Tapia-AguilarA, Ricardo Reyes-ChilpaB, Silvia Laura Guzmán-GutiérrezB, Javier Pérez-FloresB y Rodolfo Velasco-LezamaA
a Departamento de Ciencias de la Salud, Universidad Autónoma Metropolitana, San Rafael Atlixco 184, Col. México 09340. México.
b Instituto de Química, Universidad Nacional Autónoma de México, Circuito exterior, Ciudad Universitaria, México 04510, México. *e-mail: vega@xanum.uam.mx.
Recibido Junio 2012
Aceptado Agosto 2012
Resumen
Justicia spicigera es una planta nativa de México que se emplea desde la época prehispánica para tratar la disentería, por lo que objetivo del presente trabajo fue evaluar el efecto del extracto etanólico y su fracción hexánica sobre microorganismos causantes de la disentería bacteriana así como en Staphylococcus aureus y la levadura Candida albicans. Se determinó la concentración mínima inhibitoria (MIC) del extracto etanólico y su fracción mediante el método de la resazurina. El extracto etanólico en concentraciones ≤ 2.5 mg/mL inhibió el crecimiento de Shigella flexneri, Salmonella typhi, Salmonella typhimurium, Escherichia coli y Staphylococcus aureus. La fracción hexánica inhibió el crecimiento de las bacterias en concentraciones ≤ 1.25 mg/mL, así como el de Candida albicans (0.25 mg/mL). Estos resultados apoyan el uso empírico de Justicia spicigera en el tratamiento de la disentería.
La fracción hexánica es un líquido amarillo, aromático y se analizó por cromatografía de gases acoplada a espectrometría de masas, se compararon los espectros con la colección NIST y se detectaron los siguientes compuesto: 4-metil-3-pentenal; 2-hidroxi-2-metil-butanoato de metilo; 3,4-epoxi-2-hexanona; 1,2-diol-(2-furanil)-3-buteno; 3,4-epoxi-2-hexanona; 4-(1-metiletoxi)-1-butanol; ácido 2-hidroxi-2-metil-butanoíco; 2-hexenoato de etilo; ácido 3-tiofen-acético; ácido ftálico-2-etil-butil éster; 1-fenil-1,2-di-(4-metoxifenil)-eteno. Estos compuestos no se han reportado previamente en Justicia spicigera.
Palabras clave: Justicia spicigera, disentería, compuestos volátiles, resazurina.
Abstract
Justicia spicigera is a native plant from Mexico used since prehispanic times to treat dysentery. The aim of this research was to evaluate the effect of ethanol extract (EE) and its hexanic fraction (HEE) on bacteria causing dysentery, as well as on Staphylococcus aureus and the yeast Candida albicans. The minimal inhibitory concentration (MIC) was determined by resazurin assay. The EE inhibited the growth of Shigella flexneri, Salmonella typhi, Salmonella typhimurium, Escherichia coli and Staphylococcus aureus MIC ≤ 2.5 mg/mL. The HEE inhibited bacterial growth MIC ≤ 1.25 mg/mL. This fraction also inhibited Candida albicans with MIC = 0.25 mg/mL. These results support the empirical use of Justicia specigera to dysentery treatment. The volatile compounds of the HEE, a fragrant yellow oil, were analyzed by gas chromatography-mass spectrometry and identified by the NIST library: 3-pentenal,4-methyl; butanoic acid, 2-hydroxi-2-methyl-,methyl ester; ethanone, 1-(3-ethyloxiranyl)-; 1-butanol,4-(1-methylethoxy)-; 2-hydroxy-2-methylbutyric acid; 3-butene-1,2-diol, 1-(2-furanyl)-; 2-hexenoic acid ethyl ester; 3-thiopheneacetic acid; 1,2-benzendicarboxilic acid, mono (2-ethylhexyl) ester; benzene, 1,1'-(-1-phenyl-1,2-ethenediyl) bis[4-methoxy]. None of these compounds have been reported previously from Justicia spicigera.
Key words: Justicia spicigera, dysentery, volatile compounds, resazurin.
Introducción
Las infecciones de las vías respiratorias y del tracto intestinal son las dos principales enfermedades en el grupo de niños mexicanos de 0 a 14 años. Durante el año 2010, las infecciones respiratorias representaron el 76.5 % en tanto que las infecciones intestinales constituyeron el 11.4 % (INEGI, 2012). A pesar de que en la antigüedad no se conocía la existencia de los microorganismos y su papel en la generación de infecciones ya se empleaban las plantas Melissa officinalis, Alium sativum y Melaleuca alternifolia, para el tratamiento de enfermedades infecciosas comunes, en la actualidad se reconoce a estas plantas como agentes antimicrobianos de amplio espectro (Heinrich et al, 2004).
México es un país donde la medicina tradicional aun juega un papel importante en el cuidado y preservación de la Salud, por lo que las plantas medicinales, ofrecen posibilidades para descubrir moléculas con actividad antimicrobiana (Ríos et al, 2003). Justicia spicigera (muitle, muicle, hierba tinta) es una planta endémica de Mesoamérica, que crece desde México hasta el sur de Colombia y se emplea en México desde la época prehispánica para tratar la disentería, gonorrea, sarna, fiebre y sangrado uterino (Hernández, 1790). Actualmente se sigue empleando con fines medicinales para tratar el cáncer, enfermedades circulatorias, diarrea, nervios, reumatismo, inflamación de estómago y dolor de cabeza, (Andrade-Cetto, 2009). Además, en combinación con Arnica montana, Hippocratea excelsa, Amphipterygium adstringens y Tecoma stan se elabora el té que se usa en la terapia alternativa/complementaria en pacientes seropositivos a VIH (Herrera-Arellano et al, 2009). En la medicina tradicional de Guatemala se emplea para tratar infecciones como erisipela, leucorrea y pielonefritis causada principalmente por bacterias y hongos (Cáceres et al., 1987). Justicia spicigera tiene la sinonimia de Jacobina spicigera (Euler & Alam, 1982).
Se han conducido diversos estudios para conocer la actividad biológica de los extractos de J. spicigera y se ha reportado que el extracto etanólico de las hojas en una concentración de 417 µg/mL causa la muerte del 97± 2 % de trofozoítos de Giardia duodenalis, e induce cambios morfológicos en el 98 % de los trofozoítos (Ponce-Macotela et al, 2001). El extracto hexánico de J. spicigera, en concentración de 500 g/L, inhibe el 100% de los trematodos de Fasciola hepática (Ibarra-Moreno et al, 2012). El extracto acuoso de J. spicigera en una concentración de 100 mg/mL mostró ser citotóxico en células leucémicas en tanto que no afectó la proliferación de células normales precursoras de la hematopoyesis (Cáceres-Cortés et al, 2001). La actividad citotóxica del extracto etanólico se observó en cultivos de células T47D (ED50= 0.43 µg/mL) y HeLa (ED50=5.59µg/mL) (Vega-Avila et al, 2009).
La actividad antimicrobiana de los extractos metanólico y etanólico ha sido probado por dos grupos de investigadores empleando la prueba de difusión en agar en cultivos de E. coli, P. aeruginosa, S. aureus y B. subtilis (Gómez-Verjan et al., 2012) por lo que el objetivo del presente trabajo es evaluar el efecto del extracto etanólico y su fracción hexánica sobre cepas de bacterias responsables de la disentería bacteriana, así como en Staphylococcus aureus y la levadura C. albicans, empleando a la resazurina como indicador de viabilidad celular y determinar los compuestos volátiles presentes en la fracción.
Material y métodos
Material vegetal: Se adquirió la planta fresca en el Mercado de Sonora de la Ciudad de México. Se depositaron ejemplares en el herbario de la Universidad Autónoma Metropolitana-Unidad Iztapalapa siendo clasificada, por el Dr. Adolfo Espejo Serna como Justicia spicigera y se le asignó el número de voucher UAMIZ 65465.
Obtención de los extractos: La planta completa se secó y molió y con ella se obtuvieron los extractos por maceración sucesiva durante 48 horas con hexano, diclorometano, acetato de etilo y etanol. Los disolventes se evaporaron por rotoevaporación (Bucki II, Suiza).
Fraccionamiento del extracto etanólico: El extracto etanólico se disolvió en una disolución de carbonato de sodio y posteriormente se maceró con hexano para obtener la fase orgánica. Se eliminó el hexano por rotoevaporación y la fracción se almacenó a 4 ºC hasta su uso.
Determinación de la actividad anti-bacteriana: Las bacterias usadas para el ensayo antimicrobiano fueron obtenidas del cepario de la Escuela Nacional de Ciencias Biológicas del Instituto Politécnico Nacional. Las cepas empleadas fueron Staphylococcus aureus (ATCC 6538), Escherichia coli (ATCC 8739), Salmonella typhi (ATCC 6539), Salmonella typhimurium (ATCC 14028) y Shigella flexneri (ATCC 29003).
Se determinó la actividad antibacteriana midiendo la concentración mínima inhibitoria (MIC) empleando el método de la resazurina (Sarker et al., 2007), como indicador de viabilidad ya que es un indicador de oxido-reducción que al ser reducido a resorufina por las enzimas oxidoreductasas, sólo activas en células vivas, cambia su tonalidad de azul a rosa.
El extracto y la fracción hexánica se disolvieron en dimetisulfóxido (DMSO) en concentración de 10 mg/mL de DMSO al 10%, y con ellas se realizaron una serie de diluciones dobles en 8 pozos consecutivos, por triplicado, en una placa de 96 pozos utilizando como disolvente solución salina fisiológica estéril. El intervalo de las concentraciones empleadas en este ensayo fue de 5.0 a 0.039 mg/mL. Se colocaron en cada pozo 50 µL de la dilución del extracto o fracción, 10µL de la suspensión de bacterias viables (4x106 UFC/mL), 10 µL de resazurina sódica (0.675% p/v en agua) y 30 µL de medio de cultivo Mueller-Hinton 3x (MH3x). Las placas se incubaron a 37 °C durante 20 horas. Se emplearon controles negativos (DMSO, agua) y positivo (mezcla de penicilina/estreptomicina). Se realizaron 3 experimentos independientes y el valor medio de la concentración mínima inhibitoria (MIC) se muestra en la Tabla 1. El MIC corresponde a la concentración más baja del extracto o fracción donde ocurre el cambio de color (Sarker et al, 2007).
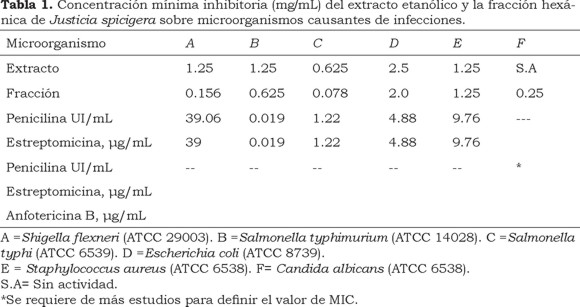
Determinación de la actividad antifúngica: Para este ensayo se obtuvo la levadura Candida albicans (ATCC 10231) del cepario de la Escuela Nacional del Instituto Politécnico Nacional. La concentración mínima inhibitoria (MIC) se obtuvo siguiendo el protocolo M27-A2 establecido por la NCCLS (Siglas en inglés del National Committee for Clinical Laboratory Standards), determinando colorimétricamente la concentración mínima inhibitoria (Liu et al., 2007). Se realizaron una serie de diluciones dobles del extracto y de la fracción hexánica en 8 pozos consecutivos, por triplicado, en una placa de 96 pozos, utilizando como disolvente medio RPMI-1640 con glutamina y sin bicarbonato sódico, tamponado con ácido morfolino propano sulfónico (MOPS) 0.164 M, a pH 7.0. Las diluciones de cada extracto se pusieron en contacto con una concentración estándar de células viables de 1 a 5x103 UFC/mL en el mismo medio suplementado con 0.1 % v/v de la disolución estéril de resazurina sódica (20 mg/ mL en agua). Además, en cada placa se colocó como control negativo DMSO al 1 % y como control positivo una serie con una mezcla de antibiótico-antimicótico (10,000 Unidades de penicilina/mL; 1000 µg/mL de estreptomicina; 25.0 µg/mL de anfotericina B). Las placas se incubaron a 37 °C durante 48 horas y después de este tiempo se determinó la concentración más baja del extracto o fracción a la cual ocurre el cambio de color. La prueba se realizó por triplicado en tres eventos independientes. Los datos obtenidos se muestran en la Tabla 1.
Cromatografía de gases: Se empleó un cromatógrafo de gases 6890 N (Agilent, EUA) acoplado a un espectrómetro de masas Jeol JMS-GC mate II, equipado con una columna HP-5 (30 m, 0.32 mm de diámetro interno y 0.25 µm de espesor de película), en un programa de 40 ºC (1 min) hasta 305 ºC, a 8 ºC/min. El inyector se mantuvo a 305 ºC, el volumen de inyección fue de 0.5µL en modo Split, y el flujo de gas portador (He) en la columna fue de 1 mL/min. La interfase entre el cromatógrafo y espectrómetro se mantuvo a 305 ºC; el modo de ionización por impacto electrónico (70 eV); y escaneo completo (35/500 m/z). La identificación de los componentes presentes en la muestra (Tabla 2) se realizó mediante comparación computarizada de los espectros de masas de la biblioteca NIST (National Institute Standard and Technology).

Resultados y discusión
El extracto etanólico fue de color púrpura y después de evaporar el disolvente se realizaron pruebas de solubilidad, logrando disolverlo en carbonato de sodio 0.5 M. Posteriormente se realizó una extracción líquido-líquido con hexano. Después de eliminar el hexano de la fracción orgánica se obtuvo un líquido denso de color amarillo y aroma agradable que solidificó a la temperatura de refrigeración. El efecto del extracto etanólico y la fracción hexánica sobre las bacterias y la levadura se muestra en la Tabla 1. La concentración mínima inhibitoria (MIC) en el extracto completo sobre Salmonella typhi (ATCC 6539) fue de 0.625mg /mL y en la fracción hexánica fue de 0.0781 mg/mL. El MIC del extracto completo sobre Salmonella typhimurium (ATCC 14028) fue de 1.25 mg/mL, mientras que para la fracción hexánica fue de 0.625 mg/mL. Salmonella typhi está presente en la disentería en tanto que S. typhimurium es uno de los serotipos que es aislado con más frecuencia en México (Hernández-Cortez et al, 2011). El extracto etanólico no afectó a concentraciones de 5.0 mg/mL el crecimiento de C. albicans (ATCC 10231). Reportes previos indican que el extracto etanólico de las hojas en concentraciones de 0.375 mg/disco (Jacobo-Salcedo et al, 2011) y 2.0 mg/disco (Murillo et al, 2001) no inhiben el crecimiento de esta levadura. Sin embargo, la fracción hexánica inhibió el crecimiento de C. albicans con MIC de 0.25 mg/mL. Nuestros datos muestran que el extracto etanólico inhibió la proliferación de Escherichia coli (ATCC 8739) con MIC de 2.5 mg/mL. Otros autores han reportado que el extracto etanólico en concentraciones de 0.375 mg/disco (Jacobo-Salcedo et al, 2011) no inhibe el crecimiento de E.coli (ATCC 412352) y de 2.0 mg/disco no inhibe el crecimiento de E. coli (ATCC 25922) (Murillo-Álvarez et al, 2001). La cepa empleada es diferente además de que los dos grupos de trabajo emplearon la técnica de difusión en agar en tanto que nosotros empleamos un método de dilución que nos permitió evaluar la actividad del extracto en diversas concentraciones, incluso más altas que la probada por dichos grupos de trabajo.
Tanto el extracto completo como su fracción hexánica inhibieron el crecimiento de Staphylococcus aureus (ATCC 6538) con MIC de 1. 25 mg/mL. De acuerdo al trabajo reportado por el grupo de Jacobo-Salcedo, el extacto etanólico en concentración de 0.375 mg/disco no inhibe el crecimiento de S. aureus (ATCC3090014). El extracto etanólico en una concentración de 2.0 mg/ disco no inhibe el crecimiento de S. aureus (Murillo, et al, 2001). Sin embargo, en este reporte no indican las características de la cepa de Staphylococcus empleada y quizás a esto se deba la discrepancia de resultados, ya que la susceptibilidad a los fármacos varía entre las diferentes cepas (Hernández-Cortéz et al, 2011).
Cabe mencionar que las características del suelo así como las condiciones climatológicas en las que crecieron las plantas fueron distintas ya que estas se colectaron en Cd. Valles SLP (Jacobo-Salcedo et al, 2011) y La Paz BCS (Murillo et al, 2001), por lo que es probable que existan variaciones en la concentración de los metabolitos secundarios presentes en dichas plantas. Los componentes detectados por cromatografía de gases acoplada a espectrometría de masas se muestran en la Tabla 2. Mediante el empleo de la base de datos NIST se identificaron 10 compuestos. El 4-metil-3-pentenal es un compuesto minoritario de la fracción hexánica que se obtuvo en un tiempo de retención de 4.1 min. Este compuesto es uno de los constituyentes del aceite esencial obtenido de hojas de Ipomoea batata L. (Wang et al., 2010). La actividad antibacteriana de nuestra fracción podría estar relacionada con la presencia de 4-metil-3-pentenal ya que otros investigadores han reportado que el hexanal aislado de Olea europea tiene actividad antimicrobiana general (Domingo y López-Brea, 2003).
Se detectó el éster 2-hidroxi-2-metilbutanoato de metilo, con tiempo de retención de 4.77 min. Este es un compuesto volátil con característica olfativa presente en la piña (Sinuco et al., 2004).
El ácido 2-hidroxi-2-metilbutanóico se detectó a los 7.21 min., compuesto que se encuentra presente en el extracto etanólico de las flores de Hibiscus rosa sinensis (Anisha et al., 2011).
El 1,2-diol-(2-furanil)-3-buteno se detectó a los 12.45 min, compuestos análogos se han detectado entre los compuestos volátiles de Ipomea batata (Wang et al., 2010). También se han reportado compuestos derivados del furano como compuestos volátiles asociado con el olor de la cereza (Sinuco et al, 2004). A la fecha se desconoce el efecto de este tipo de compuesto sobre la viabilidad bacteriana.
Se han aislado de J. spicigera los flavonoides camferitrina, y su triramnósido (Euler & Alam, 1982) y la camferitrina (II) (Domínguez et al, 1990). Otros compuesto aislados son el ß-sistosterol, el 3-O-glucósido de ß-sistosterol, la alantoina, la criptaxantina y una antocianina muy polar que presenta el comportamiento fluorescente de las infusiones de esta planta (Domínguez et al, 1990).
Los grupos químicos más importantes con actividad antimicrobiana obtenidos de plantas son los fenoles, quinonas, taninos, cumarinas, flavonas y alcaloides y en menor proporción se reportan a los aldehídos, saponinas, sulfóxidos y alcanos (Domíngo & López-Brea, 2003). Dentro de los compuestos reportados por nosotros está el aldehído 4-metil-3-pentenal y probablemente éste podría ser uno de los compuestos que podría contribuir a la inhibición de los microorganismos presentada por la fracción hexánica.
Conclusiones
Tanto el extracto etanólico como su fracción hexánica inhiben el crecimiento de los microorganismos causantes de la disentería y el mejor efecto lo presenta la fracción hexánica. Sólo la fracción hexánica inhibió el crecimiento de la levadura C. albicans, agente causal del 86-90% de las infecciones superficiales o sistémicas. Este estudio muestra que Justicia spicigera posee interesantes propiedades antimicrobianas y antimicóticas, lo cual explica el uso de esta planta en la medicina tradicional mexicana para el tratamiento de enfermedades infecciosas.
Referencias
Andrade-Cetto, A. (2009). Ethnobothanical study of the medicinal plants from Tlanchinol, Hidalgo, México. Journal of Ethnopharmacology 122:163-171. [ Links ]
Anisha, B., Nithya, V., Vidya, V.G. (2011). Phytochemical screening and in vitro antioxidant activities of the ethanolic extract of Hibiscus rosa sinensis L. Annual of Biological Research. 2:653-661. [ Links ]
Cáceres, A., Giron, L.M., Alvarado, S.R., Torres, M.F. (1987). Screening of antimicrobial activity of plants used in Guatemala for the treatment of dermatomucosal Diseases. Journal Ethnopharmacology 20:228-237. [ Links ]
Cáceres-Cortés, J.R., Cantú-Garza, F., Mendoza-Mata, M.T., Chávez-González, G., Ramos-Mandujano, M., Zambrano-Ramírez, I.R. (2001). Cytotoxic activity of Justicia spicigera is inhibited by bcl-2 proto-oncogene and induces apoptosis in a cell cycle dependent fashion. Phyytotherapy Research 15:691-697. [ Links ]
Domingo, D., López-Brea, M. (2003). Plantas con acción antimicrobiana. Revista Española de Quimioterapia 16:385-393. [ Links ]
Domínguez, X.A., Achenback, H., Conzález, C.C., Ferré-D>Amare, A.R. (1990). Estudio químico del muitle (Justicia spicigera). Revista Latinoamericana de Química 21:142-143. [ Links ]
Euler, K.L., Alam, M. (1982). Isolation of kaempferitrin from Justicia spicigera. Journal of Natural Products. 45:220-221. [ Links ]
Gomez-Verja, J.C., Reyes-Chilpa, R., Aguilar, M.I. (2012). Chemistry and pharmacology of selected Asian and American Medicinal species of Justicia. En "Bioactive Phytochemicals. Perpectives for Modern Medicine. Vol. I.". Gupta, V.K. Editor. India Daya Publishing House. New Delhi, India. 1a edición. P.p. 455-473. [ Links ]
Heinrich, M, Barnes, J., Gibbons, S., Williamson, E.M. (2004). Fundamentals of pharmacognosy and phytotherapy. Churchill. Livingstone, Edinburgh, UK. Pp 245-252. [ Links ]
Hernández -Cortéz, C., Aguilera, A.M.G. Castro, E.G. (2011). Situación de las enfermedades gastrointestinales en México. Enfermedades Infecciosas y Microbiología 31:137-151. [ Links ]
Hernández, F. (1790). De Historia Plantarum Plantae Novae. Ed. Matritence. Pp 155. Madrid. [ Links ]
Herrera-Arellano, A., Jaime-Delgado, M., Herrera-Alvarez, S., Oaxaca-Navarro, J., Salazar-Martínez, E. (2009). Uso de terapia alternativa/complementaria en pacientes seropositivos a VIH. Revista Médica del Instituto Mexicano del Seguro Social 47:651-658. [ Links ]
Ibarra-Moreno, S., Ibarra-Velarde,F., Avila-Acevedo, G. (2012). In vitro evaluation of fasciolicide activity with hexane, methanol and ethyl acetate with extracts processed and obtained from some Mexican plants used in traditional medicine based on ethno botanical studies. American Journal of Plant Sciences 3:506-511. [ Links ]
Instituto Nacional de Estadística y Geografía. 2012. Estadísticas a propósito del día del niño. [ Links ]
Jacobo-Salcedo, M.R., Alonso-Castro, A.J., Salazar-Olivo, L.A., Carranza-Alvarez, C., González-Espíndola, L.A., Domínguez, F., Maciel-Torres, S.P., García-Luján, C., González-Martínez, M.R., Gómez-Sánchez, M., Estrada-Castillón, E., Zapata-Bustos, R., Medellin-Milán, P., García-Carranca, A. (2011). Antimicrobial and cytotoxic effects of Mexican medicinal plants. Natural Product Communication 6:1925-1928. [ Links ]
Liu, M., Seidel, V., Katerere, D.R., Gray, A.I. (2007). Colorimetric broth microdilution method for the antifungal screening of plant extracts against yeast. Methods 42:325-329. [ Links ]
Murillo-Alvarez, J.I., Encarnación, D.R., Franzblau, S.G. (2001). Antimicrobial and cytotoxic activity of some medicinal plants from Baja California Sur (México). Pharmceutical Biology 39:445-449. [ Links ]
Ponce-Macotela, M., Rufino-González, Y., De la Mora, J.I., Gonzáles-Maciel, A., Reynoso-Robles, R., Martínez-G.M.N. (2001). Mortality and morphological changes in Giardia duodenalis induced by exposure to ethanolic extracts of Justicia spicigera. Proceeding Western Pharmacolgy Society.44:151-152. [ Links ]
Rios, M., Aguilar, B., Navarro, V. Two new benzofuranes from Eupatorium aschenbornianum and their antimicrobial activity. Planta Medica 2003; 69:967-970. [ Links ]
Sarker, S, D., Nahar, L., Kumarasamy Y. (2007). Microtitre plate-based antibacterial assay incorporating resazurin as indicator of cell growth, and its application in the in vitro antibacterial screening phytochemicals. Methods 42:321-324. [ Links ]
Sinuco, D.C., Morales, A.L., Duque, C. 2004. Componentes volátiles libres y glicosídicamente enlazados del aroma de la piña (Ananas comosus L.). Revista Colombiana de Química 33:47-56. [ Links ]
Vega-Avila, E., Espejo-Serna, A., Alarcón-A, F., Velasco-Lezama, R. (2009). Cytotoxic activity of four Mexican medicinal plants. Proceedings of the Western Pharmacology Society 52:78-82. [ Links ]
Wang, M., Xiong, Y., Zeng, M., Li, H., Zhang, T., Liang, Y. (2010). GC-MS combined with chemometrics for analysis of the components of the essential oils of sweet potato leaves. Chromatographia 71:891-897. [ Links ]














