Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Boletín de la Sociedad Botánica de México
versión impresa ISSN 0366-2128
Bol. Soc. Bot. Méx no.87 México dic. 2010
Ecología
Comunidades vegetales templadas de la Sierra Juárez, Oaxaca: pisos altitudinales y sus posibles implicaciones ante el cambio climático
Temperate plant communities in the Sierra Juárez, Oaxaca: altitudinal levels and possible implications associated with climate change
Yunuhé Zacarías–Eslava y Rafael F. del Castillo1
Centro Interdisciplinario de Investigación para el Desarrollo Integral Regional Unidad Oaxaca (CIIDIR Oaxaca), Instituto Politécnico Nacional. 1 Autor para la correspondencia: fsanchez@ipn.mx
Recibido: 14 de agosto de 2009.
Aceptado: 15 de agosto de 2010.
Resumen
Se caracterizó y estimó la diversidad de ecosistemas templados de la Sierra Juárez, Oaxaca: un encinar arbustivo, dos bosques de encino y un bosque de pino–encino, en orden creciente de altitud. Aunque la diversidad a fue relativamente baja en todos los sitios, particularmente para especies arbóreas, existe un gran recambio de especies aun entre sitios cercanos como lo evidencia la significativa contribución de la diversidad P a la diversidad total. La menor diversidad arbórea se encontró en el sitio más bajo. La diversidad arbustiva disminuyó con la altitud. El área basal arbórea disminuyó al aumentar la cobertura de arbustos. Las coberturas del dosel y del mantillo, a nivel de superficie del suelo, y el área basal arbórea aumentaron con la altitud, donde la humedad es mayor, por lo que ésta parece limitar la biomasa. Un déficit de árboles de la clase diamétrica más pequeña y bajas densidades de plántulas sugieren bajos niveles de reclutamientos recientes en los sitios estudiados. Proyecciones de cambio climático para 2030 establecen que las condiciones actuales de precipitación y temperatura se ubicarán a altitudes, al menos 175 m por arriba de lo encontrado actualmente, por lo que se espera la expansión del encinar arbustivo a expensas del bosque templado y la extinción de especies de pisos altitudinales elevados. Estas predicciones son consistentes con las diferencias observadas entre sitios de estructura de tamaños, densidades de juveniles y plantas muertas en pie. Es probable que las sierras oaxaqueñas no puedan brindar en un futuro cercano las condiciones climáticas en las que ahora se ubica la vegetación de altura. Se recomienda explorar los beneficios y costos de acciones de conservación activa como migración asistida y programas de mejoramiento genético para disminuir los riesgos de extinción por cambio climático.
Palabras clave: bosque de encino, bosque de pino–encino, cambio climático global, conservación, estructura de la vegetación, diversidad, encinar arbustivo, Oaxaca.
Abstract
Biodiversity was estimated and characterized in four temperate ecosystems in Sierra Juarez, Oaxaca, Mexico: an oak–dominated chaparral, two oak forests, and a pine–oak forest (from low to high elevation). Although, the a diversity was relatively low, particularly for tree species, species turnover was very high even between nearby stands, as indicated by the significant contribution of the P diversity (richness, Shannon) to total diversity. The lowest diversity of trees was found at the lowest elevation, whereas the diversity of shrubs decreased with elevation. Tree basal area increased as the shrub cover diminished. Canopy cover, soil litter cover, and tree basal area increased with elevation where humidity is higher, suggesting that humidity is limiting biomass. A deficit of trees in the smallest DBH class coupled with low density of seedlings and small–sized individuals in all sites suggests low recruitment in recent times. On the basis of an estimated shift upwards of the actual rainfall levels of 175 m in altitude by 2030, we predict the expansion of chaparral at the expense of temperate forest and the extinction of high–altitude species. Such predictions appear to be consistent with the observed differences among study sites in size structure, density of saplings and standing dead trees. It is possible that in the near future the sierras in Oaxaca will not have the current climatic conditions to sustain the high altitude vegetation. We recommend to examine the costs and benefits of active conservation in this sierra, such as assisted migration, and genetic improving, particularly for high–altitude species.
Key words: chaparral, climate change, conservation, diversity, oak forest, Oaxaca, pine–oak forest, vegetation structure.
En las regiones templadas de México, las comunidades vegetales dominadas por pinos (Pinus), encinos (Quercus) o una combinación de ambos son las más importantes en extensión y valor económico (Challenger, 2003; Bray et al., 2007). El disturbio antropogénico en este tipo de comunidades en algunas épocas de la historia de México ha sido quizás aún más fuerte que aquél al que ha sido sometido el bosque tropical (Challenger, 1998). Actualmente, el 95% de la explotación forestal en México se concentra en los bosques templados, principalmente sobre especies de pino (Masera et al., 1997). Una extensión considerable de la vegetación templada de montaña en México ha sido destruida. según un análisis del inventario Nacional Forestal en un lapso de 24 años (de 1976 a 2000) se han transformado en campos de cultivo y pastizales inducidos un 16% de los bosques templados y un 12% de los matorrales de este país (Velázquez et al., 2002).
Aunado a esta problemática, el cambio climático global es otra posible amenaza para las comunidades vegetales templadas. se esperan condiciones más secas y cálidas en estas regiones, pero sus posibles efectos han sido poco estudiados en México y se han enfocado sólo hacia algunas especies en particular (Márquez et al., 2006; Alvarado–Rosales et al., 2007; Gómez–Mendoza y Arriaga, 2007; del Castillo et al., 2009; Sáenz–Romero et al., 2010). Estos cambios pueden favorecer desplazamientos de las especies para encontrar hábitats con condiciones similares a las actuales. En ecosistemas montañosos, al existir variaciones climáticas drásticas en distancias cortas (Körner, 2007), los desplazamientos de las especies inducidos por el cambio climático posiblemente tiendan a ser hacia diferente altitud u orientación en la misma región montañosa que latitudinales que implicarían desplazamientos más largos. Además, en México se interponen sitios con climas muy secos y cálidos en las posibles rutas de migración que seguirán las especies de montaña al migrar hacia sitios más fríos de mayor latitud, lo que constituiría un serio obstáculo, probablemente infranqueable, para muchas especies (Sáenz–Romero et al., 2010). A este respecto, es instructivo estimar los desplazamientos altitudinales que tendrían las condiciones climáticas actuales ante el cambio climático aprovechando que ya existen proyecciones disponibles del cambio climático para la República Mexicana (Sáenz–Romero et al., 2010).
El estado de Oaxaca aún conserva extensiones importantes de bosque templado (Torres–Colín, 2004). La Sierra Juárez, en particular, destaca por su importancia florística (Lorence y García–Mendoza, 1989; García–Mendoza, 2004) y económica, pues sus comunidades humanas dependen de estos bosques a través del ecoturismo y de la explotación de productos forestales, maderables (principalmente coníferas y encinos) y no maderables (especies medicinales, ornamentales y comestibles) (Bray et al., 2007; Mondragón–Chaparro y Villa–Guzmán, 2008; Vázquez–Mendoza, 2008). Aunque existen estudios florísticos importantes en esta región (Saynes, 1989; Velasco y Juárez–García, 2003; Mondragón et al., 2006), son escasos los estudios de vegetación (Boyle, 1996).
En áreas montañosas el análisis de la composición, estructura y distribución espacial de la diversidad es importante pues ésta puede cambiar en distancias cortas por efectos asociados con la altitud (Boyle, 1996; Vázquez y Givnish, 1998; Sánchez–González y López–Mata, 2003). Por ello, es necesario estimar la diversidad dentro y entre localidades. La idea de dividir la diversidad total en componentes tiene cerca de medio siglo (ver Whittaker, 1972), pero los métodos para dividirla aditivamente son recientes (Vellend, 2001; Crist et al., 2003; Lande et al., 2003). La diversidad total (diversidad y) encontrada en una colección de muestras puede ser descompuesta en la diversidad de especies presentes en una muestra promedio de esa colección (diversidad a) y en la diversidad de especies ausentes en esa muestra promedio (diversidad β), que refleja así la tasa de recambio de especies.
El análisis de la estructura de la vegetación permite, además, conocer aspectos esenciales de las comunidades, particularmente la distribución de sus recursos entre las diversas especies a través de estimadores indirectos de biomasa como cobertura y área basal (Mueller–Dombois y Ellenberg, 1974; Whittaker, 1975). La captación de energía solar del ecosistema, la productividad y la perturbación se reflejan en la cobertura del dosel (Waring y Schlesinger, 1985; Lambers et al., 1988). El dosel afecta el establecimiento y sobrevivencia de plántulas al modificar la cantidad y calidad de luz que llega a la superficie del suelo (Ryan et al., 2004) y disminuye la capacidad erosiva del agua, contribuyendo a la estabilidad hidrológica de las cuencas (Cotler, 2003). Por otra parte, la abundancia de la vegetación rasante, el grado de disturbio, la pedregosidad y la carga animal del ecosistema pueden estimarse con análisis de la condición de superficie del suelo (del Castillo, 2000). Finalmente, las densidades de plántulas y de plantas muertas en pie junto con la distribución de clases de tamaños de los individuos que conforman las comunidades vegetales pueden ayudar a entender la dinámica de la vegetación (Weiner, 1988; Johnson et al., 1994). Toda esta información es esencial para valorar las condiciones de la vegetación, predecir los efectos de las especies y comunidades ante el cambio climático global y fundamentar científicamente el manejo, la conservación y la restauración de los ecosistemas.
El presente estudio es una contribución al conocimiento de las comunidades vegetales templadas de la Sierra Juárez en Santa Catarina Ixtepeji, Oaxaca en distintos pisos altitudinales. Estudios previos de la vegetación en esta zona se han enfocado a la comunidad arbórea, no han hecho una partición aditiva de la diversidad total. Las comunidades arbustivas han sido poco estudiadas y se desconoce su relación con la arbórea; tampoco existe información de la condición de superficie del suelo, ni de la cobertura del dosel. No se ha evaluado la densidad de plántulas y árboles muertos en pie ni la estructura de la vegetación, ni se ha intentado hacer una predicción de los posibles desplazamientos de la vegetación con base en las proyecciones existentes de cambio climático. Por consiguiente, los objetivos fueron: (a) contribuir al conocimiento florístico de las comunidades de árboles y arbustos en las proximidades de los límites altitudinales de la vegetación templada de sotavento de la Sierra Juárez; (b) analizar la distribución espacial de la diversidad; (c) caracterizar la estructura de las comunidades arbóreas y arbustivas, la cobertura del dosel y la condición de superficie del suelo, y (d) predecir los posibles desplazamientos locales de la vegetación ante el cambio climático global.
Materiales y Métodos
Area de estudio. El estudio se realizó en las laderas noro–rientales de la Sierra Juárez, Santa Catarina Ixtepeji, Oaxaca (Figura 1). Esta sierra, ubicada al norte de la capital del estado, forma parte de la Sierra Madre de Oaxaca (Ortiz–Pérez et al., 2004) y de la cuenca hidrológica del río Papaloapan, en la subcuenca del río Quiotepec (INEGI, 2000). El suelo es acrisol húmico (Alfaro–Sánchez, 2004) y yace sobre calizas o lutitas del Cretácico inferior (INEGI, 1984). Los muestreos de vegetación se realizaron en cuatro sitios de diferente altitud. Dos de los sitios de estudio, el Cerezo (2,900 m) y Corral de Piedra (3,120 m), están ubicados cerca del límite altitudinal superior de la Sierra. Los otros dos, Reynoso (2,145 m) y El Cerezal (2,200 m), se localizan cerca del límite altitudinal inferior que separa la vegetación templada de la tropical. A altitudes inferiores aparecen especies representativas de selva baja caducifolia. La selección de los sitios de estudio permitió hacer un análisis de la distribución espacial de la diversidad de la vegetación templada y su relación con la altitud al permitir comparar sitios distantes y sitios próximos en altitud. La vegetación en estos sitios no es reciente, como lo señalan las autoridades de Santa Catarina Ixtepeji y lo confirman las imágenes LANDSAT MSS de 1979 al compararlas con imágenes SPOT del 2005 (R. Rivera, comunicación personal).
Tres estaciones meteorológicas están ubicadas a menos de 40 km de distancia de los sitios de estudio, a sotavento, al igual que éstos, y con una amplitud altitudinal de 1,100 m: Santa Catarina Ixtepeji, a 2,050 m, con 18.3 °C y 759.3 mm de temperatura y precipitación media anuales; La Carbonera, a 2,280 m, con 15.6 °C y 772.8 mm; y Cuajimoloyas, a 3,150 m, con 10.0 °C y 1,124 mm (Servicio Meteorológico Nacional, 2009). Estas estaciones registran un clima templado subhúmedo con lluvias en verano. Análisis de regresión lineal practicados a estos datos estiman un descenso de 0.7 °C (r2 = 0.98, P < 0.05) y un incremento de 35.1 mm (r2 = 0.97, P < 0.05) en la temperatura y precipitación media anuales respectivamente por cada 100 m de incremento en altitud. Análisis del contenido de humedad del suelo practicados en los cuatro sitios estudiados confirman una mayor humedad al aumentar la altitud y un incremento lineal estimado de 7.8% por cada 100 m de elevación (r2 = 0.999, P < 0.0001) (Vázquez–Mendoza, 2008).
Protocolos de muestreo. En cada sitio se muestreó la vegetación arbórea y arbustiva, la cobertura del dosel y la condición de superficie del suelo. Se colectaron ejemplares de todas las especies muestreadas y se depositaron en el herbario del CIIDIR Oaxaca (OAX). La vegetación arbórea se estimó en diez parcelas circulares de 5.7 m de radio, separadas 18 m entre ellas y distribuidas aproximadamente sobre la misma curva de nivel. Al centro de cada parcela se estableció una parcela circular de 3 m de radio para el muestreo de vegetación arbustiva. De esta manera, en cada sitio se muestreó una superficie total de 0.1 ha para la vegetación arbórea y de 0.03 ha para la arbustiva. Se midió el diámetro a la altura del pecho (a 1.30 m a partir de la base del tronco, DAP) de todos los árboles con un DAP > 2.5 cm y la longitud máxima, d1 y la longitud perpendicular a d1, d2, de la copa de cada arbusto muestreado. Además, se estimó la densidad de árboles muertos y la de plántulas en las parcelas para árboles.
La cobertura del dosel se estimó en el centro de las 10 parcelas de cada sitio por medio de una fotografía hemisférica digital obtenida en otoño, usando una lente de 180° adaptada a una cámara Nikon D40. Ésta se colocó sobre un trípode, se niveló para que quedara horizontal y se orientó para coincidir la parte superior de la fotografía con el norte (Frazer et al., 1999). Se usó el programa Gap Light Analyzer para corregir la distorsión inherente en este tipo de fotografías y así calcular la cobertura total del dosel en cada parcela (Frazer et al., 1999). Las imágenes se dividieron en 90 regiones azimutales y 45 cenit. El valor umbral de color para distinguir las áreas vegetales del cielo fue 126.
La condición de superficie de suelo se estimó con el método de intercepción de línea (Canfield, 1941). En cada sitio se trazaron 10 líneas de 20 m cuyo punto medio se hizo coincidir con el centro de cada parcela. Así, se cubrió un total de 200 m por sitio. En cada línea, se midió la longitud total interceptada por mantillo (materia vegetal muerta), cobertura vegetal, rocas, suelo desnudo y heces (del Castillo, 2000). Análisis estadísticos. Se obtuvieron curvas de acumulación de especies por sitio y por forma de vida (arbustos y árboles) con el programa Estimates (Colwell, 1996), por medio de 50 muestras aleatorias de los parcelas por sitio. Las curvas obtenidas se ajustaron con el modelo de dependencia lineal (Moreno, 2001). La diversidad se estimó con el índice de Shannon–Wiener H' = Σ pi (ln pi), donde pi es la densidad relativa de la especie i en cada sitio de muestreo (Moreno, 2001).
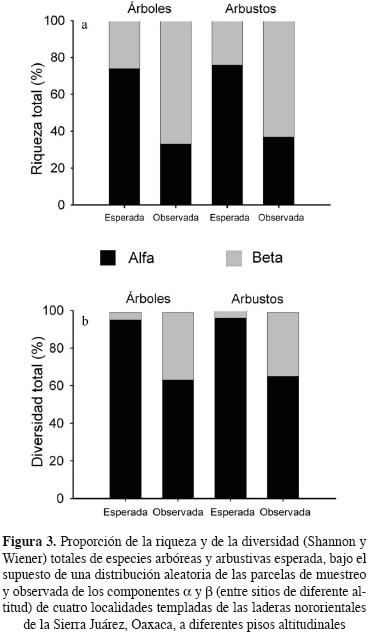
La riqueza y diversidad de especies totales (diversidad y) se dividió en sus componentes α y β usando el modelo aditivo de Veech y Crist (2007) y su programa Partition para arbustos y árboles con base en la matriz de abundancias del total de especies encontradas en cada forma de vida. Se utilizó un sólo nivel de análisis, con un diseño de muestras balanceado y un método de aleatorización basado en individuos. Las diferencias en composición entre pares de sitios para especies arbóreas y arbustivas se analizaron por separado con el índice de complementariedad, que está basado en datos de incidencia: C= 100 [(Sj+ Sk) – 2Vjk)/ [(Sj+ Sk) – Vjk]. Sj y Sk son el número de especies en los sitios j y k respectivamente. Vjk es el número de especies compartidas en tales sitios. La complementariedad varía entre 0%, cuando los dos sitios son idénticos, y 100%, cuando los dos sitios no comparten especies comunes (Colwell y Codding–ton, 1994). La frecuencia de cada especie se obtuvo a partir del número de muestreos donde se encontraron individuos de esa especie dividida entre el número de muestreos totales en cada sitio.
El área basal de cada árbol, π(DAP/2)2, la cobertura de cada arbusto, π [1/4 (d1+d2)]2, y la densidad de cada especie se calcularon a partir del número de individuos presentes en las parcelas de muestreo extrapolados a una hectárea. Se elaboraron histogramas de la distribución de clases de DAP de árboles y de diámetro de cobertura de arbustos de cada sitio de muestreo para obtener una primera aproximación de los niveles de reclutamiento. Las cantidades de heces, mantillo, cobertura vegetal, rocas y suelo desnudo se expresaron en proporciones. Las medias y varianzas de cobertura entre sitios se compararon con la prueba no paramétrica de Kruskal–Wallis y de Levene respectivamente.
Para pronosticar los posibles efectos de la vegetación asociados con el cambio climático global se tomaron en cuenta: (a) Las relaciones entre la temperatura y precipitación media anuales con la altitud descritos en la sección de área de estudio, (b) la altitud actual de los ecotonos encontrados estimada como la distancia media entre dos puntos de muestreo adyacentes que difieren en tipo de vegetación y (c) las proyecciones de cambio climático para el año 2030 en temperatura y precipitación solicitadas ex profeso al Moscow Forestry Sciences Laboratory <http://forest.moscowfsl.wsu.edu/climate/customData/> para las coordenadas y altitudes de esos ecotonos. Para el presente estudio se escogieron las proyecciones del modelo climático del Hadley Centre (HA–DCM3) que se basan en modelos generales de circulación, proporcionan proyecciones relativamente conservadoras, y se han usado en otros estudios de cambio climático para México, como el de Gómez–Mendoza y Arriaga (2007) sobre pinos y encinos mexicanos. De los posibles escenarios en los que se basan estas proyecciones, se escogió el A2 pues se basa en el supuesto de que el petróleo y el carbón se usarán hasta que se acaben y que el cambio tecnológico dirigido a mitigar los efectos de la emisión de gases de invernadero será desigual entre países desarrollados y no desarrollados, lo cual parece ser más cercano a la realidad que otros escenarios como el A1 que presuponen la difusión rápida y global de cambios tecnológicos y una rápida convergencia de ingresos entre diferentes regiones de la tierra (ver <www.ipcc–data.org>).
Resultados
Tipos de vegetación. Se identificaron tres tipos de vegetación con base en las densidades y composición florística obtenidas (Apéndice 1) y de acuerdo con la clasificación de Rzedowski (1978). En todos los sitios los encinos fueron especies dominantes, pero su abundancia y forma de vida varió entre sitios. La localidad más baja, Reynoso, fue un encinar arbustivo donde el 74% de los individuos fueron encinos principalmente arbustivos. Quercus glaucoides, Q. obtusata y Q. castanea fueron las especies dominantes. Al aumentar tan sólo 60 m la elevación y prácticamente sobre la misma orientación, en El Cerezal, la vegetación cambió a bosque de encinos (90% encinos), con Q. obtusata como especie dominante. A 700 m más arriba, en El Cerezo, continúa el bosque de encino, aunque con menor frecuencia de encinos (62%) y Quercus aff. laurina es la especie dominante. Por la abundancia de pinos, también podría considerarse como un bosque de encino–pino. Corral de Piedra, a unos 220 m por arriba de El Cerezo presenta un bosque mixto de pino–encino dominado por Pinus pseudostrobus (58%) y Q. crassifolia (41.9%).
Composición florística. En total se registraron 19 familias y 35 géneros distribuidos en 60 especies: 25 arbóreas y 42 arbustivas. Las familias con mayor diversidad de especies fueron Fagaceae (13 especies), Asteraceae (12), Fabaceae (7), Ericaceae (6) y Pinaceae (5). Siete especies presentaron ambas formas de vida. no hubo ninguna especie común a los cuatro sitios (Apéndice 1).
Abies hickelii se encuentra en peligro de extinción de acuerdo con la Norma Oficial Mexicana (N0M–059–EC0L–2001), mientras que la International Union for Conservation of Nature (IUCN, 2008), lo clasifica, junto con Cornus disciflora, como especie vulnerable y a Pinus patula, P. teocote, P. pseudostrobus, Quercus depressa y Arbutus xalapensis como especies de bajo riesgo.
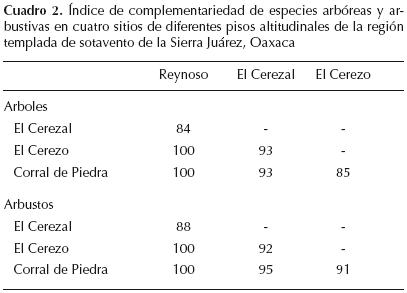
Diversidad y sus componentes. En todos los muestreos, el número de especies registradas coincidió con el valor asintótico predicho por el modelo de dependencia lineal (Figura 2). La riqueza de especies arbóreas en 0.1 ha y la diversidad estimada con el índice de Shannon–Wiener fueron menores en el encinar arbustivo y tuvieron valores muy similares en los tres bosques estudiados (Cuadro 1). Los arbustos variaron más que los árboles en riqueza de especies e índice de Shannon–Wiener. La diversidad de árboles tuvo su valor más bajo en el encinar arbustivo, mientras que en los bosques tuvo valores similares. La diversidad de arbustos disminuyó con la altitud (Cuadro 1).
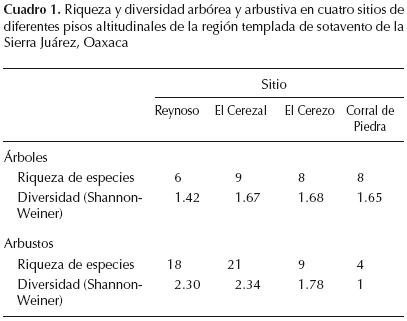
La diversidad γ, expresada en términos de riqueza de especies o de diversidad ecológica de Shannon–Wiener, tanto para especies arbóreas como arbustivas, mostró un componente de diversidad β superior al esperado bajo el supuesto de una distribución aleatoria de los individuos entre las parcelas de muestreo (Figura 3). En cambio, el componente a fue menor al esperado. De hecho, la diferenciación florística entre sitios, incluso aquéllos con poca diferencia altitudinal, Reynoso–El Cerezal y El Cerezo–Corral de Piedra, fue de 92% en promedio para árboles y arbustos de acuerdo con el índice de complementariedad (Cuadro 2).
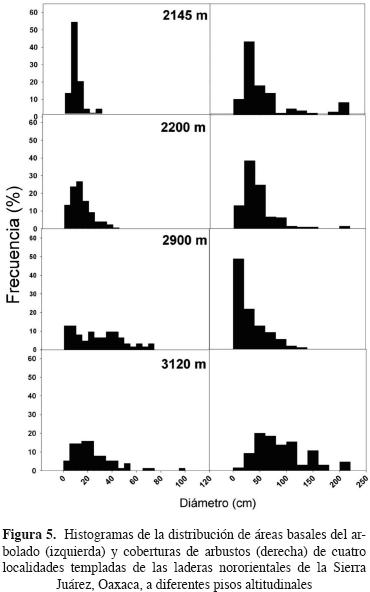
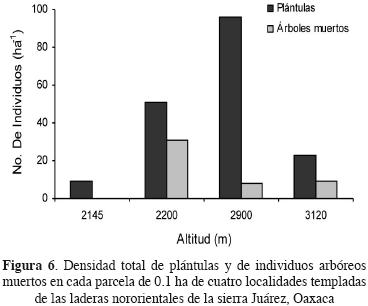
Atributos estructurales de la vegetación. La mayor área basal en Reynoso, El Cerezal y El Cerezo fue de especies de Quercus; mientras que en el sitio más elevado fue de Pinus. Los estimadores de biomasa indican que ésta sigue patrones opuestos y significativos en arbustos y árboles con respecto a la altitud: la cobertura de arbustos disminuyó mientras que el área basal arbórea aumentó significativamente (Figura 4a y 4b). De hecho, el área basal arbórea estuvo negativamente correlacionada con la cobertura arbustiva (Figura 4c). La distribución de diámetros de fuste a la altura de pecho (DAP) de individuos arbóreos con más de 2.5 cm de DAP muestra que en todos los sitios existe un déficit de la clase diamétrica más pequeña y ésta es particularmente baja en Corral de Piedra, el sitio más elevado (Figura 5). La distribución de diámetro de cobertura promedio de los arbustos muestra también un déficit de los individuos más pequeños, con la excepción de El Cerezo que muestra la clásica distribución de J invertida. Los dos sitios con elevaciones extremas presentaron los valores más bajos de densidad de plántulas (Figura 6). El bosque de menor altitud, El Cerezal, presentó la mayor densidad de árboles muertos en pie de los tres bosques analizados mientras que en el encinar arbustivo éstos no se detectaron, quizás por la baja abundancia de árboles en este sitio (Figura 6).

Cobertura del dosel y condición de superficie del suelo. La cobertura del dosel de los sitios estudiados varió significativamente en su media (Prueba de Kruskal Wallis, H = 13.6, P = 0.003) y su varianza (Prueba de Levene, F3,36 = 37.98, P = 0.0001). El encinar arbustivo presentó la varianza más alta y la media más baja, mientras que los tres sitios de bosque analizados tuvieron valores de cobertura similares (Figura 7).

A nivel de superficie del suelo, dominó la categoría de mantillo seguida por la cobertura vegetal en todos los sitios (Figura 7). Los porcentajes de mantillo y suelo desnudo estuvieron negativamente correlacionados (r = –0.76, P < 0.001), al igual que la cobertura de dosel y el suelo desnudo (r = –0.73, P < 0.001), mientras que la cobertura de dosel y el mantillo estuvieron positivamente correlacionados (r = 0.87, P < 0.05). La cobertura vegetal a nivel del suelo y la cobertura del dosel se correlacionaron negativamente (r = –0.64 P < 0.001), y la cobertura vegetal y el suelo desnudo estuvieron positivamente correlacionados (r = 0.46, P = 0.002) (Figura 8). Una carpeta de gramíneas a nivel del suelo sólo fue detectada en el encinar arbustivo de Reyno–so. Cuando se excluyeron los valores de cobertura de esta carpeta de la cobertura de vegetación a nivel del suelo, se detectó una correlación positiva entre cobertura del dosel y la cobertura vegetal a nivel del suelo (r = 0.33, P < 0.05) y una correlación negativa entre suelo desnudo y cobertura vegetal a nivel del suelo (r = –0.44, P < 0.05).

Cambio climático. Se identificaron dos ecotonos en la orientación que corresponde a la de los sitios de muestreo (norte, aproximadamente). El primero a una altitud estimada de 2,172 m que separa el encinar arbustivo del bosque de encino y el segundo a 3,010 m que separa al bosque de encino del bosque de pino–encino. El modelo climático del Hadley Centre (http://www.ipcc–data.org) bajo el escenario A2 para 2030 predice un decremento de precipitación de 7.3 y 8.3% para el primer y segundo ecotono respectivamente, mientras que las predicciones para aumento de temperatura son más pesimistas: 10.6 y 14.3%. Con base en estos resultados y las regresiones precipitación altitud ya descritas estimamos que los niveles precipitación media anual estarán ubicados 151 y 171 m por arriba de la altitud actual del primer y segundo ecotono respectivamente y 177 y 277 m si usamos las predicciones de cambio de temperatura.
Discusión
Vegetación y altitud. La composición y estructura de la vegetación cambió drásticamente aun entre localidades con poca diferencia altitudinal. El encinar arbustivo, en el piso altitudinal más bajo, contrasta con los bosques estudiados por la dominancia de arbustos, la escasa y heterogénea cobertura del dosel y una carpeta de gramíneas a nivel del suelo. Por su fisonomía y composición corresponde a un tipo de chaparral, algo más mésico que el descrito por Valiente–Banuet et al. (1998) en el Valle de Tehuacán. En todos los bosques, en cambio, la cobertura del dosel fue mayor y más homogénea y, quizás por ello, no existe una carpeta de gramíneas y el mantillo fue más abundante (Figura 4 y 8).
Resultan notables las diferencias entre el encinar arbustivo de Reynoso y el bosque de encino de El Cerezal: ambos comparten orientación similar, mismo sustrato, varían sólo 60 m en altitud y distan 4.6 km. Es poco probable que estas diferencias se expliquen por niveles más elevados de disturbio en Reynoso. En todo caso, El Cerezal por su mayor proximidad (1.8 km) y accesibilidad para los pobladores de Santa Catarina Ixtepeji, el poblado más cercano, debería estar expuesto a mayor perturbación antropogénica. Estas diferencias, en cambio, pueden deberse a una menor disponibilidad de recursos de Reynoso, más pedregoso que El Cerezal, según el análisis de condición de superficie del suelo. Esto sugiere un menor volumen de suelo y menores recursos hídricos y nutrimentales. Las diferencias de temperatura y precipitación medias anuales entre Reynoso y Cerezal calculadas con base en las mencionadas relaciones clima–altitud son 0.4 °C y 35.1 mm y pueden contribuir a explicar estos cambios. La substitución de arbustos por árboles como especies dominantes con el incremento en altitud ha sido reportada en numerosos estudios y es atribuida a variaciones climáticas (e.g., Whittaker y Niering, 1965; Santos–Guerra et al., 2007). En particular, los encinares arbustivos mexicanos ocupan áreas intermedias entre vegetación semiárida y bosques subhúmedos (Miranda y Hernández–X., 1963; Rzedowski, 1978).
La composición y estructura también variaron ampliamente cerca del límite superior altitudinal de esta sierra, en Corral de Piedra (bosque de pino–encino) y El Cerezo (bosque de encino), con sólo 220 m de diferencia altitudinal. En este caso, las diferencias climáticas esperadas son más acentuadas: Corral de Piedra debe ser 1.5 °C más frío y 77 mm más lluvioso que El Cerezo con base en las relaciones clima–altitud obtenidas. Datos de humedad del suelo obtenidos en estas localidades corroboran que Corral de Piedra es más húmedo que El Cerezo (Vázquez–Mendoza, 2008).
Composición florística. Cuatro observaciones de nuestros resultados destacan en cuanto a composición de la vegetación estudiada. a) Las Fagáceas y Asteráceas fueron las familias más diversas y frecuentes, en consistencia con estudios florísticos de bosques templados mexicanos (Saynes, 1989; Cruz y Téllez–Valdez, 2004; Encina–Domínguez et al., 2007; Martínez–Meléndez et al., 2008); b) los encinos fueron especies dominantes en todos los sitios pero tienden a disminuir con la altitud a favor de los pinos; c) la tendencia del número de familias, géneros y especies a disminuir con altitud, en coincidencia con las observaciones de Boyle (1996) en esta sierra; y d) la mayoría de las especies muestra ámbitos ecológicos restringidos. Las causas de esta distribución restringida necesitan explorarse porque diferentes escenarios como dispersión limitada, gradientes ambientales intermedios (ni muy pronunciados ni poco pronunciados), o especiación parapátrica, conducen a este resultado (Doebeli y Dieckmann, 2003). una dispersión limitada ha sido encontrada para muchas especies de los bosques mesófilos cercanos de la Sierra Juárez (del Castillo y Pérez–Ríos, 2008), pero aún no existe información sobre la capacidad de dispersión de las especies de ambientes templados en esta región.
Diversidad y altitud. La escasa diferencia en riqueza de especies arbóreas con respecto a la altitud (Cuadro 1) es similar a la de la Sierra de Manantlán (Vázquez y Givnish, 1998), pero contrasta con estudios teóricos que predicen un decremento monotónico de la diversidad de especies con la altitud, bajo el fundamento de que ésta está relacionada con la disponibilidad de energía y la productividad (ver Rahbek, 1997; Brown et al., 2004). En cambio, es posible que ninguno de los ambientes templados extremos estudiados de la Sierra Juárez tenga condiciones favorables para mantener una gran diversidad de árboles. Corral de Piedra, el sitio más elevado, es más húmedo pero su temperatura media anual estimada es baja. En el otro extremo, la temperatura de Reynoso es más favorable pero la precipitación estimada es escasa y la humedad del suelo fue la más baja (Vázquez–Mendoza, 2008). Ambos extremos parecen tener limitaciones ambientales relativamente fuertes; pero entre éstas, la humedad parece la más grave como lo sugiere la menor diversidad arbórea y la menor productividad del sitio más bajo (ver más adelante). En bosques secos de encinos del sur de España, la diversidad arbórea aumenta con la altitud pues las zonas bajas, son también las más cálidas y más secas (Hervás–Serrano, 2002). Así, es posible que las relaciones entre riqueza arbórea y altitud estén condicionadas por la disponibilidad de humedad.
Este planteamiento parece reforzarse al comparar la diversidad arbórea del presente estudio con la de los bosques mesófilos de esta misma sierra. En promedio, la riqueza de especies arbóreas de los tres bosques templados estudiados en 0.1 ha corresponde al 25% de la encontrada en esa misma superficie y en esta misma sierra en bosques mesófilos de montaña a 1,850 m (31 especies, Blanco–Macías, 2001; del Castillo y Blanco–Macías, 2007). Los suelos de estos bosques mesófilos son muy infertiles: su acidez es muy elevada y, consecuentemente, presentan niveles tóxicos de aluminio intercambiable y concentraciones exiguas de fósforo y bases intercambiables (Bautista–Cruz y del Castillo, 2005). Los suelos de los sitios estudiados deben ser menos ácidos, pues yacen sobre roca calcárea en contraste con los esquistos de los bosques mesófilos de esta sierra, y son abundantes en encinos. Ambos factores disminuyen la acidez del suelo (Waring y Schlesinger, 1985). Por lo tanto, la menor riqueza de especies encontrada en bosques templados de sotavento difícilmente podría explicarse por una menor fertilidad del suelo. Es posible que en los bosques mesófilos se combinen temperaturas y precipitaciones más benignas que en los bosques templados estudiados que reciben entre 47 y 20% menos de precipitación media anual y tienen temperaturas medias anuales entre 24 y 58% más bajas que las de los bosques mesófilos cercanos, con base en datos meteorológicos de localidades cercanas (Servicio Meteorológico Nacional, 2009). Así, la menor diversidad de especies arbóreas puede atribuirse, al menos parcialmente, a condiciones menos favorables (ambientes más fríos y más secos) que la encontrada en bosques mesófilos. Estas aseveraciones son consistentes con los análisis globales de Francis y Currie (2003) que señalan a los factores climáticos como los principales determinantes de la diversidad global de angiospermas; y los regionales de González–Espinosa et al. (2004) quienes hallaron a la evapotranspiración actual como el principal factor limitante, de la diversidad arbórea de Chiapas. Dicha variable está positivamente relacionada con la temperatura media e inversamente relacionada con la precipitación media anual.
La diversidad arbustiva pudo haber disminuido con la altitud, al menos en parte, por competencia con los árboles que fueron más abundantes en los sitios de mayor elevación, pues la cobertura arbustiva y el área basal arbórea estuvieron negativamente correlacionadas. Un dosel cerrado limita la cantidad de luz que pasa al sotobosque, modifica el micro–hábitat y la composición de arbustos y herbáceas generalmente más sensibles a variaciones microclimáticas (Decoq, 2002; Chang–Ming et al., 2005). Además, los arbustos por su menor talla son probablemente menos demandantes de humedad que los árboles y, de hecho, tienden a dominar en climas más secos como Reynoso. Estos resultados coinciden con lo encontrado en regiones montañosas tropicales (Vázquez y Givnish, 1998; Chang–Ming et al., 2005) y templadas secas (Encina–Domínguez et al., 2007).
División aditiva de la diversidad. Estudios previos (Saynes, 1989; Boyle, 1996; Hernández, 2007) y el presente realizados en la vegetación templada de sotavento de la sierra Juárez muestran una diversidad a relativamente baja, particularmente de árboles. Sin embargo, el análisis de la partición aditiva de la diversidad muestra que la riqueza de estos ecosistemas estriba principalmente en su gran recambio de especies aun entre sitios cercanos. Más aún, los tres tipos de vegetación encontrados difieren de los descritos en otras regiones templadas de esta sierra, como los bosques dominados por Quercus dysophylla y Q. laurina en la porción meridional (Saynes, 1989); el bosque de Pinus ayacahuite y Quercus sp. en la pendiente orientada hacia el Golfo de México (Boyle, 1996); el bosque de Quercus ocoteifolia en Capulalpam de Méndez (Hernández, 2007) y el bosque con Pseudotsuga menziessi en las partes altas de la sierra (Acevedo, 1998). Por lo tanto, analizar la diversidad o riqueza de especies basadas sólo en su componente a puede subestimar grandemente la diversidad total. Será necesario realizar estudios más minuciosos de esta región que contemplen dividir la diversidad total en sus componentes, y analizar con más detalle la diversidad P como ya se ha hecho en otros tipos de vegetación en México (Balvanera et al., 2002).
Productividad y atributos estructurales. Dentro de los límites térmicos en los que operan los eucariontes, es bien sabido que la cinética de las reacciones bioquímicas, y por ende, el metabolismo, aumentan exponencialmente con la temperatura. Por ello, se espera que, la productividad y la diversidad aumenten también (Brown et al., 2004). Al contrario de esas predicciones, los sitios más fríos de las regiones templadas de sotavento de la Sierra Juárez son probablemente las más productivos por lo siguiente: (1) Los árboles dominan en estos sitios a diferencia de los arbustos que lo hacen en las regiones bajas; (2) el área basal arbórea promedio junto con (3) la cobertura total del dosel aumentaron con la altitud; y (4) los sitios de mayor elevación tuvieron los individuos de mayor DAP. Estos resultados sugieren que el principal factor limitante en estas regiones templadas no es la temperatura, sino la humedad. La cantidad de mantillo también aumentó con la altitud lo que puede indicar una mayor productividad, pero también menores tasas de descomposición al disminuir la temperatura. Con mayor humedad, como en los bosques mesófilos cercanos, de las regiones de barlovento de esta sierra, el área basal arbórea total por hectárea supera entre 3 y 4 veces la de los bosques de sotavento estudiados ubicados a una altitud media de 1,900 m, ligeramente inferior a la de Reynoso (del Castillo y Blanco–Macías, 2007). La disminución de la cobertura arbustiva con la altitud probablemente está relacionada con la menor temperatura y la mayor humedad y cobertura de dosel que hay en altitudes más elevadas.
Estructura de clases diamétricas. La distribución de clases diamétricas es función del reclutamiento, el crecimiento y la mortalidad. En rodales no jóvenes y con reclutamiento constante, la distribución de clases diamétricas tiende a adquirir una forma de J invertida debido a una representación desproporcionadamente elevada de individuos pequeños (Weiner, 1988; Johnson et al., 1994; Silvertown y Charlesworth, 2001). En contraste, las distribuciones de diámetros obtenidas para arbustos y para árboles muestran un déficit marcado de estos individuos con excepción de los arbustos de El Cerezo. El bajo reclutamiento o altos niveles de mortalidad que genera este tipo de resultado pueden deberse a competencia asimétrica en la que los individuos de mayor talla inhiben el establecimiento o incrementan la mortalidad de los individuos más pequeños al reducirles la cantidad de luz solar, particularmente en especies heliófilas (Silvertown y Charlesworth, 2001). Sin embargo, la similitud de las distribuciones de diámetros observada aún entre sitios con coberturas del dosel contrastantes como el encinar arbustivo y los bosques estudiados sugiere que el bloqueo de luz solar por el dosel no es una explicación común. Tampoco lo sería para la distribución de diámetros de cobertura de El Cerezo donde los arbustos pequeños fueron los más abundantes, pero la cobertura del dosel es elevada y similar a la de los otros bosques estudiados. Las cohortes de la clase diamétrica más pequeña de arbustos y árboles probablemente estén formadas en gran parte por individuos jóvenes originados en la última década del siglo pasado que registró temperaturas y sequías extraordinarias, si suponemos una correlación positiva entre la edad de las plantas y su tamaño. En particular, 1998 fue el año más caliente desde 1860 (US Global Change Information Office, 2003). Esta sequía pudo haber contribuido a la escasez de individuos jóvenes observada en todos los sitios. Los arbustos de El Cerezo probablemente no hayan mostrado esta disminución por ser el sitio más protegido de todos los estudiados. El mayor número de plántulas encontrado en este sitio es consistente con este resultado. Sea cual fuere la explicación, la reducida proporción de individuos juveniles de talla pequeña y las bajas densidades de plántulas encontrada indican una baja regeneración.
Cambio climático. Las proyecciones de cambio climático en combinación con las relaciones clima–altitud obtenidas predicen que la temperatura y la precipitación media anuales se ubicarán en puntos más elevados en la sierra y que el cambio climático será más acentuado en los sitios más elevados. En particular, las condiciones de precipitación a las que ahora se ubica el encinar arbustivo se desplazarán al menos unos 175 m por arriba de los niveles actuales, por lo que el encinar arbustivo se verá favorecido sobre el bosque de encino pino en los partes bajas de la región templada de la sierra. En los sitios elevados, los bosques de encino tendrán condiciones más favorables que los bosques de pino, y aún bajo las proyecciones más optimistas obtenidas serán muy escasos los sitios en la sierra que puedan brindar condiciones climáticas similares a las de precipitación y temperatura donde actualmente está ubicada el bosque de pino–encino, pues existen pocas prominencias con altitudes por arriba de 3,000 m. Sin embargo, estas estimaciones son sólo una primera aproximación. Estudios más detallados deberán tomar en cuenta las variaciones microambientales que también influyen en la vegetación como lo sugiere este estudio. Especies de altura como Pinus hartwegii, claramente estarán en gran riesgo de extinción. En general, los bajos niveles de reclutamiento observados en todos los sitios sugieren condiciones adversas para el establecimiento. El cambio climático puede ser una de ellas. Estas predicciones coinciden con lo que encontrado en otras regiones de México. Existe evidencia basada en estudios de Arctostaphylos pungens de la retracción de bosques templados hacia mayores elevaciones y su substitución por vegetación arbustiva en Durango (Márquez–Linares et al., 2006). La substitución de comunidades vegetales de mayor biomasa por otras de menor biomasa puede afectar negativamente la captación de CO2 en esta sierra.
Con base en un meta análisis que incluyó datos de más de 1,700 especies, Parmesan y Yohe (2003), calculan un desplazamiento medio de 6.1 km por década hacia las regiones polares de estas especies ocasionado por el cambio climático global. De manera que nuestras estimaciones son conservadoras con relación a este valor. Dada la elevada longevidad de los árboles comparada con la de otras especies, la evidencia de estos cambios climáticos en las poblaciones deberá buscarse primeramente examinando los atributos demográficos más que cambios de desplazamiento de áreas. Estos resultados parecen encontrar apoyo en la elevada densidad de árboles jóvenes muertos del bosque más bajo estudiado y la baja tasa de reclutamiento de nuevos individuos encontrado en Corral de Piedra, el sitio más elevado estudiado. Una elevada densidad de árboles jóvenes muertos también fue observada en los bosques de pino–encino de la reserva de la biosfera de la Michilía, en Durango (Márquez–Linares et al., 2006) y en los bosques de encino de Guanajuato, Aguascalientes y Nayarit (Alvarado–Rosales et al., 2007) debido principalmente a la sequía ocasionando estrés hídrico y mayor vulnerabilidad a plagas.
Recomendaciones para conservación. La elevada diversidad P observada y los posibles desplazamientos de las especies hacia sitios más elevados requieren aumentar la extensión altitudinal de reservas como la de Santa Catarina Ixtepeji. También recomendamos el establecimiento de áreas protegidas distribuidas en corredores que incluyan las porciones más altas de la Sierra Norte de Oaxaca, a fin de fomentar el flujo genético y migración entre poblaciones cercanas de especies de altitudes elevadas y con ello tratar de disminuir la magnitud de los efectos estocásticos ecológicos y genéticos asociados con poblaciones de tamaño pequeño. Recomendamos, además, explorar la posibilidad de acciones más contundentes para conservar la biodiversidad como plantados extensivos para aumentar el tamaño poblacional, programas de mejoramiento genético y migración asistida (ver del Castillo et al., 2009).
Agradecimientos
Los autores agradecen el financiamiento de la Comisión Europea a través del proyecto INCO V program (RE–FORLAN FP6–2004–INCO–DEV–3 032132) y del Instituto Politécnico Nacional; a la Dra. Susana Valencia por la identificación de los encinos; a Raúl Rivera García por el apoyo logístico, la interpretación de imágenes de satélite y el mapa de la Figura 1; a Eder Gil Méndez por su trabajo de campo, a Cuauhtémoc Sáenz Romero por sus comentarios sobre cambio climático. Remedios Aguilar y Sadoth Vázquez Mendoza y dos revisores anónimos leyeron el manuscrito y ofrecieron valiosas críticas y sugerencias. YzE disfrutó una beca del CONACYT para apoyar sus estudios de maestría en el Programa de Conservación y Aprovechamiento de los Recursos Naturales del CIIDIR Oaxaca del Instituto Politécnico Nacional.
Literatura citada
Acevedo R.R. 1998. Estudio sinecológico del bosque de Pseudotsuga menziessi (Mirb.) Franco var. oaxacana Debreczy & Rácz, en la zona de Santa Catarina Ixtepeji, Oaxaca, México. Tesis de licenciatura, Universidad Autónoma Chapingo, México. 105 pp. [ Links ]
Alfaro–Sánchez G. 2004. Suelos. En: García–Mendoza A.J., Ordóñez–Díaz M.J. y Briones– Salas M.A. Eds. Biodiversidad de Oaxaca. pp. 55–65. Instituto de Biología, Universidad Nacional Autónoma de México, Fondo Oaxaqueño para la Conservación de la Naturaleza, World Wildlife Fund. México D.F. [ Links ]
Alvarado–Rosales D., Saavedra–Romero L. de L., Almaraz–Sánchez A., Tlapal–Bolaños B., Trejo–Ramírez O., Davison J.M., Kliejunas J.T., Oak S., O Brien J.G., Orozco–Torres F. y Quiroz–Reygadas D. 2007. Agentes asociados y su papel en la declinación y muerte de encinos (Quercus, Fagaceae) en el centro oeste de México. Polibotánica 23:1–21 [ Links ]
Balvanera P, Lott E., Segura G., Siebe C. y Islas A. 2002. Patterns of 6–diversity in a Mexican tropical dry forest. Journal of Vegetation Science 13:145–158. [ Links ]
Bautista–Cruz M.A. y del Castillo R.F. 2005. Soil changes during secondary succession in a tropical montane cloud forest area. Soil Science Society of America Journal 69:906–914 [ Links ]
Blanco–Macías M. 2001. Análisis sucesional del bosque mesófilo de montaña en El Rincón, Sierra Norte de Oaxaca. 2001. Tesis de Licenciatura. Universidad Nacional Autónoma de México, Iztacala. Estado de México. 60 pp. [ Links ]
Boyle B.L. 1996. Changes in altitudinal and latitudinal gradients. Tesis Doctoral. School of Arts and Sciences, Washington University, Washington. pp. 275 [ Links ]
Bray B.D., Durán–Medina E., Merino–Pérez L., Torres–Rojo J.M. y Velásquez–Montes A. 2007. Nueva evidencia: Los bosques comunitarios de México protegen el ambiente, disminuyen la pobreza y promueven la paz social. Informe de Investigaciones. Universidad Nacional Autónoma de México, Centro de Investigación y Docencia Económica, Instituto Politécnico Nacional, Universidad Internacional de Florida, Consejo Civil Mexicano para la Agricultura Sostenible y Offset Santiago, México. [ Links ]
Brown J.H., Gillooly J.F., Allen A.P, Savage V.M. y West G.F. 2004. Toward a metabolic theory of ecology. Ecology 85:1771-1789 [ Links ]
Canfield R.H. 1941. Application of the line interception method in sampling range vegetation. Journal of Forestry 39:388– 394. [ Links ]
Challenger A. 1998. Utilización y Conservación de los ecosistemas terrestres de México. Pasado, Presente y Futuro. Comisión Nacional para el Conocimiento y Uso de la Biodiversidad, Instituto de Biología, Universidad Nacional Autónoma de México y Agrupación Sierra Madre S. C. México, D.F. [ Links ]
Challenger A. 2003. Conceptos generales acerca de los ecosistemas templados de montaña de México y su estado de conservación. En: Sánchez O., Vega E., Peters E., Monroy–Vilchis. Eds. Conservación de ecosistemas templados de montaña en México, pp.17–42, Instituto Nacional de Ecología. México. [ Links ]
Colwell R.K.1996. EstimateS, Statistical estimation of species richness and shared species from samples <viceroy.eeb.uconn. edu/estimates> (consultada en diciembre, 2008). [ Links ]
Colwell R.K. y Coddington J.A. 1994. Estimating terrestrial biodiversity througth extrapolation. Philosophical transactions of the Royal Society (Series B) 345:101–118. [ Links ]
Cotler E. 2003. Características y manejo de suelos en ecosistemas templados de montaña. En: Sánchez, O., Vega E. Peters E. y Monroy–Vilchis. Eds. Conservación de ecosistemas templados de montaña en México. pp.153–171, Instituto Nacional de Ecología. México [ Links ]
Crist T.O., Veech J.A., Gering J.C. y Summerville K.S. 2003. Partitioning species diversity across landscapes and regions: a hierarchical analysis of a, P, and y diversity. American Naturalist 162:734–743. [ Links ]
Decoq G. 2002. Patterns of plant species and community diversity at different organization level in a forested riparian landscape. Journal of Vegetation Science 13:91–106 [ Links ]
del Castillo R.F. 2000. Composición y estructura de una nopalera bajo situaciones contrastantes de exposición de ladera y herbivoría. Boletín de la Sociedad Botánica de México 65:5–22 [ Links ]
del Castillo R.F. y Blanco–Macías A. 2007. Secondary succession under a slash–and–burn regime in a tropical montane cloud forest: soil and vegetation characteristics. En: Newton A.C. Ed. Biodiversity loss and conservation in fragmented forest landscapes, pp.158–180. CAB International, Wallingford. [ Links ]
del Castillo R.F. y Pérez–Ríos A. 2008. Changes in seed rain during secondary succession in a tropical montane cloud forest region in Oaxaca, México. Journal of Tropical Ecology 24:433–444 [ Links ]
del Castillo R.F., Trujillo–Argueta S. y Sáenz–Romero C. 2009. Pinus chiapensis, a keystone species: genetics, ecology and conservation. Forest Ecology and Management 257:2201–2208. [ Links ]
Doebeli M. y Dieckmann U. 2003. Speciation along environmental gradients. Nature 421:259–264. [ Links ]
Encina–Domínguez J., Zárate–Lupercio A., Valdéz–Reyna J. y Villareal–Quintanilla J.A. 2007. Caracterización ecológica y diversidad de los bosques de encino de la sierra de Zapalinamé, Coahuila México. Boletín de la Sociedad Botánica de México 81:51–63 [ Links ]
Francis A.C. y Currie D.J. 2003. A globally consistent richness–climate relationship for angiosperms. American Naturalist 161:523–536. [ Links ]
Frazer G.W., Canham C.D. y Lenrtzman K.P 1999. Gap Light Analyzer (GLA). Version 2.0: Imaging Software to extract canopy structure and gap light transmission indices from true–color hemispherical photographs. Simon Fraser University, Burnaby British Columbia and the Institute of Ecosystem Studies. New York. http.www.red.sfu.ca/forestry/dowloads/gap light analyzer.htm. (Consultada en noviembre, 2009). [ Links ]
García–Mendoza A.J. 2004. Integración del conocimiento florístico del estado. En: García–Mendoza A.J., Ordoñez–Díaz M.J. y Briones–Salas M.A. Eds. Biodiversidad de Oaxaca, pp.305-325. Instituto de Biología, Universidad Nacional Autónoma de México, Fondo Oaxaqueño para la Conservación de la Naturaleza, World Wildlife Fund. México D.F. [ Links ]
Gómez–Mendoza L. y Arriaga L. 2007. Modeling the effect of climate change on the distribution of oak and pine species of Mexico. Conservation Biology 21:1545–1555. [ Links ]
González–Espinosa M., Rey–Benayas J.M., Ramírez–Marcial N., Huston M.A. y Golicher D. 2004. Tree diversity in the northern Neotropics: regional patterns in highly diverse Chiapas, Mexico. Ecography 27:741–756. [ Links ]
Hernández L.I. 2007. Cambios en la estructura y composición del bosque bajo dos tratamientos silviculturales en la comunidad de Calpulalpam de Méndez, Ixtlán Oaxaca. Tesis de Maestría. Centro Agronómico Tropical de Investigación y Enseñanza. Turrialba, Costa Rica. pp 90. [ Links ]
Hervás–Serrano J.L. 2002. Diversidad de las provincias boscosas en el centro norte de la provincia de Jaén (Sur de la Península Ibérica). Blancoana 19:80–88 [ Links ]
INEGI [Instituto Nacional de Estadística y Geografía]. 1984. Carta geológica del estado de Oaxaca. Instituto Nacional de Geografía e Informática. México, D. F. [ Links ]
INEGI. 2000. Carta Geológica del estado de Oaxaca. E14–19. Instituto Nacional de Geografía e Informática. México, D.F. [ Links ]
IUCN [International Union for Conservation of Nature]. 2008. Red list. <www.iucnredlist.org/apps/redlist/search> (consultada en diciembre, 2008). [ Links ]
Johnson E.A., Miyanishi K. y Kleb H.. 1994. The hazards of interpretation of static age structure as shown by stand reconstruction in a Pinus contorta – Picea engelmannii forest. Journal of Ecology 82:923–931. [ Links ]
Körner, C. 2007. The use of 'altitude' in ecological research. Trends in Ecology and Evolution 22:569–574. [ Links ]
Lambers H., Chapin III F.S. y Pons T.L. 1998. Plant physiological ecology. Springer, New York. [ Links ]
Lande R., Engen S. y Sœther B.E. 2003. Stochastic population dynamics in ecology and conservation. Oxford University Press, Oxford. [ Links ]
Lorence D.H. y García–Mendoza A. 1989. Oaxaca, México. En: Campbell D.G. y Hammond. H.D. Eds. Floristic inventory of tropical countries: The status of plant systematics, collections and vegetation, plus recommendations for the future pp. 253-269. The New York Botanical Garden, Nueva York. [ Links ]
Márquez–Linares M.A., Jurado E. y González–Elizondo S. 2006. Algunos aspectos de la biología de la manzanita (Arctostaphylos pungens HBK) y su papel en el desplazamiento de bosques templados por chaparrales. Ciencia, Universidad Autónoma de Nuevo León 9:57–64. [ Links ]
Martínez–Meléndez J., Pérez–Farrera M.A. y Farrera–Sarmiento O. 2008. Inventario florístico del cerro "El Cebú" y zonas adyacentes en la reserva de la biosfera El Triunfo (polígono v) Chiapas. México. Boletín de la Sociedad Botánica de México. 82:21–40 [ Links ]
Masera O., Ordóñez M.J. y Dirzo R. 1997. Carbon emissions from Mexican Forest: current situation and long term scenarios. Climate Change. 35:265–295 [ Links ]
Miranda F. y Hernández–X. E. 1963. Los tipos de vegetación de México y su clasificación. Boletín de la Sociedad Botánica de México 28:29–179. [ Links ]
Mondragón–Chaparro D., Villa–Guzmán D.M., Escobedo–Sarti G.J. y Franco–Méndez A.D. 2006. La riqueza de bromelias epífitas a lo largo de un gradiente altitudinal en Santa Catarina Ixtepeji, Oaxaca, México. Naturaleza y Desarrollo 4:13–16 [ Links ]
Mondragón–Chaparro D. y Villa–Guzmán D.M. 2008. Estudio etnobotánico de las bromelias epífitas en la comunidad de Santa Catarina Ixtepeji, Oaxaca, México. Polibotánica 26:175–191. [ Links ]
Moreno C.E. 2001. Métodos para medir la biodiversidad. Programa Iberoamericano de Ciencia y Tecnología para el Desarrollo, Oficina Regional de Ciencia y Tecnología para América Latina y el Caribe, UNESCO, Sociedad Entomológica Aragonesa (SEA), Gorfi. España. [ Links ]
Mueller–Dombois D. y Ellenberg H. 1974. Aims and methods of vegetation ecology. Wiley, USA. [ Links ]
NOM_059_ECOL_2001. Norma Oficial Mexicana que determina las especies y subespecies de flora y fauna silvestres terrestres y acuáticas en peligro de extinción, amenazadas, raras y las sujetas a protección especial y que establece especificaciones para su protección. <www.Semarnat.gob.mx/Pages/inicio/aspx> [ Links ]
Ortiz–Pérez M.A., Hernández–Santana J.R. y Figueroa–Mah–Eng, J.M. 2004. Reconocimiento fisiográfico y geomorfológico. En: García–Mendoza A.J., Ordóñez–Díaz M.J. y Briones–Salas M.A. Eds. Biodiversidad de Oaxaca, pp.43–54, Instituto de Biología, Universidad Nacional Autónoma de México, Fondo Oaxaqueño para la Conservación de la Naturaleza, World Wildlife Fund, México D.F. [ Links ]
Parmesan C. y Yohe G. 2003. A globally coherent fingerprint of climate change impacts across natural systems. Nature 421:37–42. [ Links ]
Rahbek C. 1997. The relationship among area, elevation, and regional species richness in neotropical birds. American Naturalist 149:875–902. [ Links ]
Ryan M.G., Binkley D., Fownes J.H., Giardina C.P y Senock R.S. 2004. An experimental test of the causes of forest growth decline with stand age. American Naturalist 74:393–414. [ Links ]
Rzedowski J. 1978. Vegetación de México. Limusa. México [ Links ]
Sáenz–Romero C., Rehfeldt G.E., Crookston L. N., Duval P., St–Amant R. Beaulieu J. y Richardson B.A. 2010. Spline models of contemporary, 2030, 2060 and 2090 climates for Mexico and their use in understanding climate–change impacts on the vegetation. Climate Change, en prensa [ Links ]
Sánchez–González A. y López–Mata L. 2003. Clasificación y ordenación de la vegetación del norte de la Sierra Nevada, a lo largo de un gradiente altitudinal. Anales del Instituto de Biología, Universidad Nacional Autónoma de México, Serie Botánica 74:47–71 [ Links ]
Santos B.A., Barbosa D.C.A. y Tabarelli M. 2007. Directional changes in plant assemblages along an altitudinal gradient in northeastern Brazil. Brazilian Journal of Biology 67:777–779. [ Links ]
Saynes–Vázquez A. 1989. Contribución al conocimiento florístico y fitogeográfico de la vertiente sur de la sierra de San Felipe, Distrito Centro, Oaxaca. Tesis de Licenciatura, FES –Zaragoza, Universidad Nacional Autónoma de México. 106 pp. [ Links ]
Servicio Meteorológico Nacional. 2009. Normales climatológicas. <smn.cna.gob.mx/climatologia/normales/estacion/catalogos/cat_oax.html> (consultado en julio, 2009). [ Links ]
Silvertown J. y Charlesworth D. 2001. Introduction to plant population biology. Blackwell Science, Oxford, UK. [ Links ]
Torres–Colín R. 2004. Tipos de vegetación. En: García–Mendoza A., Ordóñez–Díaz M.J. y Briones M.A. Eds. Biodiversidad de Oaxaca, pp. 105–117, Instituto de Biología, Universidad Nacional Autónoma de México, Fondo Oaxaqueño para la Conservación de la Naturaleza, World Wildlife Foundation, México. [ Links ]
US Global Change Information Office. 2003.Global change resources. http://www.globalchange.gov/ (consultada en junio, 2009) [ Links ]
Valiente–Banuet A., Flores–Hernández N., Verdú M. y Dávila P. 1998. The chaparral vegetation in Mexico undernonmediterranean climate: the convergence and Madrean–Tethyan hypotheses reconsidered. American Journal of Botany 85:1398–1408. [ Links ]
Vázquez G.A. y Givnish T. J. 1998. Altitudinal gradients in tropical forest composition structure and diversity in the Sierra de Manantlán Journal of Ecology 86:999–1020 [ Links ]
Vázquez–Mendoza S. 2008. Ecología de comunidades de macromicetos a lo largo de un gradiente altitudinal en Santa Catarina Ixtepeji, Oaxaca. Tesis de Maestría, Centro Interdisciplinario de Investigación para el Desarrollo Integral Regional Unidad Oaxaca, Instituto Politécnico Nacional, México. pp. 68 [ Links ]
Veech A.J. y Crist T.O. 2007. Partition: Software for hierarchical for additive partitioning of species diversity. versión 2.0. <www.users.muohio.edu/cristto/partition.htm> (consultada noviembre, 2008). [ Links ]
Velasco G.K. y Juárez–García G. 2003. Contribución al conocimiento de la flora vascular del bosque mesófilo de montaña de Santa Catarina Ixtepeji, Ixtlán, Oaxaca. Memoria de residencia profesional, Instituto Tecnológico Agropecuario de Oaxaca, Oaxaca. [ Links ]
Velázquez A., Mas J.F., Díaz–Gallegos J.R., Mayorga–Saucedo R., Alcántara P.C., Castro R., Fernández T., Bocco G., Ezcurra E. y Palacio J.L., 2002. Patrones y tasas de cambio de uso del suelo en México. Gaceta Ecológica 62:21–37. [ Links ]
Vellend M. 2001. Do commonly uses indices of P–diversity measure species turnover? Journal of Vegetation Science 12:545–552. [ Links ]
Waring R.H. y Schlesinger W.H. 1985. Forest ecosystems concepts and management. Academic Press, Inc., Orlando, Florida. [ Links ]
Weiner J. 1988. variation in the performance of individuals in plant populations. En: Davy A.J., Hutchings M.J., y Watkinson A.R. Eds. Plant population ecology pp. 59–81. Blackwell, Oxford. [ Links ]
Whittaker R.H. 1972. Evolution and Measurement of species diversity. Taxon 21:213–251. [ Links ]
Whittaker R.H. 1975. Communities and ecosystems. MacMillan, New York. [ Links ]
Whittaker R.H. y Niering R. H. 1965. Vegetation of the Santa Catalina Mountains Arizona (II) A gradient analysis of the south slope. Ecology 46:429–452. [ Links ]
Zhao CM., Chen W.L,, Tiang Z.Q. y Xie Z.Q. 2005. Altitudinal pattern of plant diversity in Shenongjia mountains Central China. Journal of Integrative Plant Biology 47:1431–1449. [ Links ]














