Introducción
Históricamente, el uso de injertos de grasa para corregir deformidades congénitas y heridas traumáticas complejas con pérdida de partes blandas después de una cirugía oncológica radical fue propuesto en 1893 por Neuber, Hollander en 1912, Neuhof en 1921 y Josef en 1931.1,2 La grasa es un injerto con propiedades ideales: se integra naturalmente en los tejidos, es autóloga y es 100% biocompatible.
En un centro de quemaduras en Brasil Sarto et al., utilizaron injertos grasos en cuatro situaciones:
pacientes con cicatrices hipertróficas que no mejoran o no están controladas por prendas de presión a las seis semanas o más después de la curación,
quemaduras a las tres semanas o más sin progresión aparente hacia la cicatrización,
heridas por quemaduras subagudas u otras heridas que no han cicatrizado dentro de más de seis semanas después del accidente o herida incluyendo defectos de espesor completo con exposición ósea y tendinosa en pacientes con secuela de traumatismos,
úlceras venosas o diabéticas.3
En Brasil están utilizando injerto graso para heridas crónicas y subagudas, con la técnica de Coleman,4,5 repitiendo las inyecciones con nueva cosecha grasa en cada sesión cada dos a cuatro semanas hasta la cicatrización o hasta que se realice un procedimiento definido (cierre de la herida, injerto de piel, colgajo u otro método). Después de la cicatrización, las inyecciones debajo de la cicatriz se realizan a intervalos de tres meses, también a través de la técnica de Coleman.3-5
Se ha utilizado recientemente el uso de injertos grasos con PRP para heridas vasculares crónicas (insuficiencia venosa o enfermedad arterial diabética) o por secuelas de traumatismo aprovechando los beneficios de la grasa entre ellas las propiedades metabólicas y regenerativas, así como el aumento de la vascularización y la regeneración tisular.6 Cuando estas heridas se tratan con repetidos injertos de grasa (7-15 días de diferencia), la curación es el resultado planificado.3
En un centro de quemados en Brasil utilizan los injertos grasos sin uso de PRP o fibrina rica en plaquetas, refiriendo que el injerto graso centrifugado contiene los suficientes factores de crecimiento para su fijación,3 sin embargo, en otros estudios mencionan el uso de PRP para mejorar las concentraciones de factores de crecimiento.7-11
En un reporte de casos se utilizó una cobertura biológica autóloga con injerto graso el cual se complementó con PRP de sangre autóloga, el injerto graso se mezcló bajo baño maría a 37 grados durante tres minutos hasta obtener una consistencia parenquimatosa, posteriormente se mezcló con PRP. Este sustituto dérmico autólogo se aplicó al lecho de la úlcera después del desbridamiento quirúrgico. Se espero un tiempo de cuatro semanas posterior a la cobertura y se valoró el lecho receptor para realizar un injerto de espesor parcial.12
El injerto graso autólogo con plasma rico en plaquetas para la cobertura de defectos de espesor completo tiene una larga historia de uso clínico y de evolución de su técnica, representando un método eficaz y con menor morbilidad para el paciente, al mismo tiempo que se ha vuelto una herramienta de la cirugía reconstructiva fácil de reproducir.
En este estudio se describirán la evolución que presentaron los pacientes con la aplicación de injerto graso autólogo con plasma rico en plaquetas en la cobertura de defectos de espesor completo durante el periodo de comprendido del 15 de abril 2021 al 30 de septiembre de 2021 atendidos por el departamento de cirugía plástica, estética y reconstructiva del Hospital Central Militar en la Ciudad de México.
Material y métodos
Se recolectan 5 ml de sangre completa en tubos azules con anticoagulante, distribuyéndose 1 ml en cada tubo y se centrifuga de acuerdo con el protocolo Anitua. Se obtienen tres capas: capa de glóbulos rojos (RBC), capa leucocítica (BC) y plasma pobre en plaquetas (PPP), se toman la capa PPP y BC superficial los cuales se transfieren a otro tubo sin anticoagulante (tubo rojo) para su posterior centrifugación a 1800 rpm durante 8 minutos. El concentrado final de plasma rico en plaquetas (PRP) consiste en la extracción del primer mililitro de la capa más superficial del tubo.
Se realiza polimerización de fibrina con solución de cloruro de calcio al 10%, 0.1 ml por cada mililitro de PRP. Después de 15 a 20 minutos, se forma un gel de PRP.13
Simultáneamente se realizó lipoaspiración con cánula de 3 mm. Se coloca la grasa en forma vertical para decantarla.
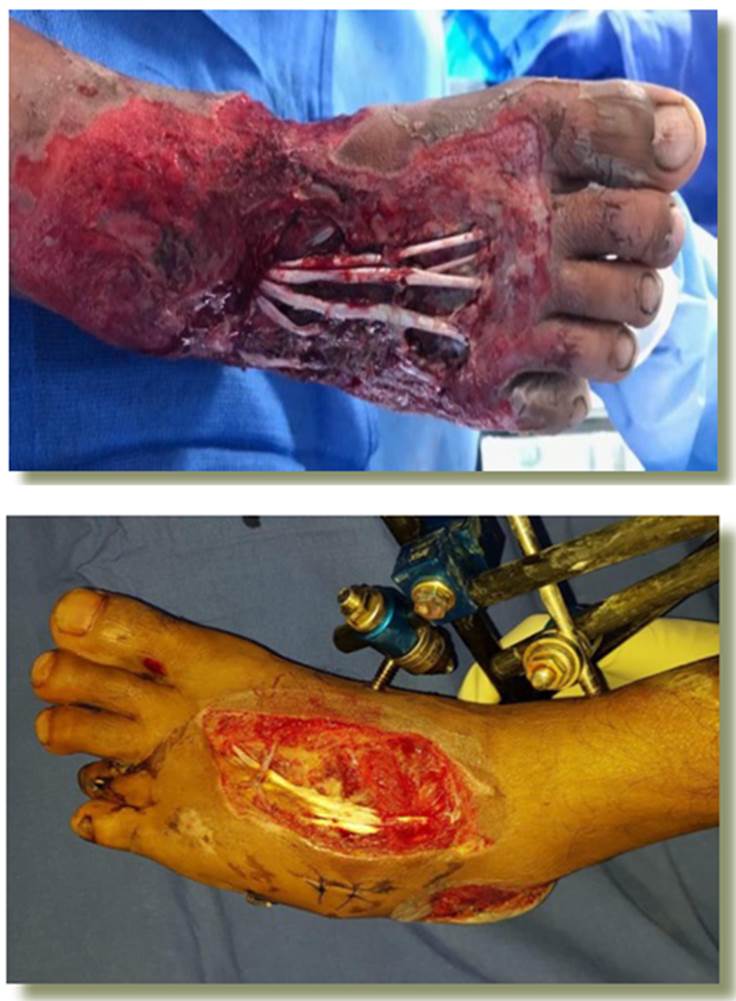
Inyección de grasa: Se realizó el injerto graso con una cánula de 2 o 2.4 mm de diámetro externo larga ya conectada a la jeringa de 1 ml, esta se inserta a través de la piel y se impulsa (con fuerza) inmediatamente debajo del lecho de la herida. Protección del injerto: El injerto graso con PRP que se encuentra encima del defecto de espesor completo se cubre con organdí vaselinado sobre la cual se coloca una esponja plateada de VAC, el sistema de presión negativo tendrá una modalidad continua a 75 mmHg con succión media.
Se realizó la revaloración de la integración de la herida y del injerto graso con PRP a los siete días posteriores a su colocación, se realiza nueva colocación de injerto graso en zonas donde no se haya integrado correctamente el injerto.
Se realizó el paso número cinco, hasta que el injerto graso se haya integrado y pueda recibir un injerto de piel de espesor parcial.
Resultados
En el presente fueron incluidos un total de seis pacientes que recibieron tratamiento a base de la aplicación de injerto graso autólogo con plasma rico en plaquetas para cobertura de defectos de espesor completo. Durante el periodo de estudio, no se identificaron motivos para la exclusión o eliminación de las participantes, integrándose la muestra con el 100% de los casos para su análisis.
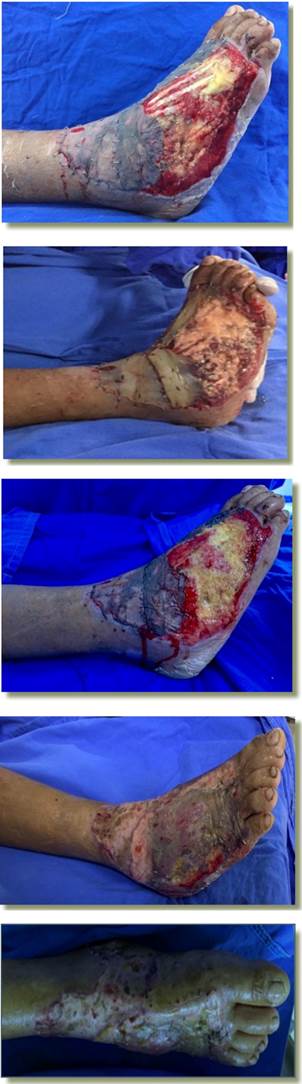
En el Cuadro 1 se muestran las características clínicas de los pacientes seleccionados. Se observó una edad promedio de 25.5±8.37 años, todos estos de género masculino. Se realizaron de tres a cuatro procedimientos para la aplicación de injerto graso (Imagen 1) con un tiempo promedio de estancia hospitalaria desde la cobertura del defecto con el injerto de piel de espesor parcial al día catorce de 10.5±3.7 días y de 19.6±0.5 días de EIH total (Imágenes 2 y 3).
Cuadro 1 Características clínicas de los pacientes seleccionados
| Media (n=6) | D.E. % | |
|---|---|---|
| Edad | 25.5 | 8.7 |
| Número de procedimiento | 2 | 0.8 |
| EIH posterior a la cobertura del defecto | 10.5 | 3.7 |
| Estancia hospitalaria total | 19.6 | 0.5 |
| Tamaño de lesión | 95.1 | 81.6 |
| Profundidad de la lesión | 1.1 | 1.1 |
| Volumen grasa obtenida | 38.1 | 18 |
| Volumen grasa injertada | 14.7 | 7.9 |
| Exposición ósea | 3 | 50.0% |
| Exposición tendinosa | 6 | 100.0% |
| Infección | 0 | 0.0% |
| Pérdida de injerto graso | 1.0 | 16.7% |
| Recidiva de defecto cutáneo | 1.0 | 16.7% |
Fuente. Expediente clínico del HCM. Se muestran a variables asintóticas.
Dentro de las características del defecto que presentaron encontramos que el tamaño de la lesión fue de 17.5 a 280 cm2 (Imagen 4), con medias de 95.1±81.6 cm2, profundidad de 1.1±1.1 cm. El volumen de grasa obtenida del defecto en promedio fue 3.81±18.0 ml con un promedio de 14.7±7.9 ml de grasa injertada, con volumen de 4 ml de PRP aplicado en el 100.0% de los pacientes.
De forma previa a la aplicación del tratamiento, encontramos exposición ósea en 50.0% de los defectos, exposición tendinosa en el 100.0% de estos (Imagen 5), y durante este no se identificaron casos con infección.
Adicionalmente, se recabó información relacionada con la evaluación analítica en los pacientes del estudio. Se registró Hb de 12.2±0.9%, leucocitos de 6.0±1.2*103 cel/ml, plaquetas 238.8±42.7 *103 cel/ml, albumina sérica de 3.7±06 g/dL, proteínas totales de 6.4±1.0 g/dL. Además no se aislaron agentes bacterianos en los cultivos realizados a la población de estudio (Cuadro 2).
Cuadro 2 Hallazgos de la evaluación analítica de los pacientes seleccionados
| Media (n=6) | D.E. % | |
|---|---|---|
| Hemoglobina | 12.2 | 0.9 |
| Leucocitos | 6.0 | 1.2 |
| Plaquetas | 238.8 | 42.7 |
| Albúmina sérica | 3.7 | 0.6 |
| Proteínas totales | 6.4 | 1.0 |
| Cultivo de herida positivo | 0.0 | 0.0% |
Fuente. Expediente clínico del HCM. Se muestran a variables asintóticas
Finalmente, se llevó a cabo la comparación de las dimensiones de los defectos a través de los procedimientos realizados, donde se encontró una diferencia de 95.13 cm2, con hallazgos estadísticamente significativos (t=4.20, IC 95% 45.84-144.42, p<0.001).
Discusión
El desafío actual en la aplicación de PRP es cómo producir una formulación estandarizada en medicina personalizada. El producto final de PRP, que debe tener una definición de los recuentos de plaquetas, la cantidad y el patrón de liberación de los factores de crecimiento, así como el andamiaje de la red de fibrina, será útil para obtener resultados experimentales con buena reproducibilidad. Hasta donde sabemos, los concentrados de plaquetas, representados principalmente por PRP, pueden combinar factores de crecimiento bioactivos derivados de plaquetas con células autólogas.14 En este sentido, un producto sanguíneo autólogo y una potente fuente de factores de crecimiento, puede mejorar la supervivencia del injerto principalmente a través de una mayor angiogénesis temprana, lo que provoca una revascularización más rápida del injerto.15
A pesar de la baja tasa de reclutamiento en este estudio, el protocolo del ensayo se implementó con éxito para todos los participantes y todos los pacientes completaron el período de seguimiento completo dentro del periodo de seguimiento y demostró que la recopilación de datos de resultados primarios y secundarios para comparar este abordaje fue sencilla y factible, ya que el 100% de las medidas se registraron en los seguimientos. Sin embargo, la población de estudio limitada a solo 6 pacientes no nos permite sacar conclusiones significativas con respecto al efecto del tratamiento, y este fue el objetivo principal del estudio. A pesar de existir diferencias significativas en el cambio en el volumen de la herida, el área de la herida, el tiempo de cicatrización, se requiere un estudio multicéntrico para evaluar completamente la eficacia de estos tratamientos en pacientes con defectos de espesor completo.
Conclusiones
A través del análisis de seis casos de pacientes, donde se realizaron de tres a cuatro procedimientos encontramos un tiempo promedio de estancia hospitalaria desde la cobertura del defecto con el injerto al día 14 de 10.5 días y de 19.6 días de EIH total. Las características del defecto de la lesión describieron un tamaño que fue de 17.5 a 280 cm2 (95.1 cm2 en promedio). No se observaron casos con signos clínicos de infección o aislamiento de agentes microbiológicos. La comparación de las dimensiones de los defectos a través de los procedimientos realizados informó una disminución del defecto estadísticamente significativa.
En conclusión, la aplicación de injerto graso autólogo con plasma rico en plaquetas demostró ser una opción eficaz y segura para la cobertura de defectos de espesor completo en la población de estudio.











 nueva página del texto (beta)
nueva página del texto (beta)