La historia del trasplante renal inicia con Mathieu Jaboulay, quien llevó a cabo el primer xenotrasplante registrado en 1906, implantando el riñón de un cerdo en el codo izquierdo de una mujer con síndrome nefrótico.
Sin embargo, la historia ha dado a los doctores Murray, Merril y Harrison el crédito de haber realizado con éxito el primer trasplante renal de un gemelo a otro con insuficiencia renal en la ciudad de Boston, Estados Unidos, el 23 de diciembre de 1954.1
En nuestro país sólo nueve años después, en 1963, los doctores Federico Ortiz Quezada, Manuel Quijano Narezo y Manuel Flores Izquierdo realizaron el primer trasplante renal, en el que fuera el Centro Médico Nacional (Siglo XXI) del Instituto Mexicano del Seguro Social (IMSS).
La historia en el Hospital Central Militar (HCM) en temas de trasplante inició en noviembre de 1992 y hasta la fecha se han realizado 830 trasplantes, de éstos, 80.7% proviene de donantes vivos relacionados o no genéticamente y el resto de donantes cadavéricos.
El creciente número de enfermos renales crónicos que requieren sustitución de la función renal, el aumento de la sensibilización de los receptores ante sus posibles donantes directos (familiares o de su comunidad), la política nacional en la que 70% de los trasplantes son de donante vivo, la mayor sobrevida del injerto demostrada cuando éste proviene de donantes no cadavéricos, la existencia de donantes altruistas y la necesidad de maximizar el recurso de obtención de órganos y su adecuada distribución para un bien común social hacen necesario iniciar y perpetuar programas que permitan superar las barreras inmunológicas entre el receptor y su donante.
Según datos del CENATRA (Centro Nacional de Trasplante) al 31 de diciembre de 2016 había 12,477 enfermos renales a nivel nacional en lista de espera, habiéndose realizado 3,028 trasplantes renales ese año, de los cuales 71.26% fueron de donante vivo. Al tercer trimestre de 2017 la misma institución publicó que la lista de espera creció a 13,633 pacientes;2 estos datos significan que, al igual que en Estados Unidos, las listas de espera se incrementan, mientras que el aumento del número absoluto de trasplantes renales permanece estable.
Este problema de salud ha sido parcialmente subsanado en países como Estados Unidos y España mediante un crecimiento en el número de trasplantes renales provenientes de donantes cadavéricos; sin embargo, se han buscado otras estrategias para disminuir esa brecha entre la oferta-demanda de órganos renales, siendo éstas el trasplante con intercambio de donantes o llamado cruzado y el ABOi (ABO incompatible).
Trasplante renal cruzado
Si bien en algunos países como Estados Unidos se admite la figura del donante altruista (conocido como «buen samaritano» en España), en la mayoría de los países occidentales la donación de donantes vivos es dirigida, esto es: el donante vivo dona su riñón a un paciente concreto, pudiendo existir incompatibilidad ABO o HLA (Human Leukocyte Antigen) (ya sea que la prueba cruzada entre donante y receptor sea positiva por sensibilización del receptor frente a ciertos antígenos de leucocitos del donante que pueden determinar un rechazo inmediato del injerto tras el trasplante) con el receptor. Como solución a esa voluntad de donación, Rapaport propuso en 1986 la posibilidad de que a pacientes que no puedan recibir un riñón de su donante, se les dé la posibilidad de intercambiar los donantes de manera que cada uno de los receptores reciba un riñón compatible y los donantes realicen su deseo de donar.3
Internacionalmente, el primer procedimiento real de intercambio se realizó en Corea del Sur en 1991, seguido de Europa en 1999 y luego en Estados Unidos en 2000, la lenta aceptación se debió principalmente a consideraciones éticas y legales. En México se publicó en medios de comunicación el primer trasplante renal cruzado a inicios de 2016 y a finales de 2017 se realizó el segundo, ambos por el Hospital Juárez de México.
Cuffy MC et al. presentan una interesante clasificación de las parejas donante-receptor: compatibles, cuasi-incompatibles e incompatibles. Desde una perspectiva clínica, los pares cuasi-incompatibles e incompatibles se beneficiarán del intercambio de parejas, mientras que los pares compatibles no tienen un claro beneficio de la participación de este intercambio a priori.4
Desde su inicio, este programa de intercambio de donantes tiene varias modalidades:5
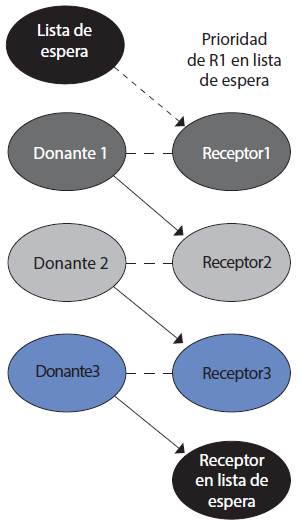
1. Intercambio por pares, entre dos pares con incompatibilidades recíprocas. Ésta es la modalidad más simple y puede aumentarse n-intercambios (ciclos) (Figuras 1 y 2).
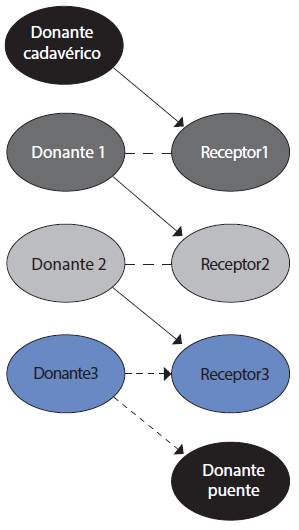
2. Cadenas de donante inespecífico o donación de pares de dominó. Puede realizarse mediante cadenas extendidas no simultáneas de donantes altruistas, las cuales reclutan «donantes puente» que en lugar de donar a la lista de espera de donantes fallecidos como el último donante en una cadena, pueden continuar esta cadena en un momento posterior (Figuras 3 y 4).
3. Intercambio de listas. Se inicia la cadena con un intercambio de listas, en las que el primer paciente de la cadena no recibe un trasplante directamente, sino que se le da prioridad en la lista de espera de donantes fallecidos para un futuro riñón, que es generalmente un riñón de sangre tipo O. El último donante de la cadena nuevamente facilita el trasplante a un paciente en la lista de espera (Figuras 5 y 6).
4. Donación de intercambio altruistamente desequilibrado. Puede dar como resultado un mayor número de trasplantes con mejor calidad. Sin embargo, esta forma de intercambio es éticamente complicada, ya que implica pedirles a parejas, que por lo demás son adecuadas, que intercambien riñones con extraños (Figura 7).
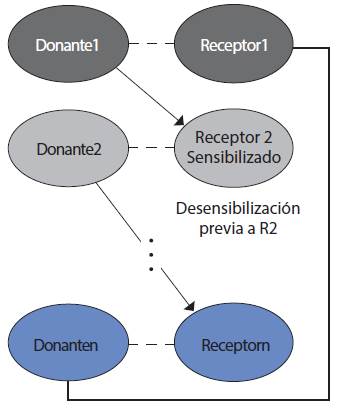
5. Desensibilización combinada. El programa de intercambio de donantes y la desensibilización a menudo han sido vistos como estrategias competitivas para trasplantar pares incompatibles, pero más recientemente se les ha considerado complementarias. El subconjunto de candidatos que están muy o moderadamente sensibilizados con donantes de tipo sanguíneo O son muy difíciles de combinar con un par compatible en programas de intercambio de donantes (Figura 8).
Pham TA et al. publicaron en 2017 un artículo en el que 81.8% de las parejas inscritas en su programa cruzado fueron exitosamente trasplantadas en un tiempo promedio de 157 días, asimismo explican que el hecho de tener un registro local simplifica la logística del trasplante y ayuda a tomar decisiones inmunológicas con criterios únicos, puesto que el laboratorio de inmunología reporta los estudios de manera estandarizada.6
Respecto a la longitud de la cadena para intercambio de riñones, KlerK M et al. analizaron el programa de trasplante alemán cruzado, el cual tenía un pool de 312 parejas registradas y demostró que la longitud óptima de la cadena para los programas de intercambio renal de donantes vivos es tres. Las cadenas más largas, con su carga logística inherente, no conducen a un número significativamente mayor de trasplantes.7
Modalidades de intercambio de donantes renales
Aun con el programa de trasplante cruzado a nivel nacional en Estados Unidos o Europa, los pacientes hipersensibilizados sólo encuentran un cruce adecuado en alrededor de 15%, permaneciendo en lista de espera periodos más largos o inclusive fallecen esperando un trasplante renal. Una solución para estos pacientes en particular es ingresar a la pareja a un programa cruzado con desensibilización del/los receptores (Figura 8). En este contexto de pacientes hipersensibilizados, Blumberg JM et al. publicaron en 2013 una cohorte de 22 pacientes hipersensibilizados, a quienes se les realizó trasplante renal cruzado (12 con anticuerpos donante específicos [DSA] y 10 sin DSA), en el grupo con DSA se aplicó desensibilización con inmunoglobulinas pretrasplante y se realizó prueba cruzada (XM). El grupo con DSA tuvo tres eventos de rechazo agudo humoral (RAH), pero no fue estadísticamente diferente del grupo no DSA (p = 0.22). La creatinina al año fue mejor en el grupo no DSA con p significativa y la sobrevida del injerto y del paciente fue de 100% en ambos.8
Ya existe literatura de este tipo de programa en población pediátrica. Sypek MP et al. publicaron en 2016 la experiencia del registro nacional australiano con el programa de intercambio de trasplante renal pediátrico. Reportan siete trasplantes con una media de 173 días desde el registro hasta su trasplante y de 229 días cuando el paciente estuvo hipersensibilizado. El seguimiento fue de hasta 54 meses y con tasa de filtración glomerular (TFG) 46-94 mL/min/m2SC. Todos tuvieron ganancia inmunológica y uno de ellos fue finalmente trasplantado con un donante ABOi.9
Otro país que publicó su experiencia fue Turquía en 2013. Yücetin L et al. informaron que compararon 272 trasplantes del programa cruzado vs 1,885 trasplantes de donante vivo directo; la media de creatinina al año de seguimiento en el primer grupo fue de 1.07 ± 0.37 y 1.17 ± 0.56 en el grupo de donantes vivos con diferencia estadísticamente significativa (p = 0.0043); la pérdida del injerto fue similar: de 2.74 y 2.71% respectivamente, asimismo los episodios de rechazo.10
Respecto a lo que es mejor, esperar un donante vivo relacionado emocional o genéticamente vs ingresar a la pareja al programa de intercambio de parejas, Kute VB et al. demostraron que en una cohorte de 34 trasplantes del programa cruzado vs 190 trasplantes de donante vivo, la supervivencia de pacientes a uno y dos años no reveló diferencias significativas entre los dos grupos (97.1%, 97.1% vs. 96.2%, 94.8%, respectivamente, p = 0.81).11
Un aspecto importante en este tipo de programa, y sobre todo cuando existe un pool grande de parejas, es la asignación, ésta debe ser óptima, equitativa y justa. Se utilizan criterios jerárquicos e incluyen los siguientes factores: maximizar el número de destinatarios coincidentes y el número de coincidencias idénticas del tipo de sangre (para maximizar la probabilidad de que los pacientes O reciban un riñón y ayudar a superar su desventaja), priorizando asignaciones basadas en el número de destinatarios involucrados con una baja probabilidad de coincidencia, minimizando la longitud de los ciclos y las cadenas y priorizando las asignaciones basadas en el tiempo de espera de los destinatarios involucrados.
Desde el punto de vista ético, moral y deontológico, existe una opinión plural y divergente en cuanto a la validez de este tipo de programa, argumentando que puede haber una especie de coerción hacia el donante a donar a una persona no directa y la incertidumbre de saber la «calidad de órgano» que su receptor original recibirá. Sin embargo, al permitir la donación de este tipo, se respeta y permite ese deseo del donante a «donar» (respeto de su autonomía), además de impedir las consecuencias morales (psicológicas por «sentimientos de impotencia y pérdida», disminución de autoestima) al no permitirle ese deseo por no ser compatible con su pareja original.
Los donantes también pueden sufrir consecuencias al no permitirles donar. Aproximadamente 87% de los donantes vivos de riñón donan a sus cónyuges y parientes cercanos. Sin esta donación familiar, la mayoría de los destinatarios pasarían varios años en la lista de espera y corren un riesgo sustancial de morir antes de recibir un riñón; por lo tanto, donar un riñón reduce el riesgo del donante de perder a un ser querido y también puede evitar las cargas financieras y de cuidados sustanciales que de otro modo causarían el deterioro de un familiar cercano mientras espera un trasplante.12
En México en el segundo semestre de 2017 Pro-renal, una Asociación Civil Mexicana que trabaja en alianza con Global Kidney Exchange, inició un programa de trasplante renal cruzado al que parejas incompatibles podrán inscribirse en una base de datos para encontrar un donante; se prevé que con el tiempo las diferentes instituciones de salud vayan incorporándose a fin de conformar un programa nacional, el cual para su adecuado funcionamiento debe tener tres pilares: la red de hospitales adscritos al programa, el registro nacional de parejas donante-receptor y el protocolo de funcionamiento. Ya varios países han demostrado el buen funcionamiento de estos programas a nivel nacional; sin embargo, debe existir una logística muy coordinada.
Otra ventaja del uso del programa de cruce de parejas es la ganancia de calidad del órgano al conseguir un mejor emparejamiento donante-receptor por edad, peso o concordancia inmunológica, lo que mejora la sobrevida del injerto y disminuye los costos del uso de menor inmunosupresión.
Trasplante ABOi
Otra forma de superar la barrera inmunológica entre el donante-receptor es el trasplante de grupo sanguíneo diferente para efectos de trasplante de órganos, el grupo sanguíneo O es un donante universal y el grupo AB es un receptor universal.
En poblaciones pioneras de este tipo de trasplante, como la japonesa y estadounidense, se ha estimado que este tipo de programas puede incrementar potencialmente el pool de donantes de vivos hasta en 30%.13
El primer trabajo publicado que demuestra que es posible realizar un trasplante con incompatibilidad ABO data de 1974, en el cual se realizaron 21 trasplantes renales de donante cadáver grupo A2 y receptores del grupo O, sin episodios de rechazo y con una supervivencia comparable a trasplantes ABO compatibles (ABOc) (Verter).14 Aproximadamente 20% de la población caucásica expresa el subtipo A2 y esto es especialmente relevante, ya que estos individuos expresan pequeñas cantidades de antígeno A (comparados con el subtipo A1) que explica el bajo riesgo inmunológico y los buenos resultados al realizar trasplantes ABOi con este tipo de donantes. Trabajos posteriores confirmaron estos buenos resultados iniciales (en donantes A2-receptores 0), enfatizaron la importancia de tener títulos bajos de isoaglutininas para obtener buenos resultados y estimularon el desarrollo de protocolos de acondicionamiento a fin de eliminar o reducir de manera sustancial los anticuerpos anti-A/B para poder realizar este tipo de trasplante con garantías de éxito.15
En Japón se iniciaron los programas de trasplante renal ABOi en 198916 y posteriormente, hacia mediados de los años 90, se establecieron también en Estados Unidos y Europa.17
En un estudio retrospectivo en Estados Unidos en el que se realizaron 738 trasplantes ABOi entre 1995 y 2009 la supervivencia del injerto fue 94.1, 89.6 y 72.9% a uno, tres y cinco años postrasplante respectivamente.18 El protocolo sueco, que fue el primero en establecer el acondicionamiento con rituximab en el año 2001, mostró una supervivencia comparable con el programa de trasplante de donantes vivos Verter (97% ABOi comparado con el grupo control Verter 95%).19 Un estudio en Alemania (Freiburg), en el que aplican el protocolo sueco desde 2004, muestra una supervivencia del injerto de 100% a uno, tres y cinco años postrasplante;20 excelentes resultados que se confirman en el seguimiento a 10 años de la misma cohorte con una supervivencia de 95%, comparable con la cohorte control Verter (ABOi n = 95, supervivencia 95% vs. Verter n = 245, supervivencia 89%, p = 0.5). Estos resultados están corroborados por la reciente publicación de la Collaborative Transplant Study (CTS) que recoge los resultados a tres años de 1,420 trasplantes ABOi procedentes de 101 centros, donde la supervivencia es comparable con los trasplantes ABOc.21
Durante estos años los tratamientos de acondicionamiento han ido variando y existen diferentes protocolos publicados en la literatura, pero en general todos ellos se basan en las siguientes premisas: preacondicionamiento de la respuesta de linfocitos B, eliminación extracorpórea de isoaglutininas e inmunosupresión pretrasplante y postrasplante. Las principales diferencias entre los distintos protocolos publicados incluyen el momento y la dosis de administración de rituximab, la utilización de terapias de inducción, de diferentes técnicas para remover las isoaglutininas (principalmente plasmaféresis vs. inmunoadsorción específica o no específica) o el uso de inmunoglobulinas endovenosas.
Todos los protocolos tienen como principal objetivo llegar al trasplante con la mínima titulación posible de isoaglutininas22 y los umbrales a partir de los cuales es aceptable realizar el trasplante se han establecido de forma empírica y varían en función del centro entre 1:4 y 1:16. No existe evidencia en cuanto al beneficio de remover las isoaglutininas de forma preventiva una vez realizado el trasplante, por lo que la práctica habitual en los diferentes centros es realizar recambios plasmáticos a demanda en función de los títulos de isoaglutininas.23
En cuanto a la población pediátrica, Stojanovic J et al. publicaron en 2017 la experiencia con 11 niños trasplantados ABOi comparándolos con 50 ABOc, utilizando desensibilización personalizada en función de los títulos de isoaglutininas pretrasplante. Sólo en los pacientes con títulos > 1:8 usaron inmunoabsorción (IA) o plasmaféresis (PF) con doble filtro. La sobrevida del injerto fue de 100% en el grupo ABOi y de 98% en ABOc con p > 0.05; respecto a los rechazos, hubo 9% en el primer grupo y 24% en el grupo ABOc; la TFG a los tres años fue de 61 mL/min/1.73 m2.24
La experiencia a nivel nacional con este tipo de trasplante es muy limitada, en mayo de 2016 se realizó el primer trasplante ABOi en el Hospital México, hasta el momento con éxito.
Dada la experiencia acumulada y la evidencia existente, que se traduce con buenos resultados a corto y largo plazo principalmente gracias a la efectividad de las estrategias de acondicionamiento, el trasplante ABOi es una alternativa eficaz y segura para pacientes seleccionados que opten por esta posibilidad y/o que no puedan acceder a otras opciones de trasplante.
Conclusión
Los programas de trasplante renal cruzado y ABOi han demostrado su eficacia y seguridad en diferentes partes del mundo. El inicio y fortalecimiento de estas modalidades no convencionales de trasplante renal en México aumentará el número de donantes vivos al promover una mejora en la autosuficiencia de órganos, reducir la lista de espera y disminuir la mortalidad de los enfermos renales crónicos.
El sector salud debe modificar a mediano plazo las políticas nacionales para implementar estos programas en los diferentes institutos dedicados al trasplante renal y coordinar su adecuado funcionamiento para que en México, al igual que en Estados Unidos, España y Asia, sean exitosos. Dentro del ejército mexicano, en el HCM es momento de iniciar estos programas bajo un adecuado protocolo y manejo de recursos humanos y económicos.
Asimismo, promover la cultura de donación de órganos tanto de donante vivo como cadavérico es parte fundamental para aumentar de manera sustancial el índice de trasplantes entre la población nacional y quizás lograr la modificación a la legislación que permita la donación presunta al morir, sea esto en conjunto con las modalidades de trasplante descritas, a fin de subsanar un problema nacional de salud como la enfermedad renal crónica, la cual desde el punto de vista económico consume un porcentaje considerable de recursos del presupuesto nacional destinado a la atención médica.











 nueva página del texto (beta)
nueva página del texto (beta)