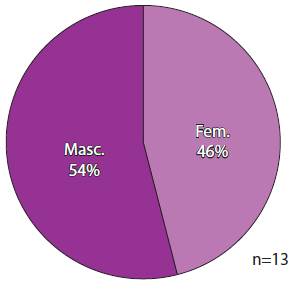Introducción
El carcinoma pulmonar es la causa mayor de muertes por cáncer en el mundo, tanto en hombres como en mujeres. De acuerdo con datos de la Organización Mundial de la Salud (OMS), de un total de 8.2 millones de defunciones por cáncer en 2012, 1.59 millones fueron secundarias a carcinoma pulmonar, lo cual representó el 19.4% del total de defunciones por esta enfermedad. Más del 60% de los casos nuevos anuales de cáncer pulmonar se registran en África, Asia, Centroamérica y Sudamérica.1
En México, de igual forma, representa un problema de salud pública. La mayoría de los casos se diagnostica en etapas avanzadas para las que no existen tratamientos curativos. La incidencia y mortalidad calculadas en el año 2012 fueron de 7.5 y 6.7 casos por 100,000 habitantes, respectivamente. En nuestro país, fue la tercera causa de mortalidad general, con 73,240 muertes del total de 602,354 defunciones ocurridas en 2012 (12.2%). El tabaquismo es el factor de riesgo principal para desarrollar cáncer pulmonar; asimismo, interviene en la mortalidad de seis de las ocho principales causas de muerte en el mundo.2
La clasificación de la OMS, de manera general, divide el cáncer de pulmón en tres principales histologías: carcinoma epidermoide o escamoso, adenocarcinoma y de células pequeñas; los dos primeros son conocidos como cáncer de pulmón de células no pequeñas (CPCNP). Actualmente, el cambio más importante ha ocurrido en el adenocarcinoma, determinado por el espécimen, histología predominante, genética tumoral y manejo del tejido para determinación de mutaciones, lo cual es primordial para el tratamiento con terapias blanco.3
La quimioterapia para el cáncer de pulmón de células no pequeñas ha mostrado resultados marginales. En el pasado, cuatro esquemas de quimioterapia (cisplatino y gemcitabina, cisplatino y docetaxel, carboplatino y paclitaxel, cisplatino y paclitaxel) se han utilizado para el tratamiento del cáncer pulmonar de células no pequeñas, ofreciendo una supervivencia global (SG) de alrededor de ocho a 10 meses.4
La activación de proteína cinasa por mutaciones somáticas o alteraciones cromosómicas es un mecanismo común de tumorigenia. La inhibición de la activación de la proteína cinasa a través de terapias dirigidas como pequeñas moléculas o anticuerpos ha demostrado ser efectiva como tratamiento en el cáncer.5
Análisis recientes sobre genes cinasa demostraron mutaciones de la proteína serina-treonina cinasa, como el gen BRAF en melanoma y otros cánceres humanos, así como múltiples genes tirosina cinasa y fosfatidilinositol 3-cinasa, subunidad catalítica PI3KCA en el cáncer colorrectal. Durante el desarrollo del CPCNP ocurren diferentes eventos moleculares que incluyen la pérdida de heterocigocidad, cambios epigenéticos, mutaciones en p53, KRAS y en el receptor del factor de crecimiento epidérmico (EGFR), sólo por mencionar algunos. Es importante destacar que las mutaciones presentes en el EGFR son prevalentes en adenocarcinomas de no fumadores, mientras que en adenocarcinomas de fumadores lo son las mutaciones en KRAS. Estas diferencias son potencialmente importantes para asignar el tratamiento adecuado al paciente, basado en agentes biológicos.6
Diversos estudios han identificado que la expresión del receptor del factor de crecimiento epidérmico (EGFR) es más abundante en tejido de carcinoma pulmonar comparado con el tejido sano adyacente. La expresión de EGFR es detectada por inmunohistoquímica. Estudios clínicos han revelado diferencias significativas en la respuesta a inhibidores de tirosina cinasa. Por ejemplo, las altas respuestas en pacientes japoneses comparados con poblaciones europeas (27.5% versus 10.4%). En Estados Unidos, las respuestas son parciales; se han observado con más frecuencia en mujeres no fumadoras y con adenocarcinoma.7,8
La utilización de inhibidores de tirosina cinasa ha incrementado la supervivencia mayor a dos años en pacientes EGFR mutados. La determinación de la mutación del receptor de tirosina cinasa juega un rol primordial en el cáncer de pulmón de células no pequeñas. La mutación de EGFR ocurre con mayor frecuencia en pacientes asiáticos, comparados con blancos, presentando mutaciones típicas cerca del 30% versus 8%, respectivamente (deleción del exón 19, mutación puntual del exón 21 L858R).9,10
En un estudio realizado en el Hospital de la Universidad de Nagoya en Japón y el Hospital de Boston, Massachusetts, se buscaron alteraciones genéticas en 119 tumores primarios de pulmón de células no pequeñas; de ellos, 70 eran adenocarcinomas pulmonares y 49 de otros tipos, 74 eran hombres y 45 mujeres. Tres de los adenocarcinomas mostraron mutación en EGFR no presente en el ADN del tejido pulmonar normal; estos tres tumores con mutación EGFR presentaron cambio de leucina 858 a argina (L858R).11,12
El gen EGFR se encuentra localizado en el brazo corto del cromosoma 7 y codifica para una proteína transmembranal, con un tamaño molecular aproximado de 170 kDa. Pertenece a una familia de cuatro receptores de membrana, con actividad de tirosina cinasas (TK): ErbB1 (EGFR, HER1), ErbB2 (HER2/neu), ErbB3 (HER3) y ErbB4 (HER4). Todos los miembros de esta familia presentan una estructura similar, que consiste en tres regiones: una extracelular (donde se localiza el dominio de unión al ligando), una transmembrana (donde se ancla a la membrana plasmática) y una intracelular (donde se encuentra el dominio de TK5).13
La actividad constitutiva del EGFR ha sido observada en más del 60% de los pacientes con CPCNP y se debe a diferentes mutaciones presentes en el receptor. Estas representan el 50% en no fumadores, con respecto al 10% de fumadores, y al 40% en adenocarcinomas, con respecto al 3% de otras histologías. Más del 90% de estas mutaciones están localizadas en los exones 19 y 21 (deleciones y la mutación puntual L858R, respectivamente) del EGFR, donde se ubica el sitio de unión al ATP del dominio TK1.14,15 Tanto las deleciones del exón 19 como la mutación L858R resultan ser mutaciones de respuesta a EGFR-TKI, como el gefitinib y erlotinib. Debido a la mutación L858R, el gefitinib se une 20 veces más a la mutante L858R que al EGFR silvestre.16,17
La percepción del lugar óptimo de los TKI en el tratamiento del CPCNP ha evolucionado en las últimas décadas. Gefitinib y erlotinib fueron inicialmente considerados como terapias de salvamento, con bajas respuestas y marginal mejoría en la supervivencia, comparados con el placebo en pacientes no seleccionados.18
Una de las diferencias en las respuestas con el uso de TKI en pacientes EGFR mutados fue apreciada en estudios aleatorizados realizados en pacientes asiáticos, donde se comparó gefitinib o erlotinib con quimioterapia basada en gemcitabina y taxano; estos trabajos demostraron un notable beneficio en la supervivencia libre de progresión (SLP), pero sus resultados fueron cuestionados porque sólo se incluyeron pacientes asiáticos.19,20
En población seleccionada para mutación del EGFR, el beneficio de estas moléculas versus quimioterapia es superior; se han realizado varias investigaciones fase III que demuestran esto. El IPASS fue un estudio fase III que comparó gefitinib versus quimioterapia estándar como primera línea en pacientes según sus características clínicas (pacientes asiáticos con adenocarcinoma que nunca hayan fumado o fumadores ligeros). Aunque gefitinib fue superior en términos de supervivencia libre de progresión, las curvas de supervivencia se entrecruzaron a los seis meses con las de los pacientes que recibieron quimioterapia. Por otro lado, se observó en este trabajo que los pacientes que recibieron quimioterapia obtuvieron mayores respuestas al inicio; sin embargo, los que recibieron gefitinib mostraron respuestas posteriores. El análisis molecular subsiguiente, que incluyó un tercio de los pacientes, demostró que el beneficio fue superior en aquéllos que tenían la mutación de EGFR positiva, y que gefitinib no ofreció ventajas en la población portadora de EGFR no mutado, por lo que se concluyó que la presencia de la mutación del EGFR es un marcador predictivo de supervivencia en el tratamiento con inhibidores de tirosina cinasa.21
El estudio japonés NEJ 002, en el cual los pacientes fueron aleatorizados para recibir gefitinib versus carboplatino más paclitaxel en primera línea, mostró un beneficio estadísticamente significativo en supervivencia libre de progresión de 10.8 meses versus 5.4 meses; sin embargo, no hubo diferencia en la supervivencia global. Estos resultados también se observaron en el estudio OPTIMAL, cuya población seleccionada eran portadores de la mutación del EGFR y asiáticos; en él se comparó el tratamiento con erlotinib versus carboplatino más gemcitabina en primera línea.22
En el año 2009, fue publicado un estudio europeo donde se evidenció que la tasa de mutación del EGFR en población caucásica fue de 16%; los pacientes que recibieron tratamientos con erlotinib presentaron una supervivencia libre de progresión de 14 meses y mediana de supervivencia global de 27 meses.
El estudio EURTAC aleatorizó pacientes a recibir dupletas basadas en platino versus erlotinib; se encontró una supervivencia libre de progresión de 9.7 meses para erlotinib versus 5.2 meses de la quimioterapia. No se pudieron obtener diferencias en supervivencia global, porque se permitió el entrecruzamiento de tratamiento; se demostró que la terapia personalizada también es altamente efectiva en este tipo de población. En contraste, en el estudio OPTIMAL se observaron 13.1 meses de supervivencia libre de progresión, lo cual podría corresponder con mayor sensibilidad de la etnia asiática al tratamiento con inhibidores de tirosina cinasa.23,24
El estudio LUX LUNG-3 incluyó pacientes de distintas partes del mundo, usando afatinib (SLP 11.1 versus 6.9 meses con quimioterapia).25 Basada en estos ensayos clínicos, la Sociedad Europea recomienda el tratamiento con inhibidores de tirosina cinasa en primera línea en pacientes portadores de la mutación del EGFR en el exón 19 o 21, similar a las recomendaciones publicadas por NCCN (National Comprehensive Cancer Network), que con los resultados de dichos trabajos sustentó que el tratamiento inicial en el CPCNP EGFR mutado sean los TKI, sin importar la raza del paciente.26,27
En México, existen pocos estudios que muestren el beneficio clínico del uso de TKI en pacientes mexicanos con CPCNP EGFR mutados. El INCAN reportó una investigación con 381 pacientes con CPCNP; de ellos, 191 (31.2%) presentaron mutaciones en el EGFR, y de éstos, 11 (9.2%) mostraron mutaciones en el exón 18, 76 (63.9%) presentaron deleciones en el exón 19, 31 (26%) la mutación L858R en el exón 21,10 (8.4%) exhibieron la mutación S768I en el exón 20, 11 (9.2%) albergaron mutaciones complejas, mientras que únicamente ocho (2.1%), pacientes revelaron la mutación T790M. Todas las mutaciones mencionadas anteriormente tuvieron una asociación independiente con la histología de adenocarcinoma, edad avanzada y ausencia de historia de tabaquismo.
Pacientes con mutaciones en EGFR y ausencia de mutaciones en KRAS recibieron tratamiento a base de terapias biológicas con EGFR-TKI en primera, tercera y cuarta línea de tratamiento. Los resultados clínicos fueron: respuesta completa en 7.1%, respuesta parcial en 55.4% (tasa de respuesta global del 62.5%) y enfermedad estable en 37.5%. SLP y SG fueron de 15.1 (IC 95%: 12.4-17.9) y de 16.4 meses (12.4-20.6), respectivamente. No se encontraron diferencias en la SG en los pacientes portadores de deleciones en el exón 19 (16,5 meses, 10.4-22.7) o L858R (16 meses, 11.1-20.9, p = 0.612); resultados similares fueron reportados en pacientes con mutaciones en EGFR tratados con gefitinib como terapia de primera línea.28
Material y métodos
Se realizó un estudio observacional, analítico, retrospectivo y transversal con el objetivo de conocer el efecto de los inhibidores tirosina cinasa en la supervivencia de pacientes con adenocarcinoma pulmonar, EGFR mutado. En un periodo de dos años (de 2013 a 2015) fueron incluidos pacientes con diagnóstico confirmado de cáncer pulmonar y la presencia de EGFR mutado realizado por FISH (siglas del inglés fluorescent in situ hybridization). Se excluyeron pacientes con cáncer pulmonar con otros tipos histológicos o sin mutación del EGFR, así como los que recibieron un tipo de tratamiento distinto a TKI o no recibieron tratamiento. Los datos fueron obtenidos a través de revisión de expedientes. Las variables fueron analizadas con estadística descriptiva e inferencial. La estadística descriptiva se realizó por medio de medidas de tendencia central y de dispersión para las variables cuantitativas; para las variables cualitativas, las frecuencias fueron expresadas en porcentaje. La supervivencia (estadística inferencial) se evaluó mediante prueba de Kaplan-Meier, Logrank o regresión de Cox, considerando una significancia estadística asociada a un valor de p < 0.005. Se utilizó el programa estadístico de SPSS versión 22 con licencia para la Universidad Anáhuac.
Resultados
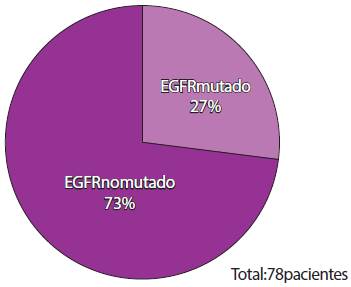
Durante el periodo de estudio, se identificaron 78 expedientes de pacientes con adenocarcinoma pulmonar en etapa clínica avanzada estirpe adenocarcinoma; de éstos, aquellos pacientes con EGFR mutado fueron 21 (26.92%) (Figura 1). Ocho pacientes no cumplieron los criterios de inclusión por distintas causas (no aceptaron tratamiento, recibieron quimioterapia intravenosa, mal estado funcional), por lo que fueron excluidos del estudio. Por esta razón, la muestra final fue representada por 13 pacientes; todos recibieron tratamiento con inhibidor tirosina cinasa tipo erlotinib.
Pacientes con adenocarcinoma de pulmón EC IIIB o IV
Figura 1 Porcentaje de pacientes conmutación EGFR. Total de pacientes: 78; de ellos, 27% presentó mutación en el receptor del factor de crecimiento epidérmico.
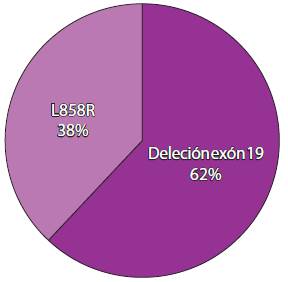
La edad promedio de los pacientes fue de 66.77 ± 9.356 años, con una mediana de 67 años; 46.2% fueron del sexo femenino y 53.8% del masculino (Figura 2). El tipo de deleción más común fue del exón 19 (en un 61.5%); la segunda fue de L858R (en 38.5%). No se reportaron mutaciones de resistencia ni alguna otra menos frecuente (Figura 3).
El antecedente de tabaquismo en el total de los pacientes fue negativo en su mayoría, representado con un 76.9 %; fue positivo sólo en el 23.1%. El 54% presentó respuestas parciales, el 31% enfermedad estable y sólo el 15% reportó respuesta completa (Figura 4).
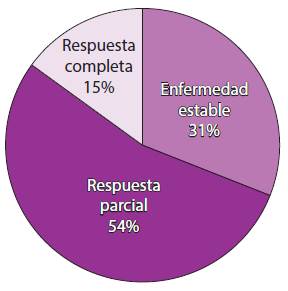
Las repuestas al tratamiento fueron valoradas a los seis meses de iniciado con un estudio tomográfico, basándose en los criterios de RECIST.
Figura 4 Porcentaje de respuestas clínicas.
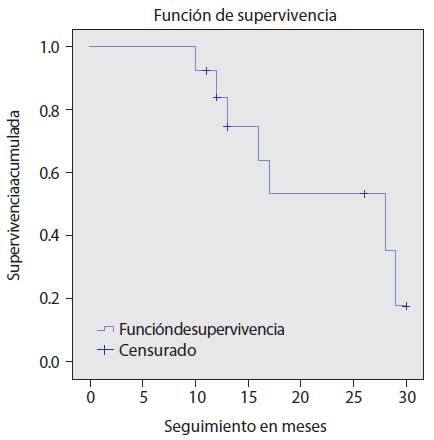
Al final del estudio, seis pacientes habían sobrevivido (46%) y siete murieron (54%). El método de Kaplan-Meier arrojó una media de 21.95 meses (intervalo al 95%) y una mediana de 23 meses (intervalo de confianza al 95%) (Figura 5).
Discusión
Este estudio sugiere que los pacientes con adenocarcinoma de pulmón en etapa clínica avanzada (IIIB o IV), EGFR mutados, tratados con inhibidor de tirosina cinasa en el Hospital Central Militar presentaron una media de 22 meses y una mediana de 23 meses de supervivencia, siendo esta similar a lo documentado en la literatura mundial. Dichos resultados no pueden ser determinantes, por tratarse de un estudio con número pequeño de pacientes y con un tiempo corto de seguimiento.
La supervivencia libre de progresión no pudo ser analizada, ya que no se encontró documentado en el expediente clínico un seguimiento objetivo con estudios de imagen con la misma periodicidad de realización; además, en varios pacientes no se trataba del mismo estudio, por lo que no pudieron ser comparados.
Las características que presentó nuestra población fueron similares a lo que se ha reportado en otros trabajos a nivel mundial, ya que la presencia de mutación EGFR en todos los pacientes con adenocarcinoma pulmonar a los que se les realizó la determinación fue de 27%. Asimismo, la mayoría de los pacientes no contaban con el antecedente de tabaquismo, el promedio de edad fue de 66 años, mas no hubo diferencia entre mujeres y hombres.
De igual forma, la mayoría de las respuestas clínicas que presentaron los pacientes fueron respuestas parciales, seguidas de enfermedad estable; sólo dos mostraron respuestas completas.
Todos los pacientes recibieron el mismo TKI, ya que a la llegada de este tipo de fármacos a nuestro hospital, el único con que se contaba era erlotinib. Actualmente, ya tenemos todos los demás inhibidores de cinasas (afatinib, gefitinib); no se ha encontrado entre ellos una diferencia significativa en resultados clínicos, mas sí en costos.
El tipo de deleción más común fue del exón 19, seguido de L858R, lo que fue similar a lo ya publicado.
Conclusiones
Podemos concluir con los resultados de este estudio que la hipótesis planteada fue comprobada, ya que se observó un incremento en la supervivencia en los pacientes con CPCNP del Hospital Central Militar tratados con TKI, lo que fue similar a los resultados publicados en la literatura nacional e internacional.
Cabe mencionar que estos resultados no son determinantes y podrían variar debido al tamaño pequeño de la muestra y sesgos secundarios, como la falta de estandarización en el seguimiento de pacientes con esta enfermedad oncológica.
Las características de nuestra población estudiada fueron muy similares y acordes al resto de las poblaciones investigadas a nivel mundial.











 nueva página del texto (beta)
nueva página del texto (beta)