Introducción
La medicina regenerativa es un área de la medicina moderna que se encarga de desarrollar estrategias para permitir la recuperación de la función perdida de tejidos u órganos dañados, sustituir o regenerar células, proporcionando elementos necesarios para la reparación in vivo y/o estimulando la regeneración del organismo. Para este fin, se emplean moléculas solubles, ingeniería genética y, en particular, células madre, células troncales o stem cells.1
Las células madre (CM) tienen la capacidad de autorrenovación y diferenciación. Se clasifican de acuerdo con su potencial de diferenciación en totipotentes, pluripotentes y multipotentes. Las totipotentes son capaces de originar cualquier tipo celular proveniente de las tres capas germinativas (endodermo, mesodermo y ectodermo); en un sentido estricto, sólo los estadios iniciales del cigoto constituirían CM totipotentes. Las CM pluripotentes son capaces de originar cualquier tipo de tejido, a excepción de la placenta y las membranas ovulares; las CM propias de cada órgano son multipotentes, porque -aunque presentan diferentes grados de plasticidad- ya están comprometidas con la diferenciación celular.2
Por otra parte, los padecimientos cronicodegenerativos (como la enfermedad renal crónica -ERC-), el envejecimiento y el efecto del ambiente aceleran la reserva de células madre de los seres vivos, limitando la capacidad de regeneración celular intrínseca de los organismos.3
La enfermedad renal crónica es una de las principales causas de atención hospitalaria y representa 70% de todas las muertes. En México, la principal causa de ERC es la diabetes mellitus tipo 2, que afecta a 6.4 millones de adultos, seguida de la hipertensión arterial, que impacta a 22.4 millones, según la ENSANUT 2012.4
Las opciones de tratamiento de la ERC dependen de la etapa de la misma; sin embargo, en la actualidad, una de las alternativas de tratamiento es el empleo de medicina regenerativa con células madre derivadas de orina (USC), que tienen la capacidad de autorrenovación y diferenciación multipotencial. Una característica importante es que estas células no forman tumores in vivo. Estas células pueden aislarse mediante la orina obtenida de un individuo: una forma no invasiva, sencilla y de bajo costo. Se estima que, en teoría, es posible conseguir de cinco a ocho células por cada 100 mL de orina y se pueden generar millones de células en cultivo para utilizarse potencialmente como terapia para la reparación de tejidos.5-10 Por otro lado, existen evidencias del uso de la espectroscopia de impedancia eléctrica (EIE) como un método para la identificación de células en cultivo celular obtenidas de diferentes fuentes.
González y sus colaboradores (2004) realizaron un estudio donde propusieron el desarrollo de una nueva tecnología de invasión mínima dirigida al diagnóstico temprano del daño isquémico de la mucosa gastrointestinal mediante espectroscopia. Los resultados indicaron que la estimación del daño isquémico con esta tecnología es viable y establecieron su potencial como una herramienta en el monitoreo del paciente críticamente enfermo y la implementación de esta tecnología en el Instituto Armado.11
En otro estudio, Yang y su grupo (2007) mostraron la posibilidad de utilizar la EIE para determinar las diferencias en la caracterización de las propiedades eléctricas de diferentes líneas de células tumorales.12
En 2014, Silva y sus colegas evaluaron una técnica simple y no costosa que empleaba espectroscopia de impedancia asistida con nanosondas para evaluar mediciones realizadas con células de cáncer de mama en suspensión.13
En la actualidad, no se han encontrado reportes donde se use la espectroscopia de impedancia para la detección de células madre mesenquimales de origen urinario utilizando nanosondas, por lo que el objetivo del estudio fue proponer y evaluar una técnica para la detección y aislamiento de células madre en muestras de orina con un biosensor, empleando espectroscopia de impedancia asistida con nanosondas.
Material y métodos
a. Diseño experimental
Se colectaron 100 muestras de orina (previo consentimiento bajo información) de pacientes con nefropatía que acudieron a la consulta de nefrología y subgabinete de diálisis peritoneal del Hospital Central Militar en el periodo comprendido de abril de 2016 a diciembre de 2017. Se obtuvieron en promedio 100 mL de orina de cada paciente, la cual se depositó en tubos cónicos estériles de 50 mL.
b. Cultivo celular
Las muestras de orina fueron centrifugadas a 1,800 rpm durante 10 minutos; los sobrenadantes fueron eliminados y el sedimento fue resuspendido en buffer salino de fosfatos (PBS) y centrifugado una vez más; se eliminó el sobrenadante y el sedimento se resuspendió en un mililitro de medio de cultivo fresco. Se realizó el conteo celular, empleando el contador automático de células; la viabilidad se determinó por exclusión con azul tripano. Las células restantes se colocaron en placas de cultivo de seis pozos -aproximadamente, 100 células por pozo- con un medio combinado, que incluye: medio de queratinocitos libres de suero, con medio de células progenitoras, en una proporción de 1:1. El medio de queratinocitos sin suero, se complementó con 5 ng/mL de factor de crecimiento epidérmico, 50 ng/mL de extracto de hipófisis bovina, 30 ng/mL de toxina del cólera, 100 U/mL de penicilina y 1 mg/mL de estreptomicina; el medio de células progenitoras contenidas –, medio de Eagle modificado de Dulbecco, ¼ Hamm’s F12, suero bovino fetal al 10%, hidrocortisona 0.4 g/mL, toxina colérica 1010 M, insulina 5 ng/mL, adenina 1.8x104 M, transferrina 5 g/mL más 2x109 M 3,39,5-triyodo-L-tironina, factor de crecimiento epidérmico 10 ng/mL y 1% de penicilina-estreptomicina.14 Se realizó el seguimiento de los cultivos a los ocho, 15 y 30 días.
c. Elaboración de nanosondas y marcaje de células obtenidas de orina
Para la elaboración de las nanosondas se emplearon nanopartículas ferromagnéticas nanoscreen -MAG/G-Ara (Chemicell, Alemania) de 100 nm recubiertas con fluorocromo color verde y sílice. Se funcionalizaron con anticuerpos monoclonales SSEA-4, CD90, CD44, CD105, CD73, CD146 (receptores de superficie de células mesenquimales indiferenciadas y multipotentes) y podocalixina (marcador de células renales). Para el efecto, se usó la técnica de acoplamiento utilizando el método de carbodiimida (protocolo A-10. Chemicell, Alemania). Las células obtenidas en los cultivos fueron analizadas por microscopia óptica para determinar sus características morfológicas, tripsinizadas y marcadas con las diferentes nanosondas para ser analizadas mediante espectroscopia de impedancia.
d. Evaluación de espectroscopia de impedancia eléctrica
Las mediciones de impedancia se realizaron empleando el espectroscopio de impedancia de alta precisión (Agilent; Modelo 4294A), que aporta una señal/cos (ωt) en un rango de 100 MHz. Por su parte, el prototipo del biosensor consiste en dos electrodos de oro insertos en una superficie de cuarzo, colocados de manera que se cierre el circuito eléctrico a través de la muestra de células en las siguientes condiciones: 200,000 células marcadas con las nanosondas, 200,000 células solas y PBS. Las evaluaciones se llevaron a cabo en un rango de frecuencia de 100 Hz a 100 MHz a 181 pasos/espaciados logarítmicamente. El principio del sistema consiste en que las mediciones representan cambios de conductividad y permitividad eléctrica; lo que significa que la bioimpedancia compleja Z varía en relación con las condiciones de las células ya mencionadas (Figura 1).

Figura 1 Sistema de análisis de espectrosco pia de impedancia eléctrica: A. es pectrómetro de impedancia de alta precisión (Agilent; Modelo4294A), B. biosensor constituido por un sistema de electrodos, una base de cuarzo y un área de depósito de células.
e. Análisis de microscopia de fluorescencia
Para la inmunotipificación de las células obtenidas en los cultivos se marcaron 100,0000 células con los diferentes anticuerpos y nanosondas SSEA-4, CD90, CD44, CD105, CD73, CD146 y podocalixina, y fueron analizadas mediante microscopia de fluorescencia (microscopio Nikon Eclipse ME600) a un aumento de 40x. Simultáneamente, se realizaron observaciones empleando el microscopio multifotón FVMPE-RS de dos canales (Olympus).
Resultados
Del total de muestras, 94 no presentaron desarrollo celular y mostraron presencia de contaminación por bacterias o levaduras. Sólo seis muestras exhibieron crecimiento celular, el cual fue registrado a los ocho, 15 y 30 días. La cantidad obtenida en promedio fue 1.4 millones de células por placa; la viabilidad promedio fue del 60% (Figura 2). Se analizaron las células conseguidas mediante microscopia óptica y se pudo determinar que su morfología es similar a un grano de arroz y algunas otras con morfología de fibroblastos, como lo menciona la literatura (Figura 3). En cuanto al análisis de espectroscopia de impedancia eléctrica, se realizó el ensayo bajo tres condiciones: PBS solo como control, células sin marcar y células marcadas con nanosondas. En lo que respecta al resultado observado en el ensayo de la fase de la espectroscopia, fue posible establecer que existen diferencias estadísticamente significativas (t de Student, p < 0.05) entre las frecuencias 1.00e+2 y 2.00e+03 Hz cuando se comparan las células solas (sin marcar) y las células marcadas con el coctel de las diferentes nanosondas (SSEA-4, CD90, CD73, CD44 y PDXL) (Figura 4). Para confirmar la expresión de los marcadores específicos de células madre, se llevó a cabo el análisis mediante microscopia de fluorescencia y multifotónica, y de manera simultánea, el marcaje del núcleo celular empleando el colorante DAPI. Se observó que existe una baja expresión de los marcadores de superficie SSEA-4, CD44, CD73, CD146 podocalixina (PDXL) y CD90; sin embargo, sí fue posible identificar las células con estos marcadores específicos de células madre.

Figura 2 Resultados del desarrollo de cultivos celulares en 100 muestras de orina de individuos nefrópatas.
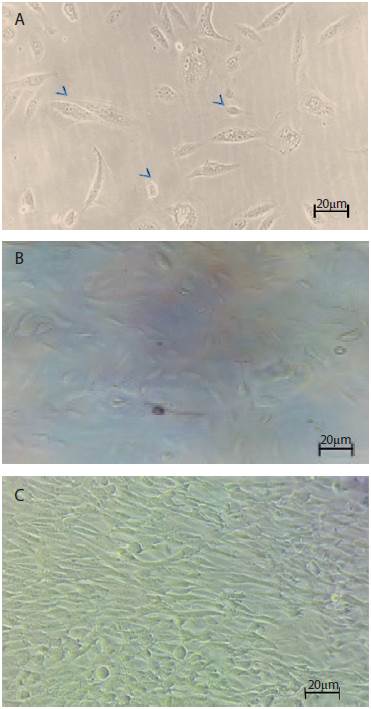
Figura 3 Microfotografías de los cultivos celulares a partir de muestras de orina: A. ocho días, B. 15 días, C. 30 días. Aumento: 40x. Campo claro (microscopio invertido Nikon Eclipse TS100).

Figura 4 Resultados de la evaluación de espectroscopia de impe dancia eléctrica. Se mues tran los registros multifre cuencia de magnitud y fase.
Por otra parte, se realizó el análisis de espectroscopia de impedancia eléctrica, el cual mostró que en la magnitud y fase fue posible establecer diferencias estadísticamente significativas (t de Student, p < 0.05) en las frecuencias de 1.0e+06 -1.0e+07 Hz y 1.0e+02 -2.0e+03 Hz cuando se comparan las células solas (sin marcar) y las células marcadas con el coctel de las diferentes nanosondas (SSEA-4, CD90, CD73, CD44, CD146 y PDXL, respectivamente) (Figuras 5 y 6).

Figura 5 Microfotografía de células obtenidas de muestras de orina marcadas con el anticuerpo monoclonalanti-SSEA-4FITC. Marcaje de núcleos con DAPI. Aumento: 25x (microscopio multifotónico).

Figura 6 Microfotografías obtenidas en microscopiode epifluorescencia, donde se muestran los resultados de la fluorescencia de los marcadores de superficie relacionados con el fenotipo de células madre multipotenciales obtenidas de orina. A. CD44, B. podocalixina, C. CD73, D. CD90, E. SSEA-4y F. CD146.
Discusión
Se considera que la fuente de la contaminación de las muestras pudo ser el procedimiento de toma de muestra, aun cuando éste se les indicó a los pacientes; otra razón posible es que los pacientes pudieron tener algún proceso de infección asociado con la nefropatía. Respecto al cultivo celular, fue posible realizarlo empleando, en un inicio, un medio que no fue el específico; posteriormente, se usó el medio enriquecido, lo que permitió que las pocas células obtenidas de muestras de orina crecieran en el cultivo; sin embargo, se sabe que las células pueden sufrir daño al momento de su extracción y resultan ser muy sensibles a la manipulación.
Se realizó el análisis morfológico de las células obtenidas, pero éstas fueron escasas; además, se presentó otro tipo de células en el cultivo, las cuales podrían ser células madre, pero ya en un estado de diferenciación, por lo que la expresión de los marcadores se pudo haber visto modificada. Sin embargo, se pudo demostrar que sí hay existencia de células madre. Los resultados generados por microscopia permitieron evidenciar que las células obtenidas en los cultivos muestran positividad leve en la expresión de los marcadores de células madre mesenquimales indiferenciadas. A pesar de ello, hace falta mejorar la técnica de marcaje con los anticuerpos y las nanosondas, así como la utilización de células como controles positivo y negativo, además de realizar más ensayos para tener la certeza de la positividad exhibida por las células obtenidas.
Se pudo evidenciar de manera inicial la factibilidad de emplear la espectroscopia de impedancia para detectar y aislar células de origen renal marcadas con nanosondas, ya que hubo ciertos rangos de frecuencia donde se detectaron diferencias en la fase y la magnitud del ensayo. Sin embargo, al ser un estudio inicial, falta realizar más repeticiones y ver la reproducibilidad de la técnica.
Conclusiones
La técnica de obtención de células madre de muestras de orina resultó ser complicada debido al alto porcentaje de contaminación y de nulo crecimiento de células en la mayoría de las muestras conseguidas. La morfología celular sugiere la presencia de células de tipo mesenquimal, pero en baja proporción, y expresan en bajo porcentaje los marcadores específicos para células mesenquimales indiferenciadas y multipotentes. El resto de las células podrían ser diferenciadas y con una mortalidad importante. Las mediciones de EIE evidenciaron en ciertas longitudes de onda diferencia entre las condiciones de células solas y células marcadas con las nanosondas, lo que permite asumir de manera inicial la presencia de células que fueron reconocidas por los anticuerpos específicos de este tipo de células. Se recomienda optimizar la técnica de obtención de muestras y realizar más estudios de espectroscopia de impedancia para corroborar los resultados preliminares de este trabajo, con el objeto adicional de validar la técnica.











 nueva página del texto (beta)
nueva página del texto (beta)


