La farmacovigilancia (FV) ha tomado importancia en las últimas cinco décadas, esto derivado de los trágicos acontecimientos relacionados con algunos medicamentos que han ocasionado reacciones adversas graves. Ejemplos representativos de lo anterior fueron los casos del uso del «elixir sulfanilamida» como jarabe para tratar la tos (EUA, 1937) y el desastre de la talidomida (1957-1963). El primero de ellos contenía dietilenglicol y llevó a la muerte de 107 personas, en su mayoría niños; la segunda afectó a nivel mundial a más de 10,000 niños que nacieron con alteraciones congénitas.1 Sin embargo, éstos no son los únicos ejemplos ni las únicas razones. En 1972 la OMS publicó el reporte «International Drug Monitoring: The Role of National Centers, en el que se mencionaba que uno de cada 20 ingresos a las salas de urgencias se asoció a una reacción adversa a un medicamento. En los años 90 ya existían cálculos de los costos que esto implicaba para el sistema de salud norteamericano, alcanzando el monto de cien billones de dólares anuales.2
En 2002, la OMS presentó cifras más específicas, lo cual facilitó el dimensionar la magnitud del problema, ya que las reacciones adversas a medicamentos (RAM) se encontraban entre la cuarta a sexta causa de muerte en Estados Unidos de América. En países como Noruega (11.5%), Francia (13%) y Reino Unido (16%), las reacciones adversas correspondieron a más del 10% de las hospitalizaciones. Esto condujo a una carga económica hasta del 15 al 20% del presupuesto de los hospitales a nivel mundial.3 En la revista «Perspectivas políticas» de la OMS sobre medicamentos, se publicó en 2004 un artículo relacionando la seguridad de los medicamentos con las actividades de farmacovigilancia, en el que se mencionaba que en algunos países, las RAM se encontraban entre las primeras 10 causas de mortalidad. Otro artículo de 2006 refirió que el costo de eventos adversos por medicamentos ascendió a un aproximado de 847 millones de dólares anuales en el Servicio Nacional Británico, y en Estados Unidos, el monto fue de 76.6 billones de dólares anualmente.4 Hoy esto sigue siendo una gran problemática, ya que genera grandes costos y aumenta la morbimortalidad. Por otro lado, algunos estudios reportan que el 3.6% de las prescripciones tienen errores, de los cuales 21% pasan inadvertidos en el área de farmacia, 23.5% podrían ocasionar un efecto adverso y 28% un daño grave; lo anterior se observó en un hospital donde se tiene establecido un servicio de farmacia intrahospitalaria que revisa todas las prescripciones y que supone una minimización de riesgos.5
Es importante entender que en el entorno de la prescripción y administración de medicamentos existen factores que afectan y aumentan los riesgos. Éstos incluyen las características mismas del paciente que presenta una idiosincrasia genética, la enfermedad, el o los métodos diagnósticos, la disponibilidad de recursos, condiciones culturales, económicas, sociales, religiosas, e incluso, de accesibilidad a los diferentes medicamentos, además de muchos otros elementos ajenos al paciente, como el desarrollo, fabricación, almacenamiento, transporte y distribución de los medicamentos, su falsificación o los medicamentos subestándar, así como la capacitación del personal sanitario, el conocimiento que tiene sobre los medicamentos en específico, la influencia de la industria farmacéutica y muchos otros aspectos ajenos a la prescripción. Algunos estudios mencionan que el porcentaje de los medicamentos falsificados o subestándar ha llegado a números importantes, como se ejemplifica en la Figura 1.6
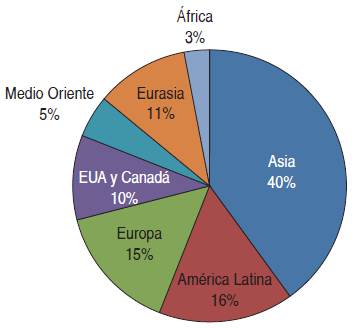
Figura 1 Porcentaje de medicamentos falsificados acorde con información de «The Pharmaceutical Security Institute», año 2011.
Ante este panorama complejo, se están haciendo esfuerzos mundiales para mejorar la prescripción, identificar los riesgos y minimizarlos, logrando conocer más sobre las reacciones adversas, interacciones y riesgos de los medicamentos. Para ello, la OMS lanzó en 1968 el Programa Internacional de Monitoreo de Medicamentos,1 el cual derivó en 1978 en un convenio entre la autoridad mundial y Suecia; de esta manera, se creó el Centro de Monitoreo Uppsala (Uppsala Monitoring Center), que alberga toda la información relacionada con reacciones adversas de medicamentos reportadas a nivel mundial; ahí se realiza la evaluación de los datos para identificar señales y, así, poder tomar acciones ante un riesgo inminente a la salud causado por algún medicamento. Uppsala Monitoring Center (UMC) establece lineamientos operativos a nivel internacional en aras de mejorar la investigación, calidad, comercialización, prácticas de prescripción, dispensación y administración de medicamentos para los pacientes, así como el seguimiento terapéutico, identificación de RAM y otras problemáticas de los medicamentos, abarcando incluso su correcta disposición final (desecho), en su caso. La OMS establece las políticas internacionales y elabora de manera conjunta con el UMC estrategias para minimizar los riesgos relacionados con los medicamentos, planteando metas y objetivos. Cabe mencionar que en el documento «Medication Without Harm, WHO Global Patient Safety Challenge», publicado en 2017 por la OMS, se establece como meta a ser alcanzada en cinco años la reducción en un 50% de los daños severos relacionados con los medicamentos mediante la implementación de acciones para reforzar los métodos de escrutinio de errores en las prescripciones, buenas prácticas en los procesos de manejo y uso de los medicamentos, y las actividades propias del análisis de los datos derivados de las actividades de farmacovigilancia.7
Como consecuencia de lo anterior, la FV se ha consolidado como una herramienta cuyo interés tiene trascendencia internacional. Sus actividades con sustento científico se encargan de vigilar, investigar y evaluar los medicamentos, productos biológicos, plantas medicinales y medicinas tradicionales con la finalidad de identificar RAM y prevenir el posible daño a los pacientes.8 Sin embargo, se han planteado diferentes definiciones que varían según su injerencia y los campos que abarca. Cada país, con base en las políticas y ordenamientos internacionales, ha buscado establecer la FV adaptándola a su sistema de salud.
En el caso de México, la FV inició en 1995 cuando se inauguró el Centro Nacional de Farmacovigilancia, integrándose al programa internacional en 1998. En 2004 fue regulada con la NOM 220.1 Ésta fue reformada en 2012,8 y luego, en el año 2017, siguiendo las observaciones que hizo el grupo de evaluación de la OMS en 2015.9 Así, la FV en nuestro país ha evolucionado con pasos firmes y consistentes, realizando la detección, evaluación, comprensión y prevención de efectos adversos por medicamentos (EA), sospechas de reacciones adversas a medicamentos (SRAM), reacciones adversas a medicamentos (RAM) y eventos supuestamente atribuibles a la vacunación o inmunización (ESAVI).9 Las acciones de FV tienen un alcance extendido que engloba a todos los involucrados en el proceso de los medicamentos, desde su creación hasta su disposición: abarca desde el gobierno (tanto federal como estatal), las organizaciones de investigación, los centros de salud y hospitalarios, la industria farmacéutica, proveedores, distribuidores y comercializadores, hasta todo el personal de salud, e incluso, los mismos pacientes y familiares.
Importancia de la farmacovigilancia
La vigilancia de los medicamentos postcomercialización y el reporte de reacciones adversas a medicamentos toman gran relevancia debido a que los estudios preclínicos, conformados por una fase in silico, in vitro, y luego en animales, resultan insuficientes para determinar la seguridad de los productos farmacéuticos en los humanos. Una vez que los medicamentos han pasado por los estudios preclínicos, se llevan a cabo las fases clínicas una a tres, en las cuales el número pacientes es limitado y son puntualmente seleccionados. El número aproximado de participantes en estos trabajos es de cinco mil. Sin embargo, para identificar aquellas reacciones adversas cuya incidencia es de una en 10 mil, se requeriría realizar estudios cuyo número mínimo fuese 30 mil pacientes, sin considerar grupos especiales como son los niños, las mujeres embarazadas o lactando y los ancianos. De lo anterior deriva la particular importancia de los estudios postcomercialización y de que el personal de salud realice reportes de reacciones adversas, así como la identificación de RAM menos comunes, lo que puede salvar y mejorar las vidas de los pacientes.3
Mucho se ha hecho por mejorar el reporte de reacciones adversas a nivel mundial, aunque los avances parecen ser poco significativos para la magnitud del problema que enfrentamos. Existen algunas barreras para la implementación correcta y completa de la FV; entre ellas está el hecho de que es percibida como un lujo que sólo se pueden dar los países desarrollados. Esto favorece que en los países en desarrollo se asignen recursos insuficientes a esta actividad, y mayores a la reducción de la morbilidad y la mortalidad, sin considerar los costos que representan los problemas relacionados con los medicamentos para el sistema de salud (costos indirectos) y que también impactan directamente en la morbimortalidad.10
En su mayoría, el personal de salud no conoce ni se encuentra preparado para desarrollar actividades de FV y no parece dar mucha importancia a este aspecto, quizá porque asume que los medicamentos utilizados a nivel mundial son seguros y no se requiere una reevaluación de dicha seguridad.10 Así mismo, no perciben o dimensionan la problemática a la que nos estamos enfrentando, ya que en sus actividades habituales, la casuística misma de problemas con medicamentos es baja en su presentación, se confunde con potenciales errores, o tan sólo no se piensa que los problemas que presenta el paciente o el fallo terapéutico puedan ser consecuencia del uso de los medicamentos; además, en el ámbito particular de cada caso, a menos que éste sea particularmente grave o fatal, no ven un resultado tangible de reportar las reacciones adversas, ya que no consideran que esto impacte en el paciente ni en su práctica clínica cotidiana. Por fortuna, las actividades de difusión de información y la capacitación están cambiando este panorama en la forma de pensar y actuar del personal de la salud.
La OMS establece que, incluso en algunas unidades de FV, la infranotificación puede ser tan alta como más del 90% y que en los países que logran la meta de 200 o más notificaciones anuales de RAM por millón de habitantes, sólo el 10% de los médicos las han realizado.11 Cabe resaltar que el número de reportes no es el único indicador: hay que considerar si dichos reportes son de adecuada calidad y si se pueden utilizar para la toma de decisiones y la generación de señales.
Recientemente se reconoce que existe, gracias a la sensibilización por la adopción de la cultura de la calidad en salud, una preocupación por parte del personal sanitario respecto a la seguridad de los medicamentos y su vigilancia; sin embargo, persiste también la creencia o mito del posible impacto negativo que tendría levantar reportes de reacciones adversas en su práctica médica, al poder ser señalado por un error o mala praxis y enfrentar la posibilidad de una denuncia.11 Además, el personal que ha realizado los reportes expresa que no alcanza a percibir un beneficio cercano, ya que no recibe ninguna retroalimentación; asimismo, considera que es un proceso tedioso y muy burocrático.
En una revisión sistemática en el año 2014, se buscó identificar las causas de la infranotificación de RAM por parte de los profesionales de la salud. Se analizaron 149 artículos de diferentes bases de datos LILACS, PAHO, SciELO, EMBASE, PubMed; se encontró que las causas principales eran la ignorancia, la inseguridad y la indiferencia.12 Ninguno de los estudios fue realizado en México; sin embargo, es muy posible que este escenario también sea aplicable en nuestro país.
En Nueva Zelanda, el 12.9% de los ingresos hospitalarios se relacionan con RAM. De todos los reportes sometidos al Centro de Monitoreo de Reacciones Adversas, 5.7% fueron realizados por farmacéuticos. Aquí, las razones identificadas de la infranotificación fueron no saber cómo hacer el reporte, no saber quién era el responsable, desconocimiento del medicamento responsable, creer que en el mercado sólo hay medicamentos seguros, preocupaciones respecto a la confidencialidad, la idea de que reportar puede demostrar ignorancia, inquietudes legales, dificultad para aceptar el daño al paciente, carga de trabajo excesiva, falta de disponibilidad del formato, información insuficiente para reportar.13
En cambio, en Estados Unidos, el reporte de los farmacéuticos corresponde al 70% de lo sometido a MedWatch; en Colombia representa el 38.8% de los reportes, y los médicos sólo reportan el 10.8%.14 En estos países, el farmacéutico clínico tiene un papel mucho más activo e importante en el sistema de salud y con el paciente. Es muy interesante que Estados Unidos es el país que más reportes tiene a nivel mundial: en 2015 representó el 57% de los reportes registrados por Uppsala, lo que corresponde a un índice de 2,004 reportes por millón de habitantes, sólo por debajo de Singapur y Corea del Sur, con 3,847 y 2,399, respectivamente.14
En países como Canadá se ha calculado que las 32,000 RAM que reciben al año corresponden sólo al 5% de las RAM que se presentan. Las causas principales, al igual que en el estudio anterior, son la ignorancia, timidez y letargo del personal de salud para reportarlas. Por ello, en este país se tomó la determinación de implementar un sistema automático de reporte que está vinculado a su sistema de información médica de pacientes: mediante sistemas tecnológicos de comunicación, el personal de salud tendrá a su disposición información sobre las RAM, la cual será de utilidad para su práctica clínica y pacientes.15
En Guatemala se realizó un estudio en el Hospital Roosevelt, donde se observó que 63% de los evaluados presentaron un conocimiento insatisfactorio sobre la FV; de éstos, en 4% fue bajo y en 59% deficiente. En este mismo trabajo se mencionó que las principales RAM identificadas fueron desmayo, confusión, náuseas, mareo, alergias, taquicardia, dificultad para respirar, síncope, reflejo vasovagal, erupción, edema, vómito y sueño.16
En México, el número de reportes seguía siendo bajo hasta hace pocos años y difícilmente llegábamos a las metas internacionales de 200 reportes anuales por millón de habitantes. En 2014 hubo un total de 40,499 reportes de sospecha de reacción adversa a medicamentos (SRAM), y en 2015, un total de 54,795.17
Es evidente que en nuestro país aún falta mucho por hacer en este tema. Hay sectores que se han involucrado más que otros. Los que han quedado rezagados en una implementación eficaz pueden deber su atraso al inicio más como un tema normativo que como un tema científico y/o clínico. Según las estadísticas del Centro Nacional de Farmacovigilancia (CNFV), los porcentajes de reporte de sospecha de reacciones adversas son en su inmensa mayoría producidos en la industria quimicofarmacéutica, y después, por centros estatales, centros institucionales y estudios clínicos, siendo prácticamente nulo el reporte del personal de salud, unidades de FV hospitalaria, estudios de bioequivalencia y pacientes, entre otros (Figura 2).17 Esto concuerda con lo que se reportó en la estadística del CNFV en 2015 y años previos, ya que en el Boletín de Farmacovigilancia 7 del CNFV, se mencionó que el porcentaje de reporte de la industria quimicofarmacéutica era de un 66%.18
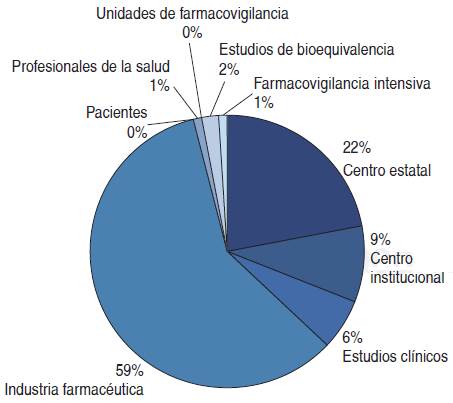
Figura 2 Origen de las notificaciones recibidas en el Centro Nacional de Farmacovigilancia de la Cofepris, año 2015. Total: 44,779 notificaciones.
No debe olvidarse que no sólo es importante el número de reportes, sino también su calidad. Según el CNFV, en 2009 la calidad de los reportes de la industria quimicofarmacéutica fue en un 69% grado cero, lo que quiere decir que únicamente se contó con las siglas del nombre del paciente, nombre del profesional que reportó, medicamento sospechoso y la RAM que se presentó. Sin embargo, se ha dicho que los reportes con peso estadístico para la evaluación del riesgo y la generación de señales son grado dos; es decir, en México se tiene un número alto de reportes, pero de mala calidad. Esta información discrepa con la de un estudio que realizó la QFB Lucía Guadalupe Alcántara en 2010 como tesis profesional en la Facultad de Estudios Superiores Zaragoza de la Universidad Nacional Autónoma de México, en la cual mencionó que el 69% de las notificaciones eran de la industria quimicofarmacéutica, y que 50% tenía un grado de calidad dos.19
Existe poca información respecto al nivel de reporte de RAM en México. Algunos de los estudios que se tienen muestran un panorama similar a la situación mundial, donde la infranotificación es muy alta y los motivos son parecidos. En un trabajo que se realizó en la Unidad Médico Familiar número 73 del IMSS en Poza Rica, Veracruz, se evaluaron 61 galenos, tanto médicos familiares como residentes de dicha especialidad, y los resultados fueron los siguientes: el nivel de conocimiento de FV era bajo en 29% del total encuestado, deficiente en 50% de los médicos residentes y 43% de los médicos familiares.1 Por el otro lado, existe una investigación del Hospital Infantil de México «Federico Gómez» que menciona que 21.8% de los ingresos al Departamento de Urgencias corresponden a RAM. De éstos, 86% fueron identificados por los médicos y 14% por el farmacéutico; de las RAM detectadas por médicos, únicamente se realizó un reporte en el 6.1%.20 Estos dos estudios no ayudan a dilucidar cuál es el nivel de infranotificación en nuestro país, ya que abarcan grupos muy pequeños de los involucrados en el proceso de FV, además de que estos estudios no evaluaron las causas de la infranotificación. Sin embargo, se cree que, al igual que en el resto de Latinoamérica, la marcada infranotificación está relacionada con la baja participación de la mayoría de los profesionales con la misma FV.21 También suponemos que un motivo importante es la poca intervención del profesional farmacéutico y la implementación de la atención farmacéutica en la atención sanitaria, a pesar de que la OPS y la OMS han hecho hincapié en la importancia de esto desde el informe de Tokio de 1993 como parte indispensable para mejorar la seguridad y el correcto manejo de los medicamentos con los pacientes.
Por su parte, el Consejo de Salubridad General, desde el año 2007, como parte de los esfuerzos en la implementación de la cultura de la calidad en salud en el país, ha impulsado en su modelo el análisis de información para la detección de riesgos y problemas en los establecimientos de atención médica, y a partir de este análisis, instituir barreras de seguridad. También establece buenas prácticas, herramientas y metodologías de calidad a fin de que se adopte un ciclo de mejora continua; en consonancia con lo anterior, estimula la instauración de procesos de análisis de información relacionada con eventos adversos asociados a la utilización de medicamentos, incluyendo las actividades de farmacovigilancia. La tercera edición del Modelo de Seguridad del Paciente del Consejo de Salubridad General, publicada en 2015, cuenta ahora con un enfoque basado en la tropicalización, condiciones y marco normativo de nuestro país, siendo la FV uno de los 12 estándares indispensables para la certificación de los hospitales. Como ya se estableció, el objetivo de este modelo es garantizar la seguridad y calidad de los servicios de salud, alineado con el Plan Nacional de Desarrollo 2013-2018. Sin embargo, cabe resaltar que muchos de los hospitales en nuestro país aún no cuentan con dicha certificación.22
Ahora bien, como hemos visto, es claro que los medicamentos, precisamente por su capacidad de interacción con los sistemas biológicos para ejercer sus efectos, tienen inocuidad relativa. Por tanto, la farmacovigilancia es responsabilidad de los sistemas de salud, que al analizar la información relacionada con los efectos de los medicamentos, estén en posibilidad de identificar características de la población en la que se manifiesten eventos adversos relacionados, para que, por medio de la metodología científica de causa-efecto, se clarifiquen sospechas, se establezcan medidas y, por lo tanto, se pueda mejorar el perfil de seguridad de los fármacos, en beneficio del resto de la población.
En los últimos años se ha llegado a superar la meta de 200 notificaciones de sospecha de reacciones adversas a medicamentos por millón de habitantes en nuestro país, pero no por esto se debe pensar que ya se ha alcanzado lo esperado a nivel internacional, ya que quedan muchas interrogantes. ¿Son estas notificaciones de calidad para poder establecer señales? ¿Por qué el área clínica, si es la que tiene mayor accesibilidad a los pacientes, es la que menos notificaciones realiza? ¿Cuál es el panorama de las diferentes áreas involucradas en la FV en nuestro país, la prevalencia de notificación en dichas áreas y por los diferentes profesionales de la salud? ¿Cuáles son las barreras para notificar que se tienen en los diferentes sectores? ¿Nuestro sistema de salud está conformado de forma adecuada para fomentar y mejorar la seguridad en torno a los medicamentos mediante la FV?
El Hospital Central Militar (HCM) ha evolucionado con el devenir de la ciencia médica y el cambio de conciencia en favor de la seguridad del paciente, procurando estar siempre a la vanguardia en las mejoras de la calidad. Por ello, alineado con las políticas públicas en materia sanitaria, ha participado de manera activa en la implementación de las mejores prácticas y estándares para la certificación hospitalaria. La farmacovigilancia en este hospital ha estado presente siempre; sin embargo, en los albores de su existencia fue una actividad un tanto inconsciente, estableciendo medidas encaminadas a la seguridad en el uso de los medicamentos sin denominarse como tal. Fue hasta el año 2012 que se instauró el Comité Hospitalario de Farmacovigilancia, y en el año 2014 se ordenó la creación de la Unidad de Farmacovigilancia Hospitalaria, para que en conjunto, como órgano técnico consultivo y operativo, respectivamente, implementen las políticas y la normatividad que correspondan, teniendo, además, la función de evaluar los procesos del sistema de medicación del hospital. El HCM es considerado por el mismo Consejo de Salubridad como referente nacional, y reconocido por el Centro Nacional de Farmacovigilancia como Centro Institucional desde el año 2015.
De todo lo anterior deriva la importancia de implementar un sistema de medicación que considere todas las aristas y características de la población en los centros de salud y hospitales de nuestro país, considerando lo que menciona el Consejo de Salubridad General y tomando como referencia prácticas tanto nacionales como internacionales, buscando nuevas e innovadoras estrategias de abordar este tema. Al final de todo en el sistema de medicación se encuentra nuestro paciente, y por él debemos buscar mejorar continuamente y brindar una atención de calidad y segura, minimizando los riesgos y evaluando nuestras áreas de mejora.
La FV es una ciencia joven que busca detectar, evaluar, comprender y prevenir los riesgos que los pacientes tienen al tomar un medicamento para poder minimizarlos, estableciendo estrategias y planes en su manejo. Esto se debe buscar con un paso firme, entendiendo la necesidad que esta ciencia implica en cuanto a la multidisciplina en aspectos normativos, administrativos, educativos, estadísticos, farmacológicos y, de forma muy importante, clínicos. Es importante entender que se requiere establecer un sistema de reporte confiable y eficaz, lo cual implica clínicos preparados en la identificación de las RAM, para poder obtener la información y, así, entender el problema que enfrentamos, analizarlo y, con esto, establecer estrategias que impacten clínicamente al paciente.











 nueva página del texto (beta)
nueva página del texto (beta)


