Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Veterinaria México
versión impresa ISSN 0301-5092
Vet. Méx vol.45 no.spe Ciudad de México 2014
Artículos científicos
Caracterización de los tipos capsulares de Pasteurella multocida en exudado faríngeo de bovinos productores de carne clínicamente sanos en el estado de Querétaro
Characterization of capsular types of Pasteurella multocida isolated from clinically healthy beef cattle pharyngeal exudate in the state of Querétaro
Ana Lilia Villegas Vázquez‡, Víctor Manuel Campuzano-Ocampo*, Rigoberto Hernández-Castro**, Francisco Suárez-Güemes***, Francisco José Trigo Tavera†, Carlos Julio Jaramillo-Arango‡
* Departamento de Medicina Preventiva y Salud Pública, Facultad de Medicina Veterinaria y Zootecnia, Universidad Nacional Autónoma de México, 04510, México, D. F.
** Dirección de Investigación, Hospital General Dr. Manuel Gea González, Secretaria de Salud, Av. Calzada de Tlalpan 4800 Col. Sector XVI, 14080, México, D.F.
*** Departamento de Microbiología e Inmunología, Facultad de Medicina Veterinaria y Zootecnia, Universidad Nacional Autónoma de México, 04510, México, D.F.
† Departamento de Patología, Facultad de Medicina Veterinaria y Zootecnia, Universidad Nacional Autónoma de México, 04510, México, D.F.
‡ Centro de Enseñanza, Investigación y Extensión en Producción Animal en Altiplano CEIEPAA, Facultad de Medicina Veterinaria y Zootecnia, Universidad Nacional Autónoma de México. Km. 8.5 Carretera Tequisquiapan, Ezequiel Montes, Tequisquiapan, Querétaro.
Autor de correspondencia:
Carlos Julio Jaramillo Arango,
Tel. 014142918100
Correo electrónico: jaramillo50@yahoo.com.mx
Recibido el19de junio de 2013
Aceptado el 4 de septiembre de 2013.
Resumen
El objetivo del presente estudio fue identificar y caracterizar los tipos capsulares de P. multocida en exudado faríngeo en bovinos destinados a la producción de carne en el estado de Querétaro. Se obtuvieron, mediante hisopo, 227 muestras de exudado faríngeo de animales clínicamente sanos en una planta de sacrificio ubicada en el municipio de Ezequiel Montes, Querétaro. Las muestras se sembraron en agar sangre y se incubaron a 37°C por 24 h en aerobiosis. Las cepas aisladas fueron identificadas mediante características morfológicas, pruebas bioquímicas convencionales y el microsistema comercial API 20NE. La tipificación de los grupos capsulares A y D se realizó por medio de una PCR múltiple para la amplificación de los genes hyaD-hyaC y dcbF, respectivamente. De acuerdo con los valores establecidos por el software API WEB, se logró la identificación de 14.09% (32/227) de cepas de P. multocida, que mostraron 96% de identidad y una tipicidad de 1 a P. multocida. Por medio de la PCR múltiple se logró la amplificación de los genes hyaD-hyaC correspondientes al grupo capsular A en el 100% (32/32) de las cepas identificadas previamente como P. multocida. No existen datos similares en México sobre la identificación y caracterización de P. multocida en bovinos destinados a la producción de carne. Con los resultados obtenidos se corrobora que, de manera similar a otros países de Europa y América, en México el grupo capsular predominante de P. multocida es el A.
Palabras clave: Pasteurella multocida, tipos capsulares, caracterización bioquímica, caracterización molecular, exudado faríngeo, bovinos, PCR.
Abstract
The objective of the present study was to identify and characterize capsular types of P. multocida isolated from beef cattle pharyngeal exudate in the state of Querétaro. Two hundred and twenty seven pharyngeal exudate swab samples from clinically healthy animals in a slaughterhouse in the municipality of Ezequiel Montes, Querétaro were obtained. Samples were seeded in blood agar and incubated at 37°C for 24 h under aerobiosis. Strains were identified through morphological characteristics, conventional biochemical tests and commercial API 20NE Micro-System. Capsular typing of groups A and D was performed by a multiplex PCR for amplification of genes hyaD-hyaC and dcbF, respectively. According to the values established by API WEB software, it was possible to identify 14.09% (32/227) of P. multocida strains, which showed an identification percentage of 96% and a typicality of 1 to P. multocida. By multiplex PCR, the amplification of genes hyaD-hyaC, correspondent to capsular group A in 100% (32/32) of the strains previously identified as P. multocida, was achieved. There are no similar data in Mexico on the identification and characterization of P. multocida in beef cattle. With the results obtained it is confirmed that, in a similar way with other countries of Europe and America, capsular type A of P. multocida is predominant in Mexico.
Key words: Pasteurella multocida, capsular types, biochemical characterization, molecular characterization, pharyngeal exudate, cattle, PCR.
Introducción
El complejo respiratorio bovino (CRB) está conformado por tres entidades clínicas: neumonía enzoótica de los terneros, neumonía intersticial y la pasteurelosis neumónica bovina; ésta última se describe como una enfermedad de curso agudo que afecta a los bovinos jóvenes y adultos, en la cual se involucran microorganismos de la familia Pasteurellaceae, como Pasteurella multocida, Mannheimia haemolytica e Histophilus somni y otros agentes como el virus de la rinotraqueitis infecciosa bovina (RIB), entre otros.1,2
Los principales patógenos presentes en el CRB son parte de la microbiota normal de las vías respiratorias de los bovinos de engorda. P. multocida es uno de los principales microorganismos aislados dentro del CRB, al igual que M. haemolytica. Estos microorganismos colonizan normalmente la nasofaringe de diversos animales domésticos y silvestres, cuando existen condiciones de tensión (estrés) o bien en infecciones virales.3,4
P. multocida se subdivide en cuatro subespecies, que incluye a Pasteurella multocida subs multocida, gallicida, septica y tigris. P. multocida se puede clasificar en cinco grupos capsulares: A, B, D, E y F, basándose en los diferentes polisacáridos de la cápsula. 5-7
La distribución geográfica de estos grupos es variable, los grupos B y E producen la septicemia hemorrágica, que afecta a los búfalos de agua y al ganado bovino en Asia, África y sur de Europa. Se ha demostrado que los grupos capsulares A y D afectan al ganado bovino en México. La determinación de la prevalencia contribuye a la elaboración de productos biológicos para la prevención y control de la pasteurelosis neumónica. 6,7
El diagnóstico de las enfermedades producidas por P. multocida se basa en los signos clínicos y características fisicoquímicas del agente. Estas pruebas se realizan con base en cualidades fenotípicas; sin embargo, las condiciones del cultivo pueden influir en la expresión de algunas características, como la morfología, fermentación de carbohidratos y propiedades serológicas, y con ello disminuir la sensibilidad y especificidad de los métodos basados en estas características.8
En años recientes, las técnicas de biología molecular han significado grandes beneficios para la identificación bacteriana, superando algunas limitaciones de los procedimientos convencionales. Los ensayos basados en la detección de los ácidos nucleicos permiten la detección de organismos directamente de las muestras clínicas, así se mejora la sensibilidad, la especificidad y el tiempo requerido para la identificación del microorganismo. Particularmente la PCR ha sido muy útil, pues con el uso de iniciadores específicos resulta fácil la identificación del género y los grupos capsulares.8,9
No obstante que en México se cuenta con estudios previos sobre la caracterización y prevalencia de los tipos capsulares de P. multocida en bovinos destinados a la producción de leche, aún no se han realizado estudios en bovinos destinados a la producción de carne; por tal motivo, los objetivos de este estudio fueron: identificar los diferentes tipos capsulares y estimar la frecuencia de Pasteurella multocida en exudado faríngeo de bovinos clínicamente sanos destinados a la producción de carne.
Material y métodos
Diseño del muestreo
Se consideró una prevalencia de 18% con base en estudios previos10 y se calculó el tamaño mínimo de muestra (TMM) con 95% de confianza y un error estimado de 5%.
Se aplicó la siguiente ecuación: n= z2 x p x q/ d2, en la que z= nivel de confianza al 95%= 1.96; p= probabilidad de que ocurra el evento o prevalencia; q= 1-p, probabilidad de que no ocurra el evento; d= error estimado. Con base en dicha ecuación, el TMM fue de 227 bovinos, para determinar la proporción de animales positivos a P. multocida.
Obtención y tipo de muestras de estudio
La obtención de las muestras se llevó a cabo en la planta de sacrificio tipo inspección federal (TIF) de la Distribuidora de Carne del Bajío (DICABSA), ubicada en el municipio de Ezequiel Montes, Querétaro, en bovinos provenientes del mismo municipio; dichos animales fueron muestreados después del sacrificio y antes del lavado de las cabezas. Se recolectaron muestras de exudado faríngeo mediante hisopos estériles que se colocaron en medio de transporte Stuart y se conservaron en refrigeración hasta su procesamiento, el cual se llevó a cabo en el Departamento de Medicina Preventiva y Salud Pública Veterinaria y en el Centro de Enseñanza Investigación y Extensión en Producción Animal en Altiplano, FMVZ- UNAM.
Aislamiento e identificación de P. multocida
El aislamiento e identificación de las colonias se realizó por siembra en cajas de agar sangre a partir del hisopo, se incubaron en aerobiosis durante 24 h a 37°C. Posteriormente se realizó la tinción de Gram. Se observaron las características morfológicas de las colonias y se seleccionaron aquéllas que coincidieron con las de P. multocida: redondas, grises, mucoides y sin presencia de hemólisis. Posteriormente se llevaron a cabo las pruebas de identificación de catalasa y oxidasa. Se realizó una nueva siembra con el fin de obtener cultivo puro de las cepas de P. multocida, y posteriormente se llevó a cabo la identificación bioquímica mediante un microsistema comercial.
Identificación bioquímica de P. multocida
Se realizó la identificación bioquímica de las cepas de P. multocida mediante el sistema API 20NE*. Las pruebas se efectuaron a partir de colonias incubadas durante 18 y hasta 24 h en agar sangre al 5%. La lectura de las reacciones se realizó utilizando la tabla de identificación provista por el fabricante, la identificación se hizo con un perfil numérico, y el reconocimiento, mediante el software de identificación en línea (APIWEB).
Caracterización molecular de los grupos capsulares de P. multocida
Extracción de ADN
Las cepas identificadas como P. multocida mediante el sistema API 20NE se resembraron en agar sangre al 5% y se incubaron a 37°C durante 24 h. La extracción de ADN se llevó a cabo mediante el método de choque térmico.11 Se suspendió una asada de la muestra bacteriana en 200 μl de agua destilada estéril, la cual se sometió a una temperatura de 92°C (ebullición) durante 15 minutos. Se centrifugó a 8000 g durante 15 minutos y se tomaron 5 μl del sobrenadante (ADN) para agregarlos a la mezcla de la PCR.
PCR
Para la caracterización de los tipos capsulares, los genes amplificados para el A fueron: hyaD-hyaC, que codifican para la síntesis de ácido hialurónico por medio de los iniciadores 5'-TGCCAAAATCGCAGTCAG-3' y 5'- TTGCCATCATTGTCAGTG- 3', y para el grupo capsular D, el gen amplificado fue dcbF, que codifica para la síntesis de una glicosil transferasa del operón capsular, para lo cual se emplearon los iniciadores 5'-TTACAAAAGAAAGACTAGGAGCCC-3' y 5'- CATCTACCCACTCAATATCAG-3'. La caracterización molecular se realizó por medio de una PCR múltiple tomando como base el protocolo descrito por Campuzano et al.8 La amplificación se realizó en un termociclador** bajo las siguientes condiciones: una desnaturalización inicial a 95°C por 5 minutos, seguida de una desnaturalización a 95°C por 30 segundos, elongación a 56.5°C por 30 segundos y extensión a 72°C durante 30 segundos por 30 ciclos. La extensión final a 72°C por 5 minutos. Las reacciones se mantuvieron a 4°C hasta su visualización. Se colocaron 32.5 μl de agua destilada estéril, 5 μl de amortiguador 1x PCR, 3 μl de MgCl2, 2 μl de DNTP‘S, 0.5 μl de cada uno de los iniciadores, 5 μl de ADN y 0.5 μl de Taq ADN polimerasa. La visualización de los productos amplificados se efectuó en geles de agarosa al 1%, teñidos con bromuro de etidio al 10% (10 mg/ml).
Resultados
Identificación morfológica de las cepas de P. multocida
De un total de 227 muestras procesadas, se recuperaron 77 aislados (33.92%) que correspondieron a la morfología de P. multocida (redondas, grisáceas, mucoides y sin presencia de hemólisis). Posteriormente se realizó la tinción de Gram, en donde 54 colonias (23.78%) correspondieron a cocobacilos Gramnegativos. Finalmente se utilizaron las pruebas de oxidasa y catalasa, con las que resultaron 50 aislamientos (22.02%) positivos.
Identificación bioquímica de las cepas mediante API 20NE
Los 50 aislados que resultaron positivos a los ensayos de catalasa y oxidasa fueron sometidos al microsistema API 20NE para obtener la identificación bioquímica definitiva, con los siguientes resultados: 64% (32/50) mostró 96% de identificación y tipicidad de 1 a P. multocida, y 24% (12/50) correspondió a Pasteurella spp, con una identificación y tipicidad menores a 96% y 1, respectivamente.
Tipificación molecular
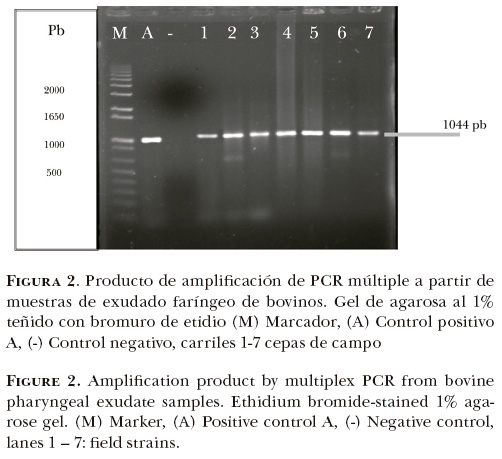
Mediante la prueba de PCR se amplificaron los genes hyaD-hyaC para el grupo capsular A, y el gen dcbF para el grupo D, cuyos productos de amplificación tuvieron un peso molecular esperado de 1044 pb para el grupo A y de 657pb para el grupo D (Figura 1). Por medio de la PCR múltiple se logró la amplificación de un producto de ~1044 pb en 100% de las cepas (n = 32), que corresponde al grupo capsular A de P. multocida (Figura 2).
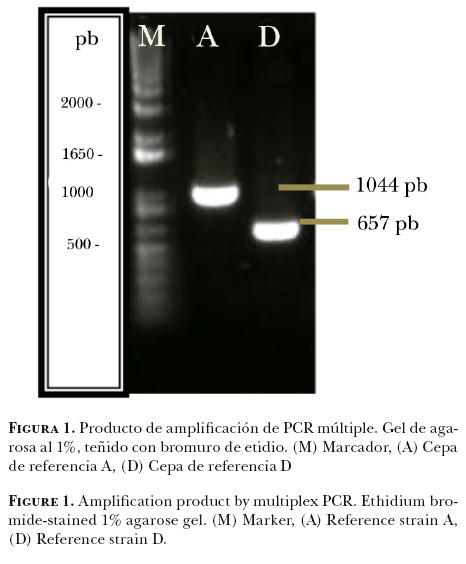
Frecuencia de P. multocida en bovinos clínicamente sanos destinados a la producción de carne.
Con base en los resultados obtenidos en la identificación bioquímica y molecular, la frecuencia estimada de P. multocida fue de 14.09% (32/227), de la cual el 100% (32/32) fue grupo A.
Discusión
El CRB ha sido reconocido como una enfermedad de gran importancia económica en el ganado. Su confirmación es difícil debido a la variedad en los signos clínicos y a que los procedimientos para su diagnóstico pueden tomar mucho tiempo. Los agentes bacterianos son los patógenos más comúnmente involucrados, actualmente no existe una prueba eficaz y sencilla para determinar la etiología de la enfermedad.1, 11,12
Las principales bacterias encontradas en los problemas respiratorios en el ganado bovino son: M. haemolytica, H. somni y P. multocida, ésta última se cita como la más comúnmente aislada en las neumonías de becerras de razas especializadas en la producción de leche,13,14 lo cual refleja, en alguna medida, la naturaleza oportunista de este microorganismo al superar el desarrollo de otras bacterias.15,16
Se han identificado los grupos capsulares A y D de P. multocida como los responsables de la pasteurelosis neumónica en México. En estudios llevados a cabo en el país con muestras pulmonares provenientes de rastros, se han logrado aislamientos de Pasteurella spp en alrededor de 50% de los casos, en los que P. multocida ha sido el principal agente patógeno identificado.17-19
El diagnóstico de P. multocida se ha basado en la presencia de signos clínicos y la presentación de características fisicoquímicas del agente. Las pruebas se realizan con base en características fenotípicas; sin embargo, las condiciones de cultivo pueden influir en la expresión de las propiedades de la bacteria y con ello disminuir la especificidad y sensibilidad de los métodos basados en estas características.
Para la identificación bioquímica de P. multocida se dispone de métodos que se basan en microsistemas comerciales o miniaturizados, los cuales facilitan y agilizan la tipificación. Entre ellos se encuentra el sistema API 20NE, el cual se ha empleado como herramienta en la identificación de enterobacterias y no enterobacterias en medicina veterinaria, con resultados muy satisfactorios en cepas de P. multocida y M. haemolytica.19 El sistema API es capaz de identificar con precisión P. multocida en menos tiempo (64% menos), en comparación con otros sistemas como Oxi/Ferm. El porcentaje de errores de identificación es de sólo 10% en los aislamientos de P. multocida.20-21
En los resultados obtenidos mediante el uso de este sistema se observó un alto porcentaje de identificación y tipicidad completa a P. multocida en 100% de los aislamientos. Al utilizar el sistema API 20NE se logró identificar 32 cepas (14.09%) como P. multocida, las cuales mostraron 96% de identificación y tipicidad de 1 a P. multocida; se observaron 12 cepas (5.28%) con porcentajes de identificación y tipicidad menores a 96% y 1, respectivamente. Los resultados obtenidos del perfil bioquímico de las cepas estudiadas en este trabajo, en cuanto al porcentaje de identificación y tipicidad con respecto a P. multocida, concuerdan con los obtenidos por Campuzano et al.,8 quienes en 97.5% de las cepas analizadas encontraron 96% de identificación y tipicidad de 1 a P. multocida, por lo cual se considera al sistema de identificación API 20NE como un método fácil de aplicar y de alta confiabilidad para el reconocimiento de este microorganismo.
Se ha observado que la detección de P. multocida se realiza en una menor cantidad de tiempo utilizando la técnica de PCR. Con la identificación de los genes implicados en la biosíntesis del polisacárido capsular, las secuencias específicas de los grupos capsulares identificadas se utilizan como iniciadores para la tipificación capsular de P. multocida22 La PCR puede realizarse a partir de una colonia bacteriana o mediante la extracción de ADN por ebullición, lo que reduce el tiempo para la tipificación, sin necesidad de la extracción del ADN bacteriano por métodos más costosos o con mayor inversión de tiempo, como en el caso de la lisis alcalina. La PCR dirigida a los genes hyaD -hyaC proporciona una detección específica de las cepas de P. multocida.11,12
Las ventajas de la PCR, en comparación con otras pruebas existentes, incluyen una mayor velocidad, sensibilidad, especificidad y simplicidad. No requiere medios de cultivo especiales ni la inoculación de animales de laboratorio y, por lo tanto, es más segura, ya que evita el manejo de bacterias vivas.11
Las frecuencias del presente trabajo (14.09%), de las cuales el 100% fue identificada como grupo capsular A, son similares a las registradas por otros autores que han reconocido al grupo A en porcentajes que van de 80% hasta 100%.22 Trabajos similares se han realizado en ovinos, becerras y ganado lechero, en los que el grupo capsular más frecuentemente encontrado es el A, con porcentajes que van desde 77 hasta 97.3%,5,13 mientras que en el grupo capsular D el intervalo es de 0.02 hasta 27%.21,23,24 Yates25 menciona que el tipo A está asociado comúnmente con la neumonía en bovinos, mientras que el grupo D sólo se encuentra esporádicamente en casos de enfermedad respiratoria.
En otros informes basados en la caracterización fenotípica de las cepas de P. multocida de origen bovino y otros rumiantes, el grupo capsular predominante es el A. Investigaciones realizadas en bovinos con muestras de pulmones neumónicos de becerras Holstein en el Estado de México,24 y en pulmones neumónicos en el Estado de México y en Durango, informaron la presencia del grupo A en un intervalo de 98.7 a 100% de las muestras estudiadas y 1.2 % para el grupo D.19,24 Blanco et al.118 indicaron la presencia del grupo A en el 100% de los aislamientos de P. multocida en pulmones con lesiones neumónicas provenientes de becerras en el Estado de México.
En el presente estudio, la totalidad de los aislamientos de P. multocida corresponden al grupo capsular A, dichos resultados demuestran que este grupo predomina en los bovinos clínicamente sanos destinados a la producción cárnica y se asemejan a los resultados obtenidos en el trabajo de Campuzano et al.,8 en el que se utilizaron muestras de exudado nasal de bovinos lecheros clínicamente sanos procedentes de la Comarca Lagunera de los estados de Coahuila y Durango, y en el estado de Hidalgo, con lo cual se corrobora que, de manera similar a otros países de Europa y América, en México el grupo capsular predominante de P. multocida es el A.
La identificación y caracterización de los grupos capsulares de P. multocida es importante en la prevención y tratamiento de la pasteurelosis neumónica en bovinos destinados a la producción de carne, así como para conocer la situación epidemiológica de este microorganismo en el municipio de Ezequiel Montes, en el estado de Querétaro. De igual forma, puede contribuir al desarrollo de inmunógenos más eficaces y como apoyo en los programas de prevención y control de dicha enfermedad.
Es menester resaltar que no existen datos publicados en México sobre la identificación y caracterización de P. multocida en bovinos destinados a la producción de carne.
Agradecimientos
Se agradece al Consejo Nacional de Ciencia y Tecnología (Conacyt) por el apoyo recibido para el proyecto CB104031; al Departamento de Medicina Preventiva y Salud Pública y al Centro de Enseñanza, Investigación y Extensión en Producción Animal en Altiplano (CEIEPAA) de la Facultad de Medicina Veterinaria y Zootecnia de la UNAM, por las facilidades otorgadas para la realización de este trabajo.
Referencias
1. COOPER VL, BRODERSEN BW. Bovine Respiratory Disease. Vet Clin North Am: Food Anim Pract 2010; 26:191-426. [ Links ]
2. LILIE LE. The Bovine Respiratory Disease Complex. The Canadian Veterinary Journal. Symposium on Immunization of Cattle Against the Common Diseases of the Respiratory Tract. Rev Vet Can 1974; 15:233-42. [ Links ]
3. JARAMILLO ACJ, TRIGO TFJ, SUÁREZ GF, Mannheimiosis Bovina: Etiología, Prevención y Control. Vet Méx 2009; 403:293-311. [ Links ]
4. BOYCE RY, WILKIE I, ADLER B. Pasteurella and Mannheimia In: GYLES CL, PRESCOTT JF. Pathogenesis of bacterial infections in animals. 3rd ed. Iowa: Blackwell Publishing 2007; 1: 273-270. [ Links ]
5. VIDHYA M, CHANDRAN DJ, MANOBAR P, DHINAKAR R. Molecular identification of serogroups of Pasteurella multocida isolated from sheep by capsular PCR typing. J Vet Anim Sci 2007;3:140-143. [ Links ]
6. CUETO LM, PASCUAL HA. Pasteurella multocida. Departamento de microbiología. Hospital universitario Virgen Macarena. Sevilla. [En línea: 2013 enero] [Citado: 2013 enero 20]. Disponible en: http://www.seimc.org/control/revisiones/bacteriologia/pmultocida.pdf [ Links ]
7. BOYCE JD. JING YC. ADLER B. Pasteurella multocida capsule: composition, function and genetics. J Biotechnol 2000; 83:153-160. [ Links ]
8. CAMPUZANOOVM,GONZÁLEZRAD,HERNÁNDEZ CR, SUÁREZ GF, TRIGO TFJ, JARAMILLO ACJ. Caracterización fenotípica y molecular de cepas de Pasteurella multocida de exudado nasal en bovinos, en dos cuencas lecheras de México. Vet Méx 2011; 1:1-10. [ Links ]
9. BOYCEJD, CHENGJ Y, ADLER B. Genetic organization of the capsule biosynthetic locus of Pasteurella multocida M104 (B:2). Vet Microbiol 2000; 72:121-34. [ Links ]
10. JARAMILLO ACJ, HERNÁNDEZ CR, SUÁREZ GFS, MARTÍNEZ MJ, AGUILAR RF, JARAMILLO ML et al. Characterization of Mannheimia spp.strains isolated from bovine nasal exudate and factors associated with isolates, in dairy farms in the Central Valley of Mexico. Res Vet Sci 2008; 84: 7-13. [ Links ]
11. SZABO I, UDA H, SAKAMOTO H. Rapid techniques for DNA extraction from routinely processed archival tissue for use in PCR. Clin Pathol 1994; 47:318-323. [ Links ]
12. RAJEEV G, KUMAR A, SINGH VP, VIJENDRA P. SINGH,T.K. DUTTA, SB. Specific identification of Pasteurella multocida serogroup-A isolates by PCR assay. Division of Bacteriology and Mycology, Indian Veterinary Research Institute, Veterinary science 2004; 76:179-185. [ Links ]
13. DE ROSA DC, MECHOR GD, STAATSJJ, CHENGAPPA MM. Comparison of Pasteurella spp simultaneously Isolated from Nasal and Transtracheal Swabs from Cattle with Clinical Signs of Bovine Respiratory Disease. Elanco Animal Health, Greenfield, Indiana 46140,1 and Kansas State University. J Clin Microbiol 2000; 38:327-332. [ Links ]
14. GOURLAY RN, THOMAS LH, WYLD SG. Experimental Pasteurella multocida pneumonia in calves. Res Vet Sci 1989; 47:185-189. [ Links ]
15. VIRTALA AMK, MECHOR GD, GROHN YT, ERB HN, DUBOVI EJ. Epidemiologic and pathologic characteristics of respiratory tract disease in dairy heifers during the first three months of life. J Am Vet Med Assoc 1996; 208:2035-2042. [ Links ]
16. AMES TR. Dairy calf pneumonia. Vet Clin North AmFood Anim Pract 1997; 13:379-391. [ Links ]
17. TRIGO TF, HERNÁNDEZ LG, RAMÍREZ CC, BERRUECOS VM. Patología y bacteriología de pulmones neumónicos de becerros. Vet Méx 1982; 13:131-140. [ Links ]
18. BLANCO-VIERA FJ, TRIGO FJ, JARAMILLO ML, AGUILAR RF. Serotypes of Pasteurella multocida and Pasteurella haemolytica isolated from pneumonic lesions in cattle and sheep from Mexico. Rev Lat-Amer Microbiol 1995; 37:121-126. [ Links ]
19. JARAMILLO ACJ, HERNANDEZ CR, CAMPUZANO OV, SUÁREZ GR, DELGADO GR, TRIGO TF. Characterization of Mannheimia sp and P.multocida strains isolated from bovine pneumonic lungs in two slaughterhouses in Mexico. J Anim Vet Adv 2007; 12:1384-1403. [ Links ]
20. DABO SM, DEBEY BM, MONTELONGO M, CONFER W. Genomic DNA restriction site heterogeneity in bovine Pasteurella multocida serogroup A isolates detected wth rRNA probe. J. Med Microbiol 1999; 48: 279-286. [ Links ]
21. COLLINS MT, WEAVER N, ELLIS RP. Identification of Pasteurella multocida and Pasteurella haemolytica by API 2ONE, Minitek and Oxy/ferm Systems. J Clin Microb 1981; 13:433-437. [ Links ]
22. TOWNSEND KM, BOYCE JD, YENG CJ, FROST AJ, ADLER B. Genetic organization of Pasteurella multocida cap loci and development of a multiplex capsular PCR Typing System. J Clin Microbiol 2001; 39:924-929. [ Links ]
23. DE LA ROSA RJL, JARAMILLO ACJ, MARTÍNEZ MJJ, AGILAR RF, HERNÁNDEZ CR, SUÁREZ GF et al. Frecuencia de aislamientos de Mannheimia haemolytica y Pasteurella multocida en becerras con signos clínicos de enfermedad respiratoria, en un complejo lechero del estado de Hidalgo, México. Vet Méx 12; 43:1-10. [ Links ]
24. JARAMILLO CL, AGUILAR RF, TRIGO TF. Serotipificación de Pasteurella haemolytica y determinación de los tipos capsulares de Pasteurella multocida aisladas de pulmones neumónicos de becerros en México. Vet Méx 1987; 18:185-188. [ Links ]
25. YATES WDG. A review of infectious bovine rhynotracheitis, shipping fever pneumonia and viralbacterial synergism in respiratory disease of cattle. Can J Comp Med 1982; 46:225-263. [ Links ]
Este trabajo es parte de la tesis de licenciatura en Medicina Veterinaria y Zootecnia del primer autor.
* BioMérieux sa F-69280 Marcy l'Etoile, Francia.
** MAXYGENE 198 Cambridge Street, Wembley WA 6014, Australia.














