Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Veterinaria México
versión impresa ISSN 0301-5092
Vet. Méx vol.44 no.1 Ciudad de México ene./mar. 2013
Notas de investigación
Aislamiento e identificación de Avibacterium paragallinarum NAD independiente (serovariedad C-1) en gallinas de reemplazo con coriza infecciosa
Isolation and identification of NAD-independent Avibacterium paragallinarum (serovar C-1) from growing layer hens with infectious coryza
Edgardo Soriano-Vargas* Josué Sánchez-Morales** Vladimir Morales-Erasto** Alejandra García-Sánchez*
* Centro de Investigación y Estudios Avanzados en Salud Animal, Facultad de Medicina Veterinaria y Zootecnia, Universidad Autónoma del Estado de México, Carretera Panamericana Toluca-Atlacomulco, Km 15.5, Toluca, 50200, Estado de México, México.
** Boehringer Ingelheim Vetmedica, S.A. de C.V., Calle 30, núm. 2614, Guadalajara, 44940, Jalisco, México.
Responsable de correspondencia:
Edgardo Soriano-Vargas,
Tel./fax: (722) 2965555,
correo electrónico: soriano@uaemex.mx
Recibido el 26 de marzo de 2012.
Aceptado el 17 de septiembre de 2012.
Abstract
The isolation of V-factor (NAD)-independent, serovar C-1 of Avibacterium paragallinarum from growing layer hens with infectious coryza, is reported for the first time. Av. paragallinarum serovar C-1 isolates were PCR confirmed and shared a unique genetic profile. Isolation of Av. paragallinarum NAD-independent biovar, serotyping and genotyping of isolates at the avian diagnostic laboratories are discussed.
Key words: Avibacterium paragallinarum, serovar C-1, V-factor, Mexico.
Resumen
Se informa por primera ocasión el aislamiento de Avibacterium paragallinarum, serovariedad C-1, independiente del factor V de crecimiento (NAD), a partir de gallinas de reemplazo con coriza infecciosa. Los aislamientos de Av. paragallinarum serovariedad C-1 incluidos en el estudio fueron confirmados por PCR y compartieron un perfil genético único. Se discute considerar en los laboratorios de diagnóstico aviar el aislamiento de Av. paragallinarum de la biovariedad independiente de NAD, así como la necesidad de serotipificación y tipificación genética de los aislamientos.
Palabras clave: Avibacterium paragallinarum, serovariedad C-1, factor V, México.
Introducción
La bacteria Avibacterium paragallinarum es el agente causal de la coriza infecciosa, una enfermedad del tracto respiratorio superior de pollos y gallinas. La enfermedad se caracteriza por estornudo, descarga nasal e inflamación de senos infraorbitarios. El impacto económico de la coriza infecciosa se refleja en la reducción en la producción de huevo, incremento del número de aves desechadas y retraso del crecimiento.1
La mayoría de los aislamientos de Av. paragallinarum aglutinan eritrocitos de pollo y los antígenos son conocidos como hemoaglutininas. Empleando la prueba de inhibición de la hemoaglutinación, actualmente se reconocen tres serogrupos con nueve serovariedades distribuidas de la siguiente manera: A-1, A-2, A-3, A-4; B-1; C-1, C-2, C-3 y C-4.1 Algunas serovariedades tienen una distribución amplia en el mundo, mientras que otras se encuentran limitadas a ciertas áreas geográficas. Por ejemplo, la serovariedad A-3 se ha identificado en aislamientos de Brasil y Ecuador,2 y las serovariedades A-4 y C-4 se han identificado únicamente en aislamientos de Australia.3 La serovariedad C-1 se había identificado únicamente en aislamientos de Japón.4 Sin embargo, estudios recientes de serotipificación de Av. paragallinarum revelaron la existencia de la serovariedad C-1 en aislamientos de Ecuador2 y México.5 A la fecha, en México se han identificado las serovariedades A-1, A-2, B-1, C-1 y C-2,5,6 siendo el país con mayor número de serovariedades de hemoaglutinina de esta bacteria.
En muchas especies bacterianas la síntesis de dinucleótido de adenina nicotinamida (NAD, por sus siglas en inglés, nicotinamide adenine dinucleotide; factor V) ocurre inicialmente a partir del ácido quinolínico o por la vía del ácido nicotínico.7 Algunos miembros de la familia Pasteurellaceae, familia bacteriana a la cual pertenece Av. paragallinarum, no tienen estas vías de biosíntesis de NAD y deben obtenerlo directamente del medio o a partir de precursores. Para el cultivo de Av. paragallinarum, los medios son complementados con NAD o se emplea una colonia nodriza de Staphylococcus epidermidis como precursor.1 Sin embargo, desde 1989 se han identificado aislamientos de Av. paragallinarum independientes de NAD8 y con base en el requerimiento de este factor de crecimiento, actualmente se reconocen dos biovariedades diferentes en esta bacteria: 1) dependientes de NAD y 2) independientes de NAD.1 A la fecha, se han identificado aislamientos de la biovariedad independiente de NAD únicamente en Sudáfrica8,9 y México.10 Con respecto a las serovariedades de estos aislamientos, se han identificado A-1 y C-3 en los aislamientos NAD independientes de Sudáfrica,11 mientras que en los aislamientos de México se han identificado las serovariedades B-1 y C-2.10
En este trabajo se informa el aislamiento, identificación y características genotípicas de Av. paragallinarum independiente de NAD, serovariedad C-1, obtenido de gallinas de reemplazo con coriza infecciosa.
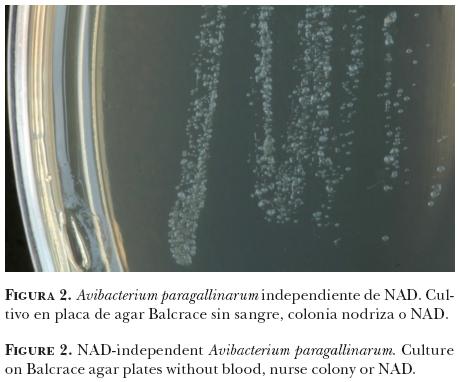
En agosto de 2011, en una granja localizada en Los Altos, Jalisco, México, se presentó un brote de coriza infecciosa en una caseta de 12,500 gallinas de postura de 12 semanas de edad. Dicha caseta era de ambiente natural bajo el sistema de producción convencional en la zona. Se registró hasta 20% de morbilidad e incremento de la mortalidad (0.1%) en el lapso de una semana. Los signos clínicos incluyeron estornudo, tos, lagrimeo, perioftalmitis e inflamación de senos infraorbitarios. Un total de 10 cabezas de gallina con senos infraorbitarios inflamados fueron remitidas al Centro de Investigación y Estudios Avanzados en Salud Animal para diagnóstico bacteriológico. El calendario de inmunización implementado en la granja incluía una bacterina contra la coriza infecciosa administrada a las 5 semanas de edad, así como vacunas contra la enfermedad de Gumboro, enfermedad de Newcastle y bronquitis infecciosa. Los estudios serológicos fueron negativos para Mycoplasma spp e influenza aviar. En el estudio bacteriológico se sembraron muestras de senos infraorbitarios en placas de base de agar con 10% de sangre de ovino con S. epidermidis como colonia nodriza, cultivadas a 37ºC en un frasco con vela durante toda la noche. Se obtuvo crecimiento bacteriano de todas las muestras y se observaron dos tipos de colonias: 1) colonias típicas de Av. paragallinarum, pequeñas, translúcidas, en forma de gotas de rocío, satelitales a la colonia nodriza; y 2) colonias grisáceas, de hasta 2 mm de diámetro y relativamente alejadas de la colonia nodriza (Figuras 1a y 1b, respectivamente). La tinción de Gram reveló bacilos negativos, cocobacilares y filamentosos en los dos tipos de colonias. Ambos tipos de colonias fueron oxidasa positivo y catalasa negativo. Una colonia grande alejada de la nodriza se cultivó, toda la noche, a 37ºC en un medio sin sangre, sin colonia nodriza y sin NAD. Las colonias se observaron grisáceas, pequeñas y coalescentes (Figura 2). Los dos tipos de cultivos fueron confirmados por medio de un PCR específico de Av. paragallinarum de acuerdo con lo descrito previamente (Figura 3).12 Brevemente, se emplearon los iniciadores N1 (5'-TGAGGGTAGTCTTGCACGCGAAT-3') y R1 (CAAGGTATCGATCGTCTCTCTACT-3'). La reacción (50 µl) incluyó 0.4 µM de cada iniciador, 45 µl de AccuPrime Supermix I (1.25 U Taq ADN polimerasa*; y 2 µl de muestra de ADN. El protocolo de PCR inició con 30 segundos de desnaturalización a 98ºC, seguido de 25 ciclos de desnaturalización (1 minuto a 94ºC), alineación (1 minuto a 72ºC) y extensión (2 minutos a 94ºC) con una extensión final a 72ºC por 10 minutos. Asimismo, se produjeron antígenos hemoaglutinantes para serotipificación de acuerdo con lo señalado previamente.5,6 Ambos aislamientos fueron identificados en el serogrupo C, serovariedad C-1 de Av. paragallinarum. Asimismo, se determinó el perfil genético de los cultivos mediante los protocolos REP-PCR13 y ERIC-PCR14 de acuerdo con lo descrito. Brevemente, para el protocolo REP-PCR se emplearon los iniciadores REP 1R (5'-NNNNCGNCGNCATCNGGC-3') y REP 2 (5'-NCGNCTTATCNGGCCTAC-3'). La reacción (25 µl) incluyó 5 µl de solución amortiguadora 10X, 1.5 mM de MgCl2, 0.2 mM de cada dinucleótido trifosfatado, 0.5 U Taq ADN polimerasa* y 2 µl de muestra de ADN. El protocolo de PCR inició con 5 minutos de desnaturalización a 94ºC, seguido de 30 ciclos de desnaturalización (1 minuto a 94ºC), alineación (1 minuto a 45ºC) y extensión (3 minutos a 72ºC) con una extensión final a 72ºC por 10 minutos. Para el protocolo ERIC-PCR se emplearon los iniciadores ERIC-1R (5'-ATGTAAGCTCCTGGGGATTCAC-3') y ERIC-2 (5'-AAGTAAGTGACTGGGGTGAGCG-3'). La reacción (50 µl) incluyó 10 mM de TrisHCl (pH 8.4), 50 mM de KCl, 3 mM de MgCl2, 0.2 mM de cada dinucleótido trifosfatado, 0.5 U Taq DNA polimerasa* y 4 µl de muestra de ADN. El protocolo de PCR inició con 5 minutos de desnaturalización a 94ºC, seguido de 35 ciclos de desnaturalización (1 minuto a 94ºC), alineación (1 minuto a 52ºC) y extensión (6 minutos a 74ºC) con una extensión final a 72ºC por 6 minutos. Dos aislamientos dependientes de NAD y un aislamiento independiente de NAD obtenidos de las muestras incluidas en este estudio, así como dos aislamientos dependientes de NAD, serovariedad C-1, previamente tipificados (ESV-129 y ESV-135),5 compartieron un perfil genético único (Figura 4).


Los resultados del presente trabajo confirman la presencia de la serovariedad C-1 de Av. paragallinarum en brotes de coriza infecciosa en México. Asimismo, este trabajo parece ser el primer informe del aislamiento e identificación de Av. paragallinarum independiente de NAD de la serovariedad C-1. Como en otros miembros de la familia Pasteurellaceae, en el caso de los aislamientos de Sudáfrica, la independencia de NAD estuvo asociada con un plásmido.15 Se desconoce si los aislamientos NAD independientes de México contienen plásmidos. El perfil genético obtenido sugiere una relación clonal entre el aislamiento independiente de NAD y las cepas típicas de Av. paragallinarum de la serovariedad C-1 identificadas en México. Es muy posible que el aislamiento NAD independiente haya adquirido el plásmido asociado con la independencia y que éste no incluya secuencias ERIC. Con base en estudios de patogenicidad de aislamientos de Sudáfrica,11 se considera que las variedades independientes de NAD son menos virulentas que las variedades típicas dependientes de NAD. Se desconocen las propiedades patogénicas e inmunogénicas de esta variedad independiente de NAD, serovariedad C-1 de Av. paragallinarum identificada, que podrían explicar la presencia de esta variedad en aves inmunizadas y con coriza infecciosa.
En conclusión, en los laboratorios de diagnóstico aviar es necesario considerar las biovariedades NAD independientes de Av. paragallinarum en casos de coriza infecciosa. Es necesario conocer la serovariedad de hemoaglutinina de los aislamientos, tanto dependientes como independientes de NAD, implicados en los brotes de coriza infecciosa. Asimismo, la tipificación genética de estos aislamientos contribuye a la epidemiología de los brotes de coriza infecciosa.
Agradecimientos
Se agradece al Dr. Francisco Robles-González y al Dr. Jesús Cabriales-Jiménez por su asistencia técnica en el desarrollo de este trabajo, al Dr. Pat Blackall de la University of Queensland, Australia, por la donación de las cepas de referencia de Avibacterium paragallinarum, y a la Universidad Autónoma del Estado de México, proyecto UAEM 3102/2011, por el financiamiento para la realización de este trabajo de investigación.
Referencias
1. BLACKALL PJ, SORIANO EV. Infectious coryza and related bacterial infections. In: SAIF YM, FADLY AM, GLISSON JR, MCDOUGALD LR, NOLAN LK, SWAYNE DE, editors. Diseases of Poultry. 12th ed. Ames:Blackwell Publishing, 2008:789-803. [ Links ]
2. CABRERA A, MORALES-ERASTO V, SALGADO-MIRANDA C, BLACKALL PJ, SORIANO-VARGAS E. Hemagglutinin serotyping of Avibacterium paraga-llinarum isolates from Ecuador. Trop Anim Health Prod 2011; 43:549-551. [ Links ]
3. BLACKALL PJ, EAVES LE, ROGERS DG. Proposal of a new serovar and altered nomenclature for Haemophilusparagallinarum in the Kume hemagglutinin scheme. J Clin Microbiol 1990; 28:1185-1187. [ Links ]
4. KUME K, SAWATA A, NAKAI T, MATSUMOTO M. Serological classification of Haemophilus paragallinarum with a hemagglutinin system. J Clin MIcrobiol 1983; 17:958-964. [ Links ]
5. MORALES-ERASTO V, GARCIA-SANCHEZ A, SALGADO-MIRANDA C, TALAVERA-ROJAS M, ROBLES-GONZALEZ F, BLACKALL PJ et al. ERIC-PCR genotyping of emergent serovar C-1 isolates of Avibacterium paragallinarum from Mexico. Avian Dis 2011; 55:686-688. [ Links ]
6. SORIANO VE, BLACKALL PJ, DABO SM, TELLEZ G, GARCIA-DELGADO GA, FERNANDEZ RP. Serotyping of Haemophilus paragallinarum isolates from Mexico by the Kume hemagglutinin scheme. Avian Dis 2001; 45:680-683. [ Links ]
7. FOSTER JW, MOAT AG. Nicotinamide adenine dinucleotide biosynthesis and pyridine nucleotide cycle metabolism in microbial systems. Microbiol Rev 1980; 44:83-105. [ Links ]
8. HORNER RF, BISHOP GC, HAW C. An upper respiratory disease of commercial chickens resembling infectious coryza, but caused by a V factor-independent bacterium. Avian Pathol 1992; 21:421-427. [ Links ]
9. MOUAHID M, BISGAARD M, MORLEY AJ, MUTTERS R, MANNHEIM W. Ocurrence of V-factor (NAD) independent strains of Haemophilus paragallinarum. Vet Microbiol 1992; 31:363-368. [ Links ]
10. GARCIA AJ, ANGULO E, BLACKALL PJ, ORTIZ AM. The presence of nicotinamide adenine dinucleotide-independent Haemophilus paragallinarum in Mexico. Avian Dis 2004; 48:425-429. [ Links ]
11. BRAGG RR. Virulence of South African isolates of Haemophilus paragallinarum. Part 2: Naturally occurring NAD-independent field isolates. Onderstepoort J Vet Res 2002; 69:171-175. [ Links ]
12. CHEN X, MIFLIN JK, ZHANG P, BLACKALL PJ. Development and application of DNA probes and PCR tests for Haemophilus paragallinarum. Avian Dis 1996; 40:398-407. [ Links ]
13. SAXENA MK, SINGH VP, KUMAR AA, CHAUDHURI P, SINGH VP, SHIVACHANDRA SB et al. REP-PCR analysis of Pasteurella multocida isolates from wild and domestic animals in India. Vet Res Commun 2006; 30:851-861. [ Links ]
14. SORIANO VE, TELLEZ G, HARGIS BM, NEWBERRY L, SALGADO-MIRANDA C, VAZQUEZ JC. Typing of Haemophilus paragallinarum strains by using enterobacterial repetitive intergenic consensus-based polymerase chain reaction. Avian Dis 2004; 48:890-895. [ Links ]
15. BRAGG RR, COETZEE L, VERSCHOOR JA. Plasmid-encoded NAD independence in some South African isolates of Haemophilus paragallinarum. Onderstepoort J Vet Res 1993; 60:147-152. [ Links ]
* Invitrogen, Carlsbad, CA, Estados Unidos de América.














