Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Veterinaria México
versión impresa ISSN 0301-5092
Vet. Méx vol.43 no.3 Ciudad de México jul./sep. 2012
Artículos científicos
Niveles sanguíneos de cortisol y receptores a glucocorticoides en hígado y placenta de cabras en diferentes etapas de la gestación
Blood levels of cortisol and glucocorticoid receptors in liver and placenta of goats at different stages of gestation
Gabriela López* Verónica Lona Díaz* Brenda Anguiano Serrano* Maricela Luna Muñoz** Tomás Morato Cartagena* Carlos Manuel Romero Ramírez*
* Departamento de Biología de la Reproducción, Universidad Autónoma Metropolitana-Iztapalapa, Av. San Rafael Atlixco 186, Iztapalapa, 09340, México, DF.
** Instituto de Neurobiología, Campus Juriquilla, Universidad Nacional Autónoma de México, Blvd. Juriquilla 3001, Juriquilla, 76230, Querétaro, México.
Responsable de correspondencia:
Carlos M. Romero Ramírez, teléfono: (55) 5804 4708, fax: (55) 5804 4930, correo electrónico: crr@xanum.uam.mx
Recibido el 29 de julio de 2011
Aceptado el 23 de abril de 2012.
Abstract
In order to analyze the temporal relationship between cortisol levels and glucocorticoid receptors (GR) in placenta and the possible influence in noninfectious abortion in goats, changes in GR in livers of the foetuses and mothers livers and in placenta together with foetal and maternal cortisol levels under stress conditions in non-pregnant (n = 5) and pregnant goats (n = 24) were recorded. The pregnant goats were five on days 40-50 of gestation (40-50 d), six on days 51-75, four on days 76-100, three on days 101-125, and six in more than 125 days of gestation. GR values in the placenta and maternal serum cortisol levels, measured by competitive binding methods, decreased from 10.4 ± 2.7 and 174.3 ± 59.1, in the group 40-50 d to 6.1 ± 2.3 fmol/mg of protein and 79.1 ± 66.1 nmol/l in the 76-100 d group, respectively. Values then increased, reaching the highest values (P ≤ 0.05) detected in this study (18.3 ± 2.7 and 659.6 ± 76.3) in the 101-125 d group followed by a decrease of 11.6 ± 2.1 fmol/mg protein and 231.6 ± 54.0 nmol/l in the +125 d group. Progesterone was bound competitively to placental GR. However, its binding values decreased in the 101-125 d group. Reciprocal profiles were found in maternal and fetal liver GR. These data suggest that goats have innate mechanisms for abortion that occurs in case of life-threatening conditions saving mother's life and giving opportunity for new pregnancies, allowing thus the survival of this species.
Key words: Glucocorticoid receptors, cortisol, stress, abortion phisiology, placenta, goats.
Resumen
Para analizar la relación temporal entre los niveles de cortisol y los receptores a glucocorticoides (GR) en la placenta y su posible influencia en el aborto no infeccioso de las cabras, se registraron los cambios en el cortisol sanguíneo y en los GR del hígado de cabras adultas no gestantes (n = 5) y, además de los anteriores, en el hígado fetal y la placenta junto con los niveles de cortisol fetal de cabras gestantes (n = 24) bajo condiciones de estrés. Las cabras gestantes fueron: cinco de 40 a 50 días de gestación, seis de 51 a 75, cuatro de 76 a 100, tres de 101 a 125 y seis con más de 125 días de gestación. Los valores de GR en la placenta y los niveles de cortisol materno medidos por unión competitiva, decrecieron desde 10.4 ± 2.7 y 174.3 ± 59.1 en el grupo 40-50 d a 6.1 ± 2.3 fmol/mg proteína y 79.1 ± 66.1 nmol/l en el grupo 76-100 d, respectivamente. Ambos valores se incrementaron en el grupo 101-125 d, hasta alcanzar los más altos (P ≤ 0.05) detectados en este estudio (18.3 ± 2.7 y 659.6 ± 76.3) seguidos por una disminución a 11.6 ± 2.1 fmol/mg proteína y 231.6 ± 54.0 nmol/l en el grupo +125 d. Además, la progesterona se unió competitivamente a los GR placentarios; sin embargo, su unión disminuyó en el grupo 101-125 d. Los GR de los hígados materno y fetal presentaron un perfil inverso. Estos resultados permiten sugerir que las cabras cuando se encuentran en situaciones que amenazan su vida y la del feto tienen mecanismos innatos para abortar, salvando la vida de la madre y dando la oportunidad de una nueva gestación que permita la sobrevivencia de la especie.
Palabras clave: Receptores a glucocorticoides, cortisol, estrés, fisiología del aborto, placenta, cabras.
Introducción
La cabra es una especie propensa al aborto, y aunque muchas enfermedades infecciosas son responsables de una alta proporción de ello, hay otros factores que inducen los abortos en las cabras.1,2 Van Rensburg3 describió la asociación del aborto habitual en las cabras de Angora con hipercortisolismo, y Wentzel et al.4 encontraron glándulas adrenales hiperplásicas en este tipo de cabras. El aborto en la cabra también ha sido inducido por la administración de 17β-estradiol a la madre,5 o de glucocorticoides al feto.6 También se ha informado de una asociación entre el incremento de cortisol materno y aborto en cabras entre los días 102 a 134 de gestación.7
Está bien establecido que la elevación del cortisol fetal es la señal que induce el trabajo de parto en la cabra8 y en otras especies de mamíferos.9-11 Flint et al.12 demostraron que la infusión de dexametasona en fetos de cabra induce el parto por la conversión de la progesterona a 17α-hidroxiprogesterona y a estrógenos por activación inicial de la 17α-hidroxilasa placentaria. France et al.13 indujeron el parto prematuro en ovejas mediante la infusión de dexametasona aplicada al feto, con lo cual, se observó un incremento en la actividad de las enzimas placentarias 17α-hidroxilasa y aromatasa. También demostraron el incremento concomitante en el citocromo P45017α y en el ARNm para la 17α-hidroxilasa en preparaciones de microsomas de placenta ovina.
Los receptores a glucocorticoides (GR) son los mediadores entre los glucocorticoides y sus órganos blancos, y se ha determinado que su número, afinidad y disponibilidad del ligando, están relacionados con la capacidad de respuesta del órgano blanco.14 Los cambios en los GR durante la gestación han sido documentados en la placenta ovina; éstos son detectados alrededor del día 50 de gestación, se incrementan alrededor de la mitad de la gestación (90-129 días) y disminuyen hacia el final (135-147 días).15 Con métodos inmunohistoquímicos se ha demostrado que los GR se elevan en los placentomas bovinos cuando el parto es inducido con cloprostenol.16-18 Por estos mismos métodos también se demostró el incremento de los GR en la placenta de ovejas cuando se indujo el parto por administración de cortisol al feto.19
Aunque es bien conocido que el transporte de cabras gestantes bajo ayuno prolongado incrementa los niveles de cortisol sanguíneo en la madre y las crías,20,21 no existen estudios que relacionen los altos niveles de cortisol detectados en la madre y la expresión de los GR en estas condiciones. Con este propósito, se estudió el efecto del transporte de los niveles de cortisol y GR en la madre y en el feto, en diferentes estadios de la gestación bajo ayuno, así como sobre hormonas propias de la gestación: progesterona, 17α-hidroxiprogesterona y 17β-estradiol en el suero materno.
Material y métodos
Animales y muestras
Las cabras adultas fueron recolectadas por introductores de ganado, estuvieron sujetas a ayuno por lo menos 36 horas, además del estrés de transporte asociado con el sacrificio. Para obtener las muestras y otros datos, los animales fueron sacrificados conforme a la NOM-033-200-1995,22 a las 12 horas en todos los casos.
Se estudiaron 29 cabras mestizas seleccionadas al azar. El tiempo de gestación se estimó con base en la edad fetal, la cual fue determinada por el peso corporal, la longitud de la coronilla a la cadera y otros parámetros morfológicos.23 De las 29 cabras, 5 fueron no gestantes (npg); de las 24 gestantes, con base en el tiempo de gestación, se integraron los siguientes grupos: de 40 a 50 días de gestación (40-50 d; n = 5), de 51 a 75 días de gestación (51-75 d; n = 6), de 76 a 100 días de gestación (76-100 d; n = 4), de 101 a 125 días de gestación (101-125 d; n = 3) y de 126 o más días de gestación (+126 d; n = 6).
Las muestras de sangre se obtuvieron de la vena yugular de las cabras y del cordón umbilical de los fetos, se centrifugaron a 1000 g por 15 minutos y el suero obtenido se congeló a -20°C hasta su ensayo. Las muestras de hígado materno y fetal y los cotiledones placentarios se recolectaron inmediatamente después del sacrificio, se lavaron con solución de NaCl 0.9% fría, seguida de una solución de sacarosa 0.3 M, se transportaron a -196°C en nitrógeno líquido y se mantuvieron en el laboratorio a -70°C hasta su análisis.
Proteína en la fracción citosólica y preparación de las muestras
Los tejidos congelados fueron pulverizados mientras se mantenían en nitrógeno líquido, y los procesos subsecuentes se realizaron a 4°C. Los tejidos pulverizados se homogeneizaron en tres volúmenes (P/V) de solución amortiguadora de Tris-HCl pH 7.4 (10 mM tris HCl, 1.5 mM EDTA, 2mM ditiotreitol, 0.1 M molibdato de sodio y 10% de glicerol), y se centrifugaron a 1000 g durante 10 minutos, y el sobrenadante fue centrifugado nuevamente a 105,000 g por una hora.24 El sobrenadante final se utilizó para los ensayos y para la medición de la proteína total por el método de Bradford.25
Medición de la capacidad de unióndel receptor a glucocorticoides
Las incubaciones se realizaron por triplicado utilizando 2 mg de proteína citosólica en 0.6 ml de solución amortiguadora de Tris-HCl pH 7.4, agregando 0.4 pmol de 3H-dexametasona (46 000 dpm de 6,7-3H-dexametasona, actividad específica (AE) 47.0 Ci/mmol) y después de mezcladas se incubaron a 4°C durante 18 h. La unión inespecífica a los GR se determinó por incubación de 3H-dexametasona, proteína citosólica y un exceso de dexametasona no radiactiva (96 pmol por tubo). Para calcular la unión inespecífica del sistema de incubación se utilizaron tubos incubados sin proteína citosólica. La radiactividad libre y unida se separó por adición de 0.2 ml carbón-dextran (0.75-0.075%) en solución amortiguadora de Tris-HCl pH 7.4, se mezcló y se dejó reposar una hora a 4°C y se centrifugó a 1200 g durante 15 min. Los sobrenadantes se transfirieron a viales de vidrio, agregados con 5 ml de líquido de centelleo, mezclados vigorosamente; el contenido radiactivo se midió por espectrometría de centelleo líquido. La unión específica a los GR se calculó después de la corrección para la unión inespecífica y se expresó como fmol/mg de proteína.
Desplazamiento de la unión receptor-3H-dexametasona por la progesterona en placenta
Se utilizaron tres series de tubos, en la primer serie se calculó la unión total de 3H-dexametasona, en la segunda, la unión inespecífica, y con la tercera, la unión a 3H-dexametasona en presencia de progesterona. A las tres series de tubos se agregaron 2.0 mg de proteína total citosólica y 3H-dexametasona (0.4pmol, 50 000 dpm); a la segunda serie se agregaron, además, 96 pmol de dexametasona; y, a la tercera serie, progesterona (96,000 fmol). El ensayo se incubó a 4°C durante 18 horas y después de la incubación se agregaron 0.2 ml de carbón-dextran (0.75-0.075%) para eliminar los esteroides no unidos, los tubos se dejaron reposar una hora a 4ºC, y se centrifugaron a 1200 g. El sobrenadante se decantó en viales de conteo, a los que se les agregó 5 ml de líquido de centelleo y fueron mezclados vigorosamente y medidos por espectrometría de centelleo líquido. Después de corregir la unión inespecífica, la unión competitiva de progesterona se calculó comparándola con la unión total y se expresó como porcentaje (%).
Determinaciones hormonales
El cortisol se midió en 0.5 ml de suero que fue sometido a extracción con cloruro de metileno (1:10), la fracción hidrosoluble se eliminó y el solvente se evaporó a sequedad. El residuo de la fracción liposoluble se llevó a suspensión en 2 ml de amortiguador de fosfatos (0.01 M pH 8.0). De la suspensión se realizaron las mediciones por triplicado con 0.5 ml mediante un ensayo de competencia por unión a proteínas usando 3H-cortisol (1,2,6,7-3H-hidrocortisona, AE 70.0/Ci mmol), suero ovino (libre de cortisol) y cortisol para la curva estándar. Los valores se calcularon después de las correcciones para unión inespecífica y pérdidas durante el proceso, y se expresaron como nmol/l.26 Los coeficientes de variación intra e inter-ensayo fueron 3 y 14%, respectivamente.
La progesterona, la 17α-hidroxiprogesterona y el 17β-estradiol fueron determinados de fracciones de 0.5 ml de suero extraído con éter etílico (1:10), el extracto fue evaporado a sequedad, y el residuo llevado a suspensión en 2.0 ml de amortiguador de fosfatos. Fracciones de 0.5 ml de la suspensión fueron ensayadas por triplicado mediante radioinmunoanálisis, usando anticuerpos específicos obtenidos en conejos,27 esteroides marcados (1,2,6,7-3H-progesterona, AE 101.7 Ci/mmol; 1,2,6,7-3H-17α-hidroxiprogesterona, AE 67.0 Ci/mmol; y 1,2,6,7,16,17-3H-17β-estradiol, AE 136.0 Ci/mmol), y esteroides purificados como estándares en concentración conocida. La radiactividad se cuantificó por conteo de centelleo líquido. Los valores fueron corregidos para blancos inespecíficos y pérdidas experimentales, y expresados como mmol/l. Los coeficientes de variación intra e inter-ensayo fueron 8 y 14% para progesterona, 9 y 12% para 17α-hidroxiprogesterona y 5 y 10% para 17β-estradiol, respectivamente.
Análisis estadístico
Los resultados se presentan como la media ± el error estándar. Las diferencias estadísticas se determinaron por ANDEVA de una vía y la prueba de diferencias mínimas significativas de Fisher.28 Las diferencias con una P ≤ 0.05 se consideraron significativas.
Resultados
Los cambios en los niveles de cortisol en el suero materno, así como en los sitios de unión de los GR en la placenta (GRp) y en el hígado (GRh) materno se resumen en la Figura 1. Los niveles de cortisol en el suero de los grupos de cabras npg y de 40-50 d no fueron diferentes significativamente (117.1 ± 58.5 y 174.3 ± 59.1 nmol/l, respectivamente). Los valores de GRp presentaron una tendencia a disminuir desde 10.4 ± 2.7 en el grupo de 40-50 d,hasta 6.1 ± 2.3 fmol/mg de proteína en el grupo de 76-100 d. En los mismos grupos, los niveles de cortisol en el suero materno disminuyeron (P ≤ 0.05) desde 174.3 ± 59.1 a 79.1 ± 66.1 nmol/l. Los niveles de GRp y cortisol se incrementaron (P ≤ 0.05) en el grupo de 101-125 d con valores de 18.3 ± 2.7 fmol/mg de proteína y 659.6 ± 76.3 nmol/l, los más altos detectados en este estudio. Posteriormente siguió un descenso (P ≤ 0.05), tanto en los niveles de cortisol (231.6 ± 53.9 nmol/l) como en el contenido de los GRp (11.6 ± 2.2 fmol/mg de proteína) en el grupo de +125 d.

El número de sitios de unión de los GRh de cabras npg fue semejante al de cabras con 40-50 d, 16.6 ± 1.4 y 20.0 ± 4.2 fmol/mg de proteína, respectivamente. Se observaron cambios recíprocos en los GRh maternos y fetales. Los GRh maternos decrecieron (P ≤ 0.05) progresivamente desde 20.0 ± 4.2 fmol/mg de proteína en el grupo de 40-50 d a 3.9 ± 4.2 fmol/mg de proteína en el grupo 101-125 d, y luego incrementaron (P ≤ 0.05) a 18.0 ± 3.3 fmol/mg de proteína en el grupo de +125 d. Por el contrario, en los GRh del feto se encontró un incremento (P ≤ 0.05) progresivo desde 35.2 ± 7.3 fmol/mg de proteína en el grupo de 40-50 d a 82.7 ± 13.5 fmol/mg de proteína en el grupo de 101-125 d, y luego decrecieron (P ≤ 0.05) a 23.3 ± 10.4 fmol/mg de proteína en el grupo de +125 d. El cortisol fetal no mostró un perfil particular y osciló en un intervalo de 35-82 nmol/l en todos los grupos (Figura 2).

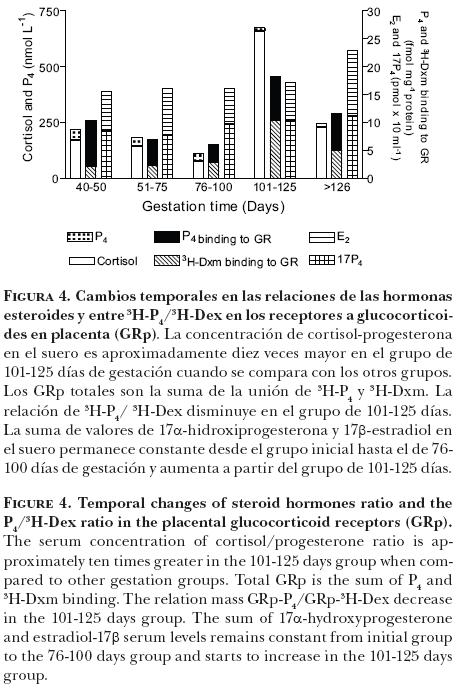
El perfil de los esteroides sexuales en el suero materno se presenta en la Figura 3. La concentración de progesterona en el suero decreció gradualmente de 46.1 ± 3.7 nmol/l en el grupo de 40–50 d a 11.7 ± 3.4 nmol/l en el de +125 d. Los perfiles de 17α-hidroxiprogesterona y 17β-estradiol en el suero no cambiaron significativamente en los grupos estudiados y fluctuaron en los intervalos de 0.79 ± 0.13 a 1.1 ± 0.14 y de 0.64 ±0.20 a 0.81 ±0.17 nmol/l, respectivamente. Los niveles de 17β-estradiol fueron altos (1.17± 0.17 nmol/l) sólo en las cabras de final de gestación (Figura 3). El porcentaje de inhibición de la unión de 3H-dexametasona por la adición de progesterona en los sitios de los GRp decreció progresivamente de 77.6% en el grupo de 40-50 d a 42.8% en el grupo de 101-125 d (Figura 4).

Discusión
Desde el trabajo clásico de Van Rensburg,3 se ha reconocido que las cabras son una especie propensa al aborto. En un trabajo anterior se identificó una asociación entre concentraciones elevadas de cortisol en la sangre materna y aborto en cabras con 102 a 134 días de gestación.7 En el presente trabajo se informa que las cabras gestantes estresadas cuando se encuentran entre 101-125 d presentan los valores más altos de cortisol y GRp, comparadas con cabras igualmente estresadas en otros periodos de gestación. Flint y Burton15 midieron los GRp en la oveja y encontraron un incremento en los sitios de unión entre los 90 y 129 días de gestación, intervalo que comprende el periodo con los valores más altos observados en el presente trabajo. También se ha descrito una asociación entre los GRp y el cortisol elevado durante el trabajo de parto en ovinos.29 Parece probable que la coincidencia temporal del incremento en los niveles de cortisol materno detectado cuando el alto número de GRp hace a la placenta más receptiva a esta hormona, pueda participar en la iniciación de un trabajo de parto prematuro en las cabras.
Asimismo, se observó que la unión competitiva de progesterona a los GRp disminuyó progresivamente hasta alcanzar los valores más bajos en el grupo de 101-125 d (Figura 4). En los experimentos in vitro para calcular el desplazamiento por la progesterona,, esta hormona se encuentra 240 veces más concentrada que la 3H-dexametasona. Sin embargo, en el grupo de 101-125 d, el cortisol se encontró 36 veces más alto que la progesterona, de donde se infiere que en este caso, la competencia de la progesterona por el receptor es prácticamente despreciable. La unión de progesterona a los GRp ha sido propuesta como un posible mecanismo por el que esta hormona protege al feto de una activación prematura del proceso de parto, causada por incrementos transitorios en el cortisol materno.15 Aparentemente, este mecanismo protector está disminuido en los días 101 a 125, particularmente bajo condiciones que incrementan el cortisol como el estrés intenso.
Las concentraciones de cortisol fetal se encontraron, en todos los periodos, dentro de límites normales (40-80 nmol/l) y fueron similares a las informadas por Ford et al.30 en fetos caprinos. Estos valores no tuvieron un patrón particular entre los grupos estudiados (Figura 2). No se correlacionaron con el incremento en el número de GRh fetales ni con el incremento en la concentración de cortisol en la sangre materna, lo cual sugiere que el feto no sufre estrés durante el transporte y las condiciones de ayuno materno. Los bajos niveles de cortisol fetal encontrados en todos los periodos estudiados, reafirman que el cortisol materno es el principal desencadenante del proceso de aborto cuando aumenta extraordinariamente bajo estrés, como se plantea en un estudio anterior.7
Los valores de GRh fetales tuvieron un patrón inverso a los del hígado materno: los GRh fetales aumentaron progresivamente de los días 40-50 a sus valores máximos en los días 101-125 (Figura 2), mientras que el número de GRh maternos disminuyeron progresivamente a los valores más bajos en el mismo periodo (Figura 1). El mayor número de GRh fetales entre los días 101 a 125 de gestación pueden estar relacionados con una mayor necesidad de glucosa en el último tercio de la gestación,31 la consecuente producción de glucosa en el hígado fetal a partir de glucogenólisis y gluconeogénesis,32 asociada con un incremento en la actividad de la glucosa-6-fosfatasa33,34 inducido por el cortisol en ese periodo.35,36
Es difícil explicar la gran diferencia encontrada en el contenido de GRp y GRh maternos en el grupo de 101-125 d, pese a que ambos valores disminuyeron progresivamente desde los encontrados en el grupo de 40-50 d de gestación hasta los del grupo 76-100 d, los GRp se elevaron abruptamente y coincidieron con los GRh más bajos en el grupo de 101-125 d. Parece que este periodo es crítico para la gestación en una situación de estrés, cuando la concentración de cortisol se eleva considerablemente (Figura 1) y el hígado puede estar restringido en su respuesta a la glucogenólisis y gluconeogénesis. Esta limitante del hígado para responder al cortisol coincide con el momento en que la placenta es más receptiva a esta hormona, predisponiendo así al aborto.
Los niveles de esteroides sexuales encontrados en el suero materno fueron acordes al perfil de gestación conocido: la 17α-hidroxiprogesterona y el estradiol tendieron a incrementarse en los grupos de gestación más avanzada. La progesterona decreció conforme avanzo la gestación.
Cuando se analizaron en conjunto las concentraciones hormonales y los de GRp sobre el curso de la gestación (Figura 4), se observó que en el grupo de 101-125 d, la relación entre la progesterona y el cortisol es muy baja y el porcentaje de la unión de la progesterona a los GRp está disminuido cuando se compara con el de los grupos de periodos previos. El efecto progestacional puede estar reducido cuando los GRp y el cortisol se encuentran muy elevados. Las condiciones señaladas pueden resultar en una predisposición al aborto en la etapa temprana del último tercio de la gestación en las cabras (101-125 días), como ha sido observado en condiciones no controladas por otros investigadores.37,38
A pesar de que las condiciones de muestreo no fueron diseñadas específicamente para estudiar el momento del aborto, los hallazgos obtenidos en este trabajo permitieron observar niveles elevados de cortisol materno en el grupo del último tercio de la gestación (101-125 d), incluso mayores a los previamente informados en ovejas39 y cabras,7,26 que pueden inducir el parto o bien el aborto.
Es importante hacer notar que el aborto en las cabras pudo haberse generado como un mecanismo adaptativo protector de la especie cuando factores adversos extremos amenazan gravemente la vida y ponen en riesgo tanto a la madre como al feto. En estas condiciones, la madre sobrevive y tiene la oportunidad de gestar nuevamente. Los resultados de este estudio fortalecen dicha hipótesis.
Agradecimientos
Se agradece al M. en C. Arturo Trejo González la ayuda proporcionada para la obtención de los animales utilizados en este estudio, así como sus comentarios sobre el experimento.
References
1. MENARD JL, LE MENS P. Listeria Lutter contre cette bacteria dans le lait. Reussir La Chevre 1993; 195: 38-40. [ Links ]
2. MELLADO M, PASTOR FJ. Aborto no infeccioso en caprinos. Ciênc Anim Bras 2006; 7: 167-175. [ Links ]
3. VAN RENSBURG SJ. Reproductive physiology and endocrinology of normal and habitually aborting Angora goats. Onderstepoort J Vet Res 1971; 38: 1-62. [ Links ]
4. WENTZEL D, MORGENTHAL JC, VAN NIEKERK CH. The habitually aborting Angora doe. IV. Adrenal function in normal and aborted does. Agroanimalia 1975; 7: 27-34. [ Links ]
5. WENTZEL D, VILJOEN KS. The habitually aborting Angora doe. VI. Induction of abortion by administration of exogenous oestrogens. Agroanimalia 1974; 7: 41-44. [ Links ]
6. WENTZEL D, ROELOFSE CS. The habitually aborting Angora doe. VII. Induction of abortion by administration of cortisone acetate. Agroanimalia 1975; 7: 45-48. [ Links ]
7. ROMERO-RCM, LOPEZ G, LUNA-MM. Abortion in goats associated with increased maternal cortisol. Small Rumin Res 1998; 30: 7-12. [ Links ]
8. CURRIE WB, THORBURN GD. Parturition in goats: Studies on the interactions between the foetus, placenta, prostaglandin F and Progesterone before parturition, at term or at parturition induced prematurely by corticotrophin infusion of the foetus. J Endocrinol 1977; 73: 263-278. [ Links ]
9. FYLLING P. Premature parturition following dexamethasone administration to pregnant ewes. Acta Endocrinol 1971; 66: 289-295. [ Links ]
10. LIGGINS GC, FAIRCLOUGH RJ, GRIEVES SA, KENDALL JZ, KNOX BS. The mechanism of initiation of parturition in the ewe. Recent Prog Horm Res 1973; 290: 111-159. [ Links ]
11. MALTER JP, LEGRAND C, BREULLIER M. La parturition. Dans: THIBAULT C, LEVASSEUR MC, éditeurs. La Reproduction chez les mammiferes et l'homme. INRA-ellipses, Paris 1991: 465-486. [ Links ]
12. FLINT APF, KINGSTON EJ, ROBINSON JS, THORBURN GD. Initiation of parturition in the goat: evidence for control by foetal glucocorticoids through activation of placental C21-steroid 17-α-hydroxilase. J Endocrinol 1978; 78: 367-378. [ Links ]
13. FRANCE JT, MAGNESS RR, MURRY BA, ROSENFELD CR, MASON JI. The regulation of ovine placental steroid 17-α-hydroxylase and aromatase by glucocorticoid. Mol Endocrinol 1988; 2: 193-199. [ Links ]
14. SCHAAF MJM, CIDLOWSKI JA. Molecular mechanism of glucocorticoid action and resistence. J Steroid Biochem Mol Biol 2003; 83: 37-48. [ Links ]
15. FLINT APF, BURTON RD. Properties and ontogeny of the glucocorticoid receptor in the placenta and fetal lung of the sheep. J Endocrinol 1984; 103: 31-42. [ Links ]
16. BOOS A, KOHTES J, STELJES A, ZERBE H, THOLE HH. Immunohistochemical assessment of progesterone, oestrogen and glucocorticoid receptors in bovine placentomas during pregnancy, induced parturition and after birth with or without retention of foetal membranes. J Reprod Fertil 2000; 120: 351-360. [ Links ]
17. BOOS A, KOHTES J, JANSSEN V, MÜLLING C, STELLJES A, ZERBE H et al. Pregnancy effects on distribution of progesterone receptors, oestrogen receptor, glucocorticoid receptors, Ki-67 antigen and apoptosis in the bovine interplacentomal uterine wall and foetal membranes. Anim Reprod Sci 2006; 91: 55-76. [ Links ]
18. SCHÄUBLI M, RITTER N, HÄSSIG M, ZERBE H, BLEUL U, BOOS A. Progesterone receptors, oestrogen receptor and glucocorticoid receptors in the bovine intercaruncular uterine wall around parturition. Anim Reprod Sci 2008; 103: 215-227. [ Links ]
19. WHITTLE WL, HOLLOWAY AC, LYE S, CHALLIS JR, GIBB W. The pattern of glucocorticoids and estrogen receptors may explain differences in steroid dependency of intrauterine prostaglandin production at parturition in sheep. J Soc Gynecol Investig 2006; 13: 506-511. [ Links ]
20. DUVAUX-PONTER C, ROUSSEL S, TESSIER J, SAUVANT D, FICHEUX C, BOISSY A. Physiological effects of repeated transport in pregnant goats and their offspring. Anim Res 2003; 52: 553-566. [ Links ]
21. KANNAN G, KOUAKOU B, TERRILL TH, GELAYE S. Endocrine blood metabolite and meat quality changes in goats as influenced by short-term, preslaughter stress. J Anim Sci 2003; 81: 1499-1507. [ Links ]
22. SAGARPA. Norma Oficial Mexicana NOM-033-200-1995, Sacrificio humanitario de los animales domésticos y silvestres. Diario Oficial de la Federación 16-julio-1996. [ Links ]
23. SIVACHELVAN MN, GHALI M, CHIBUZO GA. Foetal age stimation in sheep and goats. Small Rumin Res 1996; 19: 69-75. [ Links ]
24. PANARELLI M, HOLLOWAY CHD, BAR ABP, FRASER R, KENYLON CHJ. Differences in temperature-sensitive receptor binding in glucocorticoids in spontaneusly hypertensive and normotensive Wistar Kyoto rats. Steroids 1995; 60: 73-75. [ Links ]
25. COPELAND RA. Methods for protein analysis: a practical guide to laboratory protocols. New York: Chapman and Hall, 1994. [ Links ]
26. LUNA-MM, ROMERO-RCM, VALVERDE-RC. Ensayo por competencia de unión a proteínas para cuantificar sin purificación previa cortisol o corticosterona en el suero de algunas especies animales. Vet Méx 1990; 21: 115-122. [ Links ]
27. HERRERA DMR, LUNA-MM, ROMERO-RCM. Obtención de anticuerpos contra progesterona y estradiol, estandarización del radioinmunoanálisis y validación en suero de rumiantes. Vet Méx 1993; 24: 223-230. [ Links ]
28. HINTZE JL. NCSS 2000. Number cruncher statistical system for windows. NCSS, Kaysville UT, 2000. [ Links ]
29. GUPTA S, GYOMOREY S, LYE SJ, GIBB W, CHALLIS JR. Effect of labor on glucocorticoid receptor (GR (Total), GRalpha, and GRbeta) proteins in ovine intrauterine tissues. J Soc Gynecol Investig 2003; 10: 136-144. [ Links ]
30. FORD MM, YOUNG IR, CADDY DJ, THORBURN D. Fetal and maternal endocrine changes approaching parturition in the goat: Lack of evidence for prostaglandins E2 and F2α as signals for luteolysis. Biol Reprod 1998; 58: 1065-1070. [ Links ]
31. BAUMAN DE, CURRIE B. Partitioning of nutrients during pregnancy and lactation: A review of mechanisms involving homeostasis and homeorhesis. J Dairy Sci 1980; 63: 1514-1529. [ Links ]
32. BOYD RDH, MORRIS JRFH, MESCHIA G, MAKOWSKI EL, BATTAGLIA FC. Growth of glucose and oxygen uptakes by foetuses of fed and starved ewes. Am J Physiol 1973; 225: 897-902. [ Links ]
33. STEVENSON RE, MORRISS FH, ADCOCK JREW III, HOWELL RR. Development of gluconeogenic enzymes in fetal sheep liver and kidney. Dev Biol 1976; 52: 167-172. [ Links ]
34. DHANOTIYA RS, BHARDWAJ R. Sequential development of enzymes of gluconeogenesis and glucose synthesis in fetal goat liver. Biomed Biochem Acta 1988; 47: 805-808. [ Links ]
35. FOWDEN AL, COULSON RL, SILVER M. Endocrine regulation of tissue glucose-6 phosphatase activity in the fetal sheep during late gestation. Endocrinology 1990; 126: 2823-2830. [ Links ]
36. FRANCO KL, GIUSSANI DA, FORHEAD AJ, FOWDEN AL. Effects of dexamethasone on the glucogenic capacity of fetal, pregnant, and non-pregnant adult sheep. J Endocrinol 2007; 192: 67-73. [ Links ]
37. MELLADO M. La cabra criolla en América Latina. Vet Méx 1997; 28: 333-343. [ Links ]
38. ENGELAND IV, WALDELAND H, ANDRESEN Ø, LØKEN T, BJÖRKMAN C, BJERKAS I. Foetal loss in dairy goats: An epidemiological study in 22 herds. Small Rumin Res 1998; 30: 37-48. [ Links ]
39. KHAN JR, LUDRI RS. Hormone profile of crossbred goats during the periparturient period. Trop Anim Health Prod 2002; 34: 151-162. [ Links ]
El presente trabajo forma parte de la tesis de Maestría en Biología Experimental del primer autor, quien recibió una beca Conacyt número 91611 y una beca para estudios de posgrado del personal académico de la Universidad Autónoma Metropolitana.














