Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Veterinaria México
versão impressa ISSN 0301-5092
Vet. Méx vol.43 no.2 Ciudad de México Abr./Jun. 2012
Artículos de revisión
Cambios nutrimentales en el lechón y desarrollo morfofisiológico de su aparato digestivo
Nutritional changes in piglets and morphophysiologic development of their digestive tract
Tércia Cesária Reis de Souza*, Gerardo Mariscal Landín**, Konisgmar Escobar García***, Araceli Aguilera Barreyro***, Aline Magné Barrónt†
* Facultad de Ciencias Naturales, Universidad Autónoma de Querétaro, Av. de las Ciencias s/n, Juriquilla, Querétaro, 76230, México.
** CENID Fisiología INIFAP, km 1, carretera a Colón, Ajuchitlán, Colón, 76280, Querétaro.
*** Alumnos del Doctorado en Ciencias Biológicas, Facultad de Ciencias Naturales, Universidad Autónoma de Querétaro, Av. de las Ciencias s/n, Juriquilla, Querétaro, 76230, México.
† Alumna de la Maestría en Recursos Bióticos Facultad de Ciencias Naturales, Universidad Autónoma de Querétaro, Av. de las Ciencias s/n, Juriquilla, Querétaro, 76230, México.
Responsable de correspondencia:
Tércia Cesária Reis de Souza,
Tel.: (442) 1921200, ext. 5391,
Fax: (442) 2342958,
correo electrónico: tercia@uaq.mx.
Recibido el 22 de mayo de 2011
aceptado el 28 de noviembre de 2011
Abstract
This review shows the development of the pig gastrointestinal tract (GIT) since intrauterine life. Immediately after birth, the GIT begins another important stage in its ontogenesis, which ensures for the piglets to have access to the protective substances in colostrum and milk nutrients. Another important stage in the development of the GIT begins after weaning. In general, life changes in the days around weaning leading to a decrease in feed intake, which, in turn, leads to nutritional stress that results in the atrophy of intestinal villi, diminishing the piglets ability to digest and absorb nutrients necessary for growth. The small intestine loses weight due to a net loss of intestinal mucosa. The decrease in voluntary feed intake also produces a reduction in both pancreatic enzyme activity, due to lack of substrate, and brush border enzyme activity, due to physical loss of enterocytes in the small intestine and to lack of substrate. Once the animals begin to eat solid food the organism goes through an adaptation process to all the adverse factors previously mentioned and GIT growth and digestive function are restored. During this process, the amount of feed provided to the newly weaned piglet and the ingredients used play an important role in GIT maturation.
Key words: piglet nutrition, weaning, digestive physiology, gastrointestinal tract development.
Resumen
En esta revisión se muestra el desarrollo que tiene el tracto gastrointestinal (TGI) desde la vida intrauterina. Inmediatamente después del nacimiento el TGI inicia otra fase importante de su ontogénesis, la cual garantiza el acceso de los lechones a sustancias protectoras del calostro y a los nutrimentos de la leche. Otra etapa de importancia en el desarrollo del TGI se da después del destete, en general, en los días alrededor del mismo se presentan cambios en la vida del lechón los cuales conducen a una disminución en el consumo de alimento por la confluencia de una serie de factores que llevan a un estrés nutricional, y tiene como consecuencia la atrofia en las vellosidades intestinales, disminuyendo la capacidad del lechón para digerir y absorber los nutrimentos necesarios para su buen crecimiento. El peso del intestino delgado se ve afectado debido a una pérdida neta de mucosa intestinal. La disminución en el consumo voluntario también produce una reducción en la actividad de las enzimas pancreáticas, por la falta del sustrato necesario para su acción, y de las enzimas de borde en cepillo, en primer lugar por una pérdida física de enterocitos a nivel del intestino delgado y, en segundo lugar, por una ausencia de sustrato. Una vez que los animales empiezan a consumir alimento sólido, el organismo pasa por un proceso de adaptación a todos los factores adversos antes mencionados y los animales comienzan a recuperar el crecimiento del TGI y con ello sus funciones digestivas. En este proceso, la cantidad de alimento que se proporciona, así como las materias primas que lo componen, tienen un papel importante en la maduración del TGI de los lechones recién destetados.
Palabras clave: nutrición de lechones, destete, fisiología digestiva, desarrollo del tracto gastrointestinal.
Introducción
Las diferentes fases de desarrollo del tracto gastrointestinal (TGI) fueron revisadas por Cranwell,1 quién describe que durante la vida fetal el TGI del cerdo, y de otros mamíferos, empieza su desarrollo pasando por tres fases: en la primera, se da un periodo de proliferación, crecimiento y morfogénesis; en la segunda, se presenta la diferenciación de las células epiteliales; y, en la tercera, la maduración funcional. Inmediatamente después del nacimiento, con el consumo del calostro y de la leche, se establece otra etapa importante en la ontogénesis del TGI, la cual es responsable de proveer a los neonatos las sustancias protectoras a través de la endocitosis de las inmunoglobulinas presentes en el calostro, así como los metabolitos resultantes de los procesos de digestión y absorción de los nutrimentos de la leche.2
Al destete, el cambio de la leche materna a una dieta sólida basada en almidón y proteínas de origen vegetal, hace que el TGI pase por un largo proceso de adaptación, debido a que este no estaba preparado para digerir dichos nutrimentos.3 Esta situación genera cambios morfológicos y funcionales en el TGI que pueden causar trastornos en el consumo de alimento y alteraciones en el proceso digestivo, impidiendo que el animal cubra sus requerimientos de proteína y energía, lo que dificulta su crecimiento inicial.4 Este proceso ocurre principalmente durante la primera semana posdestete; posteriormente, el desarrollo del aparato digestivo está íntimamente ligado con el consumo de alimento sólido. Los animales que consumen una mayor cantidad de alimento y, por ende, más energía, tienen un mayor crecimiento del estómago, páncreas, intestino delgado e hígado, ya que estos órganos consumen aproximadamente 50% de la energía total.5,6
Durante el periodo comprendido entre los años setenta y noventa se intensificaron los estudios sobre fisiología digestiva y el efecto de la nutrición en el TGI de los lechones recién destetados; por esta razón, en la presente revisión se citan muchos trabajos publicados en esos años. En los últimos años, a partir de los conocimientos generados en esos estudios, la industria ha desarrollado alimentos iniciadores de alta calidad para minimizar las alteraciones en un aparato digestivo poco desarrollado, estimular el consumo voluntario y disminuir el costo energético del proceso de adaptación posdestete en los lechones. Se recomienda que las raciones iniciadoras sean altamente digestibles para obtener un aprovechamiento lo más eficiente posible, y no poner en riesgo la salud y el desarrollo de los animales jóvenes. Dada la importancia del tema, el objetivo del presente trabajo fue revisar los principales cambios que ocurren en el TGI durante la fase inicial de la vida de los lechones, y su relación con los aspectos nutrimentales que estimulan o inhiben su desarrollo.
Desarrollo de los órganos digestivos en el periodo predestete
El desarrollo funcional del TGI es el resultado de la interacción de un gran número de factores: desarrollo intrínseco, reloj biológico y mecanismos reguladores endógenos,1 genética7 (las razas "magras" tienen el TGI más desarrollado que las "obesas"),8 e influencias ambientales tales como, la dieta, factores de crecimiento, poliaminas, factores antinutrimentales y bacterias.2,7 En relación con otras especies, el TGI de los cerdos se desarrolla muy poco durante la vida fetal, pero se acelera después del nacimiento aumentando en su longitud, diámetro y peso en los primeros días de vida,4 maximizándose el crecimiento una vez que los lechones se destetan. El TGI alcanza la madurez alrededor de las 12 semanas de vida.5,8,9
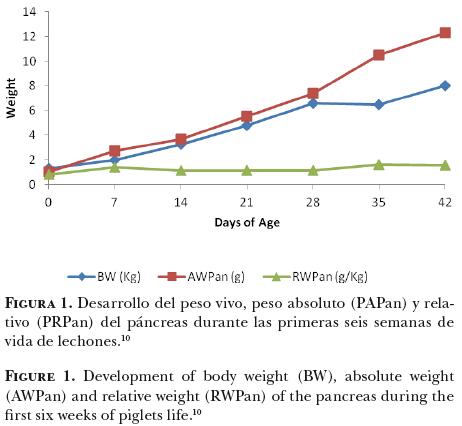
Desde el nacimiento hasta la sexta semana de vida, el lechón aumenta alrededor de 7.5 veces su peso, cada uno de los órganos pasa por transformaciones importantes, por ejemplo, el páncreas aumenta 12 veces su peso absoluto (Figura 1).10 Aparentemente, el desarrollo del páncreas está íntimamente ligado a la ingestión de alimento, ya sea en forma de calostro o alimento sólido, pues es un órgano esencial para la vida extra uterina.2,11 Las enzimas pancreáticas que alcanzan la luz intestinal son esenciales para la hidrólisis de los macronutrimentos después del nacimiento, mientras que en el feto, los nutrimentos son transferidos vía placentaria y no por el TGI, por lo tanto, es probable que no se requiera la función exocrina del páncreas durante la gestación. Las hormonas que secreta tienen un papel central en el control de la homeostasis del metabolismo energético y proteínico. Una revisión bibliográfica11 describe detalladamente el desarrollo del páncreas antes del nacimiento en diferentes especies de animales domésticos, mencionando que los resultados de varios experimentos sugieren que la función endocrina del páncreas es necesaria para la nutrición y crecimiento del feto; sin embargo, durante la fase fetal, ambas funciones pancreáticas (endocrina y exocrina) están relativamente inmaduras en términos estructurales y funcionales, pues la maduración de estas funciones se presenta varias semanas después del nacimiento. En los lechones recién nacidos, el páncreas tiene un crecimiento masivo (50–80% de incremento en su peso absoluto) en respuesta a las primeras horas de ingestión de calostro, es decir, el páncreas depende más de la estimulación enteral para su crecimiento y desarrollo, que de otras señales.2,11 Al día 3 de vida, el peso absoluto del páncreas aumenta entre 100 y 130%, y este crecimiento es mayor que el aumento del peso vivo del animal.11 Después del destete, el páncreas pasa por una nueva fase de aceleración en su crecimiento (Figura 1).10
Antes del nacimiento, la mucosa gástrica es capaz de secretar HCl y enzimas; el final de la vida fetal se caracteriza por un descenso del pH estomacal de 7 a 2–3. Justo después del nacimiento de los lechones el estómago crece intensamente y su capacidad de secretar ácido aumenta cerca de cinco veces en la primera semana posparto, con un posterior incremento muy lento hasta el destete.2 Resultados de diferentes trabajos presentados en una revisión bibliográfica,1 muestran una correlación positiva entre el peso relativo (g/kg de peso vivo (PV)) del estómago y la edad del lechón; entre el nacimiento y el tercer día de vida. Entre el día cuatro y 36 de vida la correlación es negativa; es decir, al día 36 el peso del estómago por unidad de PV es menor que al nacimiento. En la mucosa gástrica, se observa10 un comportamiento similar al del peso del estómago durante el periodo de lactancia (Figura 2).

El intestino delgado de los cerdos presenta un desarrollo acelerado durante los primeros 10 días después del nacimiento, y es entonces cuando ocurren aumentos significativos en su peso absoluto y en el peso de la mucosa intestinal.1 Después del día 10 de vida se observa que el intestino delgado pasa por un proceso de maduración, que se caracteriza por aumentos marcados del volumen, longitud y peso.12 Los cambios macroscópicos del intestino delgado están asociados con las transformaciones que sufren las vellosidades de la mucosa intestinal. En fetos porcinos, los enterocitos tienen membranas bien desarrolladas, pero las vellosidades intestinales están distribuidas de manera relativamente dispersa, y son de un diámetro angosto y de longitud irregular.1 Al nacimiento, las vellosidades tienen forma de dedos alargados, y conforme avanza la edad se van engrosando. En cerdos lactantes de aproximadamente dos semanas de edad, las vellosidades disminuyen gradualmente de altura y su ancho y la profundidad de las criptas de Lieberkühn aumentan.13 Además, se incrementa la población celular de la mucosa, se desarrollan las capas musculares y aumenta la longitud y el diámetro del intestino delgado. Mougham et al.14 y Xu et al.15 describieron detalles sobre los cambios morfológicos iniciales, así como las diferencias regionales de las vellosidades, glándulas de Brunner y criptas de Lieberkühn. Los factores reguladores del desarrollo perinatal de la mucosa del TGI y sus secreciones en le–chones y otros mamíferos se describen con detalle en la revisión publicada por Zabielski et al.2
El intestino puede cambiar su superficie con el su crecimiento longitudinal, y por el aumento o disminución de la altura de las vellosidades. El acortamiento y la fusión de vellosidades propiciarán en una pérdida de la superficie de digestión y absorción de los alimentos.16 Para que la digestión y la absorción de los nutrimentos se lleven a cabo de una manera satisfactoria, es necesario que se mantenga la integridad de la mucosa intestinal, la cual depende del recambio y de la renovación de sus células. La función digestiva (secreción de carbohidrasas y peptidasas) de los enterocitos y sus microvellosidades comienza solamente cuando se completa la diferenciación estructural de la mucosa, lo que generalmente ocurre durante el periodo de migración celular hacia el primer tercio de la vellosidad. La absorción de azúcares y aminoácidos empieza cuando el enterocito migra hacia la mitad de la vellosidad y continúa aumentando hasta que sale por descamación en la punta de ésta.16
Efecto del destete
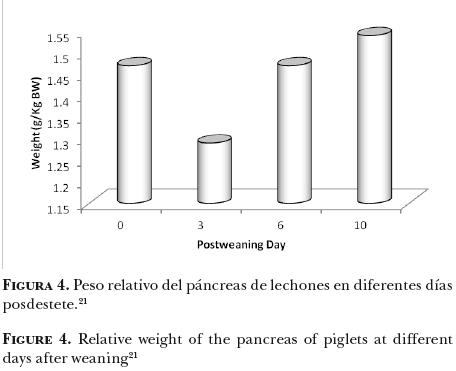
El destete en condiciones naturales se lleva a cabo varias semanas después del nacimiento, y es un proceso durante el cual el sistema digestivo del lechón se adapta progresivamente a un menor consumo de leche y mayores cantidades de alimento sólido. Desde finales de la década de los setenta se practica el destete "temprano" con el objetivo de que las cerdas reinicien su ciclo reproductivo de manera prematura. Eso significó que se pasara de un destete gradual, realizado por la misma cerda entre las 15–22 semanas de edad de los lechones, a un destete brusco y ultra precoz alrededor de los 7 días de edad.17 En la actualidad, el destete se realiza en la mayor parte del mundo entre los 21 y 28 días de edad. Contrariamente a lo que ocurre en condiciones naturales, en el destete temprano los factores psicológicos, sociales y nutrimentales inherentes a esta etapa, interfieren de manera importante en el desarrollo de los animales, particularmente del TGI.18 Las alteraciones generadas por el destete temprano no se presentan en ningun otra etapa del crecimiento del cerdo y, debido al cambio radical en la alimentación, los animales se someten a un severo estrés nutrimental.19 La leche materna, líquida, altamente digestible y muy bien acoplada a las enzimas del tubo digestivo del lechón, se reemplaza por una dieta sólida, elaborada a base de cereales (fuente de almidón) y de proteínas de origen vegetal.19 Los lechones recién destetados poseen un menor grado de maduración de la función digestiva, pues su TGI aún no produce todas las enzimas necesarias para la digestión de alimentos sólidos.20 Además, las secreciones digestivas no son suficientes,21 y el epitelio intestinal pasa por cambios morfológicos muy drásticos, por lo que la absorción de los nutrimentos se reduce. En consecuencia, se observa en el lechón recién destetado una capacidad limitada de digestión y de absorción de los alimentos, sobre todo respecto a las proteínas vegetales,22 lo que repercute en el consumo de alimento.23–26 La primera semana posdestete suele ser en la que más consecuencias negativas tiene en el TGI. En los dos o tres primeros días posdestete se observa una disminución del peso de los órganos digestivos, aunque en algunos casos, el peso permanece constante en este periodo (Figuras 3 y 4).27,28

Efecto del consumo de alimento
La nutrición enteral representa una de las influencias más significativas en el desarrollo del TGI y del páncreas, y depende de la naturaleza del alimento ingerido (calostro versus leche materna) y de la diversidad de los ingredientes que componen el alimento.2 El efecto del consumo de alimentos sólidos sobre el TGI es ambiguo, pues por un lado es benéfico y estimulador del desarrollo (mucosa gástrica, páncreas y flora microbiana no patógena); por otro lado, es adverso debido a las alteraciones estructurales de la mucosa del intestino delgado y al desarrollo de una flora microbiana patógena. Así, dependiendo del órgano digestivo considerado, los efectos en el desarrollo son distintos.
Estómago. El crecimiento del estómago se asocia con el desarrollo de la mucosa gástrica, lo que provoca una mayor producción de HCl y de pepsina en respuesta al estímulo físico provocado por el aumento de la masa alimenticia ingerida y al efecto trófico de la hormona gastrina.10 Durante las cuatro semanas posdestete, se observó1 que el crecimiento del estómago fue positivamente alométrico, de tal manera que el peso estomacal aumentó de 4.9 a 6.3 g/kg en relación con el peso corporal. El peso absoluto de la mucosa gástrica se incrementa de manera relevante durante las dos primeras semanas posdestete (Figura 2);10,17 sin embargo, el desarrollo parece estabilizarse en las semanas subsecuentes.17 El peso relativo (g/kg de PV) de la mucosa gástrica incrementó en la etapa inicial de ingestión de alimento sólido. Este efecto fue más evidente bajo condiciones en las que el lechón presentó una ligera pérdida de peso en la semana inmediata al destete (Figura 2).10
Páncreas. El páncreas de un animal al destete es generalmente del mismo tamaño o mayor que al nacimiento; sin embargo, en los primeros días después del destete, el ayuno o el bajo consumo de alimento provocan un descenso en los pesos absoluto y relativo del páncreas (Figura 4).21 También se señala que el ayuno provoca un aumento en la concentración de enzimas en su tejido, lo que se refleja en una reducción de la secreción de jugo pancreático. A partir de estudios moleculares, se ha observado18 que los niveles de ARN mensajero (ARNm) en el páncreas son bajos inmediatamente después del destete; lo que originó una disminución en la síntesis de las enzimas pancreáticas en este periodo. Sin embargo, pocos días después, se restauraron los niveles pancreáticos de ARNm y la actividad enzimática, con excepción de la actividad de la lipasa.18 Después de que los animales empiezan a aumentar el consumo de alimento se observa un gran aumento en la tasa de crecimiento del tejido pancreático. El tamaño del páncreas en cerdos de 7 a 17 kg de peso vivo (2 y 4 semanas posdestete) fue de 1.54–2.19 g/kg, significativamente más grande que antes del destete (0.8–1.0 g/kg).10,29
Intestino delgado. Muchos estudios sobre la fisiología digestiva de lechones recién destetados se abocaron a determinar los efectos del destete sobre la morfología y la función del intestino delgado, y a caracterizar la magnitud de los cambios provocados por los alimentos.19,23,30–32 Los resultados de estos trabajos sugieren que la disminución en la ganancia de peso, el bajo consumo y las alteraciones intestinales, son capaces de producir enfermedades diarreicas durante el destete, y se relacionan con una limitada capacidad del TGI para digerir y absorber eficientemente las dietas iniciadoras.32 La disminución del nivel de consumo de alimento impide que el animal alcance a satisfacer los requerimientos necesarios de energía y proteína, lo que afecta la proliferación, diferenciación y migración de las células del epitelio intestinal.31 Se han mencionado otros factores como causantes de una reducida capacidad digestiva en los lechones recién destetados, entre éstos se encuentran: la presencia de antígenos (proteínas alergénicas) en la dieta, que afectan la inmunidad local intestinal, la fibra dietaria y los factores antinutrimentales presentes en las materias primas. Como consecuencia, se observan alteraciones en la integridad de la mucosa intestinal, las cuales van de la mano con la disminución de la actividad enzimática del borde en cepillo de los enterocitos.23 Diversos autores17,21,30 coinciden en que las vellosidades pueden disminuir 75% de su altura durante las primeras 24 horas posdestete, debido a la pérdida de enterocitos maduros. Esta disminución se manifiesta en un cambio morfológico de las vellosidades, de largas como un dedo en los recién nacidos y cerdos lactantes, a más cortas y anchas como una hoja o una lengua, en los recién destetados.31 Simultáneamente, la actividad de la lactasa disminuye,24,33 debido a la presencia de enterocitos inmaduros en las vellosidades acortadas, los cuales no pueden expresar su máxima capacidad de síntesis de enzimas. Las peptidasas presentes en las membranas y en el citosol de los enterocitos, y que se encargan de la hidrólisis final de los péptidos, disminuyen su actividad desde el nacimiento hasta la quinta semana de edad.1 También se puede explicar la reducción de la actividad de las enzimas intestinales, por el consumo de alimento errático que se observa durante los primeros días posdestete, lo que provoca una baja de sustratos en la luz intestinal.21 Por ejemplo, la actividad de la lactasa disminuye a consecuencia de la reducción en la ingestión de lactosa.34 Los cambios funcionales y estructurales que se observan en el intestino delgado suceden dentro de las primeras 24 a 36 horas posdestete y traen como consecuencia una disminución del 20 al 30% del peso intestinal.18 La recuperación del crecimiento de las vellosidades se observa desde el día tres posdestete,19,23,31,35 lo cual se ha relacionado con la presencia de alimento en el tubo digestivo.
Influencia de la composición del alimento sobre el TGI
El desarrollo y la diferenciación intrínseca del TGI del lechón recién nacido dependen profundamente de la interacción entre los componentes dietarios y la flora microbiana, teniendo el alimento un efecto determinante. El calostro y la leche contienen altas concentraciones de factores de crecimiento que aceleran la proliferación y la maduración del intestino de los animales recién nacidos.26
Después del destete, la composición del alimento iniciador tiene un papel importante en los cambios morfofisiológicos del TGI. La manera de formular las dietas iniciadoras ha cambiado en las últimas décadas, pasando de dietas simples (dos ingredientes) a dietas más complejas, en las cuales el número de ingredientes es muy amplio.36 La dieta simple se formula estrictamente con productos vegetales, por ejemplo, cereales y pasta de soya. Las dietas complejas están compuestas por productos y subproductos lácteos, tales como: leche en polvo descremada, caseína y suero seco de leche; harinas de origen animal, al igual que una cantidad mínima de cereales y pasta de soya, con la finalidad de estimular el consumo de alimento y mantener la integridad intestinal.19 Al momento de realizar el cambio de una dieta compleja a una simple, el lechón ya ha superado el estrés del destete y ha ajustado su consumo de acuerdo con su capacidad física, de modo que su aparato digestivo se encuentra preparado para recibir mayores cantidades de almidón y de proteína de origen vegetal. La lactasa, que es la principal enzima intestinal para la digestión de carbohidratos en el periodo de lactancia, declina paulatinamente después del destete; en el caso de las enzimas maltasa y sacarasa el comportamiento es a la inversa, pues se expresan y se activan con el consumo del alimento sólido, que contiene almidones y sacarosa.1 De igual forma, la mucosa intestinal parece ser bastante sensible a la composición de las dietas. Un grupo de investigadores37 comparó dos tipos de dietas: una típica estadunidense, que contenía proteínas de origen animal y promotores de crecimiento (óxido de zinc, sulfato de cobre y antibióticos); y la otra, una dieta típica europea, a base de proteínas vegetales, sin promotores de crecimiento. Como resultado se encontró que el consumo de la dieta europea causó una reducción de alrededor de 20% en la altura de las vellosidades, y un aumento en la profundidad de la cripta, en comparación con los lechones alimentados con la dieta estadunidense, reduciéndose la superficie de absorción intestinal. Esto probablemente se originó por una reducción en la tasa de mitosis o al aumento en la tasa de apoptosis, o por ambos procesos.37 El desarrollo del páncreas también está directamente relacionado con el tipo de dieta que consuma el animal, ya que si los animales tienen acceso a alimentos ricos en proteínas, grasas o carbohidratos, este órgano tendrá que desarrollar sus funciones de acuerdo con dichos sustratos.31 Los principales componentes de la dieta que afectan el desarrollo del TGI son las fuentes de lactosa, los alimentos proteínicos y los cereales.31
Los ingredientes lácteos son fuente de lactosa y de proteína de alta calidad y son alimentos clave durante los primeros días posdestete, pues la recuperación de peso es más rápida, ya que su presencia en la dieta iniciadora hará que el cambio de alimentación sea menos brusco para el lechón, por el sabor y el valor nutritivo de estos productos, además de que su TGI está adaptado (secreciones enzimáticas, motilidad y absorción) a sus componentes desde el nacimiento.38 Un factor importante es la continuidad de la presencia de sustrato en el tracto gastrointestinal después del destete, y ésta tiene un efecto sobre la actividad de la enzima lactasa intestinal. La presencia de lactosa en la dieta, independientemente de la fuente (lactosa cristalina o suero de leche), incrementó la actividad de la lactasa (68%) y el peso del intestino delgado durante los primeros 14 días posdestete.34 Otra ventaja es que los subproductos lácteos poseen factores de crecimiento, que estimulan el desarrollo del TGI en los animales recién destetados.26
Fuentes de proteína. La cantidad, la fuente y la digestibilidad de la proteína dietaria determinan la disponibilidad de aminoácidos y péptidos en el lumen del intestino delgado, lo que puede influir en la recuperación de la morfología intestinal después del destete.39 Resultados de diferentes trabajos sugieren que la glutamina es un aminoácido que sirve como sustrato energético muy importante para los enterocitos.31 Lechones alimentados con dieta adicionadas con glutamina exógena presentaron vellosidades más altas y criptas más profundas en la primera semana después del destete, que cerdos que no recibieron glutamina.40
La calidad de la fuente de proteína incluida en la dieta para lechones tiene un papel importante en el desarrollo del TGI. Esa calidad depende en gran medida del origen de las fuentes proteínicas (animal o vegetal). Las fuentes proteínicas de origen animal se emplean con gran frecuencia en las dietas iniciadoras por su alto contenido de proteína, valor biológico y alta digestibilidad,41 así como por la ausencia de factores antinutrimentales; sin embargo, tiene un costo elevado. Hasta la aparición de la encefalitis espongiforme bovina, los ingredientes animales más utilizados tradicionalmente en las dietas de lechones destetados, se encontraban las harinas de sangre y de carne y el plasma sanguíneo (bovino), que mejoraban sustancialmente el consumo, el crecimiento y el índice de conversión, así como el estado inmunitario del animal. En la actualidad, estos ingredientes están prohibidos en varios países, y se utilizan en mayor escala los productos lácteos, el plasma porcino y la harina de pescado, cuyo mayor problema radica en la variabilidad de su calidad.26
Las fuentes proteínicas de origen vegetal, principalmente la pasta de soya, suelen resultar económicas y constituyen un mayor aporte de proteína durante las fases de crecimiento y finalización del cerdo. El excelente perfil de aminoácidos de la pasta de soya es muy reconocido, pero existe una variación en el valor nutrimental de sus distintas variedades,42 debido a factores como el nivel de proteína cruda y la cantidad y tipo de factores antinutrimentales. En la soya es relevante la presencia de ciertos componentes que suelen provocar problemas digestivos en los lechones, especialmente cuando no se procesa correctamente,43 por lo que su uso es limitado en la fase inicial de crianza. Entre los componentes antinutrimentales presentes en la pasta de soya se incluyen los factores inhibidores de proteasas (quimotripsina y tripsina), antivitaminas y lectinas.44 Algunas fracciones proteínicas (P–conglicinina y glicinina) pueden dañar las vellosidades intestinales, debido a un proceso de hipersensibilidad transitoria que ocurre en la mucosa intestinal y, consecuentemente, disminuyen la digestión de proteínas.45,46 Las lectinas son glicoproteínas resistentes a las enzimas digestivas proteolíticas y al ligarse a las moléculas de hidratos de carbono de las membranas de las células epiteliales de la mucosa intestinal pueden dañar las vellosidades intestinales; la toxicidad que causa depende de la magnitud de este enlace.44 Así, los factores antinutrimentales pueden causar la inhibición del crecimiento, disminución de la eficiencia alimentaria, hipertrofia pancreática, hipoglicemia y daño hepático en animales no ruminantes, en función de la especie, edad, tamaño, sexo, estado de salud y plano de alimentación.43 Las lesiones de la mucosa causadas por la pasta de soya pueden variar según el nivel de inclusión en las dietas,47 o la variedad utilizada. Para aumentar el valor nutrimental de la soya se han seleccionado variedades con una mayor concentración de proteína cruda o con una menor cantidad de inhibidores de tripsina y lectinas.43 Felizmente, muchos de los factores antinutrimentales son termolábiles y se destruyen durante la aplicación de tratamientos térmicos. Otros componentes no deseables en la soya, que no son eliminados con el procesamiento,48 son los oligosacáridos (estaquiosa y rafinosa); éstos representan de 4 a 6% de su materia seca y pueden causar flatulencia, diarrea y estrés a los animales no rumiantes, debido a su incapacidad para digerir estas sustancias, ya que no sintetizan la enzima a–1,6 galactosidasa, que es la responsable de su digestión, dejándolas como sustrato para los procesos fermentativos bacterianos en el tracto intestinal posterior, que alberga las bacterias anaerobias, y que pueden producir hidrógeno, dióxido de carbono y pequeñas cantidades de metano.49
Actualmente, existen variedades de soya que contienen de 70 a 90% menos oligosacáridos que la pasta de soya convencional. Por su uso se observa una mayor digestibilidad de la mayoría de los aminoácidos de la pasta de soya con menor nivel de oligosacáridos en relación con la convencional, y una digestibilidad de energía comparable a la pasta de soya convencional,50 por lo que probablemente la pasta de soya baja en oligosacáridos, tenga un menor impacto negativo en la integridad intestinal.
La industria de alimentos ha desarrollado otros subproductos de la soya con alto valor biológico, como es el caso de los concentrados y aislados de proteína de soya, éstos disminuyen la reacción de hipersensibilidad pasajera que se presenta al utilizar pasta de soya, lo que se manifiesta en un menor daño de las vellosidades intestinales, mayor digestibilidad de los nutrimentos y mejores ganancias de peso. Sin embargo, estos alimentos altamente digestibles no son estimuladores del crecimiento de las vellosidades intestinales.51
Otras fuentes de proteína vegetal también son evaluadas como posibles alternativas a la pasta de soya.
La inclusión de 10% de canola natural o canola peletizada en dietas que se consumieron durante 14 días después del destete no afectó la altura de las vellosidades intestinales.52 Comparándose dietas formuladas con pasta de soya o pasta de ajonjolí no se observaron diferencias en la morfología de las vellosidades o de las criptas intestinales después de un periodo de 25 días de consumo.53 En otro trabajo,54 lechones alimentados durante 22 días después del destete con dietas a base de pasta de soya o de ajonjolí no presentaron diferencias en el peso relativo de los órganos digestivos (Cuadro 1).
Cereales. Los cereales son los ingredientes presentes en mayor proporción en las dietas de iniciación (entre 50 y 70%), pero no están bien determinadas las consecuencias de su uso sobre la integridad intestinal.55 Según algunos autores,56 los taninos y los polisacáridos no amiláceos (fibra) de los cereales55–58 podrían afectar negativamente la estructura de la mucosa del intestino delgado.57 Sin embargo, otros autores35 no observaron diferencias significativas en el peso absoluto o relativo (g/kg de peso vivo) del intestino delgado o en la altura de las vellosidades y en la profundidad de las criptas intestinales entre animales que consumieron, en los primeros 14 días posdestete, dietas con maíz o sorgo (pobres en fibra) o con cebada (rica en fibra). El nivel de taninos de los sorgos incluidos en las dietas tampoco afectó la morfología de las vellosidades ni de las criptas intestinales (Cuadro 1).35–59
Otros ingredientes de la dieta. Para reducir el impacto del destete sobre el crecimiento y en la salud del lechón se adicionan a las dietas algunos ingredientes (alimentos funcionales) para atenuar o evitar problemas gastrointestinales, previniendo la proliferación de bacterias patógenas, mejorando la función digestiva y sustituyendo a los antibióticos. Los alimentos funcionales son compuestos que, ya sea que aporten, o no, nutrimentos, tienen efectos positivos en una o varias funciones del organismo y propician bienestar en los animales.60 Entre ellos destacan: los antibióticos, probióticos, prebióticos, simbióticos, extractos de plantas, ácidos orgánicos, antioxidantes, oligosacáridos no digestibles (FOS y MOS), lípidos estructurales, etc. Existe relativamente poca información sobre el efecto de la adición de estos alimentos a las dietas iniciadoras sobre el desarrollo del TGI y la mejoría observada en la salud intestinal de los lechones parece estar relacionada con la modificación de la microbiota y los productos de la fermentación que realizan. Algunos autores coinciden en que la utilización de aditivos probióticos o antimicrobianos no afecta la estructura intestinal. La inclusión de levaduras solas o adicionadas con ácido cítrico,61 o proteína de papa (Solanum tuberosum L. cv. Golden valley) y ciertos extractos de plantas,62–63 en dietas para lechones, no provocó un efecto positivo en la altura de las vellosidades intestinales. Sin embargo, el uso de prebióticos, como los quitooligosacáridos, adicionados a dietas posdestete durante 21 días, incrementó la altura de las vellosidades de yeyuno e íleon.64 Los ácidos orgánicos son compuestos que se utilizan como aditivos en las dietas para prevenir diarreas, al controlar la proliferación de bacterias indeseables en el TGI.65 Algunos datos sugieren que la complementación de una fórmula láctea con butirato de sodio puede contribuir a un mayor desarrollo de la mucosa intestinal en lechones neonatales.66 La acción protectora de los ácidos orgánicos puede ser de gran valor cuando el cambio de leche a la dieta iniciadora es abrupto. El uso de butirato en dietas de iniciación incrementó el espesor de la mucosa gástrica, así como el número de células parietales por glándula gástrica y de células neuroendocrinas, lo que probablemente esté relacionado con su acción en la maduración de las mucosas y diferenciación celular.67
Influencia de la fermentación microbiana en el TGI
El tubo digestivo en el momento del nacimiento es estéril, pues en condiciones no patológicas, los lechones se encuentran exentos de microorganismos en el útero de la cerda. Pasadas algunas horas después del nacimiento, ya se encuentran colonias de bacterias procedentes de la propia cerda (fundamentalmente a partir de las heces y del canal del parto), o bien del ambiente de la maternidad, de tal manera que, a las 12 horas de vida, ya se detecta en las heces de los lechones una cifra de 108–109 bacterias/g de heces. Estas bacterias buscan el nicho más adecuado, donde compiten e interactúan entre sí, constituyendo finalmente una población relativamente estable y compleja que representa a la flora intestinal saprófita. Después de la colonización microbiana inicial en los animales recién nacidos, el número de las poblaciones bacterianas del TGI permanecen bastante estables durante el periodo de lactancia, pero pueden ocurrir cambios cualitativos.68 Sin embargo, el consumo de alimento sólido causa una mayor alteración tanto cualitativa como cuantitativa en la flora, aumentando las bacterias anaeróbicas estrictas, como los Bacteroides y disminuyendo concomitantemente los microorganismos facultativos. Por lo tanto, el proceso de destete puede dejar a los animales jóvenes vulnerables a la presencia de microorganismos potencialmente patógenos.69 Los nutrimentos no digeridos y no absorbidos, presentes en la luz intestinal, sirven de sustrato para las bacterias enteropatógenas, propiciando su proliferación70 y conduciendo al animal a cuadros diarreicos.
A pesar de que la digestión enzimática y el proceso de absorción son muy efectivos en el intestino delgado, existe un constante aporte de nutrimentos al intestino grueso proveniente de componentes dietarios no digeridos, enzimas endógenas y células del epitelio intestinal descamadas. Las enzimas microbianas facilitan la utilización de los alimentos no digeridos como el almidón resistente y los polisacáridos no almiláceos.71 Las bacterias del colon metabolizan los carbohidratos disponibles generadores de energía para su crecimiento y mantenimiento (incluyendo motilidad, síntesis de enzimas, mantenimiento del gradiente iónico y osmótico y transporte activo).69
En los animales no rumiantes la fermentación ocurre de forma más intensa en el intestino grueso, principalmente por el mayor tiempo de tránsito en este tramo del TGI. Mientras que el tiempo que tarda en pasar el contenido intestinal a lo largo del intestino delgado es solamente de dos a cuatro horas en el ser humano, en el intestino grueso el contenido intestinal tarda entre veinte y ochenta horas; esto quiere decir que hay mucho tiempo para el desarrollo y la actividad de la microflora.69,71 La cantidad y la composición de las sustancias que llegan al intestino grueso pueden modificarse fácilmente en función de la dieta, siendo la fracción más importante la de los carbohidratos resistentes a la digestión en el intestino delgado. Es probable que los carbohidratos puedan estimular el crecimiento de ciertos microorganismos, los cuales producen ácidos grasos volátiles (AGV) y utilizan amoniaco (NH3) como su fuente de nitrógeno. Algunos compuestos específicos pueden tener efectos más precisos en especies bacterianas particulares; por ejemplo, se sabe que substancias tales como la manosa72 y la galactosa,73 bloquean la adherencia de cepas patógenas de E. coli.
La fermentación anaeróbica de los carbohidratos ha sido resumida mediante la siguiente ecuación general:74
57.5 C6H12O6 + 45 H2O → 65 acetato + 20 propionato + 15 n–butirato + 140 H2 + 95 CO2 + 288 ATP
El colon absorbe rápidamente los AGV formados, conservando la energía y reduciendo la presión osmótica. Los AGV, especialmente el ácido butírico, son un combustible importante para los colonocitos. Todos los AGV son absorbidos, pero solamente el ácido acético aparece en la circulación sistémica, vía hepática, en cantidades considerables, llegando a los músculos en donde puede ser metabolizado; el ácido butírico se metaboliza en los colonocitos. Así, la fermentación microbiana en el TGI repercute en la salud intestinal del animal hospedero,75 pues los AGV formados durante la fermentación de los carbohidratos son importantes para el mantenimiento de la integridad morfológica y funcional del epitelio del colon.
Como las fuentes de carbohidratos (almidones y otros carbohidratos fermentables) se van reduciendo debido a la fermentación en el intestino grueso, el nitrógeno (N) en el ciego disminuye y la fermentación se vuelve más proteolítica.76 Por lo tanto, algunos de los AGV intestinales pueden provenir de polipéptidos, los cuales, aparentemente, son la principal fuente de la mayoría de los AGV ramificados (isobutírico, valérico e isovalérico), los cuales se forman a partir del metabolismo de los aminoácidos ramificados, como valina, leucina e isoleucina.77 Una fermentación proteolítica también puede conducir a la formación de metabolitos potencialmente tóxicos, como NH3, aminas, fenoles volátiles e indoles,77–79 los cuales se encuentran en pequeñas cantidades en un colon saludable,80 pero en elevadas cantidades en procesos patológicos, lo que genera los cuadros diarreicos.75 De hecho, la desaminación de los aminoácidos tanto de la proteína endógena como de la dietaria, es la principal fuente de NH3 en el colon.81 El NH3 generado en el colon pasa a través de la pared intestinal, ganando acceso a otros tejidos del cuerpo. El NH3 puede afectar el desarrollo de la mucosa intestinal82 y se ha determinado que está negativamente correlacionado con la altura de las vellosidades intestinales. El NH3 absorbido debe ser excretado en forma de urea, con un costo de energía de 7% del total del gasto energético, tanto en animales no rumiantes como en rumiantes.83 Los niveles subagudos de NH3 pueden influir en el metabolismo del huésped y resultar en una disminución en el rendimiento del animal.76 Las aminas generadas por los microbios pueden alterar el nivel de ácido y bicarbonato agregado por parte de la mucosa intestinal y la velocidad de tránsito a través del intestino. Sin embargo, la presencia de carbohidratos fermentables estimula el crecimiento microbiano. Ello conlleva a un aumento en la demanda de aminoácidos por parte de los microorganismos,84 como está indicado a travésde la reducción del catabolismo de las proteínas en el intestino grueso y, consecuentemente, habrá menores concentraciones de NH3 y excreción de nitrógeno uri–nario.85 Por lo tanto, la producción de compuestos potencialmente perjudiciales, como el escatol derivado del catabolismo del triptófano a, sería menos probable con la presencia de fuentes de carbohidratos. De manera similar, existe evidencia de que la excreción de N en forma de urea a través de la orina puede ser desplazada por la excreción de N como proteína bacteriana en las heces por medio de la inclusión de compuestos fibrosos en la dieta.86
Conclusiones
La ontogénesis del tracto gastrointestinal de los lechones depende de diferentes factores fisiológicos, ambientales y nutrimentales. Las diferentes fases del aparato digestivo parecen estar adaptadas a las necesidades del animal para nutrirse y protegerse de los patógenos que amenazan constantemente su supervivencia, debido a la inmadurez de sus funciones digestivas e inmunológicas. La nutrición intrauterina está bajo la responsabilidad de la madre, lo que no requiere de un mayor desarrollo de las estructuras digestivas. Después del nacimiento, el sistema digestivo pasa por un periodo de intenso desarrollo, pero los órganos digestivos están morfofisiológicamente adaptados a la alimentación láctea (calostro y leche), permitiendo un alto desempeño de los animales durante la fase de lactación. El destete es un periodo durante el cual se interrumpe bruscamente la armonía alcanzada en la lactancia y, el aparato digestivo, sufre un revés en su desarrollo durante la primera semana posdestete, ocasionando un periodo de subnutrición transitoria en el lechón. Tras un nuevo periodo de adaptación a la nueva alimentación y al nuevo ambiente, éste recupera el ritmo de desarrollo de todos sus sistemas vitales, principalmente del sistema digestivo. En este proceso, la cantidad de alimento que se proporciona al cerdo recién destetado y las materias primas que componen su alimento, desempeñan un papel importante en la maduración del tracto gastrointestinal.
Referencias
1. CRANWELL PD. Development of the neonatal gut and enzyme systems. In: VARLEY MA, editor. Wallingford UK: CAB International, 1995: 99–154. [ Links ]
2. ZABIELSKI R, LE HUËRON–LURON I, GUILLOTEAU P. Development of gastrointestinal and pancreatic functions in mammalians (mainly bovine and porcine species): influence of age and ingested food. Reprod Nutr Dev 1999; 39:5–26. [ Links ]
3. DIRKZWAGER A, VELDMAN B, BIKKER P. A nutritional approach for the prevention of Post Weaning Syndrome in piglets. Anim Res 2005; 54:231–236. [ Links ]
4. LE DIVIDICH J, SÈVE B. Effects of underfeeding during the weaning period on growth, metabolism, and hormonal adjustments in the piglet. Domest Anim Endocrinol 2000; 19:63–74. [ Links ]
5. QUINIOU N, NOBLET J. Prediction of tissular body composition from protein and lipid deposition in growing pigs. J Anim Sci 1995; 73: 1567–1575. [ Links ]
6. NYACHOTI CM, DE LANGE CFM, SCHULZE H. Estimating endogenous amino acid flows at the terminal ileum and true ileal amino acid digestibilities in feedstuffs for growing pigs using the homoarginine method. J Anim Sci 1997; 75: 3206–3213. [ Links ]
7. DROZDOWSKI LA, CLANDININ T, THOMSON ABR. Ontogeny, growth and development of the small intestine: Understanding pediatric gastroenterology. World J Gastroenterol 2010; 16: 787–799. [ Links ]
8. KOONG LJ, NIENABER JA, MERSMANN J. Effects of plane of nutrition on organ size and fasting heat production in genetically obese and lean pigs. J Nutr 1983; 113: 1626–1631. [ Links ]
9. BIKKER P, VERSTEGEN MWA, KEMPS B, BOSH MW. Performance and body composition of finishing gilts (45 to 85 kilograms) as affected by energy intake and nutrition in earlier life: I. Growth of the body and components. J Anim Sci 1996; 74: 806–816. [ Links ]
10. LINDEMAN MD, CORNELIUS SG, EL KANDELGY SM, MOSER RL. Effect of Age, Weaning and diet on digestive enzyme levels in the piglet. J Anim Sci 1986; 62:1298–1307. [ Links ]
11. SANGILD PT. Biology of the pancreas before birth. In: PIERZYNOWSKI SG AND ZABIELSKI, editors. Biology of the pancreas in growing animals. Amsterdan, The Netherlands. Elsevier Science BV, 1999:1–13. [ Links ]
12. SEVE B. Elévage et sevrage des porcelets. In: PÉREZ JM, MORNET P, RÉRAT A, editors. Le porc et son élevage, bases scientifiques et techniques. France: Editorial Maloine, 1986: 403. [ Links ]
13. CERA KR, MAHAN DC, CROSS RF, REINHART GA, WHITMOYER RE. Effect of age, weaning and postweaning diet on small intestinal growth and jejunal morphology in young swine. J Anim Sci 1988; 66:574–584. [ Links ]
14. MOUGHAM PJ, BIRTLES MJ, CRANWELL PD, SMITH WC, PEDRAZA M. The piglet as a model for studing aspects of digestion and absorption in milk–fed human infants. World Rev Nutr Diet 1992; 67:40–113. [ Links ]
15. XU RJ, TUNGTHANATHANICH P, BIRTLES MJ, REYNOLDS GW, SIMPSON HV. Growth and morphological changes in the small and large intestine in piglets during the first three days after birth. J Dev Physiol 1992; 18:161–172. [ Links ]
16. VAN DIJKAJ, MARGRY CF, VAN DER LEE AG, HEMKE G, BEYNEN AC. Growth performance and Health status in weanling piglets fed spray–dried proccine plasma under typical Northen european conditions. J Anim Physiol Anim Nutr 2002; 86:17–25. [ Links ]
17. JENSEN MS, JENSEN SK, JAKOBSEN K. Development of digestive enzymes in pigs with emphasis on lypolitic activity in the stomach and pancreas. J Anim Sci 1997 75:437–445. [ Links ]
18. LALLÈS JP, BOUNDRY G, FAVIER C, LE FLOC'H N, LURON I, MONTAGNE L et al. Gut function and dysfunction in young pigs: physiology. Anim Res 2004; 53:301–316. [ Links ]
19. PLUSKE JR, WILLIAMS IH, AHERNE FX. Nutrition of the neonatal pig. In: VARLEY MA, editor. The neonatal pig: development and survival. Wallingford, UK: CAB International, 1995:187–235. [ Links ]
20. FOWLER WR. The nutrition of weaned pigs. Pigs News Info 1980, 1:11. [ Links ]
21. MAKKINK CA, BERNTSEN PJM, OP DEN KAMP BML, KEMP B, VERSTEGEN WA. Gastric protein breakdown and pancreatic enzyme activities in response to two different dietary protein sources in newly weaned pigs. J Anim Sci 1994; 72:2843–2850. [ Links ]
22. LALLÈS JP, TOULLEC R. Digestion des proteins vègètales et hypersensibilitè digestive chez le veau prèrumiant. INRA. Prod Anim 1996; 9:255–264. [ Links ]
23. HAMPSON D. Alterations in the pig small intestinal structure at weaning. Res Vet Sci 1986; 40:32–40. [ Links ]
24. MILLER BG, JAMES PS, SMITH MW, BOURNE FJ. Effect of weaning on the capacity of pig intestinal villi to digest and absorb nutrients. J Agric Sci Camb 1986; 107:579–589. [ Links ]
25. KELLY D, SMYTH JA, MCCRACKEN KJ. Digestive development of the early–weaned pig. 2. Effect of level of food intake on digestive enzyme activity during the immediate post–weaning period. Br J Nutr 1991; 65:181–188. [ Links ]
26. KELLY D, KING TP. Digestive physiology and development pigs. In: VARLEY MA, WISEMAN J, editors. The weaner pig, nutrition and Management, 2001: 179–206. [ Links ]
27. AGUILERA BA, SOUZA RTC, MARISCAL LG, JUÁREZ GY. Desarrollo de los órganos digestivos hasta la cuarta semana posdestete en lechones alimentados con subproductos lácteos. Memorias del XI Congreso de la AMENA y I del CLANA; 2003 agosto 18–23; Cancún, Quintana Roo, México. Querétaro, Querétaro: Cuarón JA, Cortez M, Fernández D., Labandero E, Pérez VG, Quintana M, editores, 2003:335–336. [ Links ]
28. ESCOBAR GK, REIS DE SOUZA TC, GUERRERO MJC, MARISCAL LG, AGUILERA BA, BERNAL MGS. Morfología del intestino delgado de lechones destetados alimentados con diferentes fuentes de proteína. Memorias del III Congreso CLANA; 2008 Noviembre 18–21; Cancún, Quintana Roo, México. CELIS A, GARCÍA M, editores, 2008:513–516. [ Links ]
29. OWSLEY WF, ORR DE, TRIBBLE LF. Effects of age and diet on the development of the pancreas and synthesis and secretion of pancreatic secretions in the young pig. J Anim Sci 1986; 63: 497–504. [ Links ]
30. EFIRD RC, ARMSTRONG WD, HERMAN DL. The development of digestive capacity in the young pigs: effect of weaning regimen and dietary treatment. J Anim Sci 1982; 55: 1371–1379. [ Links ]
31. PLUSKE JR, HAMPSON DJ, WILLIAM IH. Factors influencing the structure and function of the small intestine in the weaning pig: a review. Livest Prod Sci 1997; 51: 215–236. [ Links ]
32. XIANHONG G, DEFA L, RUIPING S. Effect of weaning on small intestinal structure and function in the piglet. Arch Anim Nutr 2002; 56:275–286. [ Links ]
33. HAMPSON DJ, KIDDER DE. Influence of creep feeding and weaning on brush border enzyme activities in the piglet small intestine. Res Vet Sci 1986; 40:24–31. [ Links ]
34. REIS DE SOUZA TC, MARISCAL LG, AGUILERA BA. Empleo de dos fuentes de lactosa en la dieta de lechones y sus efectos en el aparato digestivo. Tec Pec Méx 2002; 40:299–308. [ Links ]
35. REIS DE SOUZA TC, GUERRERO MJC, AGUILERA BA, MARISCAL LG. Efecto de diferentes cereales sobre la morfología intestinal de lechones recién destetados. Tec Pec Méx 2005; 43:309:321. [ Links ]
36. MEDEL P, LATORRE MA, MATEOS GG. Nutrición y alimentación de lechones destetados precozmente. En: REBOLLAR PG, DE BLAS C, MATEOS GG, editores. XV Curso de especialización avances en nutrición y alimentación animal. Madrid, España: Fundación Española para el Desarrollo de la Nutrición Animal, 1999:145–196. [ Links ]
37. PIVA A, GRILLI E, FABBRI L, PIZZAMIGLIO V, GATTA PP, GALVANO F et al. Intestinal metabolism of weaned piglets fed a typical United States or European diet with or without supplementation of tributyrin and lactitol. J Anim Sci 2008; 86:2952–2961. [ Links ]
38. ZIJLSTRA RT, WHANG KY, EASTER RA, ODLE J. Effect of feeding a milk replacer to early–weaned pigs on growth, body composition, and small intestinal morphology, compared with suckled littermates. J Anim Sci 1996; 74:2948–2959. [ Links ]
39. VENTE–SPREEUWENBERG MAM, VERDONK JMAJ, KOENINKX JFJG, BEYNEN AC, VERSTEGEN MWA. Dietary protein hydrolysates vs. intact proteins do not enhance mucosal integrity and growth performance in weaned piglets. Liv Prod Sci 2004; 85:151–164. [ Links ]
40. WU G, MEIER SA, KNABE DA. Dietary glutamine supplementation prevents jejunal atrophy in weaned pigs. J Nutr 1996; 126:2578–2584. [ Links ]
41. HANSENJA, NELSSENJL, GOODBAND RD, WEEDEN TL. Evaluation of animal protein supplements in diets of early–weaned pigs. J Anim Sci 1993; 71:1853–1862. [ Links ]
42. SMIRICKY MR, GRIESHOP CM, ALBIN DM, WUBBEN JE, GABERT VM, FAHEY GC Jr. The influence of soy oligosaccharides on apparent and true ileal amino acid digestibilities and fecal consistency in growing pigs. J Anim Sci 2002; 80:2433–2441. [ Links ]
43. PALACIOS MF, EASTER RA, SOLTWEDEL KT, PARSONS CM, DOUGLAS MW, HYMOWITZ T et al. Effect of soybean variety and processing on growth performance of young chicks and pigs. J Anim Sci 2004; 82:1108–1114. [ Links ]
44. LIENER IE. Factors affecting the nutritional quality of soya products. J Am Oil Chem Soc 1981; 58:406–415. [ Links ]
45. LI DF, NELSSEN JL, REDDY PG, BLECHA F, HANCOCK JD, ALLEE GL et al. Transient hypersensitivity to soybean meal in the early–weaned pig. J Anim Sci 1990; 68:1790–1799. [ Links ]
46. FRIESEN KG, NELSSEN JL, GOODBAND RD, BEHNKE KC, KATS LJ. The effect of pre and postweaning exposure to soybean meal on growth performance and on the immune response in the early–weaned pig. J Anim Sci 1993; 71:2089–2098. [ Links ]
47. DUNSFORD BR, KNABE DA, HAENSLY WE. Effect of dietary soybean meal on the microscopic anatomy of the small intestine in the early weaned pigs. J Anim Sci 1989; 67:1855–1863. [ Links ]
48. LESKE KL, JEVNE CJ, COON CN. Effect of oligosaccharide additions on nitrogen–corrected true metabolizable energy of soy protein concentrate. Poult Sci 1993; 72:664–668. [ Links ]
49. CUMMINGS JH, ENGLYST HN. Gastrointestinal effects of food carbohydrate. Am J Clin Nutr 1995; 61(suppl):938S–945S. [ Links ]
50. BAKER KM, STEIN HH. Amino acid digestibility and concentration of digestible and metabolizable energy in varieties of soybeans and fed to growing pigs soybean meal produced from conventional, high–protein, or low–oligosaccharide. J Anim Sci 2009; 87:2282–2290. [ Links ]
51. REIS DE SOUZA TC, AGUILERA MAB, AGUILERA AB, MARISCAL GL, CARRILLO MJG. Digestive tract morphology of piglets fed diets with isolated or concentrate soy protein. Arch Latinoam Prod Anim 2007; 15:134–140. [ Links ]
52. REIS STC, GUERRERO CMJ, MARISCAL LG, AGUILERA BA. Integridad intestinal en lechones alimentados con dietas complementadas con pasta de canola. XII Congreso Nacional AMENA; 2005 octubre 25–28; Puerto Vallarta, Jalisco, México. Querétaro, Querétaro: AMENA, 2005:1–2. [ Links ]
53. ESCOBAR GK, REIS DE SOUZA TC, GUERRERO MJC, MARISCAL LG, AGUILERA BA, BERNAL MGS. Morfología del intestino delgado de lechones destetados alimentados con diferentes fuentes de proteína. Memorias del III Congreso CLANA; 2008 Noviembre 18–21; Cancún, Quintana Roo, México. Celis A, García M, editores, 2008: 2008:513–516. [ Links ]
54. REIS TC, AGUILERA BA, MARISCAL LG, BALDERRAMA PVN, BERNAL SMG, ESCOBAR GK et al. Efecto de las pastas de ajonjolí y soya de sobre el tracto digestivo de lechones destetados. XLVI Reuniones Nacionales de Investigación e Innovación Agroalimentaria y Forestal en México; 2010 Noviembre 22–27; Campeche, Campeche, México. Guadalajara, Jalisco, México: Editores Prometeo SA de CV, 2010:249. [ Links ]
55. RIOPÉREZ J, SÁNCHEZ CP, CASTAÑO M. Estudio histopatológico del íleon de lechones precozmente destetados dependiente del cereal utilizado en su alimentación. Arch Zootec 1991; 40:261–271. [ Links ]
56. SALGADO P, FREIRE LPB, MOURATO M, CABRAL F, TOULLEC R, LALLÈS JP. Comparative effects of different legume protein sources in weaning piglets: Nutrient digestibility, intestinal morphology and digestive enzymes. Liv Prod Sci 2002; 74:191–202. [ Links ]
57. BEDFORD MR, CAMPBELL LD. Enzymes application for monogastric feeds a review. Can J Anim Sci 1992; 72:449–466. [ Links ]
58. COWAN WD, KORSBAKA, HASTRUP T, RASMUSSEN PB. Influence of added microbial enzymes on energy and protein availability of selected feed ingredients. Anim Feed Sci Technol 1996; 60:311–319. [ Links ]
59. GÓMEZ–SOTO JG, REIS DE SOUZA TC, MARISCAL–LANDÍN G, AGUILERA–BARREYRO A, MONTEMAYOR HM. Efecto del nivel de taninos del sorgo sobre la morfofisiología digestiva en lechones destetados. XLVI Reuniones Nacionales de Investigación e Innovación Agroalimentaria y Forestal en México; 2010 Noviembre 22–27; Campeche, Campeche, México. Guadalajara, Jalisco, México: Editores Prometeo SA de CV, 2010:247. [ Links ]
60. FIGUEROA VJL, CHI MEE, CERVANTES RM, DOMINGUEZ VIA. Functional foods for weanling pigs. Vet Méx 2006; 37:117–136. [ Links ]
61. WHITE LA, NEWMAN MC, CROMWELL GL, LINDEMANN MD. Brewers dried yeast as a source of mannan oligosaccharides for weanling pigs. J Anim Sci 2002; 80:2619–2628. [ Links ]
62. JIN Z, YANG YX, CHOI JY, SHINDE PL, YOON SY, HAHNB TW et al. Effects of potato (Solanum tuberosum L. cv. Golden valley) protein having antimicrobial activity on the growth performance, and intestinal microflora and morphology in weanling pigs. Anim Feed Sci Tech 2008; 140:139–154. [ Links ]
63. MANZANILLA EG, PÉREZ JF, MARTÍN M, BLANDÓN JC, BAUCELLS F, KAMEL C et al. Dietary protein modifies effect of plant extracts in the intestinal ecosystem of the pig at weaning. J Anim Sci 2009; 87:2029–2037. [ Links ]
64. LIU P, PIAO XS, KIM SW, WANG L, SHEN YB, LEE HS et al. Effects of chito–oligosaccharide supplementation on the growth performance, nutrient digestibility, intestinal morphology, and fecal shedding of Escherichia coli and Lactobacillus in weaning pigs. J Anim Sci 2008; 86: 2609–2618. [ Links ]
65. MAVROMICHALIS I, PATON F. Nuevos ingredientes en la alimentación de cerdos. XX Curso de Especialización FEDNA: Avances en Nutrición y Alimentación Animal. En: REBOLLAR PG, DE BLAS C, MATEOS GG, editores. Fira de Barcelona, España: Fundación Española para el Desarrollo de la Nutrición Animal, 2004:125–147. [ Links ]
66. KOTUNIA A, WOLIÑSKIJ, LAUBITZ D,JURKOWSKA M, ROMÉ V, GUILLOTEAU P et al. Effect of sodium butyrate on the small intestine development in neonatal piglets feed by artificial sow. J Physiol Pharm 2004; 55:59–68. [ Links ]
67. MAZZONI M, LE GALL M, DE FILIPPI S, MINIERI L, TREVISI P, WOLINSKI J et al. Supplemental Sodium Butyrate Stimulates Different Gastric Cells in Weaned Pigs. J Nutr 2008; 138: 1426–1431. [ Links ]
68. SNEL J, HARMSEN HJM, VAN DER WIELEN PWJJ, WILLIAMS BA. 2. Dietary strategies to influence the gastro–intestinal microflora of young animals, and its potential to improve intestinal health. In: BLOK MC, VAHL H A, DE LANGE L, VAN DE BRAAK AE, HEMKE G, HESSING M, editors. Nutrition and health of the gastrointestinal tract. Wageningen, The Netherlands: Wageningen Academic publishers, 2006:37–60. [ Links ]
69. WILLIAMS BA, VERSTEGEN MWA, TAMMINGA S. Fermentation in the large intestine of single–stomached animals and its relationship to animal health. Nutr Res Rev 2001; 14:207–227. [ Links ]
70. MCCRACKEN KJ, KELLY D. Development of digestive function and nutrition/disease interactions in the weaned pig. In: FARRELL DJ, editor. Recent advances in animal nutrition in Australia. Armidale: Department of Biochemistry, Microbiology and Nutrition, University of New England, 1993:182–192. [ Links ]
71. BUGAUT M. Occurrence, absorption and metabolism of short chain fatty acids in the digestive tract of mammals. Comp Biochem Physiol 1987; 86B, 439–472. [ Links ]
72. OFEK I, MIRELMAN D, SHARON N, Adherence of Escherichia coli to human mucosal cells mediated by mannose receptors. Nature 1977; 265:623–625. [ Links ]
73. MATHEW AG, SUTTON AL, SCHEIDT AB, PATTERSON JA, KELLY DT, MEYERHOLZ KA. Effect of galactan on selected microbial populations and pH and volatile fatty acids in the ileum of the weanling pig, J Anim Sci 1993; 71:1503–1509. [ Links ]
74. EWING WN, COLE DJA. The Living Gut: An Introduction to Micro–organisms in Nutrition. Dungannon, Ireland: Context: 1994:220. [ Links ]
75. REIS DE SOUZA TC, MARISCAL LANDÍN G, ESCOBAR GARCÍA K. Algunos factores fisiológicos y nutricionales que afectan la incidencia de diarreas posdestete en lechones. Vet Méx 2010; 41:275–288. [ Links ]
76. PIVA A, PANCIROLI A, MEOLA E, FORMIGONI A. Lactitol enhances short–chain fatty acid and gas production by swine microflora to a greater extent when fermenting low rather than high fibre diets. J Nutr 1995; 126: 280–289. [ Links ]
77. MACFARLANE GT, GIBSON GR, BEATTY E, CUMMINGS JH. Estimation of short–chain fatty acid production from protein by human intestinal bacteria based on branched–chain fatty acid measurements, FEMS Microbiol Ecol 1992; 101:81–88. [ Links ]
78. YOKOYAMA MT, TABORI C, MILLER ER, HOGBERG MG. The effects of antibiotic in the weanling pig diet on growth and the excretion of volatile phenolic and aromatic bacterial metabolites. Am J of Cl Nutr 1982; 35:1417–1424. [ Links ]
79. RUSSELL JB, SNIFFEN CJ, VAN SOEST PJ. Effect of carbohydrate limitation on degradation and utilization of casein by mixed rumen bacteria. J Dairy Sci 1983; 66:763–775. [ Links ]
80. RASMUSSEN HS, HOLTUG K, MORTENSEN PB. Degradation of amino to short–chain fatty acids in humans. Scand J Gastroenterol 1988; 23:178–182. [ Links ]
81. WRONG OM, VINCE AJ. Urea and ammonia metabolism in the human large intestine. Proc Nutr Soc 1984; 43:77–86. [ Links ]
82. VISEK WJ. Ammonia: its effects on biological systems, metabolic hormones, and reproduction. J Dairy Sci 1984; 67:481–498. [ Links ]
83. EISEMANN JH, NIENABER JA. Tissue and whole body oxygen uptake in fed and fasted steers. Br J Nutr 1990; 64:399–411. [ Links ]
84. HAWE SM, WALKER N, MOSS BW. The effects of dietary fibre, lactose and antibiotic on the levels of skatole and indole in faeces and subcutaneous fat in growing pigs. Anim Prod 1991; 54:413–419. [ Links ]
85. MISIR S, SAUER WC. Effect of starch infusion at the terminal ileum on N balance and apparent digestibilities of nitrogen and amino acids in pigs fed meat–and–bone and soybean meal diets. J Anim Sci 1982; 55:599–607. [ Links ]
86. KIRCHGESSNER M, KREUZER M, MACHMÜLLER A, ROTH–MAIER DA. Evidence for a high efficiency of bacterial protein synthesis in the digestive tract of adult sows fed supplements of fibrous feedstuffs. Anim Feed Sci Tech 1993; 46:293–306. [ Links ]














