Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Veterinaria México
versão impressa ISSN 0301-5092
Vet. Méx vol.42 no.3 Ciudad de México Jul./Set. 2011
Artículos científicos
Bioequivalencia de dos formulaciones de amoxicilina–ácido clavulánico para uso oral en perros
Bioequivalence of two amoxicillin–potassium clavulanate oral preparations in dogs
Sayuri Hayashida* Lilia Gutiérrez* Jorge Luna del Villar** Fernando Osnaya*** Héctor Sumano*
* Departamento de Fisiología y Farmacología, Facultad de Medicina Veterinaria y Zootecnia. Universidad Nacional Autónoma de México. Av. Universidad 3000, Coyoacán, 04510, México, D.F.
** Departamento de Clínica y Cirugía en Pequeñas Especies, Facultad de Medicina Veterinaria y Zootecnia. Universidad Nacional Autónoma de México. Av. Universidad 3000, Coyoacán, 04510, México, D.F.
*** Departamento de Ciencias Pecuarias, Facultad de Estudios Superiores Cuautitlán, Universidad Nacional Autónoma de México, km 2.5 Carretera Cuautitlán–Teoloyucan, San Sebastián Xhala, 54714, Cuautitlán Izcalli, Estado de México.
Autor responsable de correspondencia:
Dr. Héctor Sumano, Tel.: + 52 55 56–22–59–80,
Fax: + 52 55 56–22–59–80,
Correo electrónico: sumano@servidor.unam.mx
Recibido el 27 de julio de 2010.
Aceptado el 19 de mayo de 2011.
Abstract
The aim of this trial was to carry out a bioequivalence (BE) study in dogs using a generic preparation of amoxicillin–potassium clavulanate vs a commercially available reference preparation, both claiming to achieve plasma concentrations that allow a 12 h dosing interval after oral administration. The oral pharmacokinetic profiles of a single dose of each preparation were carried out in 12 adult mongrel dogs in a crossover model with a 10 day washout period at a dose of 12.5 mg/kg of trihydrate amoxicillin and potassium clavulanate as tablets. A composite determination of amoxicillin–potassium clavulanate concentration in each sample of plasma was carried out in triplicate, using a microbiological agar diffusion analysis. Pharmacokinetic analysis was carried out with a non–compartmental model. Statistical analysis of pharmacokinetic variables was carried out by ANOVA and Bonferroni t test, setting a P < 0.05. In accordance with international standards, it was found that the generic preparation failed to be bioequivalent, i.e: AUC0–∞ 9.08 ± 0.26 μg h/ml and Cmax 5.48 ± 0.19 μg/ml for the generic preparation vs AUC0–∞ 13.28 ± 0. 30 μg h/ml and Cmax 2.9 ± 0.17 μg/ml for the reference one. A 0.25 μg/ml breakpoint can be set as minimum effective plasma concentration for amoxicillin; hence the generic preparation requires a dose interval of eight h.
Key words: Amoxicillin, clavulanate acid, β–Lactam, dogs, pharmacokinetics, tablets.
Resumen
El objetivo de este trabajo fue determinar la bioequivalencia entre dos preparados comerciales de amoxicilina–ácido clavulánico disponibles en forma de tableta para uso oral en perros, y cuyo intervalo de dosificación indicado por los fabricantes es de 12 horas. Se calculó el perfil farmacocinético de cada preparado, a una dosis oral de 12.5 mg/kg de amoxicilina y ácido clavulánico en doce perros adultos mediante un modelo cruzado. Se determinó la concentración activa de la combinación de ambos fármacos en cada muestra de plasma, utilizando un método de análisis microbiológico por difusión en agar. El cálculo farmacocinético se llevó a cabo con un modelo no compartamental y los valores obtenidos se analizaron mediante un ANDEVA y prueba T de Bonferroni, con una P < 0.05. Tomando en cuenta las pautas internacionales, la formulación genérica resultó no ser bioequivalente a la de referencia. Esto es, se obtuvieron valores de AUC0–∞ 9.08 ± 0.26 μg h/ml y Cmax 5.48 ± 0.19 μg/ml para el genérico vs AUC0–∞ 13.28 ± 0. 30 μg h/ml y Cmax 2.9 ± 0.17 μg/ml para el de referencia. Si se considera un punto de inflexión para bacterias susceptibles, de 0.25 μg/ml, el preparado genérico requiere un intervalo de dosificación de ocho horas.
Palabras clave: Amoxicilina, ácido clavulánico, beta–lactámicos, perros, farmacocinética, tabletas.
Introducción
En la actualidad los antibióticos β–lactámicos son utilizados con frecuencia en la clínica de pequeñas especies. Especialmente se recurre a la amoxicilina (AMX) para tratar algunas infecciones respiratorias, urinarias y de piel.1 Una estrategia para mitigar el desarrollo de cepas bacterianas resistentes a la amoxicilina consiste en administrarla en combinación con ácido clavulánico (en su forma estable, clavulanato de potasio [PC]). Éste forma complejos que inactivan de forma irreversible las β–lactamasas producidas por bacterias, por medio de enlaces covalentes.2–4 En numerosas especies, incluyendo humanos, la AMX y el PC tienen un comportamiento farmacocinético similar, es decir, vida media de eliminación (T1/2β) = 1.27 ± 0.20 h; 1.03 ± 0.1 h, respectivamente. Tiempo en el que se alcanza la concentración plasmática máxima (Tmax) = 1.50 h y 1.03 h para AMX y PC respectivamente,5 lo que demuestra que representan una combinación congruente farmacocinéticamente adecuada contra una gran variedad de cepas bacterianas.6
Durante algún tiempo, las formulaciones convencionales de AMX/PC se administraban en humanos a una dosis de 500/125 mg, tres veces por día.7 Posteriormente se introdujeron preparaciones indicadas para su administración cada 12 horas con gran éxito en el mercado. En el caso del área veterinaria, una formulación comercialmente disponible para perros* está indicada por el fabricante para ser administrada dos veces al día a una dosis de 12.5 mg/kg. A pesar de que la compañía farmacéutica no lo específica, dicho intervalo de dosificación implica que se trata de un sistema de liberación modificada, que hace posible el intervalo de dosificación dicho. Luego de una amplia búsqueda en la literatura formal, a través de bases de datos digitales (Agricola, MedLine, VETCD, Agris, y otras) no se encontraron estudios que describan la farmacocinética oral de preparados de AMX/PC de larga acción en perros, como ocurre en humanos.5,8 A pesar de que sí existen estudios farmacocinéticos de tabletas convencionales.6,7
Por otro lado, es importante destacar que se ha observado una notable disminución en la capacidad de absorción de la AMX en las partes distales del tubo gastrointestinal (TGI)9 y es probable que esta característica también se presente en perros. Sin embargo, las diferencias entre humanos y perros en cuanto al tiempo de vaciamiento gástrico, tránsito gastrointestinal y variación del pH en los diferentes segmentos,10,11 podría causar modificaciones de gran importancia en la tasa de absorción de ambos fármacos. Como consecuencia, la simple extrapolación de una formulación de AMX/PC de larga acción utilizada en humanos, podría no producir en perros los mismos perfiles favorables que se obtienen en plasma con estos antibióticos considerados tiempo–dependientes.5 Con frecuencia, los clínicos de pequeñas especies eligen una marca de preparados de AMX/PC con base en consideraciones de costo, sin tomar en cuenta criterios de intercambiabilidad y bioequivalencia, requisito que aún no se exige en algunos países. En México, por ejemplo, a la fecha de realización de este trabajo, los estudios de bioequivalencia todavía no eran obligatorios para registrar un medicamento, por lo que la clasificación de genérico no era real en muchos casos, como se observa también en otros países en desarrollo.
Por lo antes mencionado, el objetivo de este estudio es definir la concentración plasmática de las fracciones activas de AMX/PC del preparado de referencia* y comparar los datos obtenidos en un estudio de bioequivalencia, contra un preparado genérico, ambos indicados dos veces al día en perros.
Material y métodos
Este trabajo se llevó a cabo bajo los lineamientos de la Norma Oficial Mexicana NOM–062–ZOO–1999, dentro de las instalaciones del Departamento de Fisiología y Farmacología de la Facultad de Medicina Veterinaria y Zootecnia de la Universidad Nacional Autónoma de México. El análisis farmacocinético se realizó después de una dosis oral (PO) de 12.5 mg/kg de AMX y PC (en una proporción de 4:1) en doce perros mestizos, mediante un modelo cruzado (6 × 6). Las formulaciones comerciales se obtuvieron directamente de un distribuidor, esto es, el grupo de referencia (GR) con Clavamox® y el grupo genérico (GG) con un preparado cuyo fabricante no autorizó que se revelara el nombre comercial, pero sí es una especialidad farmacéutica comercializada en México.
La administración oral de cada preparado se llevó a cabo utilizando una pieza de aproximadamente 5 g de salchicha comercial para ocultar las tabletas en su interior. Se utilizaron doce perros mestizos clínicamente sanos cuya edad osciló entre los 3 y 9 años (7 machos y 5 hembras) y cuyo peso promedio fue de 17.3 ± 1.8 kg. Los animales fueron desparasitados con un producto comercial de ivermectina–prazicuantel** y se les alimentó con una fórmula seca para adultos*** ad limitum, y durante 15 días se les permitió adaptarse a su nuevo entorno en jaulas individuales de 2 × 3 m, con acceso libre a agua fresca y alimento. El estudio se diseñó como un modelo cruzado (6 × 6) con un periodo de depuración de 10 días.
Con la finalidad de disminuir las variaciones de la tasa de absorción, todos los animales fueron privados de alimento desde ocho horas antes y hasta una hora después de la dosificación. Se pesó a cada perro antes de la dosificación y se ajustaron las tabletas comerciales de 250 mg de AMX/PC al peso de cada perro, utilizando una navaja para raspar el excedente. La dosis establecida fue de 12.5 mg/kg de AMX y PC, como lo recomienda el fabricante del producto de referencia.
En la vena cefálica de cada perro se colocó un catéter heparinizado núm. 20,**** de 3 pulgadas y se les colocó un collar isabelino para evitar que se retiraran el catéter. Se obtuvieron 3 ml de sangre en los siguientes tiempos de muestreo pos–administración: 0.16, 0.25, 0.5, 0.75, 1, 1.5, 2, 2.5, 3, 4, 5, 6, 8, 10 y 12 h. Las muestras de sangre se centrifugaron inmediatamente a 3000 g, se recolectó el plasma de cada tubo, se identificaron y se congelaron en nitrógeno líquido durante 5 días, hasta su análisis. La concentración/actividad de AMX/PC se determinó en cada muestra de plasma por triplicado, utilizando el análisis cuantitativo/cualitativo de difusión en agar, descrito por Bennett et al.,12 el cual mide la concentración en términos de la actividad antibacteriana in vitro del fármaco o combinación. Se utilizó una cepa sensible de Bacillus subtilis como microorganismo de referencia, a una concentración de 5 × 105 ufc/ml en agar Müeller–Hinton,***** enriquecido con 0.1 ml de plasma de perro como muestra estándar.
El porcentaje de recuperación logrado con esta técnica fue de 98 ± 2.5%. El límite de cuantificación fue de 0.07 yig/ml, que correspode a un halo de inhibición de 9.9 mm de diámetro, y se midió con un calibrador electrónico. Este valor corresponde al límite inferior de la línea de calibración, cuyo coeficiente de correlación de la solución estándar de AMX/PC (4:1) fue de 0.98, calculado mediante regresión linear con el programa Origin Pro 8 (OriginLab Corporation Northampton, MA 01060). Los coeficientes de variación inter e intra–ensayo fueron de 5 y 6%, respectivamente. Los datos se expresan como la media ± 1 desviación estándar. El análisis farmacocinético se llevó a cabo como un modelo no–compartamental, utilizando el programa WinNonlin (Pharsight Corporation, Mountain View CA 94041). El área bajo la curva concentración vs tiempo (AUC0–∞) se calculó utilizando la regla trapezoidal lineal. Los valores de la concentración plasmática máxima (Cmax), tiempo de residencia media (MRT) y Tmax se obtuvieron directamente del programa. La biodisponibilidad relativa (Fr) se calculó a partir de la fórmula: AUC0–∞GG/ AUC0–∞RG x 100. Los datos se expresan como la media ± desviación estándar de doce observaciones por variable y el estadístico de las variables farmacocinéticas se llevó a cabo por medio de un análisis de varianza (ANDEVA) y prueba de t de Bonferroni, utilizando el programa de cómputo JMP (JMP Statistic Mode Visual 1989–1995 SAS Institute Inc. Version 3.1.6.2, SAS Campus Drive Cary, N.C. 27513) con una probabilidad establecida en P < 0.05.
Los límites para declarar bioequivalencia en productos veterinarios establecidos por los estándares internacionales determinan que la bioequivalencia existe si bajo las mismas condiciones experimentales, los valores medios de las diferencias de AUC y Cmax de ambos productos, permanecen entre 0.8 – 1.25, con un intervalo de confidencialidad de 90%.13–15
Resultados
En la Figura 1 se presentan los valores promedio de la concentración activa (referido aquí como concentración) de AMX y PC vs tiempo, después de la administración oral de 12.5 mg/kg de AMX y PC a partir del preparado de referencia y del genérico. En el Cuadro 1 se muestran los valores promedio ± 1 desviación estándar de las variables farmacocinéticas obtenidas, y las diferencias estadísticamente significativas entre ellas.
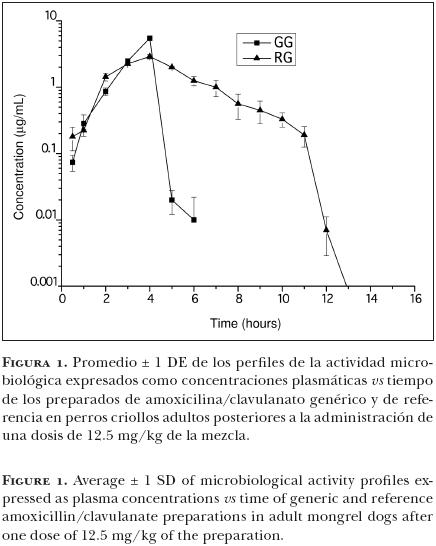
Los perfiles plasmáticos de AMX/PC después de la administración oral de los preparados, mostraron una actividad antimicrobial combinada máxima, después de cuatro horas en la formulación genérica, y 2.9 h en la de referencia. No obstante, después de las cuatro horas se observó un fuerte declive en la concentración del preparado genérico, mientras que en el de referencia se percibe una caída más suave. Los valores de AUC fueron estadísticamente diferentes con un valor mayor para el preparado de referencia (P < 0.05).
Discusión
Se considera viable el método microbiológico de difusión en agar para determinar las concentraciones plasmáticas de la acción conjunta de AMX y PC, si las muestras de plasma se mantienen congeladas en nitrógeno líquido antes de ser procesadas en un lapso de no más de cuatro semanas para evitar su degradación. No obstante, es evidente que los valores numéricos obtenidos en este estudio pueden diferir de otros análisis en los que se utilizaron métodos cromatográficos, dado que en este estudio se determinó la concentración en función de la actividad antimicrobiana compuesta de la AMX y PC. La actividad antimicrobiana del PC es nula por sí sola, pero su actividad conjunta con AMX puede generar datos de concentración plasmática de AMX que difieren de los encontrados cromatográficamente. Sin embargo, ya que este método sólo cuantiica la fracción o fracciones activas del fármaco o combinación de fármacos, revela una imagen clara de las propiedades antimicrobianas de la combinación en el contexto de su perfil farmacocinético conjunto. Considerando lo anterior y el hecho de que los valores de la variación inter e intra–ensayo obtenidos en este estudio fueron notablemente bajos, puede concluirse que los resultados conseguidos son confiables y repetibles. Tomando como base este hecho y los criterios establecidos por la Agencia Europea de Medicamentos ( EMEA), para determinar cuándo dos productos farmacéuticos son bioequivalentes o no,13–15 es factible afirmar que la preparación genérica probada no es bioequivalente al preparado de referencia. Este es, por sí mismo, un resultado importante desde el punto de vista de farmacovigilancia y, de igual manera, un hallazgo potencialmente útil para los clínicos de pequeñas especies cuando se evalúan los resultados clínicos. Los valores medios de AUC0–∞ y Cmax del preparado genérico fueron 31.6% más bajos y 52.9% más altos que los valores correspondientes al preparado de referencia (AUC0–co = 13.28 hr·μg/ml y Cmax = 2.9 ug/ ml para el preparado de referencia y AuC0–∞= 9.08 ± 0.26 y Cmax = 5.48 ± 0.21 μg/ml para el preparado genérico).
Las diferencias observadas permiten algunas consideraciones, por ejemplo, el comportamiento farmaco–cinético de la amoxicilina y los factores que modulan su perfil concentración vs tiempo son esenciales para obtener una eficacia clínica máxima considerando su relación farmacocinética/farmacodinámica (PK/PD). Esto es, la acción conjunta de AMX/PC expresada como concentración, debe mantenerse en el plasma por arriba de la concentración mínima inhibitoria (CMI), por lo menos durante 50% del intervalo de dosificación, ya que existe evidencia para β–lactámicos, de que el máximo efecto clínico se alcanza cuando las concentraciones plasmáticas se mantienen arriba del nivel de la CMI durante 70% del intervalo de dosificación.16 Esta no es una meta sencilla, si se considera que la T½β de estos fármacos en las formulaciones convencionales es muy corta, por ejemplo; la AMX de acuerdo con Arancibia et al.,17 tiene una T½β de aproximadamente una hora en humanos; Marier et al.18 registran lo mismo en perros. Además, la absorción de la AMX se ve limitada a los primeros segmentos del TGI. 9 Por lo tanto, las formulaciones de AMX/ PC deben ser capaces de liberar los principios activos en las partes proximales del TGI, sin ser arrastrados distalmente por los movimientos peristálticos. De este modo, la absorción se llevará a cabo en el estómago y particularmente en el duodeno.8 Sin embargo, si el total del antibiótico es liberado hacia el duodeno en un corto periodo, el pH alcalino de ese medio inactivará la mayor parte de la AMX disponible,19 además, si esto no ocurriera, se sabe que la AMX tiene una absorción saturable, mediada por transportadores proteínicos específicos para la AMX, y aparentemente específicos para las aminopenicilinas, denominados PepT1, que se expresan en el borde de cepillo de los enterocitos en el intestino delgado,20,21 y sólo se puede absorber una parte de la AMX que llega al duodeno.
Uno de los problemas más críticos que reducen la tasa de absorción de la AMX a partir de las formulaciones de larga acción, es el tránsito del alimento por el TGI. Se ha demostrado que bajo condiciones de ayuno, las formulaciones de AMX/PC son desalojadas del estómago mucho más rápido que si se administran al inicio de una comida rica en carbohidratos.22 Considerando las peculiaridades que presenta la absorción de AMX/PC en el TGI, no resulta aventurado señalar que la interacción de los fármacos con vehículos adecuados es esencial para obtener formulaciones con mayores capacidades gastro–retentivas que logren liberar pequeñas fracciones de los principios activos de forma prolongada para ser absorbidos por el estómago y sobre todo por el duodeno,8 a in de lograr perfiles farmacocinéticos más acordes con la farmacodinamia de esta combinación.
Si la CMI se establece en < 0.25 μg/ml, basándose en los valores estándares para el punto de inflexión establecidos por el Clinical and Laboratory Standards Institute–CLSI (antes NCCLS)23 para cepas bacterianas patógenas causantes de infecciones respiratorias y cutáneas en perros,24–26 entonces la concentración mínima efectiva (CME) de 2–4 veces el valor para la amoxicilina será de 0.5 μg/ml.27,28 De forma ideal, esta CME debería mantenerse por lo menos durante 50–70% del intervalo de dosificación.16 Bajo tal perspectiva, la formulación genérica necesitaría ser administrada tres veces al día, mientras que el preparado de referencia se podría administrar cada 12 horas, dado que alcanza concentraciones plasmáticas con actividad antimicrobiana durante dicho intervalo de dosificación. Sin embargo, para tratar microorganismos menos susceptibles, se requieren concentraciones plasmáticas más altas para cumplir con la relación óptima PK/PD, es decir, dos veces el valor de CMI previa (0.5 μg/ml).28 En esos casos, los resultados obtenidos sugieren que la simple estrategia de incrementar la dosis no es suficiente para lograr las concentraciones requeridas, como fue observado en estudios previos por Vree et al.,7 quienes definieron la farmacocinética de dos formulaciones comerciales de AMX/PC en perros, a 25 mg/kg. Esos autores no especifican si se utilizaron formulaciones de larga acción en sus estudios, sin embargo, a partir de sus resultados, es posible distinguir que no se obtuvieron concentraciones plasmáticas útiles más allá de las ocho horas. Un perfil farmacocinético similar fue descrito por Bywater et al.6 con una T > MIC (0.25 μg/ml) de seis a ocho horas aproximadamente, después de la admnistración de 12.5 mg/kg AMX/PC de una formulación convencional para perros. Aparentemente, todas esas formulaciones y el preparado genérico que se utilizó en este estudio no son bioequivalentes al preparado de referencia aquí usado, y únicamente podrían proveer concentraciones plasmáticas adecuadas si son administrados cada ocho horas. Si dicha indicación se establece para el cumplimiento de la relación PK/PD esperada, es posible que se obtengan concentraciones plasmáticas más altas que las que se obtienen con el preparado de referencia, administrado cada 12 horas.
Finalmente, es importante hacer hincapié en que la ausencia de bioequivalencia entre la preparación genérica y la de referencia no necesariamente significa que la primera no sea efectiva, siempre y cuando su intervalo de dosificación se ajuste hasta lograr una relación PK/PD más apropiada.
Referencias
1. FRANCIS ME, MARSHALL AB, TURNER WT. Amoxicillin: clinical trials in dogs and cats. Vet Rec 1978; 102: 377–380. [ Links ]
2. RICHMOND MH, SYKES RB. The β–lactamases of gram–negative bacteria and their possible physiologic role. In: ROSE AH, TEMPEST DW, editors. Advances in Microbial physiology. Vol 9. London: Academic Press, 1973: 31–38. [ Links ]
3. BROWN AG, BUTTERWORTH D, COLE M, HANSCOMB G, HOOD JD, READING C et al. Naturally– occurring B lactamase inhibitors with antibacterial activity. J Antibiot 1976; 29: 668–669. [ Links ]
4. READING C, COLE M. Clavulanic acid: A β–lactamase–inhibiting β–lactam from Streptomyces clavuligerus. Antimicrob Agents Chemother 1977; 11: 852–857. [ Links ]
5. KAYE CM, ALLEN A, PERRY S, MCDONAGH M, DAVY M, STORM K et al. The Clinical Pharmacokinetics of a new pharmacokinetically enhaced formulation of amoxicillin/clavulanate. Clin Ther 2001; 23: 578–584. [ Links ]
6. BYWATER RJ, PALMER GH, BUSWELL JF, STANTON A. Clavulanate– potentiated amoxicillin: Activity in vitro and bioavailability in the dog. Vet Rec 1985; 116: 33–36. [ Links ]
7. VREE TB, DAMMERS E, VAN DUURE E. Variable absorption of clavulanic acid after an oral dose of 25 mg/kg of ClavubactinTM and SynuloxTM in healthy dogs. J Vet Pharmacol Ther 2003; 26: 165–171. [ Links ]
8. KERC J, OPARA J. A new amoxicillin/clavulanate therapeutic system: Preparation, in vitro and pharmaco–kinetic evaluation. Int J Pharm 2007; 335: 106–113. [ Links ]
9. BARR WH, ZOLA EM, CANDLER EL, HWANG SM, TENDOLKAR AV, SHAMBUREK R et al. Differential absorption of amoxicillin from the human small and large intestine. Clin Pharmacol Ther 1994; 56: 279–285. [ Links ]
10. OGATA H, AOYAGI N. Bioavailability of nalidixic acid from uncoated tablets in humans and in vitro dissolution rates. Int J Clin Pharmacol Toxicol Ther 1984; 22: 240–245. [ Links ]
11. LUI CY, AMIDON GM, BERARDI RR, FLEISHER D, YOUNGBERG C. Comparison of gastrointestinal pH in dogs and humans: implications on the use of the beagle dogs as a model for oral absorption in humans. J Pharm Sci 1986; 75: 271–274. [ Links ]
12. BENNETT JV, BRODIE JL, BRENNER EJ, KIRBY J. Simplified accurate method for antibiotic assay of clinical specimens. Appl Microbiol 1966; 14: 170 – 177. [ Links ]
13. EUROPEAN MEDICINES AGENCY. Committee for veterinary medicinal products: Guidelines for the Conduct of Bioequivalence studies for Veterinary Medicinal Products. London: EMA, 2001. [ Links ]
14. RIVIERE JE. Unique problems associated with the determination of veterinary drug preparation bioequivalence. J Vet Pharmacol Ther 1994; 17: 86–88. [ Links ]
15. STEINIJANS V, HAUSCHKE D, JONKMAN G. Controversies in bioequivalence studies. Clin Pharmacokinet 1992; 22: 247–253. [ Links ]
16. CRAIG WA. Pharmacokinetic/Pharmacodynamic parameters: Rationale for Antibacterial Dosing of mice and men. Clin Infect Dis 1998; 26:1–12. [ Links ]
17. ARANCIBIA A, GUTTMANN J, GONZALEZ G, GONZALEZ C. Absorption and disposition kinetics of amoxicillin in normal human subjects. Antimicrob Agents Chemother 1980; 17: 199–202. [ Links ]
18. MARIER JF, BEAUDRY F, DUCHARME MP, FORTIN D, MOREAU JP, MASSÉ R et al. A pharmacokinetic study of amoxicillin in febrile beagle dogs following repeated administrations of endotoxin. J Vet Pharmacol Ther 2001; 24: 379–383. [ Links ]
19. ZIA H, SHALCHIAN N, BORHANIAN F. Kinetics of amoxicillin degradation in aqueous solution. Can J Pharmacol Sci 1977; 12:80–83. [ Links ]
20. WESTPHAL JF, DESLANDES A, BROGARD JM, CARBON C. Reappraisal of amoxicillin absorption kinetics. J Antimicrob Chemother 1991; 27:647–654. [ Links ]
21. LI M, ANDERSON GD, PHILLIPS BR, KONG W, SHEN DD, WANG J. Interactions of amoxicillin and cefaclor with human renal organic anion and peptide transporters. Drug Metab Dispos 2006; 34: 547–555. [ Links ]
22. WEITSCHIES W, FRIEDRICH C, WEDEMEYER RS, SCHMIDTMANN M, KOSCH O, KINZIG M et al. Bioavailability of amoxicillin and clavulanic acid from extended release tablets depends on intragastric tablet deposition and gastric emptying. Eur J Pharm Biopharm 2008; 2:641–648. [ Links ]
23. CLINICAL AND LABORATORY STANDARDS INSTITUTE. Performance Standards for Antimicrobial Disk and Dilution Susceptibility Tests for Bacteria Isolated From Animals. Approved Standard. 2nd ed. Wayne PA: NCCLS document M31–A, 2004. [ Links ]
24. GANIERE JP, MEDAILLE C, MANGION C. Antimicrobial Drug susceptibility of Staphylococcus intermedius Clinical Isolates from canine Pyoderma. J Vet Med 2005; 52: 25–31. [ Links ]
25. PAPICH MC. Susceptibility testing in animals–How breakpoints are derived and interpretation of susceptibility data. Proceeding of 15th AAVPT Biennial Symposium; 2007 May 20–24; Pacific Grove, California. [Serial online: 2007 May] [Cited: 2010 December 13]. Available from: http://www.ivis.org/proceedings/aavpt/2007/papich.pdf [ Links ]
26. ROYJ, MESSIER S, LABRECQUE O, COX WR. Clinical and in vitro eficacy of amoxicillin against bacteria associated with feline skin wounds and abscesses. Can Vet J 2007; 48: 607–611. [ Links ]
27. GOODMAN LS, GILMAN A. The Pharmacological basis of Therapeutics. 2nd ed. New York: Macmillan, 1956. [ Links ]
28. AMBROSE PGJ, OWENS RC, GRASELA D. Antimicrobial pharmacodynamics. Med Clin North Am 2000; 84: 1431–1446. [ Links ]
* ClavamoxTM, Pfizer Animal Health.
** Pet–Gard® Cpmax Pharmaceuticals, México.
*** Pedigree® Mars Incorporated, México.
**** Becton Dickinson®, México.
***** Merck, México.














