Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Veterinaria México
Print version ISSN 0301-5092
Vet. Méx vol.42 n.2 Ciudad de México Apr./Jun. 2011
Nota de investigación
Empleo de una tinción rápida para el diagnóstico de microsporidiosis
Using a quick dye for the diagnosis of microsporidiosis
Luis Edgar Rodríguez Tovar* Heidi Giselle Rodríguez Ramírez* Yazel Valdez Nava* Alicia Magdalena Nevárez Garza* Rafael Ramírez Romero*
* Departamento de Patología, Facultad de Medicina Veterinaria y Zootecnia, Universidad Autónoma de Nuevo León. Av. Francisco Villa s/n, Ex Hacienda el Canadá, Campus de Ciencias Agropecuarias, 66050, General Escobedo, Nuevo León, México.
Correspondencia:
Rafael Ramírez Romero.
Teléfono: (81)13404390 Ext. 3612,
Correo electrónico: raramirez@prodigy.net.mx
Recibido el 1 de marzo de 2010.
Aceptado el 20 de septiembre de 2010.
Abstract
Cystic–like structures similar to xenomas containing ovoid or piriform organisms were observed in brain and kidney of a one–month–old rabbit. Different dyes such as H&E, PAS, toluidine blue and trichrome blue were tested. Trichrome blue yielded the best results in terms of specificity, resolution and confirmation of microsporidia spores. This dye is easily adaptable to paraffin–embedded samples by not requiring additional equipment; it is rapid, cheap and could be used as a confirmatory technique for other microsporidiosis.
Key words: Trichrome blue, rabbit, Encephalitozoon cuniculi, H&E, PAS.
Resumen
Se observaron estructuras quísticas similares a xenomas con organismos ovoides o piriformes en encéfalo y riñón de un conejo de un mes de edad. Se probaron diferentes tinciones, como HE, PAS, azul de toluidina y azul de tricromo. El azul de tricromo proporcionó los mejores resultados en cuanto a especificidad, resolución y confirmación de esporas de microsporidios. Este colorante es fácilmente adaptable a cortes desparafinados por no requerir de equipo adicional; es rápido, económico y podría utilizarse como técnica confirmatoria para otras microsporidiosis.
Palabras clave: Azul de tricromo, conejo, Encephalitozoon cuniculi, H&E, PAS.
Introducción
La encefalitozoonosis es una enfermedad parasitaria ocasionada por el microsporidio Encephalitozoon spp, que es un agente intracelular obligatorio generador de esporas. Este microorganismo se encuentra ampliamente distribuido en el mundo y tiene una gran variedad de huéspedes, entre los que se encuentran los roedores silvestres y de laboratorio, carnívoros y rumiantes; sin embargo, este parásito afecta principalmente a conejos.1 Actualmente, E. cuniculi es considerado como un patógeno común de conejos y roedores, causa desde una ligera a una moderada infección crónica sin presentación de signos clínicos, aunque puede cursar con una fuerte afección del sistema nervioso central (encéfalo) y riñón, en donde ocasiona grave meningoencefalitis granulomatosa y nefritis intersticial, respectivamente.1 Se ha sugerido que esta importante respuesta granulomatosa se debe a un componente estructural de la pared celular de las esporas, formado principalmente de quitina. No obstante, este microsporidio también puede afectar otros órganos y tejidos, como el ojo y el hígado. Existe una variedad de métodos que han sido registrados en la literatura para la detección de este parásito en conejos con sospecha de la enfermedad. Entre los métodos más utilizados están los inmunológicos (ELISA, IFA) o moleculares (PCR), realizados en muestras coprológicas.1 Las pruebas inmunológicas detectan solamente la presencia de anticuerpos (Ac) en casos de encefalitozoonosis crónica,2 pero no confirman al microorganismo como el agente causal de la enfermedad.3 La detección del microsporidio por medios moleculares parece ser un método sensible para confirmar la presencia del parásito en secreciones y fluidos corporales en seres humanos, pero este método no ha sido suficientemente evaluado para la detección de E. cuniculi en conejos con sospecha de encefalitozoonosis. Actualmente, el método estándar más comúnmente utilizado para confirmar la infección de encefalitozoonosis en conejos es a través de la detección de las lesiones típicas de esta enfermedad en secciones tisulares teñidas con HE, PAS y azul de toluidina.3 No obstante, la identificación histopatológica de las esporas por medio de estas tinciones resulta algunas veces difícil de interpretar, debido a que la fuerte inflamación granulomatosa enmascara la presencia de este pequeño parásito (1um x 2 um) en el sitio de la lesión. En contraste, la presencia de las esporas también pudiera pasar desapercibida en casos de mínima respuesta inflamatoria. Recientemente se ha sugerido emplear inmunohistoquímica (IHQ) o fluorocromos (calcoflúor, uvitex, fungiqual) para la detección de las esporas de microsporidia;3 sin embargo, estas técnicas requieren de equipo y personal especializado y resultan costosas para casos individuales. En este trabajo, se propone un método de tinción específico para la quitina de la espora de este parásito mediante el empleo de azul de tricromo. Este colorante identifica fácilmente las esporas de microsporidia, es rápido, económico, compatible con tejidos embebidos en parafina y ayudaría a confirmar el diagnóstico inicial de esta infección en conejos.
Se remitió al Departamento de Patología Diagnóstica (Facultad de Medicina Veterinaria y Zootecnia, Universidad Autónoma de Nuevo León), el cadáver de un conejo hembra, criolla, de aproximadamente un mes de edad y con un peso aproximado de 300 g. El animal fue adquirido en una tienda de mascotas de Monterrey, NL y se mostraba sin aparente alteración de su estado de salud. A los seis días de su compra, el animal murió súbitamente. Debido a lo anterior, se decidió realizar la necropsia. Cabe mencionar que el animal no recibió ningún tratamiento previo, ni se le practicó ningún examen de patología clínica.
Macroscópicamente, se reconoció congestión y hepa–tomegalia; además, varias estrías irregulares de color blanquecino de 2–5 cm de largo que se extendían hacia el interior del parénquima hepático. Se confirma en el estudio microscópico que estas lesiones correspondían a zonas de necrosis asociados con migración parasitaria. Los pulmones se apreciaron congestionados y edematosos, con discretas adherencias de fibrina. Otros órganos, como el bazo y vísceras huecas, se observaron congestionados sin mayores cambios.
Microscópicamente, en el hígado se apreciaron extensas zonas coalescentes de necrosis caseosa, limitada parcialmente por tejido conectivo fibroso e infiltradas en su periferia por linfocitos, heterófilos y células gigantes. En pulmón se reconoció engrosamiento de septos alveolares asociado con congestión, edema e infiltración de linfocitos y heterófilos; además, algunas zonas de necrosis coagulativa adyacentes a vasos sanguíneos e infiltradas por macrófagos y heterófilos. En el riñón se apreciaron focos de infiltración de linfocitos y heterófilos en el intersticio; en el interior del epitelio tubular había numerosos quistes repletos de numerosas estructuras alargadas de 1–2 um de largo por 1um de ancho aproximadamente (Figura 1). La presencia de los quistes, cuya morfología concordaba con la descrita para los "xenomas", hacía que muchas células mostraran un citoplasma agrandado y protruido con lisis y liberación de los organismos hacia el lumen tubular ocupado por detritus. La presencia de los microorganismos en el xenoma era intracelular bien definida y en su mayoría no mostraba respuesta inflamatoria adyacente. En el cerebro se observaron algunos focos de reacción glial y discreta infiltración linfoide perivascular. Al revisar con mayor aumento (100X) las zonas, se observaron formaciones quísticas similares a las encontradas en riñón. En su mayoría los xenomas no mostraban respuesta inflamatoria adyacente. No se observaron otros cambios importantes en los demás órganos. Con base en lo anterior, se estableció un diagnóstico etiológico presuntivo de microsporidiosis, por lo que se realizaron cortes adicionales de riñón y de encéfalo para su tinción con PAS, azul de toluidina y azul de tricromo.
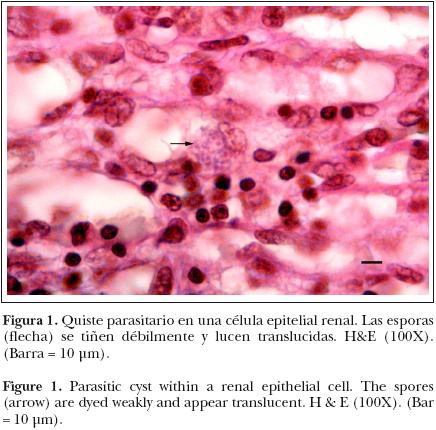
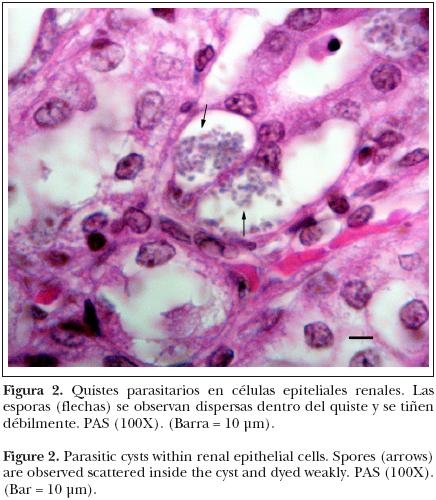
La tinción de PAS y azul de toluidina en riñón y cerebro demostraron una reacción débilmente positiva de los elementos que formaban los quistes, si bien se reconocieron con mayor facilidad que con HE (Figuras 2 y 3).

Las muestras desparafinadas colocadas en portaobjetos se sumergieron en metanol absoluto por 10 minutos para su fijación. Posteriormente, en la tinción de azul de tricromo modificado* (Volu–Sol, Inc.) durante 90 minutos. Se hizo una rápida inmersión de las muestras en alcohol–ácido (90% etanol y 10% ácido acético) y dos lavados en alcohol etílico al 95%, cada uno de 5 minutos. Después, las muestras se sumergieron en alcohol etílico al 100% por 10 minutos y luego en xileno durante 10 minutos. Por último, los frotis se dejaron secar al aire, montados con resina sintética y cubiertos con un portaobjetos.
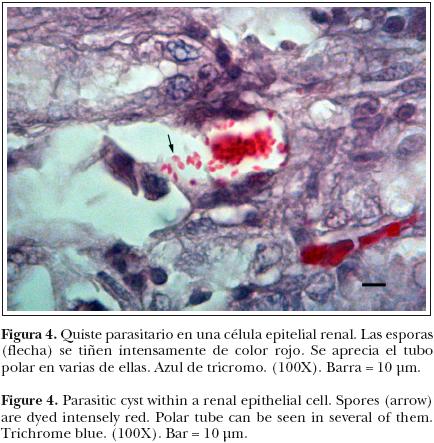
La tinción con azul de tricromo demostró, tanto en encéfalo como en riñón, la presencia de xenomas con esporas ovales en su interior, las cuales se tiñeron de un color rojo a un rojo–rosado, que era más intenso en uno de los polos (polaroplasto) y con una clara vacuola en el extremo opuesto. Asimismo, se observó en algunas esporas la característica línea diagonal o ecuatorial (tubo polar), lo que permitió fácilmente diferenciar a estos parásitos de bacterias u hongos y confirmar el diagnóstico definitivo de microsporidiosis (Figura 4).
Se observaron las siguientes lesiones: en hígado, una hepatitis piogranulomatosa crónica, multifocal coalescente; en riñón, nefritis intersticial, discreta, subaguda a crónica y multifocal; en cerebro, encefalitis linfocitaria con focos de reacción glial, moderada, crónica y multifocal, y en pulmón, una neumonía intersticial con focos de necrosis en parénquima, moderada, aguda y difusa.
Tanto en riñón como en cerebro, se consideró a Encephalitozoon cuniculi como causa de las lesiones. Las lesiones en pulmón no se asociaron categóricamente con este agente, pero se consideró su probable participación. Las lesiones hepáticas se consideraron como resultado de la migración de parásitos, probablemente nematodos.
En este trabajo, la confirmación definitiva de microsporidiosis se estableció con la determinación de las distintivas características de las esporas teñidas con azul de tricromo: coloración rojo a rojo–rosado, presencia de un polaroplasto, de una vacuola clara y de un tubo polar, así como también uniformidad en el tamaño de las esporas (2 um de largo por 1 um de diámetro). En base a lo anterior y a la presencia de xenomas con esporas tanto en el encéfalo como en las células epiteliales del riñón del conejo, se sugirió un diagnóstico etiológico de Encephalitozoon cuniculi.4–6
La posible fuente de transmisión del microsporidio en el conejo del presente caso no pudo ser establecida; sin embargo, la escasa edad del animal (1 mes) podría indicar una posible transmisión in utero.7–9
El diagnóstico de microsporidiosis por medio de histopatología ha sido difícil por diferentes razones, entre las más importantes están: el tamaño tan pequeño de estos parásitos, su forma de espora que lo hace fácilmente confundible con esporas de hongos, su distribución algunas veces en empalizada, por lo cual se les confunde con bacterias u otros artefactos,10 como se observó en el presente caso, especialmente en las muestras de encéfalo y riñón teñidas con HE, PAS y azul de toluidina. Además, se ha informado que las esporas poseen propiedades de coloración variable de acuerdo con su estado de desarrollo y pueden producir una respuesta inflamatoria mínima en el huésped, lo cual puede pasar desapercibido.11 En este trabajo, esta situación se observó en riñón y en encéfalo.
ELISA, IFA, PCR y fluorocromos son las pruebas más comúnmente recomendadas y utilizadas en investigación y en laboratorios de diagnóstico.12 A pesar de su confiabilidad para el diagnóstico de microsporidiosis, estas técnicas presentan algunas desventajas entre las que se puede mencionar el uso de equipo costoso y especializado.13
Uno de los métodos que ha resultado sumamente útil para el diagnóstico de microsporidiosis es el estudio histopatológico de especímenes sospechosos de encefalitozoonosis.14 Aun cuando técnicas más sofisticadas tienden a suplir lentamente a la tradicional microscopía de luz, es precisamente esta metodología la que permite un estudio claro sobre la secuencia de eventos que suceden en el proceso inflamatorio contra este parásito, así como la identificación de sus diferentes estados de desarrollo.15 Incluso, sin la orientación de la microscopía de luz, el análisis del desarrollo ultraestructural del parásito (microscopía electrónica de transmisión) no podría llevarse a cabo.16
En el presente estudio se utilizaron varias técnicas de tinción sugeridas en la literatura para la identificación de encefalitozoonosis en cortes de tejido fijados en formol y embebidos en parafina. La tinción rutinaria con HE es de las más usadas en los laboratorios de histopatología; sin embargo, la sensibilidad de este método depende de la experiencia del patólogo. Los parásitos no son fáciles de identificar, ya que aparecen como grupos de estructuras intracelulares refráctiles de difícil definición. La misma situación ocurrió con las tinciones de PAS y azul de toluidina, con las que se observó falta de especificidad para distinguir las esporas, y concuerda con lo registrado por otros investigadores.14
Recientemente se ha sugerido el empleo de azul de tricromo para la detección específica de esporas de microsporidiosis en muestras provenientes de fluidos corporales, tales como orina, esputo y excremento de animales y personas sospechosas de encefalitozoonosis y otras microsporidiosis intestinales.17,18 Sin embargo, su empleo en muestras de tejido fijadas con formalina e incluidas en parafina es escaso y solamente se ha utilizado en análisis oculares.18 Los resultados del presente trabajo sugieren que la tinción con azul de tricromo constituye una gran mejora en los procedimientos para la detección de microsporidia en tejidos incluidos en parafina. Los puntos esenciales que esta tinción ofrece en el diagnóstico definitivo de microsporidia son la identificación tanto del poraloplasto y el tubo polar.19
En este reporte se observó que la tinción con azul de tricromo resultó efectiva y rápida para el diagnóstico definitivo de microsporidiosis en el conejo; además, esta metodología puede ser estandarizada fácilmente en cualquier laboratorio de histopatología.
Referencias
1. KUNZEL F, GRUBER A, TICHY A, EDELHOFER R, NELL B, HASSAN J et al. Clinical symptoms and diagnosis of encephalitozoonosis in pet rabbits. Vet Parasitol 2008; 151: 115–124. [ Links ]
2. CERRONE A, MARIANI F, CIABRELLI M, GALIERO G, DE CARLO E, FIORETTI A et al. Parasitological zoonosis in rabbit meat: Results of seroepidemiological survey for the investigation of Encephalitozoon cuniculi, Toxoplasma gondii and Chlamydia psittaci in Italian rabbits. Proceedings of the 8th World Rabbit Congress; 2004 September 7–10; Puebla, Mexico. Valencia Spain: University of Valencia. 498–503. [ Links ]
3. BOOT R, HANSEN AK, HANSEN CK, NOZARI N, THUIS HC. Comparison of assays for antibodies to Encephalitozoon cuniculi in rabbits. Lab Anim 2000; 34: 281–289. [ Links ]
4. CALI A, TAKVORIAN PM. Developmental morphology and life cycles of the microsporidia. In: WITTNER M, WEISS LM, editors. The Microsporidia and Micro–sporidiosis. Washington DC USA: ASM Press, 1999: 85– 128. [ Links ]
5. VENTURA E, JUAREZ M, CANDANOSA E. Diarrheal case in semintensive production of New Zealand white (NZW) rabbit in Mexico City. "Characterization of macroscopic and microscopic lesions". Proceedings of the 8th World Rabbit Congress; 2004 September 7–10; Puebla, Mexico. Valencia Spain: University of Valencia. 664–668. [ Links ]
6. HARCOURT–BROWN FM. Encephalitozoon cuniculi infection in rabbits. Semin Avian Exot Pet 2004; 13: 86– 93. [ Links ]
7. BANEUX PJ, POGNAN F. In utero transmission of Encephalitozoon cuniculi strain type I in rabbits. Lab Anim 2003; 37: 132–138. [ Links ]
8. DIDIER ES, WEISS LM. Microsporidiosis: current status. Curr Opin Infect Dis 2006; 19: 485–492. [ Links ]
9. DEPLAZES P, MATHIS A, MULLER C, WEBER R. Molecular epidemiology of Encephalitozoon cuniculi and first detection of Enterocytozoon bieneusi in faecal samples of pigs. J Eukaryot Microbiol 1996; 43: 93S. [ Links ]
10. BOTERO–GARCÉS J, MONTOYA–PALACIO MN. Microsporidiosis intestinal: una visión integral. Infect 2002; 6: 213–225. [ Links ]
11. WASSON K, PEPER RL. Mammalian microsporidiosis. Vet Pathol 2000; 37: 113–128. [ Links ]
12. FRANZEN C, MULLER A. Microsporidiosis: human diseases and diagnosis. Microbes Infect 2001; 3: 389400. [ Links ]
13. RINDER H, JANITSCHKE K, ASPOCK H, DA SILVA AJ, DEPLAZES P, FEDORKO DP et al. The diagnostic multicenter study group on Microsporidia. Blinded, externally controlled multicenter evaluation of light microscopy and PCR for detection of Microsporidia in stool specimens. J Clin Microbiol 1998; 36: 1814–1818. [ Links ]
14. BETTENS S, GIGI J, DELMEE M. Les infections a microsporidies. Louvain Med 1999; 118: 446–456. [ Links ]
15. FEDORKO DP, HIJAZI YM. Application of molecular techniques to the diagnosis of microsporidial infection. Emerg Infect Dis 1996; 2: 183–191. [ Links ]
16. HAZARD EI, ELLIS AE, JOSLYN DJ. Identification of Microsporidia. In: BURGES HD, editor. Microbial Control of Pests and Plant Diseases. Oxford, London: Academic Press, 1981: 163–182. [ Links ]
17. DIDIER ES, ORENSTEIN JM, ALDRAS A, BERTUCCI D, ROGERS LB, JANNEY FA. Comparison of three staining methods for detecting Microsporidia in fluids. J Clin Microbiol 1995; 33: 3138–3145. [ Links ]
18. JOSEPH J, VEMUGANTI GK, GARG P, SHARMA S. Histopathological evaluation of ocular microsporidiosis by different stains. BMC Clin Pathol 2006; 6: 6. [ Links ]
19. SIALA A, CHABCHOUB N, BOURATBINE A, AOUN K. Les microsporidioses intestinales epidemiologie, pathogenie et diagnostic. Rev Tun Infectol 2007; 1: 20–24. [ Links ]
* Salt Lake City, USA.














