Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Veterinaria México
versión impresa ISSN 0301-5092
Vet. Méx vol.42 no.2 Ciudad de México abr./jun. 2011
Artículos científicos
Toxoplasmosis en una colonia de monos ardilla (Saimiri sciureus) en cautiverio en Cuernavaca, Morelos, México
Toxoplasmosis outbreak in a private collection of squirrel monkeys (Saimiri sciureus) in Cuernavaca, Morelos Mexico
Adriana Méndez Bernal*,** Ileana Martínez Ramos* Bernardo Saucedo Garnica* José Ramírez Lezama*
* Departamento de Patología, Facultad de Medicina Veterinaria y Zootecnia–Universidad Nacional Autónoma de México, 04510, México, DF.
** Unidad de Microscopía Electrónica, Departamento de Patología. Facultad de Medicina Veterinaria y Zootecnia–Universidad Nacional Autónoma de México, 04510, México, DF. Correo electrónico: mvzadrimb@gmail.com
Recibido el 24 de junio de 2010.
Aceptado el 10 de marzo de 2011.
Abstract
Toxoplasmosis is a disease of worldwide distribution that parasites the intestinal tract of wild and domestic cats. However, in New World monkeys it is considered an acute and fatal illness. The reason for its high susceptibiliy in this particular species is still unknown, but it has been theorized that their habitat and living conditions, in high trees, might be an important factor. Necropsy was performed on 5 squirrel monkeys (Saimiri sciureus), three males (adult) and two females (one of them gravid), with a clinical history of eye redenning and presence of bloody serous foam in the nostrils. Gross examination of the lung showed non collapsed lobes, dark red parenchyma and irregular pale pink nodular areas. All five animals showed apparent hepatomegaly. Histological findings revealed an interstitial pneumonia with a prominent thickening of alveolar septae, and numerous foamy macrophages with intracytoplasmic basophilic structures 20– 25 urn long, covered by a refringent wall and housing PAS positive basophilic structures that were aproximately 8 urn long (bradyzoites), which were identified as protozoal cysts. The liver showed multiple foci of periportal inflammatory cells and numerous parasitic cysts that were also observed in spleen and brain tissue. Inmunohistochemical technique was performed on selected samples of brain, liver and lung tissue, which resulted positive for Toxoplasma gondii using antibodies of hyperimmune antiserum–caprine 6244 origin, in a 1:300 dilution. Samples of the same tissues were processed for transmission electron microscopy. Hepatocytes of the liver showed multiple intracytoplasmic vacuoles with parasitic structures consistent with tachyzoites, which were 3.6 μm long and measured 2.3 μm in diameter. They possesed a slightly wavy electrodense plasmatic membrane that exhibited a conoid in its anterior end, along with several electrodense micronemes. Ultraestructural features like the conoid and the location of micronemes allowed us to identify the parasite as Toxoplasma gondii. Clinical history, necropsy findings, microscopic examination, inmunohistochemical analysis and electron microscopy of all five squirrel monkeys were consistent with a diagnosis of systemic toxoplasmosis. This report shows the high suceptibiliity of New World monkeys to become infected with this parasite. Therefore, toxoplasmosis should be considered among the differential diagnosis for diseases with non specific clinical signs in this particular species.
Key words: Toxoplasmosis, squirrel monkey, inmunohistochemistry, electron microscopy.
Resumen
La toxoplasmosis es una enfermedad de distribución mundial provocada por el protozoario Toxoplasma gondii cuyos huéspedes definitivos son los felinos y una gran diversidad de especies animales son los huéspedes intermediarios. En primates del Nuevo Mundo se caracteriza por ser una enfermedad aguda y de curso fatal. La razón de la alta susceptibilidad en estos animales hasta la fecha se desconoce y generalmente se ha asociado con sus hábitos arborícolas. Se realizó la necropsia de cinco monos ardilla (Saimiri sciureus), tres machos (adultos) y dos hembras (una de ellas gestante), con historia clínica de enrojecimiento de los ojos y salida de espuma serosanguinolenta por la nariz. Macroscópicamente, los cinco animales presentaron los lóbulos pulmonares no colapsados y el parénquima rojo oscuro con áreas rosa claro entremezclado que en ocasiones tenían aspecto nodular. El hígado de los cinco animales se apreció aumentado de tamaño y pálido en su totalidad. Microscópicamente se observó neumonía intersticial caracterizada por el engrosamiento de los septos alveolares y la presencia de numerosos macrófagos espumosos cuyo citoplasma contenía estructuras elongadas, basofílicas de 20–25 μm de diámetro con pared refringente que a su vez albergaban estructuras basofílicas de 8 um (bradizoítos) PAS positivas consistentes con quistes de protozoarios. El hígado presentó focos de infiltrado inflamatorio periportal, así como numerosos quistes de protozoarios, que también se apreciaron en bazo y cerebro. Se realizó inmunohistoquímica de secciones histológicas de pulmón, hígado y cerebro, las cuales fueron positivas para Toxoplasma gondii con el anticuerpo Hyperimmune antiserum–caprine, a una dilución de 1:300. Asimismo, muestras de estos mismos tejidos fueron procesadas para microscopía electrónica de transmisión, en las que el hígado exhibía en su citoplasma vacuolas parasitarias con estructuras correspondientes a taquizoítos que medían de 3.6 μm de largo por 2.3 μm de diámetro, con una membrana plasmática electrodensa, ligeramente ondulada, que en ocasiones exhibían en su extremo anterior el conoide, y por debajo de éste, escasos micronemas electrodensos. Las características ultraestructurales como el conoide, y la ubicación de los micronemas, son criterios primordiales que permiten identificar al parásito como Toxoplasma gondii. La historia clínica, los hallazgos a la necropsia, el estudio histopatológico, la inmunohistoquímica y microscopía electrónica de los cinco monos ardilla fueron consistentes con un cuadro de toxoplasmosis sistémica. Este informe demuestra la alta susceptibilidad que poseen los primates del Nuevo Mundo al ser infectados por este protozoario, por lo que se debe considerar entre los diagnósticos diferenciales para enfermedades de curso clínico no específico en estos animales.
Palabras clave: Toxoplasmosis, mono ardilla, inmunohistoquímica, microscopía electrónica.
Introducción
El protozoario Toxoplasma gondii es un parásito de distribución mundial, es una coccidia que parasita el intestino de felinos domésticos y silvestres, que son los huéspedes definitivos. Anticuerpos anti–Toxoplasma se han encontrado frecuentemente en felinos silvestres y en cautiverio, como leones, ocelotes, linces, cheetas y panteras, y se ha regristrado en zorros rojos y grises, mapaches, pandas rojos, osos negros, osos Kodiak y osos Polares, además se han descrito en minks y hurones especialmente en neonatos.1,2 Existen diversos trabajos sobre toxoplasmosis en primates del Nuevo Mundo, en los cuales se informa que la enfermedad suele ser aguda y fatal; la razón de su alta susceptibilidad se desconoce; sin embargo, se asocia con sus hábitos arborícolas, que les ha proporcionado aislamiento durante el transcurso de la evolución.1–7
Toxoplasma gondii es un parásito intracelular obligado.3 El taquizoíto es la forma vegetativa con proliferación activa, que se observa en las infecciones agudas, diseminadas y puede hallarse en sangre, secreciones y una amplia variedad de tejidos. Tiene forma de media luna, mide 4–8 × 2–4 micrómetros; uno de sus extremos es más ancho y redondeado y posee un núcleo grande central. Esta fase del parásito sobrevive pocas horas en los tejidos de animales muertos. El bradizoíto es considerado la forma en reposo de Toxoplasma, se encuentra dentro de los quistes tisulares y se halla presente en las infecciones tanto congénitas como adquiridas, crónicas o asintomáticas.2,8,9 El ooquiste, que se elimina en las heces de felinos después de la ingestión de cualquiera de las tres formas infectantes (taquizoítos, bradizoítos y ooquistes), es el resultado de una fase de multiplicación sexual en su intestino delgado. Los ooquistes son muy resistentes y pueden sobrevivir en el medio ambiente durante varios meses, esporulan dos a cuatro días después de la eliminación y se tornan infecciosos en una gran variedad de huéspedes.10–12
Se han establecido dos ciclos distintos; uno enteroepitelial en intestino delgado de los felinos, con producción de ooquistes; y un ciclo extraintestinal que involucra bradizoítos y taquizoítos.
El primer ciclo ocurre solamente en miembros de la familia Felidae, mientras que el segundo ocurre en cualquier animal de sangre caliente.1,3,9,11,13 El ciclo en los felinos parece ser más activo cuando la infestación ocurre por ingestión de bradizoítos, ya que los jugos gástricos disuelven la pared del quiste, pero se retarda su acción sobre los bradizoítos, los cuales alcanzan a sobrevivir más o menos 6 horas, y como cada quiste puede contener miles de bradizoítos, la posibilidad de infección es alta. El ciclo extraintestinal ocurre en cualquier especie de mamífero diferente de los felinos, y especialmente se trata de una multiplicación de tipo binario. Las formas infectantes, liberadas de los bradizoítos o de los ooquistes, penetran en principio en el sistema linfático y luego se diseminan en sangre dentro de los macrófagos. Esta fase de la infección es cuando la multiplicación se intensifica rápidamente, ocurre la invasión de gran cantidad de células de todo tipo, las cuales pueden ser destruidas o fagocitadas.5,8,11–13
Existen diversas técnicas de diagnóstico que se aplican en animales vivos, como las pruebas de patología clínica, entre ellas el hemograma en el cual puede apreciarse leucopenia en los casos graves. Las pruebas bioquímicas revelan hipoalbuminemia e hipoproteinemia en la etapa aguda de la enfermedad. Por citología pueden observarse taquizoítos en líquidos corporales, en la etapa aguda, por ejemplo en los derrames pleurales y peritoneales. En el examen parasitológico de heces en félidos, los ooquistes de Toxoplasma gondii son similares morfológicamente a los de otros parásitos de esta misma familia, motivo por el cual debe inocularse el material sospechoso en ratones, en los cuales se producen lesiones características y se puede aislar el Toxoplasma. Este método es muy riesgoso por el manejo de un agente infeccioso zoonótico. Asimismo, se realiza examen de PCR para descartar que se trate de ooquistes con morfología similar a otros protozoarios. Por lo cual las pruebas serológicas son más eficientes en el diagnóstico de esta enfermedad, como son las pruebas de ELISA para IgG e IgM, la aglutinación directa e inmunofluorescencia indirecta.
Las técnicas de diagnóstico directas incluyen: estudios histopatológicos, en los que se pueden observar lesiones como neumonía intersticial, hepatitis necrótica, linfadenitis, entre otras, y los quistes protozoarios así como taquizoítos.
La inmunohistoquímica se emplea para la detección de antígeno específico de Toxoplasma gondii. La microscopia electrónica es fundamental para la identificación y diferenciación de la ultraestructura del protozoario, así como el uso de técnicas moleculares como PCR (reacción en cadena de la polimerasa), que constituye una metodología sensible y específica que permite la identificación de segmentos génicos mediante la amplificación selectiva de secuencias de ADN particulares, a partir de sangre, orina, líquido cefalorraquídeo, humor vítreo, líquido amniótico y tejidos.1–3,5–7,14,15
Material y métodos
Historia clínica
Fueron remitidos para el estudio post mortem al Departamento de Patología de la Facultad de Medicina Veterinaria y Zootecnia de la UNAM, cinco monos ardilla (Saimiri sciureus), tres machos (adultos) y dos hembras (una de ellas gestante), que formaban parte de un grupo de nueve individuos, cuya historia clínica incluye únicamente muerte súbita con enrojecimiento de los ojos y salida de espuma sanguinolenta por la nariz. Con base en los signos y la especie, los principales diagnósticos diferenciales que se consideraron fueron: una enfermedad viral (Hantavirus) y una intoxicación.
Necropsia
Se llevó a cabo el estudio post mortem de los cinco animales referidos y se recolectaron muestras de pulmón, hígado, bazo, linfonodo y encéfalo para su estudio histopatológico.
Resultados
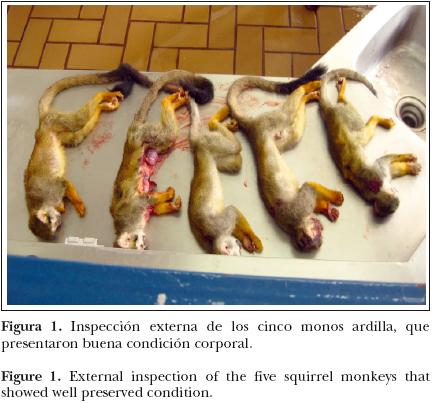
En los cinco monos ardilla, los hallazgos a la necropsia fueron similares, variando sólo el grado de severidad de las lesiones. A la inspección externa, los cinco animales presentaron buena condición corporal, tres de ellos en mal estado de conservación y dos en buen estado de conservación (Figura 1). Al incidir la cavidad torácica, los pulmones de cuatro de los monos no colapsaron y el 80% de la superficie era roja oscura con áreas rosa pálido entremezcladas, que en ocasiones tenían aspecto nodular. En los cinco animales se apreció discreto aumento en el tamaño del hígado y 100% del parénquima era pálido con el patrón lobulillar ligeramente incrementado.
Aspectos microscópicos
Los tejidos recolectados se conservaron en formalina amortiguada al 10%, fueron deshidratados e incluidos en parafina. Se realizaron cortes de 4 a 5 μm de grosor, se tiñeron con hematoxilina y eosina (H & E) y posteriormente con la tinción de histoquímica: ácido peryódico de Schiff (PAS: periodic acid–Schiff).
Se revisaron diferentes secciones de tejido pulmonar, en los que se observó neumonía intersticial, caracterizada por engrosamiento de los septos alveolares por infiltrado inflamatorio compuesto por macrófagos, linfocitos y células plasmáticas, así como por abundante cantidad de eritrocitos. En la luz de los alvéolos había macrófagos espumosos, algunos de ellos mostraron en el interior de su citoplasma estructuras redondas a elongadas, basofílicas de 20–25 μm de diámetro con pared refringente, que contenían numerosas estructuras basofílicas de 8 μm (bradizoítos), PAS positivas consistentes con quistes protozoarios, asimismo, se observó abundante material eosinofílico homogéneo compatible con edema (Figura 2).

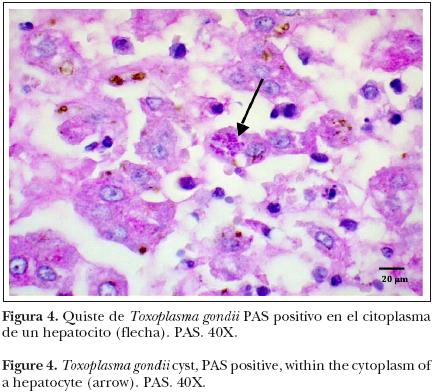
El hígado presentó hepatitis necrótica, caracterizada por focos de restos celulares que en la periferia tenían estructuras redondas a ovaladas, basofílicas que medían de 20 a 25 μm de diámetro, y que contenían numerosas estructuras ligeramente basofílicas de 8 μm (bradizoítos) consistente con quistes protozoarios, así como disociación de los cordones hepáticos y zonas con infiltrado inflamatorio en la zona periportal compuesto por neutrófilos degenerados y en menor cantidad linfocitos (Figuras 3 y 4).

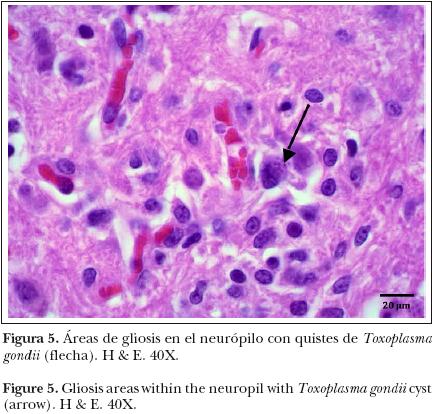
En las secciones de cerebro, el neurópilo mostró proliferación de células de la glía y algunas de estas células rodeaban cuerpos neuronales. Asimismo, el neurópilo exhibió estructuras redondas a ovaladas, basofílicas de 20 a 25 μm de diámetro, y que contenían numerosas estructuras basofílicas de 8 um, consistente con quistes protozoarios (Figura 5).
En el bazo no se apreció población linfoide, pero sí numerosas estructuras parasitarias con características morfológicas similares a las descritas en pulmón, hígado y cerebro.
Como pruebas auxiliares se empleó la técnica de inmunohistoquímica para evidenciar la presencia del antígeno de Toxoplasma gondii, y la microscopía electrónica para la identificación ultraestructural característica del protozoario.
Inmunohistoquímica
Para esta prueba se seleccionaron secciones de pulmón, hígado y cerebro fijadas en formalina al 10%, las cuales fueron deshidratadas e incluidas en parafina. Posteriormente, se realizaron cortes de 4 μm de grosor, que se colocaron en laminillas cubiertas con poli–L–lisina. Como anticuerpo primario se utilizó un anticuerpo comercial: antisuero hiperinmune caprino origen 6244,* a una dilución de 1:300 y como anticuerpo secundario se utilizó el anticuerpo biotin SP–conjugated AfinniPure rabbit anti–goat IgG (H+L).** Posteriormente, para magnificar la reacción inmunológica se utilizó el complejo avidina–biotina–peroxidasa (CAB) empleando el paquete de reactivos de ZYMED.***
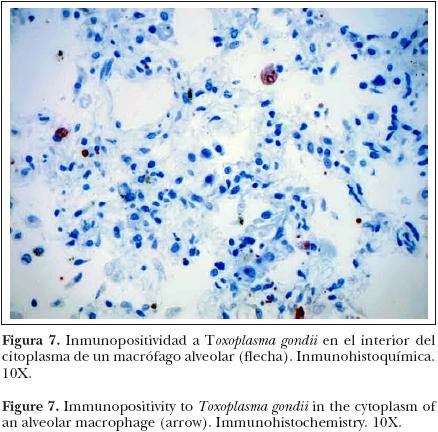
Se revisaron secciones histológicas de pulmón, hígado y cerebro, en las que se observaron múltiples estructuras con inmunopositividad a Toxoplasma gondii, en el interior de los macrófagos alveolares, así como en el citoplasma de los hepatocitos y en el neurópilo (Figuras 6 y 7).

Microscopía electrónica
De los tejidos obtenidos del estudio post mortem se recuperó pulmón, hígado y cerebro, los cuales estaban fijados en formalina al 10%. Estos tejidos se lavaron con solución amortiguada de cacodilatos y posteriormente se fijaron con tetraóxido de osmio al 1% y se lavaron con solución amortiguada de cacodilatos con pH de 7.2a 0.1 M. Posteriormente, se deshidrataron con concentraciones ascendentes de acetona y se incluyeron en resinas epóxicas (Epón 812) y se polimerizaron a 60°C por 24 horas. Después, se realizaron cortes semifinos de cada uno de los órganos y se montaron en laminillas, las cuales fueron contrastadas con azul de toluidina. A continuación se realizaron cortes finos de 60 μm montados en rejillas de cobre y contrastados con acetato de uranilo y citrato de plomo y se observaron en un microscopio electrónico.****
Se revisaron cortes ultrafinos de hígado, cuyos hepatocitos exhibían en su citoplasma vacuolas parasitarias con estructuras correspondientes a taquizoítos en varios estadios de maduración. Los taquizoítos observados medían de 3.6 μm de largo por 2.3 um de diámetro, con una membrana plasmática electrodensa, ligeramente ondulada, que en algunos taquizoítos presentaban en su extremo anterior el conoide (Figura 8).

Asimismo, en el interior y por debajo del conoide se apreciaron escasos micronemas electrodensos, así como roptrías acortadas muy electrodensas.
Anterior al núcleo se ubicaban algunos gránulos densos, los cuales eran más numerosos en el extremo anterior. El núcleo, en la mayoría de las estructuras, era central y presentaba la heterocromatina normal y desplazada hacia la periferia. En algunos taquizoítos se observaron numerosos gránulos electrolúcidos (apicoplastos) dispuestos al azar en el citoplasma.
En los cortes ultrafinos de pulmón, las células epiteliales alveolares exhibían en su citoplasma bradizoítos que medían 2.6 μm de diámetro y 3.2 μm de largo, con una membrana plasmática electrodensa y ondulada. Los micronemas, localizados en la parte anterior del parásito, eran numerosos y estaban ausentes en la parte posterior. Asimismo, presentaron abundantes gránulos densos y roptrias acortadas y electrodensas.
Las características ultraestructurales, como el conoide, la ubicación de los micronemas y los gránulos densos, son criterios primordiales que permiten identificar al parásito como Toxoplasma gondii. En las secciones de tejido nervioso no se observaron estructuras parasitarias.
Discusión
La historia clínica de muerte súbita, los hallazgos a la necropsia, el estudio histopatológico, la inmuno–histoquímica y microscopía electrónica de los cinco monos ardilla fueron consistentes con un cuadro de toxoplasmosis sistémica.
Las razones de la alta susceptibilidad de estos primates no han sido establecidas, sin embargo, en algunos estudios refieren que estos animales no desarrollan una respuesta celular (células T) efectiva.3 Debido a la naturaleza intracelular de Toxoplasma gondii, la respuesta inmune celular se considera importante para combatir el parasito.3,5,11
Se ha sugerido que entre las posibles vías de contagio de los primates del Nuevo Mundo se encuentra la contaminación de los alimentos con heces de gatos o bien a través de vectores como cucarachas y otros artrópodos.3,15
Los hallazgos histopatológicos como las lesiones en pulmón (neumonía intersticial), hígado (hepatitis necrótica) y la presencia de quistes de protozoarios PAS positivos en linfonodos y encéfalo, son similares a las lesiones registradas por Epiphanio et al.,3 en un estudio recapitulativo en 33 primates del Nuevo Mundo.1,5–,7,9,–11,13,15
Con respecto a la inmunohistoquímica, Epiphanio et al.,3 señalan reacción inmunológica positiva a Toxoplasma gondii en hígado, pulmón, linfonodos, encéfalo, bazo, corazón, riñones, glándulas adrenales, arterias e intestino delgado en informes de epizootias, en este caso, la técnica sólo se llevó a cabo en el tejido hepático, pulmonar y encéfalo por ser los órganos con lesiones más representativas y de los animales mejor conservados; siendo inmunopositivos.1,3,5,6,9–11,15
La disposición y el tamaño de las estructuras observadas con microscopía electrónica (conoide, roptrias, micronemas, entre otros) son características del género Aplicomplexa y concuerda con la información de la ultraestructura de Toxoplasma gondii, los cuales fueron tomados como criterios diagnósticos3,5,6,8,9,11,13,15–18
Este informe concuerda con los estudios de epizootias de toxoplasmosis en primates del Nuevo Mundo en zoológicos, en donde se informa alta mortalidad, sin signos evidentes o específicos en muchos de ellos antes de la muerte,3,5,9,10,13,15 y demuestra la gran susceptibilidad de los monos ardilla a este protozoario. Así como, sus graves consecuencias en poblaciones de monos en zoológicos, colecciones privadas y centros de investigación, por lo que se debe considerar entre los diagnósticos diferenciales para enfermedades con curso clínico no específico en estos animales. Por otra parte, debido al estrecho contacto con el hombre, se le considera una zoonosis importante en medicina humana.
Referencias
1. PADUA MC, MUÑOZ GJ, CEDILLO CP, MORALES SE. Toxoplasmosis en monos ardilla (Saimiri Sciureus). XV Congreso Nacional de Patología Veterinaria; 2006 junio 21 – 23; Zacatecas, Zac. Zacatecas, Zac., 2006. [ Links ]
2. SALLES CJ, PRATS N, LOPEZ S, DOMINGO M, MARCO AJ, MORAN J F. Epizootic Disseminated Toxoplasmosis in Captive Slender–tailed Meerkats (Suricata suricatta). Vet Pathol 1997; 34: 1–7. [ Links ]
3. EPIPHANIO S, SINHORINI IL, CATAO–DIAS JL. Pathology of Toxoplasmosis in Captive New World Primates. J Comp Path 2003; 129: 196–204. [ Links ]
4. VARELA N. La toxoplasmosis en los primates del Nuevo Mundo, Boletín Geas, 2001; 2: 30–35. [ Links ]
5. ESPINOSA AD, MORALES MM. Brote de toxoplasmosis en una colonia de monos ardilla (Saimiri Sciureus). Vet Méx 2007; 38: 366–369. [ Links ]
6. JEROME ME, RADKE J R, BOHNE W, ROOS DS, WHITE MW. Toxoplasma gondii Bradyzoites Form Spontaneously during Sporozoite–Initiated Development. Infect Immun 1998; 66: 4838–4844. [ Links ]
7. KIM K, WEISS LM. Toxoplasma: the next 100 years, Microbes Infect 2008; 10: 978–984. [ Links ]
8. MUÑOZ ED, CHÁVEZ AV, CASAS EA, SUÁREZ FA, GAVIDIA CC, MUÑOZ KD et al. Frecuencia de anticuerpos contra Toxoplasma gondii en monos Cebus apella criados en cautiverio. Inv Vet Perú 2005; 16: 163–168. [ Links ]
9. LEVINE DN. Veterinary Protozoology. Ames, Iowa: Iowa State University Press, 1985. [ Links ]
10. SHERDING GR. The cat diseases and clinical management. Vol 1. 2nd ed. New York: WB Saunders Company, 1994: 565–584. [ Links ]
11. DUBEY JP. History of the discovery of the life cycle of Toxoplasma gondii. Int Parasitol 2009; 398: 77–882. [ Links ]
12. DUBEY JP, LINDSAY DS, SPEER CA. Structure of Toxoplasma gondii Tachyzoites, Bradyzoites, and Sporozoites and Biology and Development of tissue Cyst. Clin Microbiol Rev 1998; 11: 267–299. [ Links ]
13. INNES E. Toxoplasmosis: Comparative species susceptibility and host immune response. Comp Inmunol Microbiol Infect Dis 1997; 20:131–138. [ Links ]
14. SPEER CA, DUBEYJP, MCALLISTER MM, BLIXT JA. Comparative ultraesctructure of tachyzoites, bradyzoites, and tissue cysts of Neospora caninum y Toxoplasma gondii. J Parasitol 1999; 29: 1509–1519. [ Links ]
15. QUINN PJ, MCCRAW B M. Current status of Toxoplasma and toxoplasmosis. Can Vet J 1972; 13:247–262. [ Links ]
16. CHEVILLE NF. Ultrastructure Pathology. Ames, Iowa: Iowa State University Press, 1994. [ Links ]
17. SPEER CA, DUBEYJP. Ultraestructure of the Oocysts, sporocysts, and sporozoites of Toxoplasma gondii. J Parasitol 1998; 84: 505–512. [ Links ]
18. RIBEIRO AM. Toxoplasmosis in squirrel monkeys: histological and inmunohistochemical analysis. Cienc Rural 2007; 37:1724–1727. [ Links ]
* VMRD, Inc. # de Catalogo 6244. Lote 111392, USA.
** Jackson ImmunoResearch, Laboratorie Inc. Lote 68958, USA.
*** ZYMED 95–6143. Lote 50481616, USA.
**** Zeiss EM 900.














