Serviços Personalizados
Journal
Artigo
Indicadores
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Veterinaria México
versão impressa ISSN 0301-5092
Vet. Méx vol.41 no.4 Ciudad de México Out./Dez. 2010
Artículo de revisión
Algunos factores fisiológicos y nutricionales que afectan la incidencia de diarreas posdestete en lechones
Some physiological and nutritional factors affecting the incidence of post–weaning diarrhea in piglets
Tércia Cesária Reis de Souza* Gerardo Mariscal Landín** Konisgmar Escobar García*
* Facultad de Ciencias Naturales, Universidad Autónoma de Querétaro, Av. de las Ciencias s/n. Juriquilla, 76000, Querétaro, Querétaro, México.
** CENID Fisiología INIFAP, km 1 Carretera a Colón, 76280, Ajuchitlán, Colón, Querétaro.
Correspondencia:
Tércia Cesária Reis de Souza,
Tel.: (442) 1 92 12 00, extensión 5391,
Fax: (442) 2342958,
Correo electrónico: tercia@uaq.mx
Recibido el 3 de diciembre de 2009
Aceptado el 12 de agosto de 2010.
Abstract
Weaning causes disturbances in the digestive function and intestinal health of piglets and is almost always associated with a severe growth depression and diarrhea. For this reason antibiotics in sub–therapeutic doses are often added to feed to prevent diarrhea and as growth promoters. However, due to the ban of antibiotics in feedstuffs in different parts of the world, an increase in post–weaning diarrhea in piglets has been observed. Several nutritional strategies have been used as control measures. This work reviews some aspects of nutrition, digestive physiology, intestinal microflora in weaned piglets and their relationship with post–weaning diarrhea. It is concluded that the use of probiotics and prebiotics in pig starter diets may be an alternative to replace antibiotics in post–weaning diarrhea control. Fed piglets after weaning with a low crude protein diet (17%) instead to high crude protein diets (23% or more), may also be an efficient strategy to diarrhea control through the reduction in the urea nitrogen level in plasma and the production of microbial toxic metabolites such as ammonia, which indicates a reduction in the fermentation of proteins and contributes to maintain intestinal health.
Key words: Piglets, Weaning, Crude protein level, Diarrhea.
Resumen
El destete produce perturbaciones en el funcionamiento digestivo y en la salud intestinal de los lechones y casi siempre se asocia con una severa depresión del crecimiento y diarrea. Por ello, con frecuencia se agregan dosis subterapéuticas de antibióticos al alimento como medida preventiva contra las diarreas y como promotores de crecimiento. Sin embargo, debido a la prohibición del uso de antibióticos en la alimentación animal, en diferentes partes del mundo se ha observado un incremento de las diarreas posdestete en lechones. Para contrarrestar este problema se ha promovido el uso de estrategias nutricionales como medidas de control. El presente trabajo tuvo como objetivo revisar algunos aspectos relacionados con la nutrición, la fisiología digestiva, la microbiota intestinal de lechones recién destetados y su relación con las diarreas posdestete. Se concluyó que el uso de probióticos y prebióticos en las raciones iniciadoras puede ser una alternativa para reemplazar los antibióticos en control de las diarreas posdestete. Alimentar a los lechones después del destete con dietas con niveles bajos de proteína cruda (17% de PC, en lugar de 23% o más) también puede ser una estrategia eficiente para controlar diarreas. Esto a través de la reducción del nivel de nitrógeno ureico plasmático y de la producción de metabolitos microbianos tóxicos, como el amoniaco, lo que indica una reducción en la fermentación de proteínas y contribuye a mantener la salud intestinal.
Palabras clave: Lechones, Destete, Nivel de proteína cruda, Diarrea.
Introducción
El funcionamiento digestivo y la salud intestinal de los lechones son perturbados por el destete. La supresión de la leche materna no es inmediatamente compensada por un consumo adecuado de agua o por una suficiente secreción salival o gastrointestinal. En este contexto, el estrés inherente a esta etapa puede ocasionar un aumento del peristaltismo y hasta una interrupción abrupta de la síntesis de algunas enzimas; originando diarreas en el mismo día del destete.1 Esta problemática resultó ser más importante en lechones destetados a una edad temprana, cuando se compararon a cuatro y seis semanas de edad;2 sin embargo, en la producción de cerdos orgánicos, en la cual el destete se realiza más tardíamente (siete semanas en Dinamarca), las diarreas posdestete también son un problema.3
El lechón recién destetado es un animal altamente demandante de energía para los procesos fisiológicos relacionados con el desarrollo corporal y la maduración de su sistema inmunológico.4 Paradójicamente, la capacidad digestiva necesaria para que los lechones aprovechen los nutrimentos es bastante limitada en el periodo posdestete, pues los órganos del tracto gastrointestinal están poco desarrollados y la actividad de las secreciones digestivas es baja;5 el problema es más grave con las proteínas de origen vegetal, pues son menos susceptibles a la digestión enzimática que las de origen animal.6 Así, en el periodo posdestete, cuando el lechón empieza a consumir dietas sólidas con base en materias primas vegetales, se incrementa su susceptibilidad a los desórdenes gastrointestinales. 1 Lo anterior contribuye a que este periodo sea el más crítico en la vida del cerdo, pues se presenta una fase de anorexia y subnutrición7 que repercute en la fisiología digestiva y en el desarrollo de los animales. En las últimas décadas se ha observado un gran avance en la formulación de las raciones de la primera fase de la crianza, para adaptar a los lechones a una dieta posdestete a base de carbohidratos y de proteínas de origen vegetal, reduciendo así el riesgo de las diarreas posdestete. Estas dietas normalmente incluyen dosis subterapéuticas de antibióticos8 como una medida preventiva contra las diarreas y como promotores de crecimiento.9 Sin embargo, recientemente, debido a la prohibición del uso de antibióticos en la alimentación animal en diferentes partes del mundo, han incrementado las diarreas posdestete (DPD) en lechones. 1° Para contrarrestar este problema se ha promovido el uso de estrategias nutricionales como medidas de control de las DPD 8,9,11–14 incluyendo la manipulación de los ingredientes de la dieta para modificar las poblaciones bacterianas patógenas y comensales.2 Entre las soluciones nutricionales propuestas, la reducción del nivel de proteína cruda (PC) dietaria ha sido una de las alternativas más estudiadas2,3,10,13,15–19 para disminuir los problemas digestivos en los lechones. El presente trabajo tuvo como objetivo revisar algunos aspectos relacionados con la nutrición de los lechones recién destetados, y sus consecuencias en la fisiología digestiva y en la microbiota intestinal; y analizar la eficacia de algunas estrategias nutricionales en la reducción de la incidencia y severidad de las diarreas posdestete.
El destete y la fisiología digestiva
Al momento del destete de los lechones, el cambio de la alimentación láctea por una ración sólida está frecuentemente asociado con una severa depresión del crecimiento y con la presencia de diarrea, dando lugar al denominado "síndrome de las diarreas posdestete", con una etiología multifactorial (manejo, composición de las dietas, higiene, entre otros); la anorexia y la subnutrición son los factores desencadenantes más importantes de este síndrome.3,14,20–24 La Figura 1 ilustra cómo interactúan los factores que conducen a los procesos diarreicos. Durante las primeras 24 a 36 horas posdestete se observan cambios en la mucosa del intestino delgado a nivel funcional y estructural, principalmente con atrofia de las vellosidades e hipertrofia de las criptas Lieberkühn, con una reducción de entre 20 y 30% del peso de este órgano.23,24 Aunado a ello, algunos factores antinutrimentales presentes en las proteínas dietarias de origen vegetal pueden causar reacciones de hipersensibilidad a nivel del epitelio intestinal, agravando aún más la salud intestinal y su actividad enzimática. Considerando también que las alteraciones morfológicas de las vellosidades intestinales, con las pérdidas de enterocitos maduros ricos en enzimas digestivas, observadas en el periodo posdestete, traen como consecuencia una disminución en la actividad de las enzimas del borde de cepillo.22,25 La interacción de las enzimas pancreáticas, tripsina y quimotripsina, con los factores antitrípsicos, disminuye sus actividades, pues éstos compiten por el punto de unión enzima–sustrato, afectando la digestión de las proteínas provenientes de la dieta.26 A través de estudios moleculares se observó que inmediatamente después del destete, los niveles de ARN mensajero (ARNm) en el páncreas son bajos, por lo que hay una disminución en la síntesis de las enzimas pancreáticas en este periodo.24 Sin embargo, pocos días después, los niveles pancreáticos de ARNm y la actividad enzimática fueron restaurados, con excepción de la actividad de la lipasa. Durante este periodo de baja síntesis, secreción y actividad de las enzimas digestivas, el proceso digestivo está altamente comprometido y los nutrimentos no digeridos y no absorbidos, presentes en la luz intestinal, sirven de sustrato para las bacterias enteropatógenas (E. coli, por ejemplo), haciendo que éstas proliferen y causen enfermedades diarreicas (colibacilosis) que pueden aumentar la morbilidad y la mortalidad en la etapa posdestete.27 Aumentando la edad al destete y disminuyendo el nivel de proteína dietaria se puede contribuir a mantener la salud intestinal y minimizar los efectos de la colibacilosis posdestete.2 Disminuir el contenido de proteína dietaria suele ser especialmente importante en los destetes precoces, particularmente en ambientes adversos a la salud de los lechones. En el Cuadro 1 se resumen los puntos anteriormente mencionados, presentando el contexto en que se desarrolla el destete, los desórdenes entéricos inducidos y los principales factores de riesgo para la aparición de las diarreas posdestete.24
Utilización digestiva de los nutrimentos y diarreas
Se sabe que la digestibilidad de un nutrimento es una consecuencia del proceso digestivo y una estimación indirecta de su absorción es, por tanto, una medición del valor nutritivo de los alimentos. A partir de la evaluación de la digestibilidad de los diferentes nutrimentos de la ración de destete, es posible medir la capacidad digestiva del animal y su grado de tolerancia a los alimentos.28 La digestibilidad se expresa matemáticamente como la diferencia de la cantidad ingerida y la excretada de un nutrimento, entre la cantidad ingerida.29 En una revisión bibliográfica30 se discuten las diferentes formas de expresión de la digestibilidad de los nutrimentos. Las mediciones a nivel ileal son más apropiadas para expresar la disponibilidad de la proteína y de la grasa dietaria en el aparato digestivo de los lechones recién destetados,31 debido a que los microorganismos del intestino grueso utilizan los nutrimentos no absorbidos hasta el íleon, aumentando los valores de digestibilidad fecal de manera significativa.32–34 Sin embargo, la expresión de la digestibilidad fecal es la más apropiada para estimar la utilización de la materia seca del alimento y, consecuentemente, de su energía,35 dada la importancia de la fermentación bacteriana de los polisacáridos no amiláceos de los alimentos, la cual genera ácidos grasos volátiles de cadena corta, que son fuente de energía para los animales.36
Existe una relación negativa entre la digestibilidad fecal aparente de la energía y la presencia de diarreas.37 Por ejemplo, el almidón de chícharos tiene una menor digestibilidad ileal que el proveniente de los cereales, y su incompleta digestión en el intestino delgado puede llevar a un incremento del proceso fermentativo en el intestino grueso, lo que corresponde a un aumento en la digestibilidad fecal de la energía.38 Como consecuencia de la excesiva fermentación en el ciego y colon se provocan diarreas y deshidratación.38 Se sabe que los componentes proteínicos del alimento de origen vegetal tienen menor digestibilidad ileal que los de origen animal.39 La proteína dietaria que excede la capacidad de digestión y absorción, además de la de origen endógeno no digerida y no reabsorbida en el intestino delgado, pasan al intestino grueso y la flora microbiana las fermenta, produciendo productos tóxicos, como ácidos volátiles de cadena ramificada, aminas biogénicas, compuestos fenólicos, amoniaco y ácido sulfhídrico que pueden ser dañinos a la salud de los animales, causando diarreas y efectos detrimentales en su desarrollo.13,40 En diferentes revisiones bibliográficas11,41–44 se discuten los efectos de la fermentación proteínica en el intestino grueso y la síntesis de compuestos tóxicos.
Las dos semanas que siguen al destete representan el período más difícil para la utilización digestiva de los nutrimentos, y es cuando los lechones son más sensibles a los diferentes factores que afectan negativamente la digestibilidad en el tracto digestivo anterior.45 Tal vez por eso a esta edad son más susceptibles a los trastornos gastrointestinales.18
La salud del tracto digestivo y la microbiota intestinal
La salud intestinal puede ser definida como la capacidad del tracto gastrointestinal (TGI) de mantenerse en equilibrio, ya que es un ecosistema en constante cambio.46 Existen tres principales componentes de la salud intestinal: la dieta, la mucosa y la microbiota comensal. Ciertos componentes de la dieta para lechones destetados, como la pasta de soya, pueden causar daños de la mucosa intestinal, acumulación de líquido intestinal y predisponer a diarreas posdestete.11 El desarrollo del sistema inmune de la mucosa intestinal depende de la colonización por bacterias comensales y patógenas.7 La mucosa está compuesta por el epitelio digestivo, el tejido linfoide asociado con el intestino (TLAI) y el moco que recubre el epitelio. El TLAI, la microbiota comensal y el moco interactúan con las células del hospedero, generanun sensible y dinámico equilibrio en el TGI, asegurando el correcto funcionamiento del proceso digestivo.47
En el área de nutrición animal, el reto planteado por la prohibición de los antimicrobianos promotores de crecimiento, ha hecho que se busquen instrumentos capaces de aportar un mayor conocimiento de los componentes de la microbiota intestinal, es decir, del conjunto de microorganismos que conforman uno de los microcosmos simbióticos más interesantes del reino animal.48 La microbiota del TGI es un ecosistema complejo que contiene varios miles de especies de bacterias, las cuales tienen un papel importante en la salud intestinal, previniendo la colonización de microorganismos potencialmente patógenos.49 Tradicionalmente, los estudios que analizaban los efectos de las materias primas o aditivos sobre la microbiota intestinal recurrían a la microbiología clásica para hacer recuentos de algunos microorganismos, en general fácilmente cultivables, que permiten una visión parcial de los cambios que pudieron ocurrir en el interior del tubo digestivo.48 Sin embargo, sólo entre 0.1% y 10% de las bacterias en el ambiente es cultivable,50 ya que muchos de los microorganismos estrictamente anaeróbicos son indetectables con las técnicas microbiológicas de cultivo convencionales.40,51,52 Estas limitantes en las técnicas de cultivo se superan con el desarrollo de herramientas moleculares, que permiten detectar e identificar bacterias basándose en la secuenciación de la diversidad del gen ARNr 16S. Gracias a estas técnicas, los conocimientos sobre el desarrollo y las modificaciones de la composición de la flora microbiana intestinal han tenido avances importantes en los últimos años. Recientemente, análisis filogenéticos de la subunidad 16S del gen ARN proveniente del TGI de cerdos, revelaron una población microbiana muy compleja, cuyas especies bacterianas no han sido caracterizadas en su mayoría.53 Estos autores reunieron una biblioteca con 4 270 secuencias clonadas del gen ARN 16S, representando 375 filo tipos procedentes del íleon, ciego y colon de cerdos entre 12 y 18 semanas de vida. Estas miles de especies de bacterias del TGI, que conforman un ecosistema complejo, juegan un papel importante en el bienestar global del animal,54 sobre todo en la salud intestinal, previniendo la colonización de microorganismos potencialmente patógenos.49
Al nacer, los lechones quedan expuestos a los microorganismos del ambiente que les rodea, y el contacto con la flora microbiana materna y sus heces en la maternidad, introduce bacterias que colonizan su tracto digestivo.54 Estas bacterias buscan el nicho más adecuado donde compiten e interaccionan entre sí, constituyendo finalmente una población relativamente estable y compleja, que representa la microbiota intestinal normal.54 En el lechón lactante las bacterias dominantes en el estómago e intestino delgado suelen ser lactobacilos y estreptococos, ambos grupos están bien adaptados a utilizar el sustrato lácteo disponible.54 La microbiota que se desarrolla en el intestino grueso poco después del nacimiento, está constituida por una extensa y variada selección de bacterias mayoritariamente anaerobias estrictas, incluyendo bacteroides, bífidobacterias, eubacterias, estreptococos y lactobacilos, mientras que en menor densidad pueden encontrarse otros microorganismos, como las enterobacterias; normalmente, el género bacteroides es el más numeroso y puede representar más de 30% del total.55 La flora microbiana normal que se establece después del nacimiento, interactúa con los sistemas digestivo e inmunológico del cuerpo y sus actividades pueden ser benéficas o dañinas para el huésped.7 La colonización de los diferentes compartimentos del intestino por bacterias comensales específicas, particularmente por medio de la asociación con el moco o de la adhesión a las células epiteliales, sirve como la primera barrera de defensa contra organismos invasores o sustancias tóxicas presentes en la dieta. Al momento del destete, en un corto periodo ocurren cambios en la composición de la microbiota intestinal del lechón en términos de cantidad y calidad, la cual evoluciona a una compleja y estable comunidad.52 El desarrollo de la microbiota intestinal es un proceso gradual y secuencial que depende de factores nutricionales y no nutricionales.52,56 Se ha informado57 que la composición de la microbiota intestinal de los lechones difiere entre individuos, aun cuando los animales consuman la misma dieta.
Incidencia y severidad de las diarreas posdestete
En los trabajos experimentales realizados, la incidencia y la severidad de las diarreas se determinan mediante la apreciación visual de la consistencia de las heces. La mayoría de las veces se emplea una escala, en la cual se atribuyen calificaciones del 0 al 3.37 E1 valor 0 indica heces normales, por tanto, la no existencia de diarrea; el valor 1 describe una diarrea ligera, pastosa; el valor 2, una diarrea moderada, semi–liquida; y el valor 3 una diarrea severa, muy líquida. La calificación diaria se suma durante el periodo experimental y se calcula el índice de severidad de la diarrea.37 Este índice se puede expresar a partir de la siguiente ecuación:
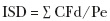
Donde:
ISD= Índice de severidad de la diarrea.
CFd= Calificación de la consistencia fecal diaria.
Pe= Periodo experimental (días).
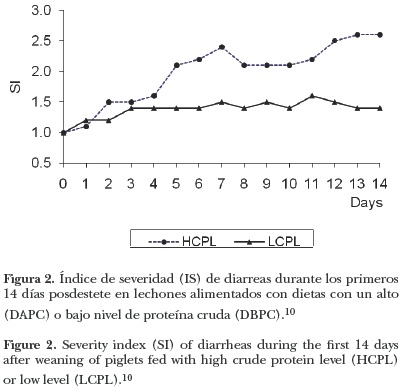
La incidencia de diarrea se mide en función del número de días en que se presenta. En general, esta se incrementa entre la primera y tercera semana posdestete.18 La severidad de las diarreas aumenta en los últimos días de la primera semana posdestete,3,58y en la segunda semana posdestete,10 sin importar la dieta consumida, como se puede observar en la Figura 2.
Probióticos, prebióticos y diarreas posdestete
Los probióticos y los prebióticos se consideran alimentos funcionales al ser compuestos que tienen efectos positivos sobre una o varias funciones del organismo y propician bienestar en el animal.59 Los probióticos se definen como productos que contienen un microorganismo específico, viable y en cantidad suficiente, que por implantación o colonización altera la microflora de un compartimiento del tracto gastrointestinal de un hospedero, causando efecto benéfico.60 Los probióticos han ganado popularidad como ingredientes alimenticios funcionales incluso para humanos.9 Sus efectos en la salud humana han sido estudiados bajo varias condiciones, sin todavía presentar resultados consistentes, pero se ha identificado su eficacia para reducir las señales de intolerancia a la lactosa, la duración de varios tipos de diarreas, la actividad de enzimas bacterianas y para estimular el sistema inmune.61 Los efectos positivos del uso de probióticos en la alimentación de lechones se manifiestan en el balance de la microbiota intestinal, en la integridad del epitelio intestinal en la maduración de los tejidos asociados al tracto digestivo, y en su función neuroendócrina.62 La inclusión de cultivos bacterianos (probióticos) a los alimentos fue una de las primeras alternativas usadas para reemplazar los antibióticos en la alimentación animal.9 Su efecto en el control de las diarreas posdestete depende del microorganismo utilizado.7 Se observó una disminución en la incidencia de diarreas en lechones cuando se empleó una mezcla de cuatro lactobacilos aislados de lechones destetados,63 al igual que cuando se utilizó E. coli cepa Nissle 1917.64 Sin embargo, con el uso de levaduras en la alimentación de lechones no se observó una disminución en la incidencia de diarreas.65
Los prebióticos son otra alternativa interesante para suplir los antibióticos que disminuyen la incidencia y severidad de las diarreas. Aquéllos son ingredientes alimenticios no digestibles que afectan benéficamente al hospedero, pues estimulan de forma selectiva el crecimiento o la actividad una bacteria o de un número limitado de bacterias del colon, mejorando su salud.66 Los prebióticos son sustratos para microorganismos benéficos (bifidobacterias y lactobacilos, entre otros), y pueden ser usados para controlar diarreas posdestete.9,59 Los prebióticos pertenecen a un grupo muy variado de carbohidratos representados por oligosacáridos, como la inulina y oligofructosa, o polisacáridos non amiláceos, los cuales pueden afectar la fermentación del tracto gastrointestinal y su microbiota.66 Los efectos de los carbohidratos sobre el tracto gastrointestinal y las poblaciones de E. coli, y consecuentemente sobre la incidencia de colibacilosis, parecen estar asociados al tipo de carbohidratos (solubles o insolubles; polisacáridos u oligosacáridos) presente en la dieta.11 Las poblaciones bacterianas del tracto gastrointestinal de lechones recién destetados fueron significativamente modificadas por el consumo de dietas con pulpa de remolacha, inulina, lactulosa y almidón de trigo.52
Dietas bajas en proteína cruda y diarreas posdestete
Las diarreas posdestete (DPD) están consideradas dentro de un grupo importante de enfermedades gastrointestinales en los cerdos, con una etiología multifactorial, mencionada anteriormente (Figura 1) y asociada con la proliferación de E. coli entero toxigénica (ETEC).2,11,21,22 Durante el periodo inmediato al destete, si no se adicionan antibióticos a las dietas iniciadoras, es necesario que éstas se formulen con apenas 17–18% de proteína cruda (PC) para evitar el mal funcionamiento intestinal y la incidencia de diarreas.67 La incidencia y la severidad de las diarreas posdestete son mayores en lechones alimentados con dietas altas en PC (Figuras 2 y 3).10,18,37,68 Al elevar el nivel de PC de las dietas de 13% a 23%, se observó un aumento en la fluidez de las heces y disminución de su materia seca, incrementando el riesgo de incidencia en desórdenes entéricos posdestete.10 Heo et al.68 concluyen que dietas bajas en PC (17.3% contra 24.3% de PC) disminuyen la incidencia de diarreas en los primeros 7–10 días posdestete. Respuestas similares se observaron utilizando dietas con 23.6% y 17.6% de PC,18 o reduciendo la PC dietaria de 23.1% a 17.2% (Figura 3) .69 Con una mayor restricción de la PC dietaria (de 20% a 12% de PC)3 también se consignaron heces menos líquidas y con un mayor contenido de materia seca en los lechones alimentados con la dieta baja en PC. Se ha observado2 que en lechones destetados a las cuatro semanas de vida y desafiados vía oral con ETEC (E. coli 0149 239/03) en el tercer día posdestete, el consumo de una dieta con 13% de PC incrementó la firmeza de las heces tres de manera significativa a seis días después del desafío en comparación con lechones alimentados con una dieta con 23% de PC.
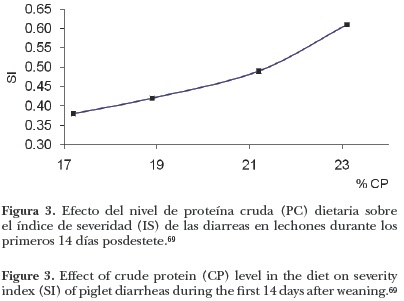
Una probable explicación a los efectos del nivel de PC dietaria sobre la incidencia y severidad de las DPD, es que dietas bajas en PC (17%) en relación a dietas altas en PC (23% o más) ayudan a mantener la salud intestinal a través de la reducción del nivel de nitrógeno ureico en plasma y de la producción de metabolitos microbianos tóxicos como el amoniaco, lo cual indica una reducción en la fermentación de proteínas.16,19,69No obstante, hay trabajos que señalan que el nivel de PC dietaria no afecta la incidencia de DPD. La reducción del nivel de PC de 22.4% a 16.9% no disminuyó la presentación de diarreas;15 tampoco se observó que la presencia de diarreas y la consistencia de las heces fuese afectada por el nivel de PC de la dieta (24% y 20%).17 Estos autores suponen que el buen estado sanitario de los lechones experimentales, además de la baja exposición a bacterias patogénicas, pudieron contribuir a la baja incidencia de DPD durante los primeros 14 días posdestete y a la falta de respuesta a la reducción del nivel de PC dietario.
Con base en todo lo anterior, se concluyó que las DPD se deben a una combinación de factores relacionados con las condiciones fisiológicas e inmunológicas del TGI, y también con las características químicas de las dietas iniciadoras y su efecto en el equilibrio de la flora microbiana intestinal, comensal y patogénica. El uso de probióticos y prebióticos en las raciones iniciadoras representa una alternativa para reemplazar los antibióticos en control de las DPD. El impacto de la concentración de PC dietaria sobre la incidencia de las diarreas posdestete no es concluyente, pues los resultados encontrados por diferentes autores son contradictorios. Sin embargo, hay evidencias importantes de que en dietas para lechones libres de antibióticos, el uso de bajas concentraciones de proteína ayuda a mantener la integridad intestinal en las dos primeras semanas posdestete; esto a través de la reducción del nivel de nitrógeno ureico plasmático y de la producción de metabolitos microbianos tóxicos como el amoniaco, lo que indica una reducción en la fermentación de proteínas. Es probable que la adición de prebióticos o de probióticos a dietas con un bajo nivel de proteína dietaria pueda generar resultados positivos para la salud intestinal de los lechones y disminuir el uso de antibióticos en las dietas iniciadoras.
Referencias
1. BOLDUAN G, JUNG H, SCHNABEL E, SCHNEIDER R. Recent advances in nutrition of weaner piglets. Pig News Infor 1988; 9:382. [ Links ]
2. WELLOCK IJ, FORTOMARIS PD, HOUDIJK JGM, KYRIAZAKIS I. Effects of dietary protein supply, weaning age and experimental enterotoxigenic Escherichia coli infection on newly weaned pigs health. Animal 2008; 2:834–842. [ Links ]
3. SØRENSEN MT, VESTERGAARD EM, JENSEN SK, LAURIDSEN C, HØJSGAARD S. Performance and diarrhea in piglets following weaning at seven weeks of age: Chalenge with E. coli 0 149 and effect of dietary factors. Livest Sci 2009; 123:314–321. [ Links ]
4. LE DIVIDICH J, SÈVE B. Effects of underfeeding during the weaning period on growth, metabolism, and hormonal adjustments. Domest Anim Endocrinol 2000;19: 63–74. [ Links ]
5. CRANWELL PD. Development of the neonatal gut and enzyme systems. In: VARLEY MA, editor. The neonatal pig development and survival. Wallingford UK: CAB International, 1995:99–154. [ Links ]
6. PIERCE KM, CALLAN JJ, MCCARTHY P, O'DOHERTY JV. Effects of high dietary concentration of lactose and increased soya–bean meal inclusion in starter diets for piglets. Anim Sci 2004; 79:445–452. [ Links ]
7. LALLÈS JP, BOSI P, SMIDT H, STOKES CR. Weaning, a challenge to gut physiologists. Livest Sci 2007; 108:82–93. [ Links ]
8. FIGUEROA VJL, CHI MEE, CERVANTES RM, DOMINGUEZ VIA. Functional foods for weanling pigs. Vet Méx 2006; 37:117–136. [ Links ]
9. VERSTEGEN MWA, WILLIAMS BA. Alternatives to the use of antibiotics as growth promoters for monogastric animals. Anim Biotechnol 2002; 13:113–127. [ Links ]
10. WELLOCK IJ, FORTOMARIS PD, HOUDIJK JGM, KYRIAZAKIS I. The effect of dietary protein supply on the performance and risk of post–weaning enteric disorders in newly weaned pigs. Anim Sci 2006; 82:327–335. [ Links ]
11. PLUSKE JR, PETHICK DW, HOPWOOD DE, HAMPSON DJ. Nutritional influences on some mayor enteric bacterial diseases of pigs. Nutr Res Rev 2002; 15:333–371. [ Links ]
12. ROSELI M, FINAMORE A, BRITTI MS, BOSI P, OSWALD I, MENGHERI E. Alternatives to in–feed antibiotics in pigs: Evaluation of probiotics, zinc or organic acids as protective agents for the intestinal mucosa. A comparison of in vitro and in vivo results. Anim Res 2005; 54:203–218. [ Links ]
13. STEIN HH, KIL DY. Reduced use of antibiotic growth promoters in diets fed to weanling pigs: dietary tools. Part 2. Anim Biotechnol 2006; 17:227–231. [ Links ]
14. LALLÈS JP, BOSI P, HAUKE S, STOKES CR. Nutritional management of gut health in pigs around weaning. Proc Nutr Soc 2007; 66:260–268. [ Links ]
15. LE BELLEGO L, NOBLET J. Performance and utilization of dietary energy and amino acids in piglet fed low protein diets. Livest Prod Sci 2002; 76:45–58. [ Links ]
16. NYACHOTI CM, OMOGBENIGUN FO, RADEMACHER M, BLANK G. Performance response and indicators of gastrointestinal health in early–weaned pigs fed low–protein amino acid–supplemented diets. J Anim Sci 2006; 84:125–134. [ Links ]
17. HTOO JK, ARAIZA BA, SAUER WC, RADEMACHER M, ZHANG Y, CERVANTES M et al. Effect of dietary protein content on ileal amino acid digestibility, growth performance, and formation of microbial metabolites in ileal and cecal digesta of early–weaned pigs. J Anim Sci 2007; 85:3303–3312. [ Links ]
18. REIS DE SOUZA TC, STEIN HH, MARISCAL–LANDÍN G, URRIOLA PE. Efecto del nivel de proteína y aminoácidos azufrados en dietas para lechones sobre la incidencia y severidad de diarreas posdestete. Memorias XLIV Congreso Nacional AMVEC; 2009 Julio 22–25; Puerto Vallarta (Jalisco), México. México DF: Asociación Mexicana de Veterinarios Especialistas en Cerdos, 2009:184. [ Links ]
19. WELLOCK IJ, HOUDIJK JGM, MILLER AC, GILL BP, KYRIAZAKIS I. The effect of weaner diet protein content and diet quality on the long–term performance of pigs to slaughter. J Anim Sci 2009; 87:1261–1269. [ Links ]
20. DONG GZ, PLUSKE JR. The low feed intake in newly–weaned pigs: problems and possible solutions. Asian–Aust J Anim Sci 2007; 20:440–452. [ Links ]
21. LAINE MT, TAPANI L, MAIJA Y, MARJUKKA A. Risk factors for post–weaning diarrhea on piglets producing farm in Finland. Acta Vet Scand 2008; 50:21–31. [ Links ]
22. DIRKZWAGER A, VELDMAN B, BIKKER P. A nutritional approach for the prevention of post weaning syndrome in piglets. Anim Res 2005; 54:231–236. [ Links ]
23. MCCRACKEN BA, SPURLOCK ME, ROOS MA, ZUCKERMANN FA, GASKINS HR. Weaning anorexia may contribute to local inflammation in the piglet small intestine J Nutr 1999; 129:613–619. [ Links ]
24. LALLÈS JP, BOUDRY G, FAVIER C, LE FLOC'H N, PIÉ S, PIEL C et al. Gut function and dysfunction in young pigs: physiology. Anim Res 2004; 53:301–316. [ Links ]
25. KELLY D, SMYTH JA, MCCRACKEN KJ. Digestive development of the early–weaned pig. 2. Effect of level of food intake on digestive enzyme activity during the immediate post–weaning period. Br J Nutr 1991; 65:181–188. [ Links ]
26. LALLÈS JP, TOULLEC R. Digestion des proteins vègétales et hypersensibilité digestive chez le veau prèrumiant. INRA Prod Anim 1996; 9:255–264. [ Links ]
27. McCRACKEN KJ, KELLY D. Development of digestive function and nutrition/disease interactions in the weaned pig. In: FARRELL DJ, editor. Recent advances in animal nutrition in Australia. Armidale AU: Department of Biochemistry, Microbiology and Nutrition, University of New England, 1993:182–192. [ Links ]
28. REIS DE SOUZA TC, MARISCAL–LANDÍN G. El destete, la función digestiva y de la digestibilidad de los alimentos en cerdos jóvenes. Téc Pec Méx 1997; 35:145–159. [ Links ]
29. SAUER WC, FAN MZ, MOSENTHIN R, DROCHNER W. Methods for measuring ileal amino acid digestibility in pigs. In: D'MELLO JPF, editor. Farm animal metabolism and nutrition. Wallingford UK: CABI publishing, 2000:279–306. [ Links ]
30. MARISCAL LG, REIS DE SOUZA TC, HERNÁNDEZ DAA, ESCOBAR KG. Pérdidas endógenas de nitrógeno y aminoácidos en cerdos y su aplicación en la estimación de los coeficientes de digestibilidad ileal de la proteína y aminoácidos de las materias primas. Revisión. Téc Pec Méx 2009; 47:371–388. [ Links ]
31. BENGALA–FREIRE J, AUMAITRE A, PEINIAU J. Effects of feeding raw and extruded peas on ileal digestibility, pancreatic enzymes and plasma glucose and insulin in early weaned pigs. J Anim Physiol Anim Nutr (Berl) 1991; 65:154–164. [ Links ]
32. DARRAGH AJ, HODGKINSON SM. Criteria and significance of dietary protein sources in humans. Quantifying the digestibility of dietary protein. J Nutr 2000; 130:1850–1856. [ Links ]
33. ALBIN DM, WUBBEN JE, SMIRICKY MR, GUBERT VM. The effect of feed intake on ileal rate of passage and apparent amino acid digestibility determined with or without corrections factors in pigs. J Anim Sci 2001; 79:1250–1258. [ Links ]
34. STEIN HH, KIM SW, NIELSEN TT, EASTER RA. Standardized ileal protein and amino acid digestibility by growing pigs and sows. J Anim Sci 2001; 79:2113–2122. [ Links ]
35. REIS DE SOUZA TC. Conséquences digestives, métaboliques et zootechniques de l'incorporation des lipides dans la ration du porcelet au sevrage (tesis de doctorado). Rennes Francia: Universidad de Rennes, 1992. [ Links ]
36. WISEMAN J, PICKARD J, ZARKADAS L. Starch digestion in piglets. In: VARLEY MA, WISEMAN J, editors. The weaner pig: nutrition and management. New York: CABI Publishing, 2001:65–80. [ Links ]
37. BALL RO, AHERNE FX. Influence of dietary nutrient density, level of feed intake and weaning age on young pigs. II. Apparent nutrient digestibility and incidence and severity of diarrhea. Can J Anim Sci 1987; 67:1105–1115. [ Links ]
38. WISEMAN J. Variations in starch digestibility in non–ruminants. Anim Feed Sci Tech 2006; 130:66–77. [ Links ]
39. SALGADO P, FREIRE JPB, MOURATO M, CABRAL F, TOULLEC R, LALLÈS JP. Comparative effects of different legume protein sources in weaned piglets: nutrient digestibility, intestinal morphology and digestive enzymes. Livest Prod Sci 2002; 74:191–202. [ Links ]
40. WILLIAMS BA, BOSCH MW, AWATI A, KONSTANTINOV SR, SMIDT H, AKKERMANS ADL et al. In vitro assement of gastrointestinal tract (GIT) fermentation in pigs: fermentable substrates and microbial activity. Anim Res 2005; 54:191–201. [ Links ]
41. PLUSKE JR. Nutritional mangement of the gastrointestinal tract to reduce enteric diseases in pigs. Adv Anim Nutr Aust 2001; 13:127–134. [ Links ]
42. WILLIAMS BA, VERSTEGEN MWA, TAMMINGA S. Fermentation in the large intestine of single–stomached animals and its relationship to animal health. Nutr Res Rev 2001; 14:207–227. [ Links ]
43. GASKINS HB, COLLIER CT, ANDERSON DB. Antibiotics as growth promotants: mode of action. Anim Biotechnol 2002; 13:29–42. [ Links ]
44. CONE JW, JONGBLOED AW, VAN GELDER AH, DE LANGE L. Estimation of protein fermentation in the large intestine of pigs using a gas production technique. Anim Feed Sci Technol 2005; 123–124:463–472. [ Links ]
45. BOUDRY G, PÉRON V, LE HUÉROU–LURON I, LALLÈS JP, SÈVE B. Weaning induces both transient and long–lasting modifications of absorptive, secretory, and barrier properties of piglet intestine. J Nutr 2004; 134:2256–2262. [ Links ]
46. MELIN L, JENSEN–WAERN M, JOHANNISSON A, EDEROTH M, KATOULI M, WALLGREN P. Developement of selected faecal microfloras and of phagocytic and killing capacity of neutrophils in young pigs. Vet Microb 1997; 54:287–300. [ Links ]
47. MONTAGNE L, PLUSKE JR, HAMPSON DJ. A review of interactions between dietary fibre and the intestinal mucosa, and their consequences on digestive health in young non–rumiant animals. Anim Feed Sci Technol 2003; 108:95–117. [ Links ]
48. PÉREZ DE ROZAS AM, ROCA M, CARABAÑO R, DE BLAS C, FRANCESCH JB, MARTIN–ORUE S et al. El estudio de la Diversidad Intestinal por RFLP. Memorias del XIX Curso de Especialización FEDNA; 2003 Octubre 23 – 24; Madrid, España. Madrid, España: Fundación española para el desarrollo de la nutrición animal, 2003:31–45. [ Links ]
49. TAKAHASHI S, YOSHIDA Y, NAKANISHI N, TSUKAHARA T, USHIDA K. Quantitative real–time PCR monitoring of Escherichia coli and Clostridium perfringes with oral administration of Lactobacillus plantarum strin Lq 80 to weaning piglets. J Anim Sci 2008; 79:737–744. [ Links ]
50. ESCALANTE–LOZADA A, GOSSET–LAGARDA G, MARTINEZ–JIMÉNEZ A, BOLÍVAR–ZAPATA F. Diversidad bacteriana del suelo: método de estudio no dependiente del cultivo microbiano e implicaciones biotecnológicas. Agrociencias 2004; 38:583–592. [ Links ]
51. KONSTANTINOV SR, ZHU WY, WILLIAMS BA, TAMMINGA S, DE VOS WM, AKKERMANS ADL. Effect of fermentable carbohydrates on piglets faecal bacterial communities as revealed by denaturing gradient gel electrophoresis analysis of 16s ribosomal DNA. FEMS Microb Ecol 2003; 43:225–235. [ Links ]
52. KONSTANTINOV SR, FAVIER CF, ZHU WY, WILLIAMS BA, KLÜB J, SOUFFRANT WB et al. Microbial diversity studies of the porcine gastrointestinal ecosystem during weaning transition Anim Res 2004; 53:317–324. [ Links ]
53. LESER TD, AMENUVOR JZ, JENSEN TK, LINDECRONA RH, BOYE M, MOLLER K. Cuture–Independent analysis of gut bacteria: the pig gastrointestinal tract microbiota revisited. Appl Environ Microbiol 2002; 68:673–690. [ Links ]
54. PLUSKE JR, HOPWOOD DE, HAMPSON DJ. Relación entre la microbiótica intestinal, el pienso y la incidencia de diarreas, y su influencia sobre la salud del lechón tras el destete. Memorias del XIX Curso de Especialización FEDNA; 2003 octubre 23–24; Madrid, España. Madrid, España: Fundación para el desarrollo de la nutrición animal, 2003:93–108. [ Links ]
55. CASTILLO GMS. Development of gut microbiota in the pig: modulation of bacterial communities by different feeding strategies [master in science]. Barcelona, Spain: Universitat Autónoma de Barcelona, 2006. [ Links ]
56. INOUE R, TSUKAHARA T, NAKANISHI N, USHIDA K. Development of the intestinal microbiota in the piglet. J Gen Appl Microbiol 2005; 51:257–265. [ Links ]
57. SIMPSON JM, MCCRACKEN VJ, GASKINS HR, MACKIE RI. Denaturing gradient gel electrophoresis analysis of 16S ribosomal DNA amplicons to monitor changes in fecal bacterial populations of weaning pigs after introduction of Lactobacillus reuteri strain MM53. Appl Environ Microbiol 2000; 66:4705–4714. [ Links ]
58. VENTE–SPREEUWENBERG MAM, VERDONK JMAJ, BEYNEN AC, VERSTEGEN MWA. Interrelationships between gut morphology and faeces consistency in newly weaned piglets. Anim Sci 2003; 77:85–94. [ Links ]
59. VELASCO JLF, MORENO EEC, RAMÍREZ MC, VARA IAD. Alimentos funcionales para cerdos al destete. Vet Méx 2006; 37:117–136. [ Links ]
60. SCHREZENMEIR J, DE VRESE M. Probiotics, prebiotics and synbiotcs–approaching a definition. Am J Clin Nutr 2001; 73:361S–364S. [ Links ]
61. GUARNER F, SCHAAFSMA GJ. Probiotics. International J Food Microbiol 1998; 39:237–238. [ Links ]
62. METZLER B, BAUER E, MOSENTHIN R. Microflora management in the gastrointestinal tract of piglets. Asian–Australas J Anim Sci 2005; 18:1353–1362. [ Links ]
63. HUANG C, QIAO S, LIFA D, PIAO X, REN J. Effects of lactobacilli on the performance, diarrhea incidence, VFA concentration and gastrointestinal microbial flora of weaning pigs. Asian–Australas. J Anim Sci 2004; 17:401–409. [ Links ]
64. SCHOROEDER B, DUNCKER S, BARTH S, BAUERFEIND R, GRUBER AD, DEPPENMEIER S et al. Preventive effects of the probiotc Escherichia coli strain Nissle 1917 on acute secretory diarrhea in a pig model of intestinal infection. Dig Dis Sci 2006; 51:724–731. [ Links ]
65. REYNOSO E, CERVANTES M, FIGUEROA JL, CUCA JM. Productive response of pigs to low–protein diets added synthetic amino acids and yeast culture. Cuban J Agricultural Sci 2004; 38:269–275. [ Links ]
66. GIBSON GR, ROBERFOID MB. Dietary modulation of the human colonic microbiota: introducing the concept of prebiotics. J Nutr 1995; 125: 899–907. [ Links ]
67. STEIN HH. Experience of feeding pigs without antibiotics: a European perspective. Anim Biotech. 2002; 13:85–95. [ Links ]
68. HEO JM, KIM JC, HANSEN CF, MULLAN BP, HAMPSON DJ, PLUSKE JR. Effects of feeding low protein diets to piglets on plasma urea nitrogen, faecal ammonia nitrogen, the incidence of diarrhea and performance after weaning. Arch Anim Nutr 2008; 29:343–358. [ Links ]
69. YUE LY, QIAO SY. Effects of low–protein diets supplemented with crystalline amino acids on performance and intestinal development in piglets over the first 2 week after weaning. Livest Sci 2007; 115:144–152. [ Links ]














