Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Veterinaria México
versión impresa ISSN 0301-5092
Vet. Méx vol.41 no.4 Ciudad de México oct./dic. 2010
Artículos científicos
Características anatómicas y fisiológicas de los músculos pélvicos en la coneja doméstica (Oryctolagus cuniculus)
Anatomical and physiological characteristics of pelvic muscles in the female rabbit (Oryctolagus cuniculus)
Yolanda Cruz* Dora Luz Corona–Quintanilla* Margarita Juárez* Margarita Martínez–Gómez**
* Centro Tlaxcala de Biología de la Conducta, Universidad Autónoma de Tlaxcala, km 1.5, Carretera Tlaxcala–Puebla, 90070, Tlaxcala, Tlaxcala, México.
** Departamento de Biología Celular y Fisiología, Instituto de Investigaciones Biomédicas, Universidad Nacional Autónoma de México, 04510, México, D. F.
Correspondencia:
Margarita Martínez Gómez,
Teléfono/fax: (246) 4 62 15 57,
Correo electrónico: marmag@biomedicas.unam.mx
Recibido el 10 de febrero de 2010
Aceptado el 10 de agosto de 2010.
Abstract
In mammals, the pelvic striated muscles have been linked to the regulation of urinary functions and little is known about the involvement of this muscle in reproductive functions. The objective of this study was to use surgical and electrophysiological techniques to determine the anatomical features and innervation of iliococcygeus and pubococcygeus muscles in adult female rabbits and characterize the reflex electromyographic (EMG) activity in response to genital stimulation. Results show that the iliococcygeus and pubococcygeus are long bilateral muscles with fibers attached to the ilium bone. The muscle fibers are not attached to the pelvic viscera but they run adjacent to the vagina and rectum to be inserted into the sacral vertebrae. The iliococcygeus and pubococcygeus muscles are innervated by branches arising from S3 and S4. The reflex EMG activity was obtained during stimulation of the vaginal orifice skin and the perineal and pelvic vagina. Abdominal vaginal stimulation did not cause an EMG response. Cervical stimulation produced a temporary inhibition in the activity of the iliococcygeus and pubococcygeus. These findings extend the poor descriptions of innervation and anatomy of the striated pelvic musculature shown in the textbooks and atlas of rabbits. They also suggest that the iliococcygeus and pubococcygeous muscles can be activated by reflex action during reproductive processes such as mating and parturition.
Key words: Pelvic floor muscles, Innervation, Vaginal stimulation, Reflex activity, Gross anatomy.
Resumen
En mamíferos, la musculatura estriada pélvica se ha relacionado con la regulación de funciones urinarias y poco se sabe de su participación en funciones reproductivas. Los objetivos del presente estudio fueron determinar las características anatómicas y la inervación de los músculos iliococcígeo y pubococcígeo de la coneja adulta, y caracterizar la actividad electromiográfica (EMG) refleja en respuesta a la estimulación genital. Para ello se utilizaron técnicas quirúrgicas y electrofisiológicas. Los resultados muestran que el iliococcígeo y pubococcígeo son músculos bilaterales que se originan en el hueso iliaco; están inervados por ramas que emergen de S3 y S4; sus fibras musculares no se adhieren a las vísceras pélvicas, sino que discurren lateral a la vagina y al recto y se insertan en las vértebras sacras. Durante la estimulación de la piel del orificio vaginal y la vagina pélvica y perineal se presentó actividad EMG refleja en ambos músculos. La estimulación de la vagina abdominal no indujo respuesta EMG. La estimulación cervical produjo inhibición temporal en la actividad del iliococcígeo y pubococcígeo. Estos resultados contribuyen a las escasas descripciones anatómicas de la musculatura pélvica de la coneja que se encuentran en libros de texto y atlas; también sugieren que los músculos pélvicos iliococcígeo y pubococcígeo podrían activarse reflejamente durante procesos reproductivos, como la cópula y el parto.
Palabras clave: Músculos del piso pélvico, Innervación, Estimulación vaginal, Actividad refleja, Anatomía gruesa.
Introducción
Las conejas domésticas (Oryctolagus cuniculus) se caracterizan por tener cópulas y partos breves en comparación con otras especies politocas, pues paren diez o más crías en un periodo de tres a 12 minutos (diez minutos en promedio).1 En contraparte, las ratas paren el mismo número de crías en casi una hora.1 Otro proceso fisiológico peculiar de los conejos constituye la micción; tanto machos como hembras presentan diferentes formas de expulsar la orina, dependiendo del contexto social. La forma más común de orinar cuando el animal se encuentra solo es en cuclillas; en presencia de congéneres los animales orinan en chisguete, en goteo o en rocío. Estos dos últimos tipos de expulsión de orina se han relacionado con la función de comunicación química.2
Es probable que las diversas y eficientes funciones del sistema urogenital en la coneja estén basadas en sus especializaciones anatómicas y fisiológicas. Una de éstas sería la musculatura estriada adyacente al tracto urogenital.3 En estudios previos se describieron las características anatómicas y fisiológicas de dos músculos perineales: isquiocavernoso y bulboesponjoso.4 El presente estudio se enfocó en el análisis de dos músculos pélvicos: iliococcígeo y pubococcígeo. En otras especies, a estos músculos también se les conoce como músculo elevador del ano, se ha propuesto que este contribuye a la regulación de funciones urinarias y sexuales.5–8
Aunque la coneja doméstica es muy utilizada para estudiar la biología reproductiva femenina de los mamíferos, no se ha descrito la topografía anatómica y la fisiología de sus músculos pélvicos, ni su relación con la regulación de funciones reproductivas.9–11 Los objetivos del presente trabajo fueron determinar las características anatómicas y la inervación de los músculos iliococcígeo y pubococcígeo de la coneja adulta, así como caracterizar la actividad electromiográfica refleja en respuesta a la estimulación genital.
Material y métodos
Se utilizaron 12 conejas adultas vírgenes de la raza Chinchilla (3.5 a 4 kg). Las hembras fueron alojadas en jaulas individuales de acero inoxidable (50 x 60 x 40 cm) y se mantuvieron en bioterio con ciclo luz–oscuridad artificial (L/O 16:8 h, la luz se encendía a las 6:00 am) a 20 ± 2°C. Se les proporcionó alimento* y agua ad libitum. Las conejas se anestesiaron con uretano** 1.5 g/kg, diluido al 20% en agua destilada.
Cuando fue necesario se administraron dosis adicionales.
Los animales se alojaron y trataron de acuerdo con los lineamentos del Consejo Mexicano para el Cuidado de los Animales (Norma Oficial Mexicana NOM–062–Z00–1999) y la Guía para el cuidado y uso de animales de laboratorio del National Institute of Health. El protocolo experimental fue aprobado por el Comité de Ética del Cuidado de los Animales, de la Universidad Autónoma de Tlaxcala.
Anatomía macroscópica
Los músculos iliococcígeo y pubococcígeo fueron localizados de acuerdo con un estudio previo.3 Se realizó análisis con vista dorsal y ventral; con microscopio estereoscópico* se observaron los músculos y se determinaron sus características anatómicas (inserción, longitud, anchura y grosor), sus relaciones topográficas con las estructuras adyacentes y su inervación. Se tomaron fotografías digitales.
Estimulación eléctrica
La inervación fue corroborada mediante la técnica de estimulación eléctrica. Se disecaron los nervios que se dirigieron a las fibras de los músculos iliococcígeo y pubococcígeo y se seccionaron. Se montaron las terminales caudales (abajo del corte) sobre electrodos bipolares de plata clorurada y se estimularon con pulsos cuadrados de 0.5–30 Hz, 0.2 ms y 0.2 yiV–2.5 V. Los pulsos fueron generados por un estimulador** conectado a una unidad de aislamiento.*** Se realizó estimulación unilateral (siempre a los nervios del lado derecho) y bilateral. Se determinó si durante la estimulación los músculos iliococcígeo y pubococcígeo se contraían, o si había movimiento de las estructuras adyacentes a ambos músculos.
Actividad electromiográfica refleja
Electromiogramas
Se realizó incisión de aproximadamente dos cm en la piel de la región dorsal de la base de la cola. En cada músculo (iliococcígeo y pubococcígeo izquierdo) se insertó un par de electrodos de acero inoxidable de 0.1 mm de diámetro y cubierto de teflón, excepto 1 mm en la punta. La actividad eléctrica fue amplificada con un preamplificador† de banda ancha que estaba conectado a un polígrafo.‡ La actividad electromiográfica también se detectó mediante el audio conectado en paralelo con el preamplificador. Se consideró como una respuesta electromiográfica cuando la amplitud de la actividad basal se incrementó al menos en 30%.
Estimulación mecánica
Piel perigenital y clítoris
Con un hisopo de algodón se estimuló la piel inguinal, la piel perivaginal, la piel perineal (entre el orificio vaginal y el ano) y la piel que cubre a la vagina perineal. El clítoris fue estimulado directamente con el hisopo y a través de la presión de la pared ventral de la vagina perineal.
Tracto vaginocervical
Se uso un émbolo de vidrio de 0.5 cm de diámetro cubierto con aceite mineral para estimular al tracto vaginal. Se introdujo el émbolo en el tracto vaginal hasta alcanzar el nivel deseado (perineal, pélvica, abdominal y cérvix) (Figura 1) y se retiró.

En cada coneja se eligió de forma aleatoria el tipo de estimulación y el nivel del tracto vaginal a estimular. Además, se realizaron al menos dos repeticiones de la estimulación cutánea y la vaginal. Los electrodos fueron insertados en los músculos diez minutos antes de iniciar la estimulación. Se grabó la actividad electromiográfica basal (antes de aplicar el estímulo) y la inducida (durante la estimulación y dos a cinco minutos después de que se retiró). El intervalo entre un estímulo y otro fue de dos a tres minutos cuando no hubo respuesta post–estimulación. Si el músculo respondió con posdescarga, se esperó de cinco a diez min después de que ésta cesara.
Resultados
Los resultados aquí descritos fueron consistentes entre los animales.
Anatomía macroscópica
Los músculos iliococcígeo y pubococcígeo son bilaterales. Se originaron en la espina ciática del hueso iliaco y se insertaron en las vértebras coccígeas. Se encontraron adyacentes al aparato urogenital, al recto y a la glándula anal; sin embargo, sus fibras no se unieron a las vísceras pélvicas.
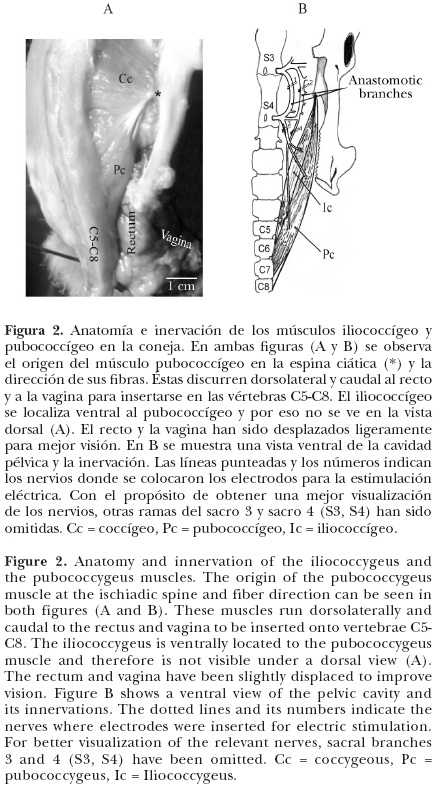
Músculo iliococcígeo
Este músculo no se pudo observar desde una vista dorsal (Figura 2A). Con vista ventral fue localizado ventrolateral al músculo coccígeo y al músculo pubococcígeo, dorsolateral al recto, caudal a la porción de la vagina pélvica y al plexo venoso y rostral a la porción de la vagina perineal (Figura 2). Las fibras del iliococcígeo emergen en la espina ciática del hueso iliaco (Figura 2A). Estas fibras discurrieron caudalmente y se insertaron mediante dos largos tendones (12 ± 2.2 mm) en las vértebras coccígeas 5 y 6 (C5, C6) (Figura 2B). El músculo iliococcígeo midió, en promedio, 35 ± 0.5 mm de longitud, 2.5 ± 0.8 mm de ancho y 26 ± 0.5 mm de grosor.
Músculo pubococcígeo
El pubococcígeo tiene forma de huso. Se localizó caudal al músculo coccígeo y dorsolateral al iliococcígeo. Se originó en un tendón adosado a la espina ciática del hueso iliaco (Figura 2A). Sus fibras presentaron orientación dorsocaudal y alrededor de 80% de sus fibras se insertaron directamente, sin apariencia tendinosa, en las vértebras coccígeas 6 y 7 (C6, C7); el resto de las fibras se mezcló con un tendón que se inserta en la vértebra coccígea 8 (C8). No hubo tejido conjuntivo que separara las fibras del músculo pubococcígeo de las del coccígeo, pero sí entre el pubococcígeo y el iliococcígeo (Figura 2A). La longitud promedio de este músculo fue de 43 ± 1.8 mm de longitud, 5 ± 1.1 mm de ancho y 26 ± 0.9 mm de grosor.
Inervación de los músculos iliococcígeo y pubococcígeo
Con la anatomía macroscópica se observó que los nervios que se distribuyen en los músculos del piso pélvico emergen de los nervios espinales sacros 3 (S3) y 4 (S4) (Figura 2B). Estos nervios espinales son complejos y de ellos emergen varios nervios que se dirigen a otras estructuras pélvicas, como vísceras. Dos ramas del nervio espinal S3 (1 y 2 en la Figura 2B) se anastomosan con ramas del nervio espinal S4. De estas ramas anastomóticas surgen los nervios enumerados como 3 y 4 en la Figura 2B. El nervio 3 se bifurcó y sus ramas discurrieron caudalmente y se distribuyeron en las fibras de los dos músculos, iliococcígeo y pubococcígeo. El nervio 4 se dirigió a la porción caudal de las fibras del pubococcígeo (Figura 2B).
Estimulación eléctrica unilateral
La estimulación de los nervios que surgen de S3 y S4 que se dirigen a visceras pelvicas no causó contracción muscular en el iliococcigeo ni en el pubococcígeo. La estimulación eléctrica independiente de cada rama anastomótica o de los nervios que emergen de S3 (1 y 2 en la Figura 2B) produjo contraccion de los músculos pubococcigeo y coccigeo. La estimulación eléctrica del nervio 3 (Figura 2B), que emerge de S4, ocasionó la contracción de las fibras del pubococcígeo y las del iliococcígeo. La estimulación eléctrica del nervio 4 (Figura 2B), que emerge de la rama anastomótica 2, causó contracción del músculo pubococcígeo. En todos los casos los músculos que respondieron fueron los del lado ipsilateral al nervio estimulado. La estimulación de la porción caudal de los nervios 3 y 4 (Figura 2B) produjo ligero movimiento de abducción de la cola.
Cuando se realizó estimulación bilateral de los nervios que inervan a los músculos iliococcígeo y pubococcígeo (3 y 4 en la Figura 2) se observó que la cola se elevó cerca de un cm y se mantuvo rígida sobre la línea media.
Actividad refleja EMG
Las Figuras 3, 4 y 5 muestran ejemplos de los registros típicos obtenidos.


Estimulación de la piel perigenital y del clítoris
La estimulación mecánica de la piel de la vagina perineal, de la región inguinal y de la base de la cola no produjo respuesta electromiográfica ni en el iliococcígeo ni en el pubococcígeo. La estimulación de la piel perivaginal y la del clítoris provocó potenciales de acción en ambos músculos (Figura 3). La respuesta fue tónica y dependió de la duración del estímulo. En la Figura 3 se muestra un registro obtenido en el músculo iliococcígeo durante la estimulación del clítoris; fue similar el electromiograma registrado en el pubococcígeo durante la estimulación clitoral.
Estimulación vaginocervical
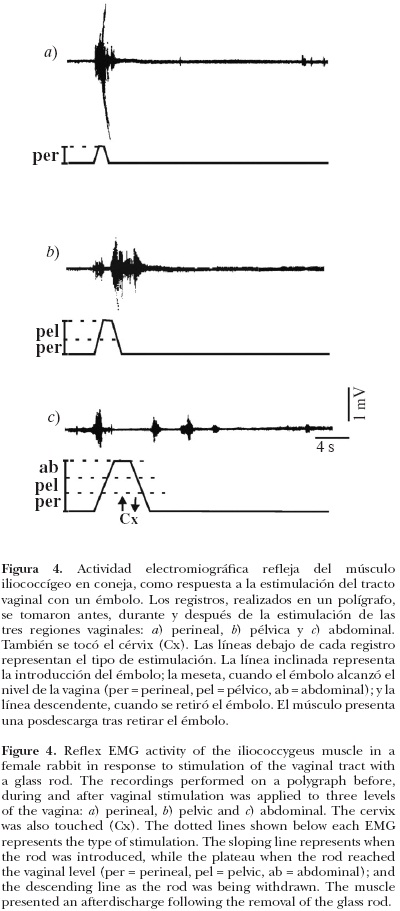
La estimulación genital indujo respuestas fásicas, tónicas y posdescargas en los músculos, iliococcígeo y pubococcígeo. La respuesta electromiográfica dependió de la región del tracto vaginal que se estimuló.
En el músculo iliococcígeo se presentaron potenciales de acción de gran amplitud y de corta duración cuando se estimuló la vagina perineal y pélvica. Cuando la estimulación cesó, al retirar el émbolo, la actividad permaneció durante tres segundos (Figura 4). Sólo al introducir el émbolo hasta la vagina abdominal o al cérvix, los músculos iliococcígeo y pubococcígeo se activaron, pero no al retirarlo (Figura 4). Después de la estimulación se presentó un tren de potenciales de acción de larga duración (Figura 4).
Cuando se registró la actividad del músculo pubococcígeo se observó que el patrón de la respuesta a la estimulación vaginocervical fue similar a la descrita para el músculo iliococcígeo. Sin embargo, al retirar el émbolo, después de estimular el cérvix, se presentó una posdescarga tónica de mayor amplitud y duración (alrededor de tres a cuatro min) que la que sucedió en el músculo iliococcígeo (Figura 5).
Discusión
Los resultados de este estudio describen por primera vez la actividad EMG refleja de los músculos iliococcígeo y pubococcígeo de la coneja en respuesta a la estimulación del tracto genital y amplían las escasas descripciones en los libros de texto y atlas sobre las características anatómicas de estos músculos y su inervación.12,13
Consistente con las descripciones en otras especies, incluyendo los seres humanos,14–18 los músculos iliococcígeo y pubococcígeo de la coneja forman el músculo elevador del ano. Hay similitudes y diferencias de esta musculatura con las de otras especies; por ejemplo, en los seres humanos el elevador del ano es un complejo muscular formado por los músculos iliococcígeo, pubococcígeo y puborrectal,19 las fibras de éstos se encuentran en estrecha relación anatómica y es difícil definir sus límites;19 además, las fibras del puboccocígeo se adhieren a la pared vaginal, y las del puborrectal al recto y ano. Por esta razón, algunos investigadores llaman a estas fibras músculos puboviscerales.6 Los resultados aquí obtenidos muestran que a pesar de que el piso pélvico de la coneja también está formado por los músculos coccígeo y el elevador del ano, este último no tiene fibras adheridas a la pared vaginal ni al recto. Por tanto, en conejos no existe el músculo puborrectal, y el pubococcígeo no tiene relación directa con las vísceras urogenitales. Especies como la rata y el mono ardilla tampoco tienen el músculo puborrectal, pero las fibras del pubococcígeo sí se adhieren a la vagina.4,17,20
En el ser humano se sugiere que la principal función del piso pélvico consiste en sostener las vísceras pélvicas, así como mantener la continencia urinaria. El daño del piso pélvico produce incontinencia urinaria y fecal, lo cual constituye una disfunción muy común en la mujer.7,8,18,21 En este contexto, la ausencia de relación directa de las fibras del elevador del ano con las vísceras en la coneja puede ser una desventaja. Sin embargo, la función urogenital de las conejas no parece ser deficiente. No sólo son capaces de mantener la continencia urinaria, sino que también regulan la cantidad de orina expulsada y la dirección de ésta. Es posible que otros músculos estriados adyacentes al tracto urogenital, como el obturador interno y el constrictor vulvar, contribuyan a la regulación de estas funciones.
Respecto de la inervación de los músculos ilio–coccígeo y pubococcígeo en la coneja, este es el primer estudio que la corrobora mediante el uso de métodos electrofisiológicos. En un estudio previo se describió que la inervación de los dos músculos proviene de S3,3 dicha información se corrobora y amplía con este trabajo. Si bien del foramen S3 y S4 surge el plexo sacro, del cual emerge la inervación (4 en la Figura 2B) de algunas fibras del pubococcígeo, el nervio que emerge de S4 (3 en la Figura 2B) inerva a ambos músculos: iliococcígeo y pubococcígeo. Este patrón de inervación también se observa en los seres humanos, pues el músculo elevador del ano está inervado por dos nervios, uno que surge de S3 a S5 y el nervio pudendo.22,23 En ratas y monos ardilla la inervación del elevador del ano emerge más rostral, desde L6–S1 y S2,4,14,17 por lo que la coneja presenta organización nerviosa similar a la de los seres humanos, más parecida que la de la rata, el animal más utilizado en el laboratorio.
Los circuitos nerviosos permiten la activación de reflejos espinales y supraespinales que regulan los procesos reproductivos y no reproductivos de las funciones de los órganos pélvicos. Este estudio muestra que la estimulación mecánica de la piel de la vagina y la vagina pélvica y perineal produce actividad electromiográfica refleja de los músculos iliococcígeo y pubococcígeo. Sin embargo, la estimulación de la vagina abdominal y cérvix no sólo no activó los músculos, sino que los inhibió temporalmente. Los circuitos nerviosos que subyacen a estos reflejos viscerosomáticos son desconocidos. Estudios anatómicos muestran que la inervación de la vagina surge de los nervios hipogástrico y pélvico.18,24 Tal vez estos nervios tengan axones aferentes que desencadenan la actividad electromiográfica de los músculos iliococcígeo y pubococcígeo cuando se estimula mecánicamente el tracto vaginal. La vía eferente de este reflejo sería a través de los nervios motores aquí descritos (3 y 4 en la Figura 2B).
La estimulación vaginal genera una amplia gama de efectos, como los reflejos neuroendocrinos que liberan prolactina y oxitocina;25–28 la activación del sistema nervioso autónomo, que aumentan la frecuencia cardiaca y presión arterial,29 la inmovilización y la inhibición de los reflejos de retirada al estímulo nociceptivo;30–34 los reflejos visceroviscerales, que aumentan la presión uretral y disminuyen la presión vesical;35,36 y el reflejo visceromotor aquí referido, que también ha sido descrito en ratas y seres humanos.14,37–40 Estos hallazgos apoyan la idea de que la función de los músculos del piso pélvico no sólo es de soporte sino también regula la actividad visceral. Se ha descrito que la estimulación eléctrica de los músculos del piso pélvico inhibe las contracciones involuntarias del detrusor y podría controlar la incontinencia urinaria por urgencia.41 Estudios recientes apoyan la idea de que, en la coneja, los músculos pélvicos, como el pubococcígeo, contribuyen a la regulación de la micción.42
En la coneja, la función de la actividad electromiográfica de los músculos iliococcígeo y pubococcígeo causada por la estimulación de las estructuras genitales es desconocida, pero el hecho de que estos músculos pélvicos se hayan activado durante la estimulación vaginal aplicada con el émbolo sugiere que también podrían activarse durante la cópula, cuando el macho inserta el pene en la vagina. La contracción de estos músculos podría incrementar la presión intravaginal, aumentando la estimulación que recibe el pene y facilitando así la eyaculación. En este contexto, se ha propuesto que en mujeres los músculos pélvicos y sus nervios se dañan durante los partos vaginales, lo que induce incontinencia urinaria posparto.7 Sin embargo, no hay estudios en modelos animales para determinar si las características de la respuesta de los músculos iliococcígeo y pubococcígeo a la estimulación vaginal difiere entre hembras nulíparas y multíparas.
En el presente estudio la estimulación eléctrica produjo movimientos de la cola. La estimulación vaginal durante el apareamiento podría inducir la elevación de la cola y así permitir la inserción peneana. Además, el hecho de que los músculos iliococcígeo y pubococcígeo no tengan relación anatómica directa con las vísceras no excluye la posibilidad de que su contracción aumente la presión intravaginal e intrauretral, contribuyendo a la continencia urinaria, a la estimulación del pene durante el apareamiento y a la expulsión de las crías durante el parto.
Agradecimientos
Se agradece el apoyo del Consejo Nacional de Ciencia y Tecnología de México (proyectos Conacyt 40081 YC y 105882 MMG ; beca 191915–DC), PAPIIT UNAM (228110 MMG ) y de la Universidad Autónoma de Tlaxcala (UATX–191); asimismo, a Isela Hernández, Germán Mendoza y Laura García, por su excelente asistencia técnica.
Referencias
1. HUDSON R, CRUZ Y, LUCIO RA, NINOMIYA J, MARTINEZ–GOMEZ M. Temporal and behavioral patterning of parturition in rabbits and rats. Physiol Behav 1999; 66:599–604. [ Links ]
2. BELL DJ. Social olfaction in lagomorphs. Sym Zool Soc Lond 1980; 45:141–164. [ Links ]
3. MARTINEZ–GOMEZ M, LUCIO RA, CARRO M, PACHECO P, HUDSON R. Striated muscles and scent glands associated with the vaginal tract of the rabbit. Anat Rec 1997; 247:486–493. [ Links ]
4. CRUZ Y, ZEMPOALTECA R, LUCIO RA, PACHECO P, HUDSON R, MARTINEZ–GOMEZ M. Pattern of sensory innervation of the perineal skin in the female rat. Brain Res 2004; 1024:97–103. [ Links ]
5. GRABER B, KLINE–GRABER G. Female orgasm: role of the pubococcygeus. J Clin Psychiatry 1979; 40:34–39. [ Links ]
6. DELANCEY JO, KEARNEY R, CHOU O, SPEIGHTS S, BINNO S. The appearance of levator ani muscle abnormalities in magnetic resonance images after vaginal delivery. Obstet Gynecol 2003; 1001:46–53. [ Links ]
7. SMITH B RA, HOSKER LG, WARREL WD. The role of pudendal nerve damage in the etiology of genuine stress incontinence in women. Br J Obs Gynecol 1989; 96:29–32. [ Links ]
8. MCMURRAY G, CASEY HJ, NAYLOR AM. Animal models in urological disease and sexual dysfunction. J Sex Med 2008; 5:1088–1096. [ Links ]
9. GONZALEZ–MARISCAL G, CUAMATZI E, ROSENBLATT JS. Hormones and external factors: are they "on/off" signals for maternal nest–building in rabbits? Horm Behav 1998; 33:1–8. [ Links ]
10. ANGULO J, CUEVAS P, CUEVAS B, SANDEEP G, SAENZ DE TEJADA I. Mechanisms for the inhibition of genital vascular responses by antidepressants in a female rabbit model. J Pharmacol Exp Ther 2004; 310:141–149. [ Links ]
11. MYUNG SC, LEE SY, YUM SH, PARK SH, KIM SC. Contractile changes of the clitoral cavernous smooth muscle in female rabbits with experimentally induced overactive bladder. J Sex Med 2008; 5:1088–1096. [ Links ]
12. BARONE R, PAVAUX C, BLIN PC, CUQ P. Atlas of rabbit anatomy. Paris: Masson et Cie, 1973:1–203. [ Links ]
13. POPESKO P, RAIJTOVÁ V, HORÁK J. A color atlas of the anatomy of small laboratory animals. London: Wolfe Publishing Ltd., 1979:115–123. [ Links ]
14. PACHECO P, MARTINEZ–GOMEZ M, WHIPPLE B, BEYER C, KOMISARUK BR. Somato–motor components of the pelvic and pudendal nerves of the female rat. Brain Res 1989; 490:85–94. [ Links ]
15. DUBROSVKY B, FILIPINI D. Neurobiological aspects of the pelvic floor muscles involved in defecation. Neurosci Biobehav Rev 1990; 14:157–168. [ Links ]
16. SHAFIK A. Levator ani muscle: new physioanatomical aspects and role in the micturition mechanism. World J Urol 1999; 17:266–73. [ Links ]
17. PIERCE LM, REYES M, THOR KB, DOLBER PC, BREMER RE, KUEHL TJ et al. Innervation of the levator ani muscles in the female squirrel monkey. Am J Obstet Gynecol 2003; 188:1141–1147. [ Links ]
18. LIEN KC, MONEY B, DELANCEY JOL, ASHTON– MILLER JA. Levator ani muscle stretch induced by simulated vaginal birth. Am Coll Obs Gynecol 2004; 103:31–40. [ Links ]
19. BARBER MD, BREMEN RE, THOR KB, DOLBER PC, KUEHL TJ, COATES KW. Innervation of the female levator ani muscles. Am J Obstet Gynecol 2002; 187:64–71. [ Links ]
20. BREMER RE, BARBER MD, COATES KW, DOLBER PC, THOR KB. Innervation of the levator ani and coccygeus muscles of the female rat. Anat Rec 2003; 275:1031–1041. [ Links ]
21. KLUTKE CG, SIEGEL CL. Functional female pelvic anatomy. Urol Clin North Am 1995; 22:487–498. [ Links ]
22. SNOOKS SJ, SWASH M. The innervation of the muscles of continence. Ann R Coll Surg Engl 1986; 68:45–49. [ Links ]
23. WALL LL. The muscles of the pelvic floor. Clin Obstet Gynecol 1993; 36:910–925. [ Links ]
24. BOWER EA. The activity of post–ganglionic sympathetic nerves to the uterus of the rabbit. J Physiol 1966; 183 (3):748–767. [ Links ]
25. FERGUSON J KW. A study of the motility of the intact uterus at term. Surg Gynecol Obstet 1941; 73:359–366. [ Links ]
26. MOOS F, RICHAR P. Level of oxytocin release induced by vaginal dilatation (Ferguson reflex) and vagal stimulation (vago–pituitary reflex) in lactating rats. J Physiol 1975; 70:307–314. [ Links ]
27. CASTRO–VAZQUEZ A, MCCANN SM. Cyclic changes in the reflex release of prolactin following cervicovaginal stimulation. Neuroendocrinol 1979; 28:3–10. [ Links ]
28. NORTHROP LE, ERSKINE MS. Selective oxytocin receptor activation in the ventrolateral portion of the ventromedial hypothalamus is required for mating–induced pseudopregnancy in the female rat. Endocrinology 2008; 149:836–842. [ Links ]
29. GOMEZ LE, ORTEGA C, DURAN I, CUEVA–ROLON R. Neural mechanisms accounting for the increase in blood pressure and heart rate during vagino–cervical stimulation. J Auton Nerv Syst 1996; 60:154–162. [ Links ]
30. NAGGAR AN, KOMISARUK BR. Facilitation of tonic immobility stimulation of the vaginal cervix in the rat. Physiol Behav 1977; 19:441–444. [ Links ]
31. KOMISARUK BR, WALLMAN J. Antinociceptive effects of vaginal stimulation in rats: neurophysiological and behavioral studies. Brain Res 1977; 137:85–107. [ Links ]
32. GOMORA P, BEYER C, GONZALEZ–MARISCAL G, KOMISARUK BR. Momentary analgesia produced by copulation in female rats. Brain Res 1994; 656:52–58. [ Links ]
33. CUEVA–ROLON R, GOMEZ LE, KOMISARUK BR, MUÑOZ–MARTINEZ EJ. Inhibition of withdrawal responses by pelvis nerve electrical stimulation. Brain Res 1995; 679:267–273. [ Links ]
34. KOMISARUK BR, SANSONE G. Neural pathways mediating vaginal function: The vagus nerves and spinal cord oxytocin. Scand J Psychol 2003; 44:241–250. [ Links ]
35. LINDSTRÓM S, FALL M, CARLSSON C, ERLANDSON BE. The neurophysiological basis of bladder inhibition in response to intravaginal electrical stimulation. J Urol 1983; 129:405–410. [ Links ]
36. SHAFIK A, EL–SIBAI O. Effect of vaginal distention on vesicourethral function with identification of the vagino–vesicourethral reflex. J Urol 2001; 165:887–889. [ Links ]
37. MARTINEZ–GOMEZ M, CHIRINO R, BEYER C, KOMISARUK BR, PACHECO P. Visceral and postural reflexes evoked by genital stimulation in urethane–anesthetized female rats. Brain Res 1992; 575:279–284. [ Links ]
38. SHAFIK A. Vaginocavernosus reflex. Clinical significance and role in sexual act. Gynecol Obstet Invest 1993; 35:114–117. [ Links ]
39. SHAFIK A. Vagino–levator reflex: description of a reflex and its role in sexual performance. Eur J Obstet Gynecol 1995; 60:161–164. [ Links ]
40. CRUZ Y, HUDSON R, PACHECO P, LUCIO RA, MARTINEZ–GOMEZ M. Anatomical and physiological characteristics of perineal muscles in the female rabbit. Physiol Behav 2002; 74:1–8. [ Links ]
41. MANZO J, ESQUIVEL A, HERNANDEZ M, CARRILLO P, MARTINEZ–GOMEZ M, PACHECO P. The role of puboccoccygeus muscle in urinary continence in the male rat. J Urol 1997; 157: 2402–2406. [ Links ]
42. CORONA–QUINTANILLA DL, CASTELAN F, FAJARDO F, MANZO J, MARTINEZ–GOMEZ, M. Temporal coordination of pelvic and perineal striated muscle. J Urol 2009; 181:1452–1458. [ Links ]
*Purina Coneja Chow, México.
**Sigma Chemical, Estados Unidos de América.
*Nikon SMZ–T2, Japón.
**Grass S48, Estados Unidos de América.
***Grass SIU–5, Estados Unidos de América.
†Grass 7P5, Estados Unidos de América.
‡Grass 79E, Estados Unidos de América.














