Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Veterinaria México
versión impresa ISSN 0301-5092
Vet. Méx vol.41 no.4 Ciudad de México oct./dic. 2010
Artículos científicos
Localización de Serratia marcescens en perfil bacteriológico y fúngico de la conjuntiva de caballos clínicamente sanos en Monterrey, Nuevo León, México
Localization of Serratia marcescens in bacterial and fungal profile of conjunctiva of clinically healthy horses from Monterrey, Nuevo Leon, Mexico
Gustavo Hernández Vidal* Rafael Ramírez Romero* Luís Edgar Rodríguez Tovar* Francisco A. Mora Valdez** Juan Antonio Vidales Contreras*** Jesús Jaime Hernández Escareño*
* Facultad de Medicina Veterinaria y Zootecnia, Universidad Autónoma de Nuevo León, Fco. Villa s/n, Ex–Hacienda El Canadá, General Escobedo, 66050, Nuevo León, Monterrey, México.
** Hospital Veterinario La Silla, Antiguo Camino al Diente 3333, La Estanzuela, 64988, Nuevo León, Monterrey, México.
*** Facultad de Agronomía, Universidad Autónoma de Nuevo León, Fco. Villa s/n, Ex–Hacienda El Canadá, General Escobedo, 66050, Nuevo León, Monterrey, México.
Correspondencia:
Dr. Jesús Jaime Hernández Escareño,
Tel.: (81) 13 40 43 93, extensión 3615,
Correo electrónico: jjescareno@hotmail.com
Recibido el 25 de enero de 2010
Aceptado el 23 de septiembre de 2010.
Abstract
The conjunctival normal microflora, formed by fungi, yeast and bacteria, of 50 clinically healthy horses from Monterrey, Nuevo Leon, was identified using three to 12 year–old horses of different breeds and gender. Samples were taken from the conjunctival sac of both eyes (n =100 eyes) using a cotton swab under sterile conditions. No eye was negative to the presence of the microorganism. There were differences in colony types in each eye of the same animal. One hundred percent were positive to fungal and bacteria colonies in both eyes, while 60% were positive to yeast. In the present study Serratia marcescens, a pathogenic, opportunist and multidrug–resistant organism, is reported for the first time in the conjunctival sac in horses. Serratia marcescens was isolated from 21 clinically healthy horses (42%) with a number of colony forming units (cfu) that ranged from 9 to 42.
Key words: Serratia marcescens, Eye, Horses, Conjunctiva, Keratomycosis.
Resumen
Se identificó la microflora normal, formada por hongos, levaduras y bacterias, de la conjuntiva en 50 caballos clínicamente sanos, de diferente raza y sexo, de tres a 12 años de edad, del área metropolitana de Monterrey, Nuevo León. Las muestras se tomaron del saco conjuntival de ambos ojos (n = 100 ojos) con un hisopo bajo condiciones estériles. Ningún ojo fue negativo a la presencia de microorganismos. Hubo a menudo diferencias en los tipos de colonias entre los ojos del mismo animal, 100% fueron positivos a la presencia de hongos y bacterias en ambos ojos, y 60% positivos a la presencia de levaduras. Este estudio presenta, por vez primera en conjuntiva de caballos, la presencia de Serratia marcescens, considerada microorganismo patógeno oportunista con multirresistencia a fármacos. En esta investigación, Serratia marcescens se logró aislar de 21 caballos clínicamente sanos (42%) con rango de nueve a 42 unidades formadoras de colonias (ufc).
Palabras clave: Serratia marcescens, Ojo, Caballos, Conjuntiva, Queratomicosis.
Introducción
Se sabe que la microflora bacteriana y fúngica de la conjuntiva en los animales sanos se controla por una serie de mecanismos que mantienen a las poblaciones en equilibrio y previenen el contagio de estos microorganismos potencialmente patógenos.1 Muchos trabajos registran presencia de diversa microflora en conjuntiva y córneas sanas en ovejas,2 vacas,3,4 cerdos,5 aves,6 conejos,7 cabras,8 perros,9 elefantes,10 gatos,11 burros12 y caballos.13,14
Se ha informado que los microorganismos no patogénicos predominantes en la flora normal conjuntival en caballos son los Gram positivos.15 Sin embargo, las bacterias Gram negativas también están presentes como parte de la flora normal conjuntival de los equinos.15
Algunos hongos son parte inherente de la microflora conjuntival normal del caballo; no obstante, tras una herida corneal, estos microorganismos pueden actuar como agentes patógenos. La queratomicosis es bastante común en caballos, pero es muy rara su presencia en perros, gatos y vacas. En caballos, la queratomicosis se manifiesta clínicamente por la aparición de queratitis ulcerativa, queratitis intersticial o de absceso estromal. Este último ocurre como resultado de la infección por bacterias u hongos en el estroma, debido a un defecto corneal16 y prolapso del iris.
Existen informes de la prevalencia de hongos aislados en ojos de caballos (95%), vacas (100%), perros (22%) y gatos (8%). La diferencia en el porcentaje puede deberse a factores como tamaño de los ojos, grado de exposición o contacto con las esporas de hongos y bacterias, principalmente esporuladas y fómites, así como a la gran cantidad de microorganismos que se encuentran en las heces en los corrales, los cuales pueden infectar el ojo ocasionando una severa lesión ocular.3
La supericie del ojo está constituida por una serie de estructuras oculares que funcionan de forma conjunta y que son necesarias para tener una buena visión. La supericie de las células epiteliales de la córnea y conjuntiva, al igual que la mayoría de las supericies mucosas del cuerpo humano, se encuentran protegidas por una capa compuesta de residuos de azúcares ramiicados, unidos a proteínas, colectivamente llamados glicocálix. Los principales componentes de este glicocálix epitelial son las mucinas o glicoproteínas integrales. No se conoce del todo la función de los carbohidratos de la mucina (O–glicanos), pero se sugiere que forman una barrera de difusión de los componentes extracelulares a manera de protección.17
La córnea y la conjuntiva tienen un sistema de defensa peculiar contra infecciones fúngicas. Existen mecanismos inmunológicos, metabólicos y antimicrobiales, que junto con la barrera física del tejido, protegen a la córnea de queratomicosis.17
Asimismo, la flora bacteriana nativa protege a la córnea contra hongos mediante el consumo de los nutrimentos necesarios para la proliferación de estos microorganismos, y por la secreción de algunos antimicrobianos con propiedades antifúngicas.18
El objetivo de esta investigación fue identificar la microflora normal de hongos, levaduras y bacterias en caballos sanos de alto rendimiento en el área metropolitana de Monterrey, Nuevo León, con la finalidad de establecer la prevalencia de microorganismos (hongos, levaduras y bacterias) y su frecuencia en conjuntiva, y así establecer factores de riesgo para el desarrollo de enfermedades o problemas oculares en equinos.
Material y métodos
El presente estudio se realizó en marzo de 2009, en el Laboratorio de Microbiología de la Facultad de Medicina Veterinaria y Zootecnia de la Universidad Autónoma de Nuevo León. Se evaluaron ambos ojos de 50 caballos sanos (n = 100 ojos) de diferente raza y sexo: 34 hembras (68%) y 16 machos (32%), de tres a 12 años de edad. Las muestras fueron tomadas de caballos de alto rendimiento, cuya actividad deportiva es el salto. Los animales se mantuvieron en cuadras con piso de concreto y cama de aserrín bajo estricto régimen de limpieza, las cuadras fueron aseadas tres veces al día. La alimentación dada es considerada convencional para un caballo atleta de alto rendimiento, que consiste en salvado, pasto bermuda, pasto Raygrass y piensos a base de avena negra, copos de maíz y cebada, gránulos con vitaminas, minerales y aminoácidos. El agua potable se dejó a libre acceso.
Tras descartar cualquier inflamación o infección ocular se procedió a la toma de muestras en conjuntiva, mediante el uso de hisopos estériles, teniendo cuidado de no contaminar la muestra por contacto con la piel. Los hisopos se colocaron en medio de transporte Stuart, se identificaron y trasladaron a una temperatura de 4°C.
Con el fin de aislar bacterias aerobias se utilizaron los siguientes medios de cultivo: agar sangre, agar eosin azul de metileno (EMB), agar Mueller Hinton y Mac Conkey. Para hongos y levaduras: agar papa dextrosa (PDA), con y sin cloranfenicol y cicloheximida (0.5 g/L). Los cultivos bacterianos fueron incubados a 37°C y revisados a las 24 y 48 horas. Para la identificación morfológica de los microorganismos estudiados se realizaron tinciones de Gram. Para la caracterización de género de las bacterias recuperadas se utilizaron las pruebas bioquímicas propuestas por Koneman et al.19
La incubación para hongos y levaduras comunes se realizó a 32°C durante siete días, mientras que el seguimiento del género Malassezia fue a 14 días. Se caracterizó a los hongos por observación directa usando lactofenol y, cuando fue necesario, se realizaron microcultivos en PDA, utilizando claves de identificación para hongos imperfectos según Barnett y Hunter.20 Las levaduras fueron identificadas por sus características macro y micromorfológicas, y por sus características fisiológicas, como la presencia de cápsula mediante la tinción negativa, usando tinta china, producción de ureasa a 25°C y la prueba de tubo germinativo.21, 22
Resultados
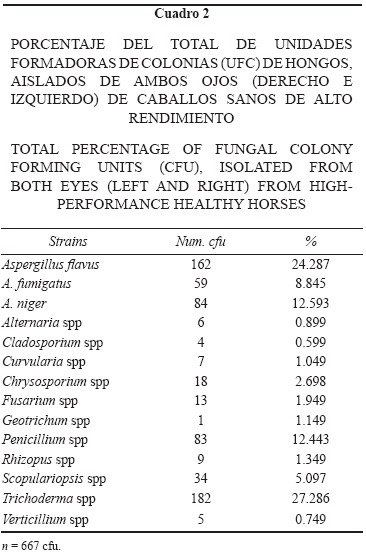
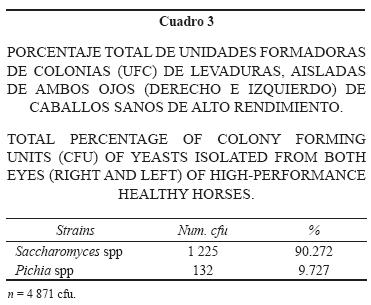
Mediante la siembra de muestras oculares en los medios de cultivo se lograron recuperar hongos, bacterias y levaduras entre los dos y siete días de inoculación. Los Cuadros 1a , 1b, 1c y 1d muestran el número total de unidades formadoras de colonias (ufc) de hongos, levaduras y bacterias encontradas en cada uno de los ojos de los caballos muestreados.
Ningún ojo fue negativo a presencia de microorganismos. El caballo 33 presentó el menor número, con 13 ufc aisladas del ojo izquierdo, y el caballo 34 presentó el mayor número, con 146 ufc aisladas en el ojo izquierdo. No se observó correlación positiva entre el número de hongos, levaduras y bacterias aisladas, la raza, el sexo o la edad del animal.
De los 50 individuos revisados se encontró que 100% fueron positivos a la presencia de hongos en ambos ojos. Los géneros recuperados fueron: Aspergillus spp (45.72 % del total de los caballos examinados), Trichoderma spp (27.28%), Penicillium spp (12.44%), Scopulariospsis spp (5.09%), Chrysosporium spp (2.69%), Fusarium spp (1.94%), Rhizopus spp (1.34%), Geotrichum spp (1.14%), Curvularia spp (1.04%), Alternaría spp (0.89%), Verticillium spp (0.74%) y Cladosporium spp (0.59%) (Cuadro 2). De los hongos, el género recuperado con mayor frecuencia fue Aspergillus spp, del cual se identificaron tres especies: A. flavus (24.28%), A. Niger (12.59%) y A. fumigatus (8.84%) (Cuadro 5). 60% (30/50) de los animales muestreados fueron positivos a la presencia de levaduras, de las cuales 90.27% fueron del género Saccharomyces spp y 9.72%, Pichia spp (Cuadro 3).
Respecto de las bacterias recuperadas, Staphylococcus aureus (35.41%) fue el microorganismo que se identiicó con mayor frecuencia, mientras que Bacillus spp se presentó en 28.35%, Escherichia coli, 21.51%, Serratia marcensces, 13.71% y Pseudomonas, 1.005% (Cuadro 4). La totalidad de los caballos revisados fueron positivos a la presencia de bacterias en ambos ojos.

Discusión
Este estudio registra, por primera vez, la presencia de Serratia marcescens en la microflora normal conjuntival en caballos sanos. Aunque esta bacteria Gram negativa se encuentra comúnmente en ambientes naturales, tierra, agua y vegetales crudos, es considerada patógeno resistente a múltiples fármacos y microorganismo oportunista, especialmente en humanos inmunocomprometidos.23 Es reconocida como agente causal de endoftalmitis24, 25 y queratitis infecciosa26 en humanos. Se cree que tiene la capacidad de liberar proteasas, causantes de pérdida de proteoglicanos en córnea, de dispersión de las fibras de colágeno, necrosis licuefactiva y perforación corneal.27
Serratia marcescens rara vez se localiza en animales; sin embargo, se tiene registro de ella como agente causal de enfermedades nosocomiales en perros y gatos28 a partir de catéteres intravenosos infectados y de mastitis bovina;29 y en equinos como agente etiológico de endocarditis,30 de sepsis,31 localizado en abscesos abdominales,32 en membranas fetales y órganos internos de fetos abortados.33 En esta investigación la Serratia marcescens se logró aislar de 21 caballos sanos (42%) con rango de nueve a 42 unidades formadoras de colonias (ufc). Los géneros Staphylococcus spp y Bacillus spp son los microorganismos que más se registraron como microflora normal del saco conjuntival. A pesar de que estas bacterias defienden el ojo de microorganismos invasivos, algunas de ellas actúan como patógenos oportunistas, causando daños en el sistema ocular.13,34
La mayoría de los estudios sobre microflora conjuntival mencionan la presencia predominante de las bacterias Gram positivas, anteriormente señaladas, en loros,35 aves exóticas y de presa,6,36 perros,37 gatos,38 cerdos,5 elefantes asiáticos10 y caballos.13 Pese a esta predominancia en conjuntiva, tanto en animales sanos como enfermos, las Gram negativas se presentan de manera relevante en lesiones corneales. Pseudomonas spp y algunas enterobacterias como E. coli son asociadas típicamente con una rápida y progresiva ulceración corneal;39, 40 en este estudio dichas bacterias representan 1.00% y 21.51%, respectivamente. Los géneros Aspergillus spp, Penicillium spp, Chrysosporium spp y Fusarium spp son hongos usualmente recuperados de la conjuntiva en caballos, y se consideran normales en muchas especies animales.13,14,41–43 Los resultados del presente estudio coinciden con los de estudios previos, donde el género predominante fue Aspergillus, seguido por Trichoderma, Penicillium, Scopulariopsis y Fusarium.
El género Aspergillus se encuentra de manera frecuente como contaminante fúngico en diferentes especies, y se considera dentro de los principales agentes etiológicos (de infección secundaria) presentes en queratomicosis del caballo; En este trabajo fue el hongo más abundante y comúnmente aislado (45.72%), dato que coincide con los reportes de Andrew et al.13 (25.7%), Rosa et al.14 (32.2%), Barsotti et al.42 (33%) y Nardoni et al.12 (33%).
En Monterrey, México, las condiciones de humedad y temperatura son aptas para una adecuada esporulación de los hongos y su subsecuente diseminación en el medio ambiente, también favorecen la presencia de levaduras. En este contexto, los resultados de estudios similares podrían variar debido a las condiciones sanitarias en la que los animales son mantenidos, las condiciones climáticas y la época del año.
Con base en este estudio, se sugiere ampliar el perfil de exámenes donde se incluya la identificación de Serratia marcescens, organismo con multirresistencia a fármacos, y patógeno importante, virulento y habitual de la conjuntiva normal en equinos.
El conocimiento de los géneros y especies prevalentes son importantes para seleccionar agentes antimicrobianos efectivos, establecer medidas adecuadas de profilaxis, y prescribir tratamiento de enfermedades oculares en caballos.
Referencias
1. BURNS RP. Indigenous flora of the lids and conjunctiva. In: TASMAN W, JAEGER EA, editors. Foundations of clinical ophthalmology. Vol 2. Philadelphia:. Lippincott Press, 1993:1–5. [ Links ]
2. SPRADBROW PB. The bacterial flora of the ovine conjunctival sac. Aust Vet J 1968; 44:117–118. [ Links ]
3. SAMUELSON DA, ANDRESEN TL, GWIN RM. Conjunctival fungal flora in horses, cattle, dogs and cats. J Am Vet Med Assoc 1984; 184:1240–1242. [ Links ]
4. WILCOX GE. Bacterial flora of the bovine eye with special reference to the Moraxella and Neisseria. Aust Vet J 1970; 46:253–256. [ Links ]
5. DAVISON HJ, ROGERS DP, YEARY TJ, STONE GG, SCHONEWESIS DA, CHENGAPPA MM. Conjunctival microbial flora of clinically normal pigs. Am J Vet Res 1994; 55:949–951. [ Links ]
6. DUPONT C, CARRIER M, HIGGINS R. Bacterial and fungal in healthy eyes of birds of pray. Can Vet J 1994; 34:699–701. [ Links ]
7. COOPER SC, MCLELLAN GJ, REYCROFT AN. Conjunctival flora observed in 70 healthy domestic rabbits. Vet Rec 2001; 149:232–235. [ Links ]
8. MUSHI EZ, BINTA MG, CHAVO RG, DINTWE K. Conjunctival flora of fifty healthy goats in Sebele farm, Gaborone, Botswana. J Anim Vet Adv 2007; 6:1388–1389. [ Links ]
9. KUDIRKIENÉ E, ZILINSKA H, SIUGZDAITE J. Microbial flora of the dog eyes. Lithuanian Vet Acad 2006; 34:18–21. [ Links ]
10. TUNTIVANICHP,SOONTORNIPAVRTK,TUNTIVANICH N, WONGAUMNUAYKUL S, BRIKSAWAN P. Conjunctival microflora in clinically normal Asian elephant in Thailand. Vet Res Comm 2002; 26:251–254. [ Links ]
11. SHEWEN PE, POVERY RC, WILSON MR. A survey of conjunctival flora of clinically normal cats and cats with conjunctivitis. Can Vet J 1980; 21:231–233. [ Links ]
12. NARDONI S, SGORBINI M, BARSOTTI M, CORAZZA G, MANCIATTI F. Conjunctival fungal flora in healthy donkeys. Vet Ophthalmol 2007; 10:207–210. [ Links ]
13. ANDREW SE, NGUYEN A, JONES GL, BROOKS DE. Seasonal effects on the aerobic bacterial and fungal conjunctival flora of normal thoroughbred brood mares in Florida. Vet Ophthalmol 2003; 6:45–50. [ Links ]
14. ROSA M, CARDOZO LM, PEREIRA JDAS, BROOKS DE, MARTINS ALB, FLORIDO PSS et al. Fungal flora of normal eyes of healthy horses from the state of Rio de Janeiro, Brazil. Vet Ophthalmol 2003; 6:51–55. [ Links ]
15. MOORE C, HELLER N, MAJORS LJ, WHITLEY RD, BURGUÉS EC, WEBER J. Prevalence of ocular microorganisms in hospitalized and stabled horses. Am J Vet Res 1988; 49:773–777. [ Links ]
16. GELATT KN. Fundamentos de Oftalmología Veterinaria. Barcelona: MASSON SA, 2003. [ Links ]
17. ARGUESO P. Azúcares: Una capa protectora excepcional de la superficie ocular. Arch Soc Esp Oftalmol 2008; 83:287–290. [ Links ]
18. MARTOS PG, FERNÁNDEZ DEL BARRIO MT, SALIDO FPF. Microbiología Clínica Aplicada. 3a ed. Madrid, España: Ed. Díaz de Santos SA, 1997. [ Links ]
19. KONEMAN EW, ALLEN SD, DOWELL VR, SOMMERS HM. Diagnóstico microbiológico. Madrid, España: Ed. Médica Panamericana SA, 1989. [ Links ]
20. BARNETT H, HUNTER BB. Illustrated genera of imperfect fungi. 3rd ed. Minneapolis Minnesota USA: Burgess Publishing Company, 1972. [ Links ]
21. FISHER F, COOK NB. Fundamental of Diagnostic Mycology. Pennsylvania: WB Saunders Company, 1998. [ Links ]
22. DE HOOG GS, GUARRO J, GENÉ J, FIGUERAS MJ. Atlas of Clinical Fungi. 2nd ed. Centralbureau voor Schimmelcultures, Utrecht, The Netherlands/ Universitat Rovira i Virgili, Reus, Spain, 2000. [ Links ]
23. RALLIS E, KARANIKOLA E, PAPADAKIS P. Severe facial infection caused by Serratia marcescens in an immunocompetent soldier. J Am Acad Dermatol 2008; 58:109–110. [ Links ]
24. EQUI RA, GREEN WR. Endogenous Serratia marcescens endophthalmitis with dark hypopyon: a case report and review. Surv Ophthalmol 2001; 46:259–268. [ Links ]
25. SHARMA NS, OOI JL, DOWNIE JA, CORONEO MT. Corneal perforation and intraocular lens prolapsed in Serratia marscescens endophthalmitis. Clin Experiment Ophthalmol 2007; 35:381–382. [ Links ]
26. ALEXANDRAKIS G, ALFONSO EC, MILLAR D. Shifting trends in bacterial keratitis in south Florida and emerging resistance to fluoroquinolones. Ophthalmology 2000; 107:1497–1502. [ Links ]
27. LYERLY D, GRAY L, KREGER A. Characterization of rabbit corneal damage produced by Serratia keratitis and by Serratia protease. Infect Immun 1981; 33:927–932. [ Links ]
28. FOX JM, BEAUCAGE CM, FOLTA CA, TROTON GW. Nosocomial transmission of Serratia marcescens in a veterinary hospital due to contamination by benzalkonium chloride. J Clin Microbiol 1981; 14:157160. [ Links ]
29. KAMARUDIN MI, FOX LK, GASKINS CT, GAY JM. Environmental reservoirs for Serratia marscescens intramammary infections in dairy cows. J Am Vet Med Assoc 1966; 208:555–558. [ Links ]
30. EWART S, BROWN C, DERKSEN F, KUFUOR–MENSA E. Serratia marcescens endocarditis in a horse. J Am Vet Med Assoc 1992; 200:961–963. [ Links ]
31. SHAFTOE S. Serratia marscescens septicaemia in a neonatal Arabian foal. Equine Vet J 1984; 16:389–392. [ Links ]
32. RIGG DL, GARTLIN SJ, REINERTSON EL. Marsupialization of an abdominal abscess caused by Serratia marscescens in a mare. J Am Vet Med Assoc 1987; 191:222–224. [ Links ]
33. JORES J, BEUTER G, HIRTH–SCHMIDT I, BORSHERS K, PITT TL, LUBKE–BECKER A. Isolation of Serratia marcescens from an equine abortion in Germay. Vet Rec 2004; 154:242–244. [ Links ]
34. GEMENSKY–METZLER AJ, WILKIE DA, KOWALSKI JJ, SCHMALL LM, WILLIS AM, YAMAGATA M. Changes in bacterial and fungal ocular flora of clinically normal horses following experimental application of topical antimicrobial or antimicrobial–corticosteroid ophthalmic preparations. Am J Vet Res 2005; 66:800–811. [ Links ]
35. ZENOBLE RD, GRIFFITH RW, CLUBB SL. Survey of bacteriologic flora of conjunctiva and cornea in healthy psittacine birds. Am J Vet Res 1983; 44:1966–1967. [ Links ]
36. WOLF ED, AMASS K, OLSEN J. Survey of conjunctival flora in the eye of clinically normal captive exotic birds. J Am Med Vet Assoc 1983; 183:1232–1233. [ Links ]
37. MCDONALD PJ, WATSON DJ. Microbial flora of normal canine conjunctivae. J Small Anim Pract 1976; 17:809–812. [ Links ]
38. ESPINOLA MB, LILENBAUM W. Prevalence of bacteria in the conjunctival sac and on the eyelid margin of clinically normal cats. J Small Anim Pract 1996; 37:364–366. [ Links ]
39. BARNETT KC, CRISPIN SM, LAVACH JD, MATTHEWS AG. Equine ophthalmology. 2nd ed. Philadelphia, USA: Elsevier Limited, 2004. [ Links ]
40. SANSON J, FEATHERSTONE H, BARNETT KC. Keratomycosis in six horses in the United Kindgdom. Vet Rec 2005; 156:13–17. [ Links ]
41. MATTHEWS AG. The aethiopatogenesis of infectious keratitis in the horse. Equine Vet J 1994; 26:432–433. [ Links ]
42. BARSOTTI G, SGORBINI M, NARDONI S, CORAZZA M, MANCIANTI F. Occurrence of fungi from conjunctiva of healthy horses in Tuscany, Italy. Vet Res Commun 2006; 30: 903–906. [ Links ]
43. WESTEIN WL, MOORE PA, SANCHEZ S, DIETRICH UM, WOOLEY RE, RITCHIE BW. In vitro efficacy of a buffered chelating solution as an antimicrobial potentiator for antifungal drugs against pathogens obtained from horses with mycotic keratitis. Am J Vet Res 2006; 67:562–568. [ Links ]














