Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Veterinaria México
versión impresa ISSN 0301-5092
Vet. Méx vol.41 no.1 Ciudad de México ene./mar. 2010
Notas de investigación
Antígenos de secreción–excreción de Toxocara canis reconocidos por cachorros del área metropolitana de la Ciudad de México
Secretory–excretory antigens of Toxocara canis recognized by puppies of the Mexico City metropolitan area
Marco Antonio Muñoz–Guzmán* Fernando Alba–Hurtado*
* Departamento de Ciencias Biológicas, Facultad de Estudios Superiores–Cuautitlán, Universidad Nacional Autónoma de México, Km 3.5, Carretera Cuautitlán–Teoloyucan, Colonia San Sebastián Xhala, Cuautitlán Izcalli, Estado de México, 54714, México.
Autor para correspondencia:
Fernando Alba–Hurtado,
Departamento de Ciencias Biológicas,
Facultad de Estudios Superiores–Cuautitlán,
Universidad Nacional Autónoma de México,
Km 3.5, Carretera Cuautitlán–Teoloyucan, Colonia San Sebastián Xhala,
Cuautitlán Izcalli, Estado de México, 54714, México,
Tel: +52 (55) 56 23 19 99, ext. 39411,
Correo electrónico: fealba@hotmail.com
Recibido el 13 de marzo de 2009
Aceptado el 7 de diciembre de 2009
Abstract
The aim of the study was to determine the Toxocara canis larvae secretory–excretory antigens (SETc–Ag), which are most often recognized by puppies infected naturally from the metropolitan area of Mexico City. At necropsy, adult phases of T. canis were found in the intestine of 20 puppies (64.6%), and 11 had no parasites (35.4%). Sera of all animals with T. canis in the intestine and seven animals without worms were positive to ELISA (X = 0.683 ± 0.184 OD) and recognized several SETc–Ag by Western blot (WB). Sera from four puppies with no T. canis did not recognize any type of antigen by WB and were negative to ELISA–IgG (X = 0.078 ± 0.045 OD). Sera from the puppies recognized three antigen groups. The first one included seven low molecular weight antigens (16, 20, 23, 24, 28, 32 and 38 kDa); the second one, three high molecular weight antigens (400, 200 and 120 kDa) and the third one, four antigens of intermediate molecular weight (86, 74, 66 and 47 kDa). The most frequently recognized SETc–Ag were of 32, 38, 66, 120 and 200 kDa, which makes them good candidate antigens to develop immunodiagnosis tests in dogs.
Key words: Toxocara canis, Secretory–Excretory Antigens, Puppies, Elisa, Western Blot.
Resumen
El propósito del presente trabajo fue determinar los antígenos de secreción–excreción de larvas de Toxocara canis (Ag–SETc) que son más frecuentemente reconocidos por cachorros infectados naturalmente del área metropolitana de la Ciudad de México. A la necropsia, 20 cachorros presentaron fases adultas de T. canis en el intestino (64.6%) y 11 no presentaron (35.4%). El suero de todos los animales con T. canis en el intestino y de siete animales, sin gusanos a la necropsia, fueron positivos a ELISA (X = 0.683 ± 0.184 DO) y reconocieron, por Western blot (WB), varios Ag–SETc. El suero de cuatro cachorros sin T. canis en el intestino no reconoció ningún antígeno por WB y fueron negativos a ELISA–IgG (X = 0.078 ± 0.045 DO). Los sueros de los cachorros reconocieron tres grupos de antígenos. El primero incluyó siete de bajo peso molecular (16, 20, 23, 24, 28, 32 y 38 kDa); el segundo, tres de alto peso molecular (400, 200 y 120 kDa) y el tercero antígenos de peso molecular intermedio (86, 74, 66 y 47 kDa). Los Ag–SETc más frecuentemente reconocidos fueron de 32, 38, 66, 120 y 200 kDa, por lo que éstos son candidatos para pruebas de inmunodiagnóstico en perros.
Palabras clave: Toxocara canis, Antígenos de excresión–secreción, Cachorros, Elisa, Western Blot.
Toxocara canis es uno de los nematodos más frecuentes en perros de México y de JL muchos otros lugares del mundo. Las formas adultas afectan principalmente a los cachorros, produciéndoles problemas digestivos, afectando su desarrollo e incrementando la mortalidad. En perros adultos y huéspedes paraténicos (roedores, cerdos, aves, humanos, etc.) las larvas se pueden encontrar en estado de latencia en diferentes órganos: hígado, riñones, pulmones, músculos, ojos y cerebro.1–3 La importancia de este parásito no es sólo por sus repercusiones en perros, sino porque también es una causa importante de zoonosis.4
Las larvas de T. canis pueden sobrevivir en medios de cultivo complementado con glucosa. Estas larvas producen in vitro gran cantidad de glicoproteínas conocidas como antígenos secreción–excreción de T. canis (Ag–SETc), las cuales han sido identificadas por algunos autores5–7 en geles de electroforesis de SDS–poliacrilamida (SDS–PAGE). Estos antígenos se han utilizado para el diagnóstico de la toxocariosis y la respuesta de anticuerpos séricos a estos antígenos ha sido evaluada por ELISA y Western Blot (WB) en diferente especies de huéspedes paraténicos; el patrón de bandas proteínicas reconocidas por el suero de cada especie de huésped es diferente.8–11 Hasta el momento no existen informes del patrón de reconocimiento de estos antígenos en los perros que orienten su utilización para el diagnóstico inmunológico, por lo que en este trabajo se determinaron los Ag–SETc más frecuentemente reconocidos por cachorros infectados naturalmente.
Se utilizaron 31 cachorros de uno a tres meses de edad, obtenidos del Centro de Control Canino, de Cuautitlán, Estado de México. A todos los cachorros se les practicó la eutanasia con sobredosis de pentobarbital* aplicando al menos dos veces la dosis terapéutica de 63 mg/kg de peso. Antes de la eutanasia se tomaron muestras de sangre, se separó el suero por centrifugación y se almacenó a –20° C hasta su utilización. Después de se les realizó la necropsia a todos los cachorros en busca de parásitos intestinales.
Los Ag–SETc se obtuvieron por cultivo de larvas de T. canis de acuerdo con el método de Savigny,12 modificado por Bowman et al.13 La pureza e integridad de los Ag–SETc fue determinada en SDS–PAGE teñidos con nitrato de plata y la cantidad de proteína se determinó mediante la técnica de Bradford.14,15
Los niveles de anticuerpos séricos contra los Ag–SETc se midieron mediante ELISA indirecta,16 ésta fue optimizada de acuerdo con la concentración de antígeno, dilución del suero y dilución del conjugado. La concentración de antígeno fue de 10 µg/mL, la dilución del suero fue de 1:200 y el conjugado** fue diluido 1:1 500. Para establecer los valores de corte de la prueba se realizó una curva bimodal de prevalencia de las densidades ópticas (DO) y los intervalos de confianza fueron definidos con la media de las dos poblaciones resultantes ± tres desviaciones estándar. Los datos de DO fueron analizados mediante ANDEVA de una vía y comparación múltiple de Tukey con el programa GraphPad Prism ver. 4.
La separación de los Ag–SETc por SDS–PAGE y su electrotransferencia a papel de nitrocelulosa se realizó utilizando una cámara vertical*** y un equipo de transferencia semihúmeda,**** respectivamente. Para la inmunodetección se usaron los sueros diluidos 1:20 y el conjugado diluido 1:2000.16,17
A la necropsia, 20 cachorros presentaron fases adultas de T. canis en el intestino (64.6%) y 11 no presentaron parásitos (35.4%), una incidencia similar fue informada por Eguía–Aguilar et al.18 en cachorros de la Ciudad de México. Diversos estudios han demostrado que la incidencia es mayor en cachorros que en perros adultos.19,20
Los datos de DO obtenidos mediante ELISA (Figura 1) mostraron diferencias estadísticamente significativas (P < 0.05) entre sueros de cachorros que reconocieron algunos antígenos al WB (0.683 ± 0.184) y los no reactivos a la misma prueba (0.078 ± 0.045). No se observaron diferencias en las DO entre los animales positivos a la necropsia (0.681 ± 0.193) y los negativos a la necropsia, pero positivos al WB (0.686 ± 0.172).
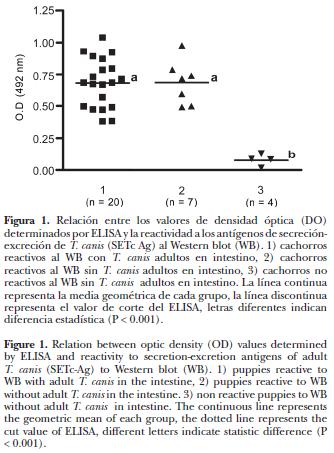
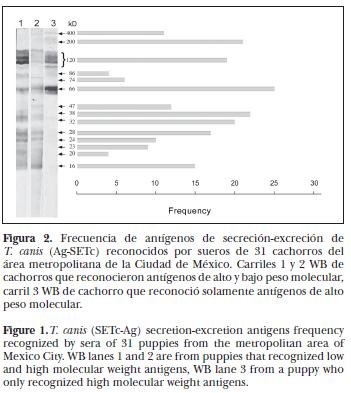
Los datos de DO obtenidos por medio de ELISA (Figura 1) muestran dos poblaciones con diferencias significativas (P < 0.001), la primera formada por sueros de todos los cachorros positivos a la necropsia y siete sueros de cachorros negativos a la necropsia (0.683 ± 0.184) y la segunda, por sueros de cuatro cachorros negativos a la necropsia (0.078 ± 0.045). El suero de todos los cachorros positivos mediante ELISA reconocieron varios Ag–SETc, la distribución y la frecuencia del reconocimiento de estos antígenos se presenta en la Figura 2. Los cuatro cachorros negativos a ELISA no reconocieron ningún antígeno por WB y no presentaron T. canis en el intestino.
La presencia de anticuerpos contra Ag–SETc en los cachorros que no presentaron gusanos adultos en el intestino puede deberse a varios factores. El primero en relación a que larvas de T. canis estén migrando y secretando antígenos en los tejidos sin que ellas hayan madurado a la fase adulta en intestino, algunos autores han observado que el periodo de prepatencia es de 42 a 56 días.21 El segundo debido a posibles reacciones cruzadas con otros helmintos como Taenia solium, Taenia crassiceps, Echinococcus granulosus y Anisakis simplex, entre otros,22,23 aunque no se detectó ninguno de estos parásitos a la necropsia. El tercero es la transferencia de anticuerpos de las perras a sus cachorros a través de la placenta.
Un total de 14 antígenos fueron reconocidas por el suero de los cachorros positivos (Figura 2). Magnaval et al.24 encontraron que los sueros de humanos con el síndrome de larva migrans visceral reconocieron siete Ag–SETc. Ellos registraron dos patrones de antígenos claramente diferenciables, uno de alto y otro de bajo peso molecular. En el presente estudio los cachorros reconocieron tres grupos de antígenos. El primer grupo incluye siete antígenos de bajo peso molecular (16, 20, 23, 24, 28, 32 y 38 kDa); en el segundo grupo, tres antígenos de alto peso molecular (400, 200 y 120 kDa), además de un patrón de antígenos de peso molecular intermedio (86, 74, 66 y 47 kDa). Algunos autores10,24 consideran que el grupo de antígenos de alto peso molecular no es específico de T. canis, dos de los cachorros negativos a la necropsia, pero positivos mediante ELISA, presentaron este patrón de antígenos, por lo que pudieran ser considerados como negativos a la presencia del parásito. Se han registrado patrones de antígenos de peso molecular intermedio en otras especies animales sin que hasta el momento se hayan encontrado en humanos. También se ha informado de un conjunto de tres bandas de Ag–SETc que migran muy cercanamente y que son reconocidas por un solo anticuerpo monoclonal, por lo que se han considerado variantes del mismo antígeno de 120 kDa.25 En el presente trabajo se identificaron tres bandas con características similares a las anteriores y que en la prueba de WB son reconocidas todas o ninguna por los diferentes sueros, por lo que se consideraron en el mismo antígeno de 120 kDa.
No todas las especies de huéspedes reconocen los mismos Ag–SETc. Los conejos reconocen hasta nueve antígenos;10 cerdos, dos;9 humanos, siete;4 ratones, cuatro;8 y gerbos, ocho.11 Estos trabajos sugieren que la inmunodominancia de los Ag–SETc es particular para cada especie de huésped.
Se concluye que los sueros de los perros muestreados reconocieron hasta 14 antígenos, los más frecuentemente reconocidos fueron: 32, 38, 66, 120 y 200 kDa, por lo que éstos son candidatos para desarrollar pruebas de inmunodiagnóstico en perros. Si bien estas pruebas tendrían una utilidad limitada en el caso de cachorros con gusanos en el intestino y que están eliminando huevos en materia fecal, su utilización en cachorros mayores de tres meses y en perros adultos que no eliminan huevos, podría ser de gran utilidad en el diagnóstico.
Referencias
1. ABO–SHEHADA MN, AL–ZUBAIDY BA, HERBERT IV. The migration of larval Toxocara canis in mice. I. Migration through the intestine in primary infections. Vet Parasitol 1984;17:65–73. [ Links ]
2. ALBA–HURTADO F, TORTORA PJ, TSUTSUMI V, ORTEGA–PIERRES M.G. Histopathological investigation of experimental ocular toxocariasis in gerbils. Int J Parasitol 2000;30:143–147 [ Links ]
3. FINSTERER J, AUER H. Neurotoxocarosis. Rev Inst Med Trop Sao Paulo 2007; 49:279–287. [ Links ]
4. MAGNAVAL JF, GLICKMAN LT, DORCHIES P, MORASSIN B. Highlights of human toxocariasis. Kor J Parasitol 2001;39:1–11. [ Links ]
5. MAIZELS RM, DE SAVIGNY D, OGILVIE BM. Characterization of surface and excretory–secretory antigens of Toxocara canis infective larvae. Parasite Immunol 1984;6 :23–37. [ Links ]
6. BADLEY JE, GRIEVE RB, BOWMAN DD, GLICKMAN LT, ROCKEY JH. Analysis of Toxocara canis larval excretory–secretory antigens: physicochemical characterization and antibody recognition. J Parasitol 1987;73:593–600. [ Links ]
7. MEGHJI M, MAIZELS RM. Biochemical properties of larval excretory–secretory glycoproteins of the parasitic nematode Toxocara canis. Mol Biochem Parasitol 1986;18:155–170. [ Links ]
8. SARIMEHMETOGLU HO, BURGU A, AYCICEK H, GÖNENÇ B, TANYUKSEL M, KARA M. Application of western blotting procedure for the immunodiagnosis of visceral larva migrans in mice by using excretory/secretory antigens. Dtsch Tierarztl Wochenschr 2001 ;108:390–392. [ Links ]
9. SOMMERFELT IE, SANTILLAN G, LOPEZ C, RIBICICH M, FRANCO AJ. Immunological and hematological response in experimental Toxocara canis–infected pigs. Vet Parasitol 2001;96:127–134. [ Links ]
10. MORALES OL, LOPEZ MC, NICHOLLS RS, AGUDELO C. Identification of Toxocara canis antigens by Western blot in experimentally infected rabbits. Rev Inst Med Trop Sao Paulo 2002;44:213–216. [ Links ]
11. ALBA–HURTADO F, MUÑOZ–GUZMAN MA, VALDIVIA–ANDA G, TORTORA JL, ORTEGA–PIERRES M.G. Toxocara canis: larval migration dynamics, detection of antibody reactivity to larval excretory–secretory antigens and clinical findings during experimental infection of gerbils (Meriones unguiculatus). Exp Parasitol 2009 IN PRESS. [ Links ]
12. SAVIGNY DH. In vitro maintenance of Toxocara canis larvae and a simple method for the production of Toxocara ES antigen for use in serodiagnostic tests for visceral larva migrans. J Parasitol 1975;61:781–782. [ Links ]
13. BOWMAN DD, MIKA–GRIEVE M, GRIEVE RB. Circulating excretory–secretory antigen levels and specific antibody responses in mice infected with Toxocara canis. Am J Trop Med Hyg 1987;36:75–82. [ Links ]
14. JOHANSSON KE. Separation of antigens by analytical gel electrophoresis. In: BJERRUM OJ, HEEGAARD NH, editors. Handbook of immunoblotting of proteins. Vol. I Florida:CRC–Press, 1988:31–50. [ Links ]
15. BRADFORD MM. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein dye binding. Anal Biochem 1976;72:248–254. [ Links ]
16. COLIGAN JE, KRUISBEEK AM, MARGULIES DH, SHEVACH EM, STROBER W. editors. Immunoblotting and immunodetection, Current protocols in immunology Vol 2. New York:Wiley & Sons, 1994. [ Links ]
17. PARK HY, LEE SU, HUH S, KONG Y, MAGNAVAL JF. A seroepidemiological survey for toxocariasis in apparently healthy residents in Gangwon–do, Korea. Kor J Parasitol 2002;40:113–117. [ Links ]
18. EGUIA–AGUILAR P, CRUZ–REYES A, MARTINEZ–MAYA JJ. Ecological analysis and description of the intestinal helminths present in dogs in Mexico City. Vet Parasitol 2005;127:139–146. [ Links ]
19. HABLUETZEL A, TRALDI G, RUGGIERI S, ATTILI AR, SCUPPA P, MARCHETTI R et al. An estimation of Toxocara canis prevalence in dogs, environmental egg contamination and risk of human infection in the Marche region of Italy. Vet Parasitol 2003;113:243–252. [ Links ]
20. MARTINEZ–MORENO FJ, HERNANDEZ S, LOPEZ–COBOS E, BECERRA C, ACOSTA I, MARTINEZ–MORENO A. Estimation of canine intestinal parasites in Cordoba (Spain) and their risk to public health. Vet Parasitol 2007;143:7–13. [ Links ]
21. FAHRION AS, STAEBLER S, DEPLAZES P. Patent Toxocara canis infections in previously exposed and in helminth–free dogs after infection with low numbers of embryonated eggs. Vet Parasitol 2008;152:108–115. [ Links ]
22. ISHIDA MM, RUBINSKY–ELEFANT G, FERREIRA AW, HOSHINO–SHIMIZU S, VAZ AJ. Helminth antigens (Taenia solium, Taenia crassiceps, Toxocara canis, Schistosoma mansoni and Echinococcus granulosus) and cross–reactivities in human infections and immunized animals. Acta Trop 2003;89:73–84. [ Links ]
23.PERTEGUER MJ, CUELLAR C, GUILLÉN JL, AGUILA C, FENOY S, CHIVATO T et al. Cross–reactivity between Anisakis simplex sensitization and visceral larva migrans by Toxocara canis. Acta Trop 2003; 89:85–89. [ Links ]
24. MAGNAVAL JF, FABRE R, MAURIERES P, CHARLET JP, DE LARRARD B. Application of the western blotting procedure for the immunodiagnosis of human toxocariasis. Parasitol Res 1991;77 :697–702. [ Links ]
25. MAIZELS RM, PAGE AP. Surface associated glycoproteins from Toxocara canis larval parasites. Acta Trop 1990; 47 :355–364 [ Links ]
* Anestesal® Pfizer, México.
** Cabra anti–IgGs de perro marcado con peroxidasa, Serotec Laboratorios, Reino Unido.
*** Mini–Protean II Electrophoretic Cell, Bio Rad Inc., Estados Unidos de América.
**** Semi–Dry Electrophoretic Transfer Cell, Bio Rad Inc, Estados Unidos de América.














