Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Veterinaria México
versión impresa ISSN 0301-5092
Vet. Méx vol.41 no.1 Ciudad de México ene./mar. 2010
Artículos científicos
Comparación de dos métodos diagnósticos para la detección del virus de influenza porcina
Comparison of two diagnostic methods for the detection of the porcine influenza virus
Diana Matilde Sánchez Moreno* Rosalba Carreón Nápoles* Juan Manuel Palacios Arriaga**
* Departamento de Producción Animal: Cerdos, Facultad de Medicina Veterinaria y Zootecnia, Universidad Nacional Autónoma de México, 04510, México, D. F.
** Schering–Plough, S. A. de C.V. Av. 16 de Septiembre 301, Col. Xaltocan–Xochimilco, 16090, México, D. F.
Correspondencia:
Rosalba Carreón Nápoles,
Tels.: (55) 5622–58–69, 70 y 71
E–mails: rcn@correo.unam.mx y rcarreonn@prodigy.net.mx
Recibido el 19 de noviembre de 2008
Aceptado el 9 de noviembre de 2009
Abstract
Due to the lack of a rapid, sensitive and specific test to detect the presence of the porcine influenza virus that offers advantages in field conditions, it is necessary to try different options to obtain a rapid and reliable diagnosis. To do so, samples of nasal mucus, obtained with sterile swabs, were taken from 100 pigs with signs of the presence of such virus. These samples were used to compare two different methods for the detection of the porcine influenza virus. The first one was a commercial test, which is based on a rapid immunochromatography designed to detect the influenza virus type A in poultry. The second method consisted in the viral isolation in cell culture, using MDCK cells sensitized with trypsin; this method, already described in former processes, was compared with the first method, using nasal mucus samples from possible infected pigs with the influenza virus. The results showed that in the immunochromatography test, ten samples were positive, while only eight in the cell culture. Therefore, the immunochromatography was 100% sensitive to detect the influenza virus. The development of this work is important because it offers options in the porcine influenza diagnosis in field conditions, using the rapid immunochromatography test, which suggests that the results must be confirmed in the diagnostic laboratory through viral isolation.
Key words: Porcine Influenza, Diagnosis, Viral Isolation, Immunochromatography.
Resumen
Debido a la falta de una prueba rápida, sensible y específica para detectar la presencia del virus de influenza porcina, que ofrezca la ventaja de utilizar aquélla en condiciones de campo, es necesario probar diferentes opciones para obtener un diagnóstico rápido y confiable. Para ello se utilizaron 100 cerdos con signos de dicho virus; de cada uno de ellos se tomaron muestras de moco nasal obtenidas con hisopos estériles y se compararon dos métodos diferentes para la detección del virus de influenza porcina. El primero de ellos fue una prueba comercial, que está basada en una inmunocromatografía rápida diseñada para detectar virus de influenza tipo A en aves. El segundo método fue el aislamiento viral en cultivo celular en células MDCK sensibilizadas con tripsina; este método, ya descrito en otros trabajos, se comparó con el primer método a partir de muestras de moco nasal de cerdos sospechosos de estar infectados con el virus. Los resultados mostraron que en la prueba de inmunocromatografía, diez muestras fueron positivas y ocho en cultivo celular; la prueba de inmunocromatografía fue 100% sensible para detectar el virus de influenza. El desarrollo de este trabajo es importante, ya que ofrece opciones para el diagnóstico de influenza porcina en campo con el uso de la prueba rápida de inmunocromatografía y sugiere que los resultados deberán confirmarse en el laboratorio de diagnóstico mediante el aislamiento viral.
Palabras clave: Influenza porcina, Diagnóstico, Aislamiento viral, Inmunocromatografía.
Introducción
En México, la industria porcina se encuentra afectada por diferentes problemas de tipo sanitario y enfermedades que originan la producción, una de éstas es la influenza porcina (IP).1
El virus de la IP es uno de los patógenos respiratorios primarios del cerdo, esto significa que puede inducir enfermedad y lesiones pulmonares por sí solo, es una zoonosis en la cual los cerdos actúan como intermediarios o como portadores de nuevas cadenas virales.2
Típicamente, la IP se caracteriza por afectar a los cerdos de la línea de producción, los cuales presentan una rápida aparición de signos clínicos, como fiebre, letargia, tos, estornudo, descarga nasal, respiración difícil, mala calidad espermática, abortos, disminución de producción láctea, pérdida de apetito. La mortalidad es baja y la recuperación ocurre en siete o diez días, por lo cual se considera como enfermedad aguda. 2–4
El virus de IP constituye un importante patógeno en los cerdos, se le asocia con el síndrome respiratorio reproductivo porcino (PRRS); Mycoplasma hyopneumoniae, Pasteurella multocida, Haemophilus parasuis, Streptococcus suis y Bordetella bronchiseptica representan el denominado complejo respiratorio porcino.
La presencia de este complejo en las granjas afecta los indicadores de producción, ocasionando disminución en la tasa de crecimiento, en la ganancia diaria, en la conversión alimentaria, en el consumo y peso de los cerdos al mercado. Se deben tomar medidas inmediatas para evitar que esta enfermedad se acompañe de otros factores que puedan causar daños severos y prolongar la enfermedad, e incluso presentar mortalidad.1,2
Los virus de influenza pueden infectar a toda una variedad de especies, aves, pavos, caballos y mamíferos acuáticos. Es un hecho que la infección interespecie puede ser un mecanismo por el cual se introduzca nuevo material genético en una población de cerdos. Los principales subtipos que afectan a estos animales son H1N1, H3N2 y H1N2, por lo que hay que considerar que el cerdo juega un papel muy importante en la epidemiologia de la enfermedad, ya que presenta receptores para virus humanos y aviares, originando con ello la posibilidad de generar nuevos subtipos que complican el manejo y el control de aquélla.5–8 Debido a lo anterior, debe considerarse el diagnóstico oportuno del virus de IP.
Inicialmente estará basado en la semiótica de la enfermedad; sin embargo, debido a que presenta un curso rápido, esta detección se dificulta, ya que el virus se replica en pulmón de tres a cinco días únicamente después de la infección, por lo que las muestras deben ser tomadas en la fase aguda de la enfermedad, lo que dificulta su rápida detección.3,9,10
Las muestras que se utilizan para el aislamiento del virus de IP son pulmón e hisopo nasal.2 El hisopo debe ser estéril, después de tomar la muestra debe suspenderse en un medio de transporte adecuado y mantenerse a 4°C hasta el momento de ser procesada. Si las muestras van a tardar más de 48 horas, se almacenarán a –70°C.2,9,10 Es conveniente agregar al medio de transporte un antimicrobiano apropiado para controlar los agentes microbianos y micóticos que puedan encontrarse en la muestra.2,10
Cuando se seleccionan cerdos para el diagnóstico, éstos deberán presentar fiebre y descarga nasal serosa, no mucopurulenta pues éste no es signo de IP. Las muestras de estos animales deben ser de pulmón y conservarse en refrigeración a 4°C hasta el momento en que sean procesadas.2,9,10
Para realizar el aislamiento del virus, generalmente se utilizan huevos de gallina embrionados de nueve días de edad, libres de patógenos específicos, estos embriones son inoculados vía saco alantoideo con una preparación de la muestra, ya sea suspensión de un tejido o suspensión de un hisopo procesado, y se obtiene la cosecha del embrión a las 72 horas posinoculación para confrontarlo con eritrocitos de ave.2,9,10
Otra opción es utilizar el cultivo celular, la más usada para el aislamiento de IP es Madin Darby Canine Kidney (MDCK).10 Esta línea celular fue usada por primera vez en 1968 por Gauss; para 1975 el uso de células MDCK ya era más frecuente para el aislamiento de los virus de influenza tipo A, tras descubrir que la adición de tripsina en el cultivo estimulaba el crecimiento del virus y les permitía tensionarse para formar placas con gran eficiencia.11
Reina et al.12 realizaron un estudio donde compararon varias líneas celulares: MDCK, VERO (green monkey continuous cell line) y MRC–5 (human lung embryonated cell) para el aislamiento viral del virus de IP de aspirados nasofaríngeos, los resultados mostraron que la línea MDCK fue superior a las demás líneas, obteniendo 100% de sensibilidad, ello significa que la línea MDCK es la más recomendable para el aislamiento de virus de influenza tipo A de muestras respiratorias.
Herman et al.13 compararon el cultivo del virus de influenza porcina en diferentes líneas celulares adicionadas con tripsina o con dietilaminoetil dextran (DEAE); sus resultados mostraron que la mejor línea celular para cultivar el virus de influenza porcina fue MDCK, adicionada con tripsina, en el resto de las líneas celulares no hubo crecimiento, ni adicionando tripsina o DEAE.
En el cultivo celular la presencia del virus de IP se evidencia el efecto citopático, éste consiste en el redondeamiento de las células a las 72 horas posinoculación y la aglutinación de sus respectivos sobrenadantes, utilizando eritrocitos de ave.10–12
La técnica de inmunocromatografía corresponde al inmunodiagnóstico más moderno, su principal ventajas es que es sencillo y rápido. Cada vez son más las aplicaciones de esta técnica, debido a que no requieren reactivos ni equipo de laboratorio.14,15 La utilización de estas pruebas para la detección del virus de influenza se ha limitado al uso en aves y humanos, debido a la importancia que han tenido este tipo de virus en la salud pública.14,15
El principio de la técnica de inmunocromatografía rápida consiste en utilizar, por lo general, un hisopo nasal, que se pone en contacto con la tira del producto comercial que tiene una zona que contiene un conjugado. Ésta se encuentra impregnada por un anticuerpo contra uno de los epítopos del antígeno a detectar y un reactivo de detección. Si la muestra contiene el antígeno a detectar, se unirá al conjugado, formará un complejo y ambos migrarán a través de la membrana de nitrocelulosa. La zona de captura está formada por un segundo anticuerpo específico contra otro epítopo del antígeno. Al llegar la muestra a esta zona, los complejos formados por la unión del antígeno y conjugado quedarán retenidos y la línea se coloreará (muestras positivas). Si la muestra no contiene el antígeno, el segundo anticuerpo no captura nada y la línea queda transparente (muestra negativa). La zona de control en la tira está formada por un tercer anticuerpo que reconoce al reactivo de detección. Cuando el resto de la muestra alcanza esta zona, el anticuerpo se unirá al conjugado libre que no ha quedado retenido en la zona de captura. Esta línea es un control de que el ensayo ha funcionado bien porque se colorea siempre, con muestras positivas y negativas.16
Actualmente existen dos productos comerciales, basados en el fundamento anterior. Uno de ellos* está diseñado para detectar nucleoproteínas de los virus de influenza tipos A y B, y fue evaluado para detectar el virus de influenza A en aves y cerdos infectados en forma experimental.17 Este paquete constituye una herramienta útil y sensible para realizar un diagnóstico rápido de influenza A en aves y cerdos.
El otro** es una prueba diseñada para detectar el virus de influenza A en aves, en fecha reciente ha sido aprobado por la FDA (Food and Drug Administration) para ser usado en el diagnóstico de influenza A en humanos; éste representa el primer producto diseñado para uso veterinario que es aprobado para uso humano.18
La necesidad de un diagnóstico rápido de la influenza conduce a probar diferentes productos comerciales, aunque éstos no hayan sido diseñados para la especie en la que se trabaja,9 por lo que el objetivo de este estudio fue detectar el virus de la IP por medio de la prueba de inmunocromatografía rápida comercial, así como mediante el aislamiento viral en cultivo celular de células MDCK en animales sospechosos de la enfermedad.
Material y métodos
Se muestrearon 100 cerdos correspondientes a la línea de producción de tres granjas, ubicadas en la zona del Bajío de la República Mexicana. La selección de la granja se basó en antecedentes clínicos y serologías positivas a IP. Los animales seleccionados presentaban signos relacionados con IP, específicamente escurrimiento nasal de tipo seroso y presentación de fiebre, la cual fue detectada a través de un termómetro digital. De cada uno de los cerdos se tomaron muestras con dos hisopos, uno para realizar la prueba de inmunocromatografía y otro para realizar el aislamiento viral. Estos hisopos se conservaron en refrigeración y se transportaron al Laboratorio de Diagnóstico del Departamento Cerdos, de la Facultad de Medicina Veterinaria y Zootecnia de la Universidad Nacional Autónoma de México (FMVZ–UNAM).
Toma de muestras
Para la prueba de inmunocromatografía rápida se tomaron muestras de moco nasal con hisopos estériles, que se frotaron en las fosas nasales de los animales elegidos y posteriormente fueron suspendidos en el medio de transporte que provee el paquete comercial. Para el aislamiento viral se tomaron muestras de moco nasal con hisopos estériles, frotándolos en las fosas nasales del cerdo, posteriormente los hisopos se depositaron en un tubo de ensayo con medio esencial mínimo (MEM), y se colocaron en una caja de poliuretano con refrigerantes para mantener las muestras a 4°C.
Detección viral
Procedimiento
La prueba de inmunocromatografía se llevó a cabo con un equipo comercial.***
Se colocaron ocho gotas de solución tampón en un tubo de ensayo.
Se tomó la muestra del cerdo, se colocó el hisopo en el tubo de ensayo y se giró el hisopo de cinco a diez veces en la solución tampón.
Antes de retirar el hisopo del tubo de ensayo, se presionó varias veces contra el borde del tubo, hasta que no salió más líquido del hisopo.
Se sacó una tira para análisis del tubo con desecante, para cada muestra a analizar, manipulándola únicamente de la parte superior.
Se colocó la tira para análisis directamente en el tubo de ensayo que contenía la muestra extraída.
Se incubó la tira de análisis durante 15 minutos.
Se retiró la tira del tubo de ensayo para realizar la lectura.
Lectura
A los 15 minutos, se observó en el centro de la tira para análisis, la presencia o ausencia de la línea rosada/ púrpura.
La línea control aparece en la parte superior de la tira para análisis, mientras que el resultado de la prueba se lee en la parte inferior de la tira.
Se desechó la tira para análisis en un recipiente para residuos biológicos.
Validación
La prueba es válida si la línea de control se desarrolla en la parte superior de la tira para análisis. La ausencia de la línea de control indica que la prueba no es válida y, por tanto, debe repetirse.
Interpretación
Resultado negativo para antígeno influenza A: presencia únicamente de la línea de control en la parte superior de la tira para análisis.
Resultado positivo para antígeno influenza A: presencia de dos líneas rosadas/púrpuras en la tira de análisis.
Aislamiento en cultivo celular
Éste se realizó de acuerdo con el protocolo de Clavijo et al.11 y Reina et al.12
Procedimiento
Del hisopo recolectado en MEM, se presionó el exceso del medio del hisopo sobre las paredes del tubo.
Se decantó el sobrenadante en otro tubo.
Se centrifugó el sobrenadante a 306 g a 4°C durante 10 minutos para separar el sobrenadante de sedimento de residuos originados por la toma de muestra.
Posteriormente el sobrenadante se filtró mediante membranas de nitrocelulosa desde prefiltro hasta membranas de 22 um de diámetro
Todos los procedimientos hasta el momento de inocular las muestras en el cultivo celular se realizaron manteniendo la muestra fría y en condiciones de esterilidad.
Preparación del cultivo celular
Veinticuatro horas antes de ingresar las muestras al Laboratorio de Diagnóstico, del Departamento Cerdos, de la FMVZ–UNAM, se prepararon placas de 24 pozos que contenían monoestratos confluentes de células MDCK, que fueron sometidos a tripsinización y sembrados a concentración aproximada de 106 células en un volumen de 2 mL/pozo. La placa se colocó en la estufa a 37 °C durante 24 horas para el crecimiento del monoestrato.
Inoculación del cultivo celular
Con pipetas estériles, se retiró el MEM de la placa de 24 pozos que contenía el monoestrato y se lavó durante tres veces con PBS estéril, posteriormente se inocularon 200 µL de la muestra previamente procesada en condiciones de esterilidad y refrigeración.
Luego de lo anterior se colocaron 180 µL de MEM adicionado con tripsina de acuerdo con el protocolo de Clavijo et al.11 y Reina et al.12
Validación
En cada inoculación se utilizaron como testigos positivos, virus H1N1 y H3N2 y como testigos negativos se dejaron pozos sin inocular con el fin de realizar la evaluación en la interpretación de resultados. También se utilizó un control de células con MEM adicionado con tripsina y otro de células sólo con MEM.
Finalmente se selló la placa con cinta adhesiva y se incubó en la estufa a 37°C
Realización de pase ciego, lectura e interpretación de resultados
Las placas se dejaron incubar 72 horas y posteriormente se revisaron en el microscopio invertido para identificar el efecto citopático, el cual consiste en el redondeamiento de las células y su desprendimiento de la monocapa. A las 72 horas posinoculación, se tomaron 200 µL de cada pozo para realizar un pase ciego en monoestrato de células MDCK, preparadas 24 horas antes de realizar el pase.
Después de realizar el pase ciego, la placa inicial se regresó nuevamente a la estufa para su incubación durante dos días más, para finalmente volver a realizar la prueba de aglutinación y titulación de sobrenadantes y teñir el monoestrato de la placa. Se realizó una lectura a las 72 horas posinoculación del pase ciego
Prueba de hemaglutinación
En cada una de las lecturas realizadas a la prueba de aislamiento viral en cultivo celular de células MDCK, se tomaron sobrenadantes de cada una de las muestras y se realizó la prueba de hemaglutinación con eritrocitos de ave a 0.5%, con ese propósito se depositaron 200 µL de sobrenadante de cada una de las muestras en cada pozo de la placa, posteriormente se añadieron 20 uL de suspensión de eritrocitos a 0.5%, se aplicó una ligera agitación a la placa y se dejó incubar por espacio de 20 a 30 minutos a temperatura ambiente. Después de su incubación se observó al microscopio invertido en busca de hemaglutinación.
Titulación de las muestras
Al mismo tiempo que se realizó la prueba de hemaglutinación, se realizaron titulaciones por duplicado en microplacas en fondo U de 96 pozos de cada una de las muestras, para conocer los títulos de las muestras positivas.
Se depositaron 50 µL de PBS en cada pozo de la placa, posteriormente se añadieron 50 uL de sobrenadante a cada pozo, se realizaron diluciones dobles seriadas, para finalmente agregar 50 µL de suspensión de eritrocitos de ave a 0.5%, se dejó incubar por espacio de 20 a 30 minutos a temperatura ambiente, después de su incubación se realizó la lectura de los títulos de las muestras.
La información obtenida fue analizada mediante una prueba de estadística descriptiva, indicando número y porcentaje de muestras positivas y negativas para cada uno de los métodos de diagnóstico utilizados.
Con el propósito obtener la sensibilidad y especificidad de la prueba de inmunocromatograffa con respecto al aislamiento viral, se realizó una tabla de 2 x 2 de acuerdo con el siguiente modelo:
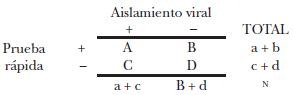
Donde:
a = verdaderos positivos
b = falsos positivos
c = falsos negativos
d = verdaderos negativos
Cálculo de sensibilidad:
S = a/a + c
Cálculo de especificidad:
E=d/b + d
Resultados
Detección viral
Prueba de inmunocromatografía rápida
Los resultados de la detección del virus de influenza por el método comercial de inmunocromatografia rápida fueron: de 100 muestras, diez fueron positivas, ocho de éstas mostraron una banda fuertemente púrpura/rosado y dos muestras aunque de un tono menos intenso, fueron visiblemente positivas. El 10% de las muestras fueron positivas; de las 100 tiras reactivas usadas en este trabajo, 90 fueron negativas.
Aislamiento viral en cultivo celular
Los resultados de la detección del virus de influenza porcina por el método de aislamiento viral en cultivo celular de células MDCK fueron: de 100 muestras, ocho mostraron efecto citopático, este resultado representa 8% del total de las muestras, 92 de 100 muestras no mostraron efecto citopático.
Al hemaglutinar en placa los sobrenadantes de las células inoculadas con eritrocitos de ave y bovino a 0.5% y cuye a 0.75%, aquéllos no mostraron aglutinación alguna, lo cual indica que los cultivos celulares se encontraban libres de hemaglutinantes inespecíficos.
Los resultados de las aglutinaciones y titulaciones a las 72 horas y cinco días posinoculación, mostraron tres diferentes situaciones; muestras positivas a la hemaglutinación que dieron título, muestras positivas a la hemaglutinación que no dieron títulos y muestras que dieron título pero que fueron negativas a la hemaglutinación (Cuadro 1).

Se consideró como muestra positiva al aislamiento viral, aquella que presentó efecto citopático y que resultó positiva a la aglutinación con un título viral. De acuerdo con lo anterior, los resultados de las pruebas de inmunocromatografía rápida, aislamiento viral y titulaciones de muestras positivas a las dos pruebas se resumen en el Cuadro 2.
Resultados del pase ciego
Las muestras que presentaron efecto citopático en el primer pase fueron las mismas que lo presentaron en el segundo, se presentó ligera disminución en la aglutinación y título de los sobrenadantes (Cuadro 2).
Análisis de resultados
Al comparar ambos métodos, se obtuvieron los siguientes resultados; ocho de las 10 muestras positivas a la prueba de inmunocromatografía rápida fueron positivas al aislamiento viral en cultivo celular de células MDCK.
Dos de las diez muestras positivas a la prueba de inmunocromatografía rápida fueron negativas al aislamiento viral en cultivo celular de células MDCK.
Ninguna de las muestras negativas a la prueba de inmunocromatografía rápida fue positiva al aislamiento viral en cultivo celular de células MDCK.
Los resultados obtenidos de sensibilidad y especificidad fueron:

De acuerdo con lo anterior, la prueba de inmunocromatografía rápida tuvo sensibilidad de 100% y especificidad de 97%.
Discusión
La información actual indica claramente que la IP se encuentra ampliamente distribuida por la República Mexicana.19–22 Aunado a lo anterior, la IP representa una enfermedad considerada emergente, lo que hace necesario realizar un diagnóstico rápido y certero de la enfermedad, tan rápido, quizá, que se pueda llevar a cabo en la misma granja, para instrumentar las medidas médico–zootécnicas necesarias inmediatamente, evitando así complicaciones mayores.10 Esta necesidad no ha sido cubierta, es por ello que en este trabajo, así como en otros, se han usado pruebas rápidas diseñadas para detectar virus de influenza tipo A en aves o humanos, debido a que el virus de IP también es un virus con este tipo de influenza, podrían también detectar virus de influenza tipo A en porcinos.17–23,24
Los resultados de este trabajo mostraron diez muestras positivas por la prueba de inmunocromatografía (10%), lo que mostró que la prueba es eficiente para la detección del virus de influenza tipo A, a partir de moco nasal de cerdos, en comparación con el aislamiento viral en cultivo celular de células MDCK, que mostró solo ocho muestras positivas.
El hecho de que de 100 muestras, sólo se haya detectado de 8% a 10% de positividad en los diferentes métodos utilizados, puede deberse al momento en que se realizó la toma de la muestra, ya que posiblemente en ese tiempo no había excreción del virus, esto es muy factible debido al corto periodo de la viremia, que es menor a siete días, por ello es muy importante la detección de la enfermedad en los animales para realizar el diagnóstico de la enfermedad.3
También debe considerarse la selección de los animales, ya que las muestras que resultaron positivas correspondieron a los que presentaron aumento de la temperatura corporal y secreción nasal de apariencia serosa, en el momento de la obtención de la muestra. Este resultado coincide con lo descrito por Olsen et al.,2 quienes mencionan que los animales infectados por influenza manifiestan principalmente estos signos, por lo que el diagnóstico debe realizarse antes de la aparición de enfermedades secundarias de origen bacteriano.
En relación con la prueba de inmunocromatografía, los resultados del presente trabajo coinciden con los obtenidos por Bai et al.,17 quienes evaluaron una prueba comercial de inmunocromatografía rápida, diseñada para humanos, en cerdos y aves, y notifican que esta prueba utilizada sí detectó el virus de influenza tipo A en dichos animales, concluyen que la prueba utilizada constituye una herramienta útil para la vigilancia de virus de influenza A en poblaciones porcinas.
En diferentes estudios23,24 estas pruebas han sido evaluadas y comparadas con otros métodos diagnósticos de influenza en diferentes especies, coincidiendo en que la prueba de inmunocromatografía rápida es una herramienta útil para detectar virus de influenza, que tiene alta sensibilidad y especificidad, resultados que coinciden con los obtenidos en este estudio.
En relación con la prueba de aislamiento viral, los resultados indican que es un método confiable para su detección, debido principalmente a la especificidad que muestra, ello también lo confirman Barigazzi et al.,25 quienes realizaron un estudio en el cual usaban diferentes métodos para diagnosticar IP en cerdas con signos de la enfermedad, el método diagnóstico por el cual lograron obtener más casos positivos fue el aislamiento viral en cultivo celular, seguido por el cultivo celular en embrión de pollo. En otro estudio, Foni et al.14 realizaron el diagnóstico de IP por diferentes métodos y obtuvieron 15.2% de positividad por el método de aislamiento viral en cultivo celular de células MDCK, sólo superado por el método de RT–PCR.
Estos estudios confirman que el método de aislamiento viral en cultivo celular es la elección para confirmar el diagnóstico de IP, no sólo por su especificidad y sensibilidad, sino también porque aunque la prueba se realiza, en aproximadamente dos semanas se confirma si el agente está o no presente.14,25
Es importante mencionar que ocho muestras fueron positivas para ambos métodos y presentaron títulos hemaglutinantes de 1:4 hasta 1:64, indicando la alta sensibilidad de ambos métodos, pero dos muestras positivas a la prueba de inmunocromatografía rápida fueron negativas al aislamiento viral, lo que concuerda con los resultados obtenidos que mostraron una sensibilidad de la prueba de inmunocromatografía rápida de 100%, ello indica que puede utilizarse como prueba rápida o de tamiz para influenza porcina, como ya ha sido mencionado por otros autores, 17,23,24 pero para confirmar la presencia del agente, lo ideal es realizar el aislamiento viral.
De acuerdo con lo anterior, se concluye que la importancia de la toma de la muestra y la selección de los animales como posibles infectados de influenza porcina son determinantes para el éxito de su diagnóstico. Los signos clínicos más importantes para la selección de los animales es la temperatura corporal, así como la presencia de moco nasal seroso.
En este contexto, al evaluar la prueba comercial rápida, por estar diseñada para detectar virus de influenza del tipo A en aves y al compararla con el asilamiento viral, resultó ser lo suficientemente sensible y específica para detectar el virus de influenza en cerdos, esto último sugiere una alternativa para la detección rápida y oportuna del virus en condiciones de campo, con resultados en 30 minutos e instrucciones sencillas ello permite que se tomen medidas inmediatas de control de este virus.
Referencias
1. FLEITES AM, BUENFIL RJ, CARRASCO CA, GUZMÁN RL, TAVERA AG, CORREA SJ. Perfil serológico de influenza porcina, Mycoplasma hyopneumoniae y Actinoba–cillus pleuropneumoniae en granjas de Yucatán, México. Vet Méx 2004; 35: 295–305. [ Links ]
2. OLSEN CW, BROWN IH, EASTERDAY BC, VAN REETH K. Swine Influenza. In: STRAW B, ZIMMERMAN JJ, D'ALLAIRE S, TAYLOR DJ, editors. Diseases of swine. Iowa USA:Blackwell Publishing, 2006: 469–482. [ Links ]
3. VAN REETH K. Swine Influenza: variations on an old theme. The European Surveillance Network for Influenza in pigs, [serial online] 2007 may [cited: 2007 jun 30] Available from: http://www.esnip.ugent.be/page4/page4.html. [ Links ]
4. SKIBBE D, ZHOU ME, JANKE HB. Comparison of a commercial enzyme–linked immunoabsorbent assay with hemagglutination inhibition assay for serodiagnosis of swine influenza virus (H1N1) infection. J Vet Diagn Invest 2004; 16: 86–89. [ Links ]
5. ZHOU ME, SENNE AD, LANDGRAF SJ, SWENSON LS, GENE E, ROSSOW K et al. Genetic reassortment of avian, swine, and human influenza A viruses in American pigs. J Virol 1999; 73: 8851–8856. [ Links ]
6. GRAMER MR. Defining swine influenza virus. J Swine Health Prod 2005; 13: 157–160. [ Links ]
7. OLSEN WC. Epidemiology of swine influenza. Proceedings of the Allen D. Leman Swine Conference; 1999 september 19–22; Saint Paul Minnesota. Saint Paul Minnesota: University of Minnesota college of Veterinary Medicine, Veterinary Outreach programs, 1999: 255–261. [ Links ]
8. FESENKO EE, KIREYEV HD, GRYADUNOV DA, MIKHAILOVICH VM, GREBENNIKOVA VT, L'VOV KD et al. Oligonucleotide microchip for subtyping of influenza A virus. Influenza Other Respir Viruses 2007; 1:121–129. [ Links ]
9. GENE E. H1N1 and H3N2 swine influeza: optimizing sample selection to confirm your diagnosis and control disease. Proc Am Assoc Swine Pract 200; 311–312. [ Links ]
10. JANKE BH. Diagnosis of swine influenza. Swine Health Prod 2000; 8: 79–84. [ Links ]
11. CLAVIJO A, TRENZAN DB, JOLIE R, ZHOU ME. Comparison of embrionated chicken eggs whit MDCK cell culture for the isolation of swine influenza virus. Can J Vet Res 2002; 66: 117–121. [ Links ]
12. REINA J, FERNANDEZ BV, BLANCO I, MUNAR M. Comparison of Madin–Darby canine kidney cells (MDCK) with a green monkey continuous cell line (VERO) and human lung embryonated cells (MRC–5) in the isolation of influenza A virus from nasopharyngeal aspirates by shell vial culture. J Clin Microbiol 1997; 35: 1900–1901. [ Links ]
13. HERMAN M, HAUGERUD S, MALIK SY, GOYAL MS. Improved in vitro cultivation of swine influenza virus. Int J Appl Res Vet Med 2005; 3: 124–128. [ Links ]
14. FONI E, CHIAPPONI C, FRATTA E, GARBARINO C, BARIGAZZI G, MERENDA M. Detection of swine influenza virus by RT–PCR and standard methods. Proccedings 4th International Sympsium of Emerging and re–emerging Pig Disease 2003 June 29–July 2; Rome, Italy. Rome, Italy:University of Parma, Faculty of Veterinary Medicine, 2003: 270–271. [ Links ]
15. SÁNCHEZ MM. Certificación de la concentración de masa de la isoenzima 2 de la creatinina – quinasa del material de referencia BCR 608 (tesis doctoral). Barcelona, España: Departamento de Bioquímica y Biología Molecular. Universidad Autónoma de Barcelona, 2000. [ Links ]
16. MARTÍN CM. Práctica 8: Inmunocromatografía. Universidad Autónoma de Madrid. 2005. [serie en línea] 2005 mayo [Citado: 2008 mayo 14] Disponible en: http://www.uam.es/personal–pdi/ciencias/mariamc/lacteos/practica8.htm [ Links ]
17. BAI RG, SAKODA Y, MWEENE SA, KISHIDA N, YAMADA T, MINAKAWA H et al.Evaluation of the ESPLINE® INFLUENZA A & B–N Kit for the diagnosis of avian and swine influenza. Microbiol Immunol 2005; 49: 1063–1067. [ Links ]
18. SYNBIOTICS CORPORATION. Synbiotics corporation announces human submission for flue detect [serial online] 2008 march [cited: 2008 may 12] Available from: http://www.synbiotics.com/PR.htm. [ Links ]
19. CHÁVEZ RS. Determinación de anticuerpos contra el virus de influenza porcina subtipo H3N2 en diferentes estados de la República Mexicana (tesis de licenciatura) México, DF: Facultad de Medicina Veterinaria y Zootecnia. Universidad Nacional Autónoma de México, 2005. [ Links ]
20. JIMÉNEZ NJ, MERCADO GC, CARREÓN NR, HERRADORA LMA. Determinación de anticuerpos contra el virus de influenza porcina subtipo H3N2 en cerdos de diferentes sistemas de producción en México. Memorias XLI Congreso de la Asociación Mexicana de Veterinarios Especialistas en Cerdos; 2006 julio 16–19; Ixtapa (Guerrero) México. México (DF): Asociación Mexicana de Veterinarios Especialistas en Cerdos, AC, 2006:200. [ Links ]
21.TRUJILLO OME, CARREÓN NR, MERCADO GC, QUEZADA MF. Determinación de anticuerpos contra el virus de influenza H1N1 y H3N2 en sueros porcinos. Memorias XXXIX Congreso de la Asociación Mexicana de Veterinarios Especialistas en Cerdos; 2004 julio 28 al 1° agosto ; Puebla (Puebla) México. México (DF): Asociación Mexicana de Veterinarios Especialistas en Cerdos, AC, 2004: 181. [ Links ]
22 BELTRÁN FR, TRUJILLO OME, MARTÍNEZ RR, SÁNCHEZ BJI. Identificación del virus de influenza porcina subtipos H1N1 y H3N2 mediante RT–PCR. Memorias XLII Congreso de la Asociación Mexicana de Veterinarios Especialistas en Cerdos; 2007 julio 25–28; Querétaro (Querétaro) México. México (DF): Asociación Mexicana de Veterinarios Especialistas en Cerdos, AC, 2007: 190. [ Links ]
23 TSUDA Y, SAKODA Y, SAKABE S, MOCHIZUKI T, NAMBA Y, KIDA H. Development of an immunochromatographic kit for rapid diagnosis of H5 avian influenza virus infection. Microbiol Immunol 2007; 51: 903–907. [ Links ]
24 ITO M, WARANABE M, NAKAGAWA N, IHARA T, OKUNO Y. Rapid detection and typing of influenza A and B by loop–mediated isothermal amplification: comparison with immunochromatography and virus isolation. J Virol Meth 2006; 135: 272–275. [ Links ]
25 BARIGAZZI G, FONI E, CHIAPPONI C, LEOTTI G, LONGO S, JOISEL F. Use of standard kit for the diagnosis of respiratory viral infections in pigs. Proceedings 4th International Symposium of Emerging and re–emerging Pig Disease; 2003 June 29–July 2; Rome, Italy. Rome, Italy: University of Parma, Faculty of Veterinary Medicine, 2003: 268–269. [ Links ]
Este trabajo es resultado de la tesis de licenciatura de Medicina Veterinaria y Zooctenia de la primera autora.
* Espline® Influenza A & B–N, Japón.
** Flue detectTM Avian Influenza Type A Antigen, Estados Unidos de América.
**** Flue detectTM Synbiotics Corporation, Estados Unidos de América.














