Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Veterinaria México
versión impresa ISSN 0301-5092
Vet. Méx vol.40 no.4 Ciudad de México oct./dic. 2009
Notas de investigación
Análisis de los parámetros del eyaculado en la rata Wistar de laboratorio: descripción de la técnica
Analysis of the parameters of the ejaculate in the laboratory Wistar rat: technical description
Rosa Angélica Lucio* José Luis Tlachi** Aurora Adriana López** René Zempoalteca* Javier Velázquez–Moctezuma***
* Centro Tlaxcala de Biología de la Conducta, Universidad Autónoma de Tlaxcala, Carretera Tlaxcala–Puebla, km 1.5 s/n, Tlaxcala, 90062, Tlaxcala, México, Apartado Postal 264, telefax: (246) 462–1557; correo electrónico: lucioral@yahoo.com.mx.
** Maestría en Ciencias Biológicas, Universidad Autónoma de Tlaxcala, Carretera Tlaxcala–Puebla, km 1.5 s/n, Tlaxcala, 90062, Tlaxcala, México.
*** Área de Neurociencias, Universidad Autónoma Metropolitana–Iztapalapa, Avenida Michoacán y La Purísima, Iztapalapa, 38340, México, D. F.
Recibido el 19 de noviembre de 2008
Aceptado el 18 de septiembre de 2009
Abstract
The number of spermatozoa, weight and size of the seminal plug has been quantified in the ejaculate of the laboratory rat and sperm viability, sperm mobility and sperm concentration in samples obtained from the epididymis. The reference values for the rat ejaculate have not been determined maybe due to the difficulty to obtain it directly from the male. Nevertheless, an approach can be obtained analyzing the ejaculate collected from the inseminated female. The objective of this study was to evaluate and propose the values of the macroscospic and microscopic parameters of the semen and seminal plug obtained from the female. The seminal analysis of the Wistar rats was performed adapting the methods used for other species. After one ejaculatory series, semen contained in the uterine horns was obtained, as well as the seminal plug from the vagina. In more than one hundred ejaculates, 94.54% were off–white with 2.35 ± 0.06 mm of viscosity and 8.13 ± 0.02 of pH. The sperm concentration was 16.3 ± 0.59 millions of spermatozoa per mL, 0.72 ± 0.01 mobility index, 64.4 ± 0.7% viability and 99.11 ± 0.20% normal morphology. From 99% of seminal plugs, 92.7% were hardened, they weighed 115.63 ± 1.54 mg, measured 12.41 ± 0.13 and 5.31 ± 0.05 mm of length and width respectively, and volume 87.70 ± 1.74 mm3 . In conclusion, the used method to obtain and to evaluate the parameters of the ejaculate is reliable, for that reason, it is suggested that the results obtained could be considered as indicative values for semen and seminal plug for the Wistar rat.
Key words: Semen, Sperm Mobility, Sperm Viability, Sperm Morphology, Number of Spermatozoa, Seminal Plug.
Resumen
Se ha cuantificado en el eyaculado de la rata de laboratorio, el número de espermatozoides, peso y tamaño del tapón seminal, y en muestras obtenidas de epidídimo, la viabilidad, movilidad y concentración espermáticas. Los valores de referencia para el eyaculado de la rata no se han determinado quizá por la dificultad para obtenerlo directamente del macho. No obstante, puede obtenerse una aproximación al analizar el eyaculado recolectado de una hembra recién inseminada. El objetivo de este estudio fue evaluar y proponer los valores de los parámetros macroscópicos y microscópicos del semen y tapón seminal obtenidos de la hembra. El análisis del semen de ratas Wistar se realizó adecuando los métodos usados para otras especies. Después de una serie eyaculatoria, se obtuvo el semen contenido en los cuernos uterinos y el tapón seminal de la vagina. En más de 100 eyaculados, 94.54% fueron blanquecinos, con 2.35 ± 0.06 mm de viscosidad y 8.13 ± 0.02 de pH. La concentración espermática fue de 16.3 ± 0.59 millones de espermatozoides por mL, 0.72 ± 0.01 de índice de movilidad, 64.4 ± 0.7% de viabilidad y 99.11 ± 0.20% de morfología normal. Del 99% de los tapones seminales, 92.7% fueron endurecidos, pesaron 115.63 ± 1.54 mg, midieron 12.41 ± 0.13 y 5.31 ± 0.05 mm de largo y ancho, respectivamente, y de volumen 87.70 ± 1.74 mm3. En conclusión, el método utilizado para obtener y evaluar los parámetros del eyaculado es confiable, por ello se sugiere que los resultados obtenidos podrían considerarse como valores indicativos para el semen y tapón seminal de la rata Wistar.
Palabras clave: Semen, Movilidad espermática, Viabilidad espermática, Morfología espermática, Número de espermatozoides, Tapón seminal.
Introducción
Durante la eyaculación se expele semen que está constituido de espermatozoides provenientes del epidídimo y de secreciones sintetizadas por las distintas glándulas sexuales accesorias. Tanto el semen de las especies de importancia doméstica como el del hombre han sido analizados en forma macroscópica y microscópica, no así el de la rata de laboratorio que es el modelo animal más ampliamente utilizado en los estudios reproductivos. Pocos estudios se han enfocado en analizar algunos de los parámetros, particularmente los microscópicos, de ellos la concentración espermática ha llamado la atención. En estudios pioneros se estimaron 83 millones1 y 58 millones2 de espermatozoides por mililitro en el semen obtenido después de la cópula normal, y 79 millones en condiciones monándricas,3 contrastado con 18 millones de espermatozoides por mililitro después de sólo una eyaculación.4 Debe mencionarse que en los trabajos referidos, el fluido seminal analizado se obtuvo de los conductos de las hembras inseminadas. Con la técnica de electroeyaculación se cuantificaron diez millones5 y 63 millones de espermatozoides6 y de dos a seis millones en eyaculaciones espontáneas.7,8
En estudios más recientes, además de la concentración espermática, se ha evaluado la movilidad y la morfología, pero no del semen de una o varias eyaculaciones, sino de los espermatozoides obtenidos del epidídimo. En relación con la concentración espermática, se han cuantificado de 152 a 230 millones,9 440 millones,10180 millones11 y 95 millones de espermatozoides.5 Otros estudios se han limitado a la morfología en ellos, se ha encontrado que 8%12 y 16% de los espermatozoides de ratas viejas tenían gota citoplásmica.11 Respecto a la movilidad espermática, 23% de los espermatozoides mostraron movilidad.5 Mediante el programa de análisis asistido por computadora para analizar el semen (CASA, por sus siglas en inglés) se encontró que 75%,12 79%13 y 100%11 de los espermatozoides presentan movilidad progresiva.
Los parámetros evaluados en el tapón seminal se han limitado a los macroscópicos: presencia, peso y tamaño. Respecto a la presencia, no se encontró tapón seminal en 32%4 y 20% de las eyaculaciones.14 En cuanto al peso, las cantidades varían desde 100 mg,4 130 mg14 hasta 170 mg.15 En cuanto al tamaño, se estiman 12 mm y 5 mm para el largo y ancho del tapón seminal, respectivamente.4 Entonces, es claro que no todos los parámetros están considerados en un mismo estudio, que las muestras analizadas se han obtenido de las hembras inseminadas o por electroeyaculación, o son espermatozoides de la cauda epididimaria. Por lo tanto, no hay un método sistemático que permita analizar el mayor número de las características del eyaculado de la rata, ni tampoco existen los valores de referencia correspondientes.
El propósito de este estudio fue adecuar la técnica para evaluar macroscópica y microscópicamente el semen y el tapón seminal, obtenidos de la hembra después de una serie eyaculatoria, así como determinar los valores indicativos respectivos.
Animales
Se utilizaron ratas macho, adultas, de la cepa Wistar (peso corporal de 300–450 g), mantenidas en condiciones estándar de bioterio con temperatura y humedad controladas y con ciclo de luz invertido 12:12 horas (la luz se encendía a las 22:00 h). Se les proporcionó diariamente alimento comercial* y tenían acceso continuo al agua. Todos los procedimientos fueron aceptados por el Comité de Ética del Centro de Investigación, de la Universidad Autónoma de Tlaxcala.
Conducta copulatoria
Las pruebas copulatorias fueron realizadas durante el segundo tercio del periodo de oscuridad, consistieron en colocar a la rata macho en una arena cilíndrica (50 x 50 cm de alto y diámetro), de acrílico transparente, durante cinco minutos de habituación. Después se colocó en la arena una rata hembra, siempre del mismo peso corporal (250–280 g), virgen, ovariectomizada y con estro inducido. El estro fue inducido mediante el tratamiento secuencial de benzoato de estradiol (10 µg) seguido de progesterona (2 mg), 48 y cuatro horas, respectivamente, antes de la prueba. Los parámetros macroscópicos y microscópicos del semen fueron evaluados en 111 eyaculados de machos intactos y expertos sexualmente.
Análisis del eyaculado
Aproximadamente diez minutos después de que el macho había desplegado el patrón eyaculatorio, la hembra fue anestesiada con pentobarbital sódico** (26 mg/kg de peso corporal, vía intraperitoneal), para realizar una incisión abdominal y exponer a los cuernos uterinos, que ligados proximal y distalmente, fueron extraídos de la cavidad. Luego los cuernos uterinos ligados fueron sumergidos en una caja de Petri que contenía solución salina (0.9%) a 37°C, para eliminar con facilidad el tejido graso y la red de vasos uterinos externos. El contenido seminal de ambos cuernos uterinos fue vertido en un tubo de microcentrífuga (transparente y con capacidad de 1.5 mL), mantenido en un termobaño*** a 37°C para el inmediato análisis de los parámetros macroscópicos y microscópicos.16
Evaluación de los parámetros macroscópicos del semen
El color del semen (aspecto del fluido seminal, considerado un parámetro cualitativo) fue determinado mediante observación directa. Para determinar la viscosidad (consistencia del fluido seminal, expresada en milímetros) se colocó sobre el borde del tubo de microcentrífuga, la punta de una pipeta de transferencia con 0.125 mL de semen fresco, se liberaron 0.60 mL de manera precisa. La punta se retiró lentamente del borde del tubo de microcentrífuga para observar la formación del filamento de semen. La longitud del filamento se midió con un Vernier digital. Para medir el pH (acidez o alcalinidad del semen) se colocaron 10 µL de semen fresco sobre un papel de indicador de pH. El color adquirido se comparó inmediatamente con los colores estándar impresos.
Evaluación de los parámetros microscópicos del semen
Para medir la concentración espermática (número de espermatozoides, expresado en millones por mililitro), primero se determinó la dilución de la muestra, para ello se vertieron 10 µL de semen fresco sobre un portaobjetos (25 x 75 mm) y sobre la muestra se colocó un cubreobjetos (22 x 22 mm) y se observó con el objetivo 20X. El número de espermatozoides se cuantificó en tres campos al azar para determinar la densidad espermática, que, en promedio, fue de 93.33 espermatozoides (y el rango de 60–120 espermatozoides). Por lo tanto, la dilución de semen que se utilizó fue 1:200; para prepararla se utilizó una manguera de succión (30–40 cm de largo y 3 mm de diámetro del lumen), conectada al extremo superior de la pipeta de dilución (para eritrocitos) Shali.
Se succionó semen fresco usando la manguera hasta la marca 0.5 de la pipeta Shali, después se absorbió el líquido de dilución (formaldehído a 2%) hasta la marca 101. La manguera fue desconectada y la pipeta se colocó horizontalmente, cubriendo sus extremos abiertos con el dedo pulgar y el dedo medio. La pipeta se sacudió en forma manual hasta homogeneizar la mezcla. El semen así diluido fue colocado en un tubo de microcentrífuga. Se colocaron 10 µL del semen diluido en cada una de las dos cuadrículas del hemocitómetro Neubauer y se observaron con el objetivo 20X. La evaluación se realizó en la cuadrícula central (conocida como E), considerando los espermatozoides de cinco cuadros específicos (los cuatro de las esquinas y el de en medio). Se contaron los espermatozoides cuyas cabezas estaban dentro de estos cinco cuadrados pequeños, como lo establece la Organización Mundial de la Salud.17
Se sumó el número de espermatozoides contados en cada cuadrícula y se dividió para obtener el promedio, el resultado se multiplicó por 1 000 000. Para determinar la movilidad espermática (movimiento individual de los espermatozoides, clasificada en cuatro categorías: progresiva rápida, progresiva lenta, in situ e inmóvil) se colocaron 10 µL de semen fresco sobre un portaobjetos, se cubrieron con un cubreobjetos y se analizaron 100 espermatozoides que cruzaron la línea horizontal dibujada sobre la mitad del campo de observación.
La lectura se hizo de izquierda a derecha y se utilizó el objetivo 20X. Los espermatozoides que tardaron tres segundos en cruzar la línea se identificaron como de movilidad progresiva rápida; los que tardaron más de cuatro segundos, de movilidad progresiva lenta. Los espermatozoides con movimiento in situ fueron considerados no progresivos, y aquellos sin movimiento se identificaron como inmóviles.
El índice de movilidad se determinó sumando el número de espermatozoides rápidos con el número de espermatozoides lentos, el resultado se dividió entre 100. La movilidad de los espermatozoides se filmó para corroborar los datos. La viabilidad espermática (número de espermatozoides vivos, expresado en porcentaje) se determinó usando un colorante constituido de nigrosina, eosina y citrato de sodio, todos solubles en agua destilada. Se colocaron 10 µL de semen sobre un portaobjetos, luego se añadieron 10 µL del colorante, ambas muestras se mezclaron con un palillo de madera. Los espermatozoides teñidos se consideraron muertos y los no teñidos, vivos. La determinación de la morfología espermática (número de espermatozoides normales, expresado en porcentaje), se realizó en la preparación teñida utilizada para evaluar la viabilidad espermática. Se distinguieron los espermatozoides normales, con cabeza en forma de hoz y flagelo largo versus los anormales, con doble cabeza, flagelo fragmentado o en zig–zag. En ambos casos se evaluaron 100 espermatozoides al azar con el objetivo 100X.
Todos los parámetros microscópicos del semen fueron evaluados dos veces para reducir errores; además se analizaron usando un microscopio**** equipado con videocámara a color,***** y una videograbadora,****** todo ello conectado a una computadora. El contador digital permite el conteo de espermatozoides considerados segun su movilidad, viabilidad o morfología.
Después de evaluar el semen, se obtuvo el tapón seminal de la vagina separando la sínfisis púbica y cortando longitudinalmente la pared vaginal. Este procedimiento es útil para obtener el semen y tapón seminal de la hembra recién inseminada.4,3
Evaluación de los parámetros macroscópicos del tapón seminal
La consistencia del tapón seminal (solidez del tapón seminal, parámetro cualitativo) se determinó mediante inspección táctil directa, el peso del tapón seminal (masa del tapón seminal, expresada en miligramos) se determinó con una balanza analítica,******* el tamaño del tapón seminal (largo y ancho del tapón seminal, expresados en milímetros), se determinó usando un Vernier digital y el volumen del tapón seminal (masa ocupada por el tapón seminal, expresado en milímetros cúbicos), aplicando la fórmula:

donde:
r = radio del tapón seminal.
Evaluación de los parámetros microscópicos del tapón seminal
Elementos citológicos del tapón seminal (número de cabezas solas, flagelos solos y espermatozoides completos, expresados en porcentaje). Primero se cortó transversalmente con un bisturí el tapón seminal en su eje ecuatorial, obteniendo dos mitades. Después, la mitad rostral del tapón se deslizó en forma horizontal de izquierda a derecha sobre un portaobjetos (25 x 75 mm), dibujando cuatro líneas, se tuvo cuidado de no traslaparlas. Se contaron los elementos observados y se sumaron, después se obtuvo el porcentaje de cada uno.
Los datos de cada parámetro macroscópico y microscópico del semen y tapón seminal fueron analizados mediante estadística descriptiva, las gráficas se hicieron con el software Statistica 7.1. Se analizaron 111 eyaculados de los conductos reproductivos de las hembras recién inseminadas. El semen se obtuvo de los cuernos uterinos y el tapón seminal de la vagina. Los valores de los parámetros macroscópicos y microscópicos de 104 de 111 muestras de semen se expresan en promedio ± error estándar en el Cuadro 1. La concentración espermática mostró gran variabilidad, la mínima fue de cuatro millones de espermatozoides por mililitro de semen, encontrada en tres muestras de semen, y la máxima de 39 millones de espermatozoides por mililitro de semen en dos de ellas. Aproximadamente 30 muestras de semen presentaron de diez a 15 millones de espermatozoides por mililitro, y alrededor de 40 tuvieron de 15 a 20 millones de espermatozoides por mililitro (Figura 1a).
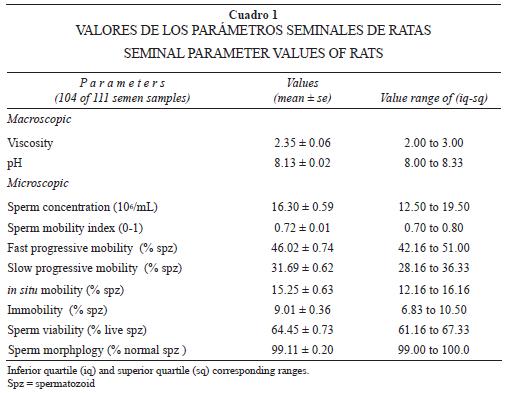

El índice de la movilidad espermática fue de 0.72 ± 0.01, el más bajo fue 0.42 en una muestra de semen, y el más alto de 0.90 en 13 muestras. La mayor parte de las muestras de semen presentaron un índice de movilidad de 0.6 a 0.8 (Figura 1b). Finalmente, la viabilidad espermática no fue tan variable; de hecho, la mayor parte de las muestras del semen presentó entre 60% a 70% de espermatozoides vivos. El valor más bajo de espermatozoides vivos fue 32% y el más alto fue de 86%, correspondiendo a dos y cinco muestras, respectivamente. El promedio de la viabilidad espermática fue 64.45 ± 0.73 (Figura 1c).
Los valores de los parámetros macroscópicos de 102 de 111 tapones seminales, como peso, tamaño y volumen fueron expresados en promedio ± error estándar (Cuadro 2). El tapón seminal contenía algunas cabezas solas y muy pocos flagelos solos, así como escasos espermatozoides completos (Figura 2).


El peso del tapón seminal fue de 115.6 ± 1.5 mg, variando desde 104.6 mg hasta 126 mg. El volumen también mostró variación, de 40 a 140 mm3, el valor promedio fue 87.7 ± 1.74 mm3. En relación con el tamaño, el promedio fue 12.4 ± 0.1 mm de longitud y 5.3 ± 0.05 mm de ancho. La longitud del tapón seminal fue más variable que el ancho, el más corto fue de 9.70 mm y el más largo de 18.45 mm; el más delgado fue de 3.60 mm y el más ancho de 6.83 mm.
Finalmente, el análisis citológico del tapón seminal mostró más cabezas solas que espermatozoides completos, sus valores variaron entre los diferentes frotis de los tapones seminales (Figura 3a). En un frotis se encontraron 23 cabezas solas, mientras que en otro se observaron 96. El rango de flagelos solos fue de uno hasta 76, aunque comúnmente se encontraron de 11 a 20 flagelos (Figura 3b). Además, 31 de 102 frotis no mostraron espermatozoides completos y en 65 frotis el rango fue de uno a diez espermatozoides completos (Figura 3c).

Los parámetros macroscópicos y microscópicos del semen se han analizado en especies de importancia económica y en el hombre. La evaluación de tales parámetros se denomina directa cuando el semen analizado es obtenido directamente del macho y depositado en contenedores especiales después de la estimulación mecánica (por ejemplo, gallo,21 hombre17) o eléctrica (por ejemplo, caballo22). Cuando el semen es obtenido de hembras recién inseminadas (por ejemplo, rata hembra,3,4 mujer17) luego de un encuentro sexual y es analizado, dicho procedimiento se conoce como evaluación indirecta. La evaluación directa o indirecta de semen (constituida por espermatozoides y secreciones de glándulas sexuales accesorias) consiste en el análisis de las características macro y microscópicas del eyaculado, mientras que en las muestras obtenidas de epidídimo (constituidas sólo por espermatozoides) el análisis se restringe a evaluar algunas de las características microscópicas de los espermatozoides, como concentración y morfología.
Para la rata ha resultado difícil obtener semen directamente del macho porque la retracción del prepucio, a pesar de inducir distintas intensidades de erección no provoca la eyaculación,23 además de que la electroeyaculación produce volúmenes muy pequeños de semen.24 Asimismo, no existen vaginas artificiales para recolectar el eyaculado.24 Esto podría explicar por qué no se han evaluado la mayoría de los parámetros del semen de la rata y tampoco se conocen sus valores de referencia.
Como consecuencia de que la rata constituye una de las especies más utilizadas en los laboratorios de biología reproductiva, en el presente trabajo se consideró que evaluar la mayoría de los parámetros tanto macroscópicos como microscópicos de su eyaculado resultaría en un estudio más completo. Por ello, el hincapié en describir detalladamente la técnica empleada, así como las condiciones del contexto copulatorio (machos expertos sexualmente, hembras vírgenes pero ovariectomizadas con estro inducido y una sola eyaculación) para obtener valores que sirvan de comparativo con otros estudios cuyo objetivo sea realizar alguna manipulación que incida sobre las características del semen. Aunque se sabe que los resultados de una espermatobioscopía pueden variar entre individuos, incluso entre las eyaculaciones de un mismo individuo, los resultados del presente estudio podrían ser considerados como valores indicativos, ya que corresponden al análisis de semen y de tapones seminales de más de 100 individuos. Para que los resultados obtenidos fueran de mayor utilidad, no sólo se expresó el promedio sino también los rangos, mínimos y máximos de cada parámetro tanto de semen como de tapón seminal (Cuadros 1 y 2). Aún más, la variabilidad de los parámetros microscópicos del semen (concentración espermática, índice de movilidad y viabilidad espermática) y del tapón seminal (cabezas solas, flagelos solos o espermatozoides completos) se representa en histogramas de frecuencia (Figuras 1 y 3).
Obtener el semen de las ratas inseminadas para evaluarlo ofrece ventajas y desventajas. Aunque los valores analizados no corresponden al fluido seminal exclusivamente porque se mezcla con el fluido uterino, permite la evaluación más aproximada de la mayoría de los parámetros del eyaculado (semen y tapón seminal) y no se limita a evaluar uno o dos parámetros, como ocurre cuando las muestras se obtienen del epidídimo. Uno de los parámetros macroscópicos que no puede evaluarse es el volumen seminal, porque es difícil diferenciar entre el volumen de semen y el volumen del fluido intrauterino.18 Además no puede estimarse un volumen aproximado porque en las observaciones hechas en el laboratorio, se detectó que el volumen de los fluidos femeninos varía desde 0.1 hasta 1 mL. Otro parámetro es el color del semen al que no se le puede analizar cuantitativamente, pero sí en forma cualitativa. Algo similar ocurre con uno de los parámetros del tapón seminal, la consistencia que se analiza cualitativamente se distingue como endurecida o no endurecida. El resto de los parámetros macroscópicos y todos los microscópicos del semen y del tapón seminal sí pueden determinarse de manera cuantitativa.
Si el interés de un trabajo se enfoca solamente en los efectos que pudiera tener una intervención quirúrgica, química o farmacológica sobre el tapón seminal, éste pudiera obtenerse de una hembra recién inseminada (a partir de los cinco minutos después de la eyaculación) sin necesidad de sacrificarla; para ello, bastaría con colocarla con otro macho y esperar a que realice entre tres y cuatro intromisiones para observar sobre el piso de la arena de observación el tapón seminal desprendido de la vagina.14 Es importante que el piso sea oscuro y no tenga viruta encima con la finalidad de visualizarlo fácilmente a aquél.14 Luego de esto último, el tapón seminal debe ser retirado de inmediato para evitar que lo ingieran la hembra o el macho.
Con base en lo anterior, se concluye que este método constituye una herramienta sencilla, confiable y económica, ya que no se requiere de equipo sofisticado. Además, al considerar que las muestras del eyaculado son producto de la cópula y que se obtiene de las estructuras anatómicas femeninas, los resultados finales reflejan las condiciones fisiológicas naturales versus los resultados de las muestras obtenidas por electroeyaculación o de epidídimo.
Agradecimientos
Los autores agradecen a María de los Ángeles Díaz y Beatriz Mendoza sus comentarios técnicos. El apoyo financiero parcial fue de PROMEP 10.3/04/2849–AUT–LAX–CA26; UATLX–CA–191 y del Consejo Nacional de Ciencia y Tecnología, de México (Proyecto 67530 a RAL). Las becas 188574 a José Luis Tlachi y 198782 a Aurora Adriana López fueron otorgadas por el Conacyt.
Referencias
1. FARRIS EJ. Spermatozoa counts in albino rats. Anat Rec 1946; 94:360–361. [ Links ]
2. BLANDAU RJ, ODOR DL. The total number of spermatozoa reaching various segments of the reproductive tract in the female albino rat at intervals after insemination. Anat Rec 1949; 103:93–109. [ Links ]
3. POUND N, GAGE MJG. Prudent sperm allocation in Norway rats, Rattus norvegicus: a mammalian model of adaptive ejaculate adjustment. Anim Behav 2004; 68:819–823. [ Links ]
4. AUSTIN D, DEWSBURY DA. Reproductive capacity of male laboratory rats. Physiol Behav 1985; 37:627–632. [ Links ]
5. MOTRICH RD, PONCE AA, RIVERO VE. Effect of tamoxifen treatment on the semen quality and fertility of the male rat. Fertil Steril 2007; 2:452–461. [ Links ]
6. SCOTT JW, DZIUK PJ. Evaluation of the electroejaculation technique and the spermatozoa thus obtained from rats, mice and guinea pigs. Anat Rec 1959: 133:655–664. [ Links ]
7. AGMO A. The number of spermatozoa in spontaneous ejaculates in rats. J Reprod Fertil 1976; 48:405–407. [ Links ]
8. AGMO A, ANDERSSON R, JOHANSSON C. Effect of oxytocin on sperm numbers in spontaneous rat ejaculation. Biol Reprod 1978; 18:346–349. [ Links ]
9. LAMANO–CARVALHO TL, KEMPINAS WG. Determination of spermatozoa concentration in the rat cauda epididymis. Braz J Med Biol Res 1987; 20:429–431. [ Links ]
10. ROBB GW, AMANN RP, KILLIAN GJ. Daily sperm production and epididymal sperm reserves of pubertal and adult rats. J Reprod Fertil 1978; 54:103–107. [ Links ]
11. GOYAL HO, BRADEN TD, MANSOUR M, WILLIAMS CS, KAMALELDIN A, SRIVASTAVA KK. Diethylbestrol–treated adult rats with altered epididymal sperm numbers and sperm mobility parameters but without alterations in sperm production and sperm morphology. Biol Reprod 2001; 64:927–934. [ Links ]
12. SYNTIN P, ROBAIRE B. Sperm structural and mobility changes during aging in the brown Norway rat. J Androl 2001; 22:235–244. [ Links ]
13. DOSTAL LA, FABER CK, ZANDEE J. Sperm motion parameters in vas deferens and cauda epididymal rat sperm. Reprod Toxicol 1996; 3:231–235. [ Links ]
14. LUCIO RA, MANZO J, MARTINEZ–GOMEZ M, SACHS BD, PACHECO P. Participation of pelvic nerve branches in male rat copulatory behavior. Physiol Behav 1994; 55:241–246. [ Links ]
15. MANZO J, VAZQUEZ MI, CRUZ MR, HERNANDEZ ME, CARRILLO P, PACHECO P. Fertility ratio in male rats: effects after denervation of two pelvic floor muscles. Physiol Behav 2000; 5:611–618. [ Links ]
16. TLACHI–LÓPEZ JL, ZEMPOALTECA R, LUCIO RA. Determinación de los parámetros macroscópicos y microscópicos del semen y las características del tapón seminal de rata. Memorias de Décimo Curso Internacional: Bases Biológicas de la Conducta. Resumen; junio, 10; Tlaxcala (Tlaxcala) México. Universidad Autónoma de Tlaxcala, 2005:1–23. [ Links ]
17. WORLD HEALTH ORGANIZATION. Laboratory Manual for the Examination of Human Semen and Sperm–Cervical Mucus Interaction. Cambridge: Cambridge University Press, 2000. [ Links ]
18. BLANDAU RJ. On the factors involved in sperm transport through the cervix uteri of the albino rat. Am J Anat 1945; 77:253–272. [ Links ]
19. MCCLINTOCK MK, ANISKO JJ, ADLER NT. Group mating among Norway rats II. The social dynamics of copulation: competition, cooperation and mate choice. Anim Behav 1982; 30:410–425. [ Links ]
20. CANCEL AM, LOBDELL D, MENDOLA P, PERREAULT SD. Objective evaluation of hyperactivated motility in rat spermatozoa using computer–assited sperm analyzis. Human Reprod 2000; 15:1322–1328. [ Links ]
21. HOWARTH B JR. Oxidation of (U–14C) palmitic acid by cock spermatozoa. Poult Sci 1978; 57:1751–1754. [ Links ]
22. ALLEN WE. Fertilidad y Obstetricia Equina. México DF: Ed. ACRIBIA, 2001. [ Links ]
23. SACHS BJ Role of striated penile muscles in penile reflexes, copulation and induction of pregnancy in the rat. J Reprod Fertil 1982; 66:433–443. [ Links ]
24. QUINLAN DM, NELSON R, PARTIN AW, MOSTWIN JL, WALSH PC. The rat as a model for the study of penile erection. J Urol 1989; 141:656–661. [ Links ]
* Purina Chow, México.
** Pfizer, S. A. de C. V., México.
*** Felisa®, FE–371, México.
**** Optiphot–2 Nikon, Estados Unidos de América.
***** TK–C1380; JVC, Estados Unidos de América.
****** LG (EC47M), México.
******* Mettler AE50, Estados Unidos de América.














