Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Veterinaria México
versión impresa ISSN 0301-5092
Vet. Méx vol.40 no.4 Ciudad de México oct./dic. 2009
Artículos científicos
Malformaciones en embriones y neonatos de tortuga golfina (Lepidochelys olivacea) en Nuevo Vallarta, Nayarit, México
Malformations in embryos and neonates of Olive Ridley sea turtle (Lepidochelys olivacea) in Nuevo Vallarta, Nayarit, Mexico
Annelisse Bárcenas Ibarra* Adrián Maldonado Gasca*
* Instituto Tecnológico de Bahía de Banderas, Crucero a Punta de Mita s/n, 63732, La Cruz de Huanacaxtle, Bahía de Banderas, Nayarit, México.
Correspondencia:
Adrián Maldonado Gasca,
correo electrónico: adrian_mg@yahoo.com
Recibido el 25 de septiembre de 2008
Aceptado el 3 de septiembre de 2009
Abstract
With the aim to know the types of malformations in Olive Ridley sea turtle (Lepidochelys olivacea) embryos and neonates, and determine their prevalence and intensity indexes and %2 in Nuevo Vallarta Nayarit, 100 nests were surveyed. From each nest, the total number of eggs and the number of embryos and neonates with any kind of abnormalities were registered. In 21 types of malformations located on seven anatomical regions, three new types were registered: anterior flippers amelia, bifurcated anterior flippers and rinodimo. The carapace presented significantly higher frequency of abnormalities (41.7%), followed by mandibles and general malformations (17.6% each one). The most frecuent type of malformation was the compressed carapace (26.9%), followed by albinism (14.8%) and xiphosis (13.2%). Prevalence (50% on nests and 1.8% on the organisms) and intensity (2.78 malformed organisms per nest and 1.57 malformations per organism) were high medium, compared to previous studies. Sea turtles from Bahía de Banderas may be exposed to anthropogenic contaminants, but is necessary to do long term studies to corroborate this possible relationship.
Key words: Olive Ridley Sea Turtle, Malformations, Embryos, Neonates, Prevalence, Intensity, Nuevo Vallarta, Nayarit, Mexico.
Resumen
Con el propósito de conocer las malformaciones en embriones y neonatos de tortuga golfina (Lepidochelys olivacea) en Nuevo Vallarta, Nayarit, México, se revisaron 100 nidos de dichos animales para registrar el número total de huevos, de embriones y de neonatos con algún tipo de malformación; los datos se analizaron con índices de prevalencia e intensidad y pruebas de Ji cuadrada. En 21 tipos de malformaciones localizadas en siete regiones anatómicas, se registraron tres nuevos tipos: bifurcación de aletas anteriores, biamelia anterior y rinodimo. La región corporal con mayor frecuencia de malformaciones fue el caparazón (41.7%), seguida por las mandíbulas y las malformaciones generales (17.6% cada una). El tipo de malformación más frecuente fue el caparazón comprimido (26.9%), seguido de albinismo (14.8%) y quifosis (13.2%). La prevalencia (50% de los nidos y 1.8% de los organismos) y la intensidad (2.78 malformaciones/nido y 1.57 malformaciones/organismo) resultaron medianamente altas, en comparación con estudios previos. Las tortugas marinas de Bahía de Banderas pueden estar expuestas a contaminantes antropogénicos, pero aún falta hacer estudios a largo plazo para corroborar esta posible relación.
Palabras clave: Tortuga Golfina, Malformaciones, Embriones, Neonatos, Preavalencia, Intensidad, Nuevo Vallarta, Nayarit, México.
Introducción
En los últimos años las poblaciones de tortugas marinas han sufrido un notorio decremento, debido principalmente a factores antropogénicos, entre ellos sobrepesca, destrucción de hábitat y contaminación.1–3 En la actualidad, todas las especies de tortugas marinas están amenazadas o en peligro de extinción y se encuentran incluidas en el apéndice I de los Acuerdos de la Convención Internacional para el Comercio de Especies de Flora y Fauna Silvestre Amenazada (CITES, por sus siglas en inglés)4 y la Norma Oficial Mexicana NOM–059–SEMARNAT–2001.5
Ante dicha situación se han creado programas de conservación que tienen como finalidad recuperar y mantener el equilibrio entre las poblaciones de tortugas marinas.1,6–8 La persistencia de las poblaciones naturales de tortugas marinas depende, en gran medida, del éxito de incubación de sus huevos en las diferentes playas de anidación.9 Sin embargo, el proceso de incubación puede resultar afectado por el tipo de manipulación de huevos durante el traslado y la siembra en los corrales o viveros de incubación.10,11
Existen factores intrínsecos (genéticos y fisiológicos) y extrínsecos (físicos, químicos, edafológicos, etc.) que afectan gravemente el proceso de eclosión de las crías. La alteración de estos factores repercute en el desarrollo embrionario y puede ser responsable de la aparición de ciertos tipos de malformaciones.12–18 Durante el desarrollo embrionario, los factores ambientales desempeñan un papel importante en la formación de las crías, no solamente en la determinación del sexo, también en el crecimiento y fisiología.10–18 De igual forma, contaminantes industriales y de la agricultura que son vertidos en canales de ríos, llegan al mar y son incorporados dentro de las cadenas tróficas, donde pueden afectar a las tortugas marinas.19–22 En cualquier caso, las malformaciones se pueden considerar relativamente raras e indicar cambios negativos en la biología de las tortugas marinas.23 La presencia de malformaciones en éstas ha recibido atención limitada en la literatura desde 1857, cuando se describió por primera vez este fenómeno.24
Diversas teorías que explican varias anormalidades han sido propuestas por Dodd25 y McGehee.26 Aunque algunas malformaciones han sido mencionadas,23,27,28 son escasos los trabajos que describen la frecuencia de anormalidades en embriones y neonatos de tortugas marinas.24,29–31 Asimismo, es indispensable conocer las causas de estas malformaciones y evaluar los posibles efectos a largo plazo en las poblaciones naturales de tortugas marinas.
La tortuga golfina (Lepidochelys olivacea) es considerada entre las especies de tortugas marinas más importantes, por su abundancia y su explotación comercial.1,32 No obstante, en México no existen estudios detallados sobre malformaciones en tal especie, salvo las descritas por Trejo10 y Ruiz33 para las costas de Jalisco y Colima, respectivamente.
El objetivo del presente estudio fue conocer los tipos de malformaciones en embriones y neonatos de tortuga golfina y determinar su frecuencia, localización en las regiones corporales, prevalencia e intensidad en las playas de Nuevo Vallarta, Nayarit, México
Material y métodos
Las playas de Nuevo Vallarta se localizan entre los 20° 41.5' y 20° 44.5' latitud Norte y 105° 17.3' y 105° 20' longitud Oeste, tienen 14 km de longitud desde el Río Ameca hasta el poblado de Bucerías, municipio de Bahía de Banderas, Nayarit, México.34 Entre noviembre de 2005 y febrero de 2006 se revisaron 100 nidos ubicados en el Centro de Protección y Conservación de la Tortuga Marina "Nuevo Vallarta", al final del periodo de incubación de las tortugas.
De cada nido se registró el número total de huevos, crías vivas, crías muertas, huevos con desarrollo embrionario (HCDE) y huevos sin desarrollo embrionario (HSDE). Para verificar la presencia de malformaciones se procedió así: todos los huevos remanentes del nido fueron abiertos y sólo se examinaron los HCDE; para el caso de las crías vivas, éstas se revisaron con cuidado, sin ser afectadas, y después se liberaron al mar. Cuando un embrión o cría mostraba malformaciones múltiples, cada una de éstas se registró por separado,10,24 posteriormente se tomaron fotografías de cada una de las malformaciones. La incidencia de malformaciones se estimó mediante los índices de prevalencia e intensidad.35
El primero muestra la proporción de organismos y de nidos en los que se registró al menos una malformación; se obtiene al dividir el número de organismos o de nidos en los que se encontraron malformaciones entre el total de organismos o de nidos revisados. La intensidad indica la cantidad de malformaciones que se encuentran por organismos y nidos, se obtiene dividiendo el número de malformaciones encontradas entre el número de organismos o nidos con malformaciones.
Con el propósito de evaluar la uniformidad de la distribución de la frecuencia de los tipos de malformaciones, así como de la distribución de las malformaciones en las diferentes regiones anatómicas, se realizaron pruebas de bondad de ajuste 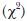 con un nivel de significancia de α = 0.05.36 Las malformaciones observadas se dividieron en tres categorías por su severidad: no letales, subletales y letales.37
con un nivel de significancia de α = 0.05.36 Las malformaciones observadas se dividieron en tres categorías por su severidad: no letales, subletales y letales.37
Resultados
En 100 nidos que se revisaron se hallaron 8 624 huevos, se obtuvo un promedio de 86.2 (± 2.0) huevos/nido. En este contexto, registraron 1 014 HSDE, 306 HCDE, 6 950 crías vivas y 355 crías muertas; se estimó un porcentaje general de sobrevivencia de 79.4% (± 0.22). Se determinó que la mitad de los nidos tenía al menos un organismo con malformaciones.
Del total de organismos revisados (7 611), se encontró que 139 individuos mostraron alguna malformación por lo que la prevalencia fue de 1.8%. Con base en el total de nidos con algún organismo malformado, la intensidad promedio fue de 2.78 (± 0.5) malformaciones/nido, se hallaron valores entre 1 y 15 malformaciones/nido. Asimismo, se determinó una intensidad de 1.57 (± 0.11) malformaciones/organismo, con valores de entre 1 y 4 malformaciones/organismo.
Se registraron 182 malformaciones, agrupadas en 21 tipos, que se presentaron en siete regiones anatómicas. En las aletas se presentaron más tipos de malformaciones (cinco), la cabeza sólo presentó un tipo (Cuadro 1).

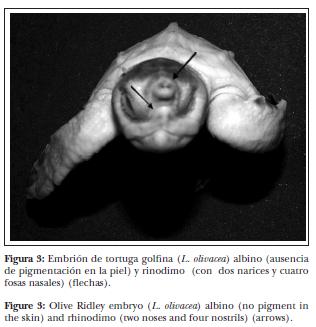
Se registraron tres nuevos tipos de malformaciones: bifurcación de aletas anteriores, biamelia anterior y rinodimo (Figuras 1, 2 y 3, respectivamente). Se observó que las 182 malformaciones registradas tuvieron una distribución significativamente diferente en las distintas regiones anatómicas (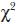 = 150.77; P < 0.0001).
= 150.77; P < 0.0001).


La mayor cantidad de tortugas presentaron malformaciones en el caparazón (76 organismos) y sólo algunas en las aletas, narinas y cabeza (7, 7 y 1 organismos, respectivamente) (Cuadro 1). El caparazón comprimido fue el tipo de malformación más abundante (49 organismos), seguida de albinismo (27 organismos) y quifosis (24 organismos).
De acuerdo con lo anterior, gemelos desiguales (Figura 4), aplasia completa, exencefalia (Figura 5), rinodimo, biamelia anterior, tetramelia y bifurcación de aletas anteriores fueron las menos abundantes (todas con un organismo) (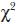 = 348.46; P < 0.0001) (Cuadro 1).
= 348.46; P < 0.0001) (Cuadro 1).


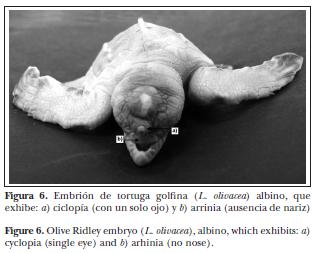
Respecto de su severidad, se registraron cinco malformaciones no letales, siete subletales y nueve letales (Cuadro 1). Las no letales son aquellas que no afectan directamente la supervivencia de los organismos, como el caparazón comprimido. Asimismo, las subletales pueden disminuir la probabilidad de supervivencia, aunque se han observado adultos que sobreviven con estas malformaciones (por ejemplo, monoamelia). Finalmente, las malformaciones letales disminuyen en forma drástica la probabilidad de supervivencia, incluso dentro del cascarón; por ejemplo, malformaciones del cerebro (Figura 5), anoftalmia, ciclopia (Figura 6) y sinoftalmia (Figura 7).

Discusión
El tamaño de la nidada y el porcentaje de sobrevivencia se ubican dentro del rango registrado para esta especie4 y en trabajos realizados en la región.33,38 La prevalencia de malformaciones por nido (50%) es la más alta de todas las que se informó; sin embargo, la prevalencia de malformaciones por organismo está dentro del rango de valores estimados por otros autores para tortuga golfina,10,30,33,38 tortuga caguama24,29,31 y tortuga verde29,39 (Cuadro 2).

No obstante, se pudo evidenciar una discrepancia en el tipo de las muestras tomadas por Kaska et al.,29 quienes sólo examinaron los embriones y el análisis se realizó en tres temporadas seguidas. Asimismo, la intensidad de malformaciones por nido fue casi el doble de lo registrado para tortuga golfina en la zona de Litibú, aledaña a Bahía de Banderas,38 mientras que la intensidad de malformaciones por organismo fue superior a lo informado por Gularte para esta especie en Guatemala.30 Para tortuga golfina2,27,29,34 y tortuga caguama20,26,28 se tienen registrados 84 y 15 tipos de malformaciones,10,23,24,29,30,31,33 respectivamente.
En este estudio se encontraron, además de dichas malformaciones, tres nuevos tipos de malformaciones para tortuga golfina: aletas anteriores bifurcadas, biamelia anterior y rinodimo (Figuras 1, 2 y 3). Considerando los nuevos tipos de malformaciones presentes en este estudio y los registros de trabajos anteriores, se determinaron 87 malformaciones para tortuga golfina.
Respecto de la frecuencia para la región anatómica y para el tipo de malformación, se observa que los resultados de este trabajo coinciden con los de la mayoría de los autores, tanto para tortuga golfina como para tortuga caguama; el caparazón es la región anatómica mas afectada y el caparazón comprimido el tipo de malformación más frecuente.10,29–31,33
Algunas malformaciones, como el albinismo, ausencia de un ojo o reducción de alguna aleta no son necesariamente letales. En este estudio el albinismo siempre se acompañó de otra malformación letal. Muchos embriones malformados mueren en etapas tempranas de su desarrollo. De los embriones malformados que se desarrollan, la mayoría son incapaces de salir de sus huevos como resultado de sus malformaciones,29 ello explica que la mayoría de los embriones se encontraran muertos en sus huevos.
Los niveles de malformaciones en embriones y neonatos para tortuga golfina en las playas de Nuevo Vallarta están muy por encima de lo informado en estudios anteriores (Cuadro 2). Aunque se conoce poco sobre la frecuencia natural o de las posibles causas naturales o antropogénicas de las malformaciones en embriones y neonatos de tortugas marinas, éstas pueden ser consecuencia de factores genéticos, condiciones de incubación o niveles de contaminantes en los huevos.11–22,29,31,37
Bishop et al.40,41 encontraron una correlación significativa entre malformaciones en embriones y concentraciones de PBC en los huevos de tortuga mor–dedora común (Chelydra serpentina) del Lago Ontario, Canadá. Asimismo, Alan y Brim42 documentaron niveles de contaminantes, como PBC y metales pesados en huevos de tortuga caguama recolectados en Saint Vincent Island, Florida, Estados Unidos de América.
Posteriormente, Carswell y Lewis31 registraron la presencia de malformaciones en dicho sitio.29 En tortugas dulceacuícolas, la presencia de malformaciones está asociada a altos niveles de contaminación.
En el John Heinz National Wildlife Refuge se registró un incremento en la tasa anual de malformaciones, de 13% a 19% en los nidos de la tortuga dulceacuícola (Chelydra serpentina), asociadas con la presencia de altos niveles de hidrocarburos aromáticos policíclicos (HAP).22 La exposición a este tipo de contaminantes reduce la sobrevivencia de los embriones y causa anormalidades en el desarrollo de las crías.
En este orden de ideas, las actividades económicas preponderantes en el municipio de Bahía de Banderas son las agropecuarias y de pesca (57%), el comercio y los servicios turísticos (24%) y, por último, el sector secundario de construcción e industria manufacturera (19%),43 que potencialmente pueden generar contaminantes con efectos teratogénicos. En esta zona existe trafico náutico relacionado con la fuerte actividad turística (paseos en lancha) y pesquera (traslado a sitios de pesca), lo cual constituye una potencial fuente de contaminación por hidrocarburos.
Asimismo, la existencia de 9 277 ha de tierra destinada para actividades agrícolas43 pudiera estar aportando contaminantes, como plaguicidas orga–noclorados, debido a la conexión entre las zonas agropecuarias y el mar por medio del río Ameca. Sin embargo, aún hacen falta estudios para corroborar la posible relación causal entre las actividades antropogénicas, la generación de contaminantes y los efectos teratogénicos de éstos sobre la fauna marina de la zona.
Por ultimo, es deseable asumir que un seguimiento a largo plazo de las malformaciones de embriones y neonatos de tortugas marinas, puede identificar cambios que indiquen una relación con los contaminantes y sus respectivos impactos.31 Como consecuencia de lo anterior, se recomienda la inclusión del informe de malformaciones como parte del proceso de evaluación del nido, con aquél se podrían generar datos adecuados para ser usados en lo futuro para la valoración de las tendencias temporales y geográficas dentro de los programas de conservación de tortugas marinas.
Agradecimientos
Se agradece al Instituto Nacional de Ecología y a la Comisión Nacional de Áreas Naturales Protegidas el apoyo brindado durante la realización de este trabajo, en especial al MVZ Miguel Flores Peregrina, así como a los estudiantes del Instituto Tecnológico de Bahía de Banderas por su participación en el trabajo de campo y laboratorio, principalmente a Carlomagno Zárate Montes y Abraham Ceja Gómez.
Referencias
1. MÁRQUEZ MR. Las tortugas marinas y nuestro tiempo. 2ª ed. México DF: Fondo de Cultura Económica, 2000. [ Links ]
2. WITHERINGTON B, FRAZER NB. Social and Economical Aspects of Sea Turtle Conservation. In: LUTZ PL, MUSICK JA, WYNEKEN J, editors. The Biology of Sea Turtles Vol II. Boca Raton, Florida: CRC Press, 2002: 355–384. [ Links ]
3. MARQUEZ R, DIAZ J, GUZMAN V, BRAVO R, JIMENEZ MC. Marine Turtles of the Gulf of Mexico. Abundance, Distribution and Protection. In: CASO M, PISANTY I, EZCURRA E, editors. Special Publication Series No. 1. Environmental Analysis of the Gulf of Mexico. Texas A & M University–Corpus Christi: SEMARNAT–INE. INECOL. Harte Research Institute for Gulf of Mexico Studies, 2004: 89–107. [ Links ]
4. MARQUEZ MR. FAO species catalogue. Vol. 11. Sea turtles of the world. An annotated and illustrated catalogue of sea turtle species known to date. Roma, FAO: FAO Fisheries Synopsis, 1990;110 (125):81. [ Links ]
5. DIARIO OFICIAL DE LA FEDERACIÓN, 2002. NOM–059–SEMARNAT–2001. Protección ambiental–Especies nativas de México de flora y fauna silvestres – Categorías de riesgo y especificaciones para su inclusión, exclusión o cambio – Lista de especies en riesgo. 2ª sección. 6 marzo 2002, [ Links ]
6. ECKERT KL, BJORNDAL KA, ABREU–GROBOIS FA, DONNELLY M, editores. Técnicas de Investigación y Manejo para la Conservación de las Tortugas Marinas. Pennsylvania: Grupo Especialista en Tortugas Marinas UICN/CSE Publicación No. 4, 2000: 235. [ Links ]
7. BRISEÑO–DUEÑAS R, ABREU–GROBOIS FA. Las Tortugas Marinas y sus Playas de Anidación. Mazatlán (Sinaloa) México: Informe Final del Proyecto UNAM–CONABIO PO66, Octubre de 1994: 57. [ Links ]
8. ROMERO JJ. Informe de temporada 2004 del Centro de Protección y Conservación de la tortuga marina "Nuevo Vallarta", Bahía de Banderas, Nayarit. Reporte técnico. Nayarit, México: INE– SEMARNAT, 2005. [ Links ]
9. BELL BA, SPOTILA JR, PALADINO FV, REINA RD. Low reproductive success of leatherback turtles, Dermo–chelys coriacea, is due to high embryonic mortality. Biol Conservation 2003; 115: 131–138. [ Links ]
10. TREJO RJA. Mortalidad embrionaria en nidos protegidos de tortuga golfina Lepidochelys olivacea en La Reserva "Playón de Mismaloya" Jalisco, México (tesis de maestría). Colima (Colima) México: Universidad de Colima, 2000. [ Links ]
11. LIMPUS CJ, BAKER V, MILLER JD. Movement induced mortality of loggerhead eggs. Herpetológica 1979; 35:335–338. [ Links ]
12. KRAEMER JE, BELL R. Rain induced mortality of eggs and hatchlings of loggerhead sea turtle (Caretta caretta) on the Georgia coast. Herpetológica 1980; 36:72–77. [ Links ]
13. ACKERMAN R. Physiological and ecological aspects of gas exchange by sea turtles eggs. Am Zool 1980; 25:575–583. [ Links ]
14. ACKERMAN R. Oxygen consumption by sea turtle Chelonia mydas, Caretta caretta eggs during development. Physiol Zool 1981; 54:316–324. [ Links ]
15. ACUÑA MR. El éxito del desarrollo de los huevos de la tortuga marina Lepidochelys olivacea (Eschscholtz, 1829) en la playa Ostional, Costa Rica. Brenesia 1983; 21:371–385. [ Links ]
16. CABRAL MT, CUEVAS LB, DOMÍNGUEZ RG, GARCÍA RA, SÁNCHEZ LV, SANTOS BG. Efecto de las diferentes temperaturas (15, 25, 30 y 35°C) sobre el desarrollo embrionario de la tortuga laúd Dermochelys coriacea. Memorias del V Encuentro Interuniversitario Sobre Tortugas Marinas en México; 1988 junio 8–11; Morelia (Michoacán) México. Morelia (Michoacán) México: Universidad Michoacana de San Nicolás, 1988: 290. [ Links ]
17. HORROKS JA, SCOTT NMAC. Nest site location and nest success in the hawksbill turtle Eretmochelys imbricate in Barbados, West Indies. Mar Ecol Prog Ser 1991; 69:1–8. [ Links ]
18. GALVÁN PVH. Estudio de la mortalidad embrionaria de Lepidochelys olivacea en nidos incubados seminatural–mente en el Playón de Mismaloya, Jalisco, México (tesis de licenciatura). Zapopan (Jalisco) México: Universidad de Guadalajara, 1991. [ Links ]
19. DAY RD. Mercury in loggerhead sea turtles, Caretta caretta: developing monitoring strategies, investigating factors affecting contamination, and assessing health impacts (dissertation). Columbia (SC): College of Charleston, 2003. [ Links ]
20. DAY RD, SEGARS AL, ARENDT MD, LEE AM, PEDEN–ADAMS MM. Relationship of Blood Mercury Levels to Health Parameters in the Loggerhead Sea Turtle (Caretta caretta). Environ Health Perspect, 2007; 115: 10, 1421–1428. [ Links ]
21. PODREKA S, GEORGES A, MAHER B, LIMPUS CJ. The Environmental Contaminant DDE Fails to Influence the Outcome of Sexual Differentiation in the Marine Turtle Chelonia mydas. Environ Health Perspect 1998; 106: 4, 185–188. [ Links ]
22. VAN METER RJ, SPOTILA JR, AVERY HW. Polycyclic aromatic hydrocarbons affect survival and development of common snapping turtle (Chelydra serpentina) embryos and hatchlings. Environ Pollut 2006; 142:466–475. [ Links ]
23. MILLER JD. Embryology of Marine Turtles. In:GANS C, NORTHCUTT RG, ULINSKY P, editors. Biology of the Reptilia. London and New York: Academic Press, 1985; 14:269–328. [ Links ]
24. DRENEN JD. Occurrence of Physical Abnormalities in Caretta caretta at Hobe Sound National Wildlife Refuge, 1987 and 1988. Marine Turtle Newsletter (serie online) 1990 Jun (cited: 2007 abr 27). Available from: http://www.seaturtle.org/mtn/archives/mtn48/mtn48p19.shtml. [ Links ]
25. DODD CK Jr. Synopsis of the biological of the loggerhead sea turtle, Caretta caretta (Linnaeus 1758). US Fish & Wildl Serv, Biological Report 1988; 88(14):1–110. [ Links ]
26. MCGEHEE MA. Factors affecting the hatching success of loggerhead sea turtle eggs (Caretta caretta) (dissertation). Orlando (FL): University Central Florida, 1979. [ Links ]
27. EWERT MA. The embryo and its egg: development and natural history. In: HARLESS M, MORLOCK H, editors. Turtles: Perspectives and Research. Wiley, New York: Krieger Publishing Company Press, 1979:333–413. [ Links ]
28. BLANCK CE, SAWYER RH. Hatchery practices in relation to early embryology of the loggerhead sea turtle, Caretta caretta (L.). J Exp Mar Biol Ecol 1981; 49:163–177. [ Links ]
29. KASKA Y, FURNESS R, DOWNIE R. Abnormal development in sea turtle embryos. In: ABREU–GROBOIS FA, BRISENO–DUENAS RR, MARQUEZ MR, SARTI L, compilers. NOAA Technical Memorandum NMFS–SEFCS–436. Proceedings of the Eighteenth Annual Sea Turtle Biology and Conservation; 1998 Mar 3–7; Mazatlan (Sinaloa) Mexico. Mazatlan (Sinaloa) Mexico: UNAM, 1998: 271–272. [ Links ]
30. GULARTE WE. Deformities in Hatchling Olive Ridleys. In: MOSIER A, FOLEY A, BROST B, compilers. NOAA Technical Memorandum NMFS–SEFCS–477. Proceedings of the Twentieth Annual Sea Turtle Biology and Conservation; 2000 Feb 29– Mar 4; Orlando (Florida) USA. Orlando (Florida) USA: NOAA–NMFS, 2000: 156. [ Links ]
31. CARSWELL LP, LEWIS TE. Embryo and hatchling abnormalities in loggerhead sea turtles on St. Vincent Island, Florida. In: SEMINOFF JA, compiler. NOAA Technical Memorandum NMFS–SEFSC–503. Proceedings of the Twenty–Second Annual Symposium on Sea Turtle Biology and Conservation; 2003 Abr 4–7; Miami (Florida) USA. Miami (Florida) USA: NOAA–NMFS, 2002: 185–186. [ Links ]
32. PLOTKIN PT, editor. Biology and conservation of ridley sea turtles. Maryland U.S.A. The Johns Hopkins University Press, 2007. [ Links ]
33. RUIZ VM. Evaluación del avivamiento y proporción de sexos en embriones y neonatos de tortuga golfina (Lepidochelys olivacea), en condiciones supervisadas en el campamento tortuguero de Manzanillo, Colima (tesis de licenciatura). Colima (Colima) México: Universidad de Colima, 2002. [ Links ]
34. HERNÁNDEZ AX. Epibiontes en Hembras Anidadoras de Tortuga Golfina (Lepidochelys olivacea) en Nuevo Vallarta, Nayarit (tesis de licenciatura). La Cruz de Huanacaxtle (Nayarit) México: Instituto Tecnológico de Bahía de Banderas, 2007. [ Links ]
35. MARGOLIS L, ESCH GW, HOLMES JC, ILONS AM, SCHAD GA. The use of ecological terms in parasitology. J Parasitol 1982; 18: 131–141. [ Links ]
36. SOKAL R, ROHLF J. Introducción a la Bioestadística. México (DF): Reverté Ediciones, S A de C V, 1999. [ Links ]
37. BELL AB. The effects of crude oil contamination on the reproduction of freshwater turtles (dissertation). Philadelphia (PA): Drexel University, 2005. [ Links ]
38. VARGAS SM. Campamento de protección y conservación de tortugas marinas en las playas de la ensenada de Litubú, Nayarit (memoria de residencia profesional). La Cruz de Huanacaxtle (Nayarit) México: Instituto Tecnológico del Mar No 6, 2004. [ Links ]
39. FOWLER LE. Hatching Success and Nest Predation in the Green Sea Turtle, Chelonia mydas, at Tortuguero, Costa Rica. Ecology 1979; 60:946–955. [ Links ]
40. BISHOP CA, BROOKS RJ, CAREY JH, MING P, NOR–STROM RJ, LEAN DRS. The case for a cause–effect linkcage between chemical contamination and development in eggs of the common snapping turtle (Chelydra serpentina) from Ontario, Canada. J Toxicol Environ Health 1991; 33:521–547. [ Links ]
41. BISHOP CA, BROWN GP, BROOKS RJ, LEAN DRS, CAREY JH. Organochlorine contaminant concentrations in eggs and their relationship to body size and clutch characteristics of the female common snapping turtle (Chelydra serpentina) in Lake Ontario, Canada. Arch Environ Contam Toxicol 1994; 27:82–87. [ Links ]
42. ALAM SK, BRIM MS. Organochlorine, PCB, PAH, and metal concentrations in eggs of loggerhead sea turtles (Caretta caretta) from Northwest Florida, USA. J Environ Sci Health B 2000; 35:705–724. [ Links ]
43. ANÓNIMO. Plan Municipal de Desarrollo Bahía de Banderas 2008–2011. Tepic, Nay: H. VII Ayuntamiento Bahía de Banderas, 2008. [ Links ]














