Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Veterinaria México
versión impresa ISSN 0301-5092
Vet. Méx vol.40 no.3 Ciudad de México jul./sep. 2009
Notas de investigación
Helmintos parásitos de importancia veterinaria: regulación de la respuesta inmunitaria del portador y su uso potencial para el tratamiento de enfermedades inflamatorias
Parasitic helminths of veterinary concern: host immune response regulation and potential use for the treatment of inflammatory diseases
Carlos Ramón Bautista Garfias*
* Centro Nacional de Investigación Disciplinaria en Parasitología Veterinaria, Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias, Km 11.5, Carretera Federal Cuernavaca–Cuautla 8534, CP 62550, Jiutepec, Morelos, México.
Recibido el 24 de marzo de 2008
Aceptado el 13 de mayo de 2009
Abstract
In recent years, a new alternative for the treatment of human inflammatory diseases, such as Crohn's disease, by oral administration of eggs from the swine parasitic nematode Trichuris suis has attracted attention, based on the capacity of helminths to polarize T helper cells (Th) to Th2 type which inhibits inflammation. In the present review the mechanisms used by parasitic helminths to modify the host immune response are analyzed and their potential use for the treatment of a variety of inflammatory diseases is discussed.
Key words: Parasitic helminths, Th1 and Th2 Responses, Inflamation Diseases.
Resumen
En años recientes ha llamado la atención una nueva alternativa para el tratamiento de enfermedades inflamatorias de humanos, como la enfermedad de Crohn, por medio de la administración oral de huevos del nematodo parásito de cerdos Trichuris suis, con base en la capacidad que tienen los helmintos de polarizar la respuesta de las células T cooperadoras (Th) a una de tipo Th2 que inhibe la inflamación. En la presente revisión se analizan los mecanismos que utilizan los helmintos parásitos para modificar la respuesta inmunitaria del portador y se discute su uso potencial para el tratamiento de una variedad de enfermedades inflamatorias.
Palabras clave: Helmintos Parásitos, Respuestas Th1 y Th2, Enfermedades Inflamatorias.
Introducción
Mecanismos de inducción de las respuestas inmunitarias innata y adquirida
La respuesta inmunitaria de los mamíferos es estimulada por sustancias extrañas (antígenos) que son reconocidas por moléculas y células inmunocompetentes. La inmunidad protectora contra microorganismos, por ejemplo, es mediada por las reacciones oportunas de la inmunidad innata y las respuestas posteriores de la inmunidad adapta–tiva que propician una respuesta inflamatoria.1'2 En este contexto, aquélla es estimulada por estructuras comunes en grupos de microorganismos, mientras que esta última es específica para diferentes antígenos (microbianos o no) y se incrementa por la exposición repetida a dichos antígenos;3 sin embargo, el sistema inmunitario no solamente puede proteger a un individuo, humano o animal, sino que también, bajo ciertas condiciones, puede causarle daño mediante mecanismos inmunopatológicos o autoinmunes.4,5
Mecanismos inmunomoduladores de helmintos parásitos
Los helmintos parásitos polarizan la respuesta inmunitaria de sus portadores a una de tipo Th2, evadiendo la respuesta Th1 que debiera ocurrir bajo condiciones normales. La respuesta inmunitaria tipo Th2 se caracteriza por aumento de células T CD4+ que secretan citocinas como la IL–4, IL–5, IL–9 e IL–13; además, los eosinófilos, células cebadas y basófilos, se incrementan en la sangre y en el sitio de infección. Cabe destacar que la característica principal es la gran cantidad de IgE que se detecta en el suero de humanos y animales infectados por helmintos.6
En cuanto a las citocinas señaladas, la IL–4 constituye el principal estímulo para la producción de IgE y para el desarrollo de células Th2 a partir de células cooperadoras vírgenes T CD4+.7 La IL–5 es un activador de eosinófilos y también funciona como enlace entre la activación de células T y la inflamación eosinofílica.8,9 La IL–13 es una citocina similar a la IL–4 y desempeña un papel importante en la respuesta inmunitaria contra helmintos.3 La IL–10 es una citocina que actúa sobre macrófagos y células dendríticas que inhibe la producción de IL–12, la expresión de coestimuladores y de moléculas de clase II del complejo principal de histocompatibilidad (CPH).3,10
En diferentes infecciones parasitarias se ha documentado en mayor o menor grado dicha respuesta. Así, por ejemplo, se ha observado en infecciones naturales o experimentales: Heligmosomoides polygyrus,11 Fasciola hepatica12 y Nippostrongylus brasiliensis13 en ratones; Strongyloides ratti,14 Fasciola hepatica15 e Hymenolepis diminuta16 en ratas; Opistorchis viverrini17 y Ancylostoma ceylanicum18 en hámsteres; Ascaridia galli en gallinas;19 Toxocara canis20 y Dirofilaria immitis en perros;21 Toxocara cati en gatos;22 Ascaris suum,23 Trichuris suis24 y Schistosoma japonicum en cerdos;25 Haemonchus contortus26 y Trichostrongylus colubriformis27 en ovinos; Fasciola hepatica,28–30 Dictyocaulus viviparous31 y Ostertagia ostertagi en bovinos;32 Strongylus vulgaris en caballos;33 Trichinella spiralis y T. britovi en humanos.34
Para explicar la regulación que ejercen los helmintos parásitos (HP) sobre la respuesta inmunitaria, se ha propuesto que se debe a que los múltiples y disímiles componentes de dichos organismos interfieren con el procesamiento de antígeno; modulan a las células presentadoras de antígeno (por ejemplo, células dendríticas–CD); mimetizan citocinas del portador e interfieren con citocinas de éste.35 Se ha sugerido que los HP regulan la producción de citocinas Th2 en el tracto digestivo e inducen la producción de células T reguladoras que pueden controlar células T autorreactivas, lo que, desde el punto vista funcional, puede limitar la inflamación.36
Los HP y sus productos pueden modificar a las células dendríticas (CD) de diferentes maneras que oscilan entre influenciar la maduración de las CD hasta afectar las señales de activación dentro de estas células (activación de receptores tipo Toll–TLR–, inducción de la quinasa ERK).37 Asimismo, se ha demostrado que favorecen el incremento de macrófagos activados alternativamente (MAA).38 Los MAA son células estimuladas por IL–4, IL–13, IL–10 e IL–21 que muestran niveles altos de expresión de marcadores como arginasa–1, receptor CD206 de manosa y receptor α de IL–4 (IL–4Rα), incluyendo la expresión incrementada de IL–10.39,40 Funcionalmente se ha sugerido que los MAA desempeñan al menos tres actividades principales: regulación de la respuesta inmunitaria, cicatrización de heridas y resistencia a la invasión parasitaria.40
Hipótesis de la higiene y enfermedades mediadas por el sistema inmunitario
En los países centrales la incidencia de enfermedades alérgicas y autoinmunes o enfermedades mediadas por el sistema inmunitario en el hombre, va en constante aumento —se estima que actualmente hay más de 40 diferentes enfermedades que en conjunto afectan a más del 10% de la población en los países centrales—,41 a diferencia de los países periféricos o semiperiféricos. Para explicar este fenómeno se ha propuesto la hipótesis de la higiene, donde se establece que los niños de los países centrales que tienen acceso a vacunas, higiene y antibióticos —"higiene alta"— presentan una baja exposición a patógenos, ello propicia una red reguladora inmunitaria débil que provoca incremento de enfermedades alérgicas y autoinmunes. Por el contrario, los niños de los países semiperiféricos que se exponen a infecciones helmínticas frecuentes y en los que además ocurre alta exposición a patógenos —"higiene baja"— desarrollan una red reguladora inmunitaria sólida y, por consecuencia, casi no se presentan enfermedades alérgicas y autoinmunes.36–38,40,42–45
Helmintos parásitos utilizados para el tratamiento de algunas enfermedades mediadas por el sistema inmunitario
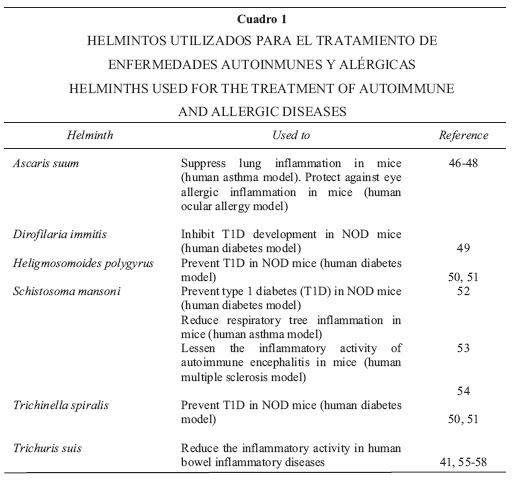
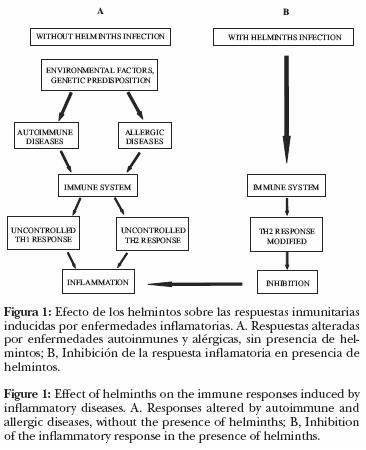
Diversas enfermedades autoinmunes y alérgicas han sido tratadas experimentalmente con helmintos parásitos (HP) y sus productos (Cuadro 1), con base en las observaciones de que los HP, como ya se indicó, para sobrevivir modifican la respuesta inmunitaria de su portador de tal forma que inhiben la respuesta inflamatoria (Figura 1).
Futuro del uso de helmintos parásitos o sus fracciones para el tratamiento de enfermedades autoinmunes
La información disponible actualmente indica que: a) la prevalencia de enfermedades mediadas por el sistema inmunitario (EMSI) en humanos se incrementa en las áreas que practican una atención meticulosa a la higiene; b) estas prácticas eliminan la exposición natural a los helmintos parásitos; c) los helmintos parásitos pueden prevenir las EMSI por medio de la modificación de las respuestas inmunitarias; d) la exposición a helmintos parásitos puede servir para el tratamiento de algunas EMSI de humanos (por ejemplo, enfermedades inflamatorias del intestino, asma, diabetes tipo 1 y esclerosis múltiple) y probablemente también en ESMI de animales domésticos.5
Debido al éxito del tratamiento de EMSI con helmintos parásitos hasta la fecha, se han propuesto las siguientes características ideales que deben reunir éstos para su uso terapéutico en humanos;54 a) tener poco o nulo potencial patogénico; b) no tener capacidad de multiplicación en el portador; c) no difundirse directamente a contactos estrechos; d) producir colonización autolimitada en humanos; e) producir colonización asintomática en humanos; f) no alterar el comportamiento en pacientes con inmunidad deprimida; g) no ser afectado por medicamentos de uso común; h) ser erradicados con un fármaco antihelmíntico; i) ser aislados libres de otros patógenos potenciales; j) ser aislados o producidos en grandes cantidades; k) ser estabilizados para transporte y almacenamiento; l) administrarse fácilmente.
Discusión
Los helmintos parásitos, además de producir parasitosis con morbilidades y mortalidades diversas, pueden tener un efecto perjudicial sobre sus portadores; por ejemplo, causar inmunosupresión a antígenos timodependientes59 en donde se afecta la respuesta inmunitaria hacia antígenos vacunales,60,61 y de diagnóstico, como es el caso de la alteración de la respuesta de bovinos infectados con F. hepatica a pruebas de diagnóstico de tuberculosis.62 Sin embargo, existen estudios cada vez más detallados de utilidad de la respuesta inmunitaria del portador contra los helmintos,63–69 y sus antígenos70 como terapias alternativas de enfermedades autoinmunes en el humano.71–73
El conocimiento de que los helmintos evaden las respuestas de tipo Th1 ha propiciado nuevas estrategias de control de dichos parásitos74–80 basadas en la estimulación inespecífica de las respuestas Th1 mediante sustancias inmunoestimuladoras.81–84 Asimismo, se ha indicado que la caracterización de moléculas derivadas de los helmintos que interaccionan con receptores tipo Toll y correceptores que estimulan una respuesta antiinflamatoria podría utilizarse para el diseño de nuevos fármacos y vacunas37 y también sería posible modular e inducir quinasas selectivamente, como la ERK– involucrada en la inducción de respuestas Th2–, cuya ausencia está relacionada con aumento de enfermedad autoinmune,85 analizando los patrones de señalización estimulados por las moléculas derivadas de helmintos.37,86
Conclusiones
La exposición natural o experimental de diversas especies de portadores a helmintos parásitos o a sus productos reduce las respuestas inmunitarias dañinas de las enfermedades autoinmunes (tipo Th1) y alérgicas (tipo Th2).
Existe la posibilidad de utilizar helmintos parásitos (o productos derivados de éstos) de animales domésticos como alternativa viable para el tratamiento tanto de enfermedades autoinmunes como de enfermedades alérgicas del ser humano.
El estudio de los diversos mecanismos que operan la respuesta inmunitaria del portador contra helmintos parásitos permitirá diseñar mejores estrategias para el control de éstos y también la utilización de moléculas (nativas o recombinantes) para el tratamiento de afecciones del hombre y sus animales domésticos.
Referencias
1. Anonymous. Get the balance right. Nat Immunol 2005;6:1177. [ Links ]
2. Henson PM. Dampening inflammation. Nat Immunol 2005;6:1179–1181. [ Links ]
3. Abbas AK, Lichtman AH, Pillai SP. Cellular and molecular immunology. 6th ed. Philadelphia: Saunders Elsevier, 2007. [ Links ]
4. Nairn R, Helbert M. Immunology for medical students. 2nd ed. Philadelphia: Mosby Elsevier, 2007. [ Links ]
5. Gershwin LJ. Veterinary autoimmunity: Autoimmune diseases in domestic animals. Ann NY Acad Sci 2007;1109:109–116. [ Links ]
6. Erb KJ. Helminths, allergic disorders and IgE–mediated immune responses: where do we stand? Eur J Immunol 2007;37:1170–1173. [ Links ]
7. Seder RA, Paul WE. Acquisition of lymphokine–producing phenotype by CD4+ T cells. Annu Rev Immunol 1994;12:635–673. [ Links ]
8. Sanderson CJ, Campbell HD, Young IG. Molecular and cellular biology of eosinophil differentiation factor (interleukin–5) and its effects on human and Mouse B cells. Immunol Rev 1988;102:29–50. [ Links ]
9. Coffman RL, Seymour BWP, Hudak S, Jackson J, Rennick D. Antibody to interleukin–5 inhibits helminth–induced eosinophilia in mice. Science 1989;245:308–310. [ Links ]
10. Bacellar O, Dóliveira A Jr, Jeronimo S, Carvalho EM. IL–10 and IL–12 are the main regulatory cytokines in visceral leishmaniasis. Cytokine 2000;12:1228–1231. [ Links ]
11. Finney CAM, Taylor MD, Wilson MS, Maizels RM. Expansion and activation of CD+CD25+ regulatory T cells in Heligmosomoides polygyrus infection. Eur J Immunol 2007;37:1874–1886. [ Links ]
12. O'Neill SM, Brady MT, Callanan JJ, Mulcahy G, Joyce P, Mills KH et al. Fasciola hepatica infection downregulates Th1 responses in mice. Parasite Immunol 2000;22:147–155. [ Links ]
13. Pesce JT, Liu Z, Hamed H, Alem F, Whitmire J, Lin H et al. Neutrophils clear bacteria associated with parasitic nematodes augmenting the development of an effective Th2–type response. J Immunol 2008;180:464–474. [ Links ]
14. Paterson S, Barber R. Experimental evolution of parasite life–story traits in Strongyloides ratti (Nematoda). Proc Biol Soc 2007;274:1467–1474. [ Links ]
15. Girones N, Valero MA, Garcia–Bodelon MA, Chico–Calero I, Punzon C, Fresno et al. Immune suppression in advanced chronic fascioliasis: an experimental study in a rat model. J Infec Dis 2007;195:1504–1512. [ Links ]
16. Webb RA, Hoque T, Dimas S. Expulsion of the gastrointestinal cestode, Hymenolepis diminuta by tolerant rats: evidence for mediation by a Th2 type immune enhanced goblet cell hyperplasia, increased mucin production and secretion. Parasite Immunol 2007;29:11–21. [ Links ]
17. Jittimanee J, Sermswan RW, Puapairoj A, Maleewong W, Wongrtanacheewin S. Cytokine expression in hamsters experimentally infected with Opistorchis viverrini. Parasite Immunol 2007;29:159–167. [ Links ]
18. Mendez S, Valenzuela JG, Wu W, Hotez PJ. Cytokine production, lymphoproliferation, and antibody responses during the course of Ancylostoma ceylanicum infection in the golden hamster. Infect Immun 2005;73:3402–3407. [ Links ]
19. Degen WG, Daal N, Rothwell L, Kaiser P, Schijns VE. Th1/Th2 polarization by viral and helminth infection in birds. Vet Microbiol 2005; 105:163–167. [ Links ]
20. Torina A, Caracappa S, Bareda A, Dieli F, Sireci G, Genchi C et al. Toxocara canis infection induces antigen–specific IL–10 and IFNgamma production in pregnant dogs and their puppies. Vet Immunol Immunopathol 2005;108:247–251. [ Links ]
21. Morchon R, Lopez–Belmonte J, Bazzocchi C, Grandi G, Kramer L, Simon F. Dogs with patent Dirofilaria immitis infection have higher expression of circulating IL–4, IL–10 and iNOS mRNA than those with occult infection. Vet Immunol Immunopathol 2007;115:184–188. [ Links ]
22. Gilbert S, Halliwell REW. The effects of endoparasitism on the immune response to orally administered antigen in cats. Vet Immunol Immunopathol 2005;106:113–120. [ Links ]
23. Dawson HD, Beshah E, Nishi S, Solano–Aguilar G, Morimoto M, Zhao A et al. Localized multigene expression patterns support an evolving Th1/Th2–like paradigm in response to infections with Toxoplasma gondii and Ascaris suum. Infect Immun 2005;73:1116–1128. [ Links ]
24. Kringel H, Iburg T, Dawson H, Aasted B, Roepstorff A. A time course study of immunological responses in Trichuris suis infected pigs demonstrates induction of local type 2 response associated with worm burden. Int J Parasitol 2006:36:915–924. [ Links ]
25. Techau ME, Johansen MV, Aasted B, Lind P, Ornbjerg N, Oswald IP. Cytokine mRNA profiles in pigs exposed prenatally and postnatally to Schistosoma japonicum. Vet Res 2007;38:25–36. [ Links ]
26. Lacroux C, Nguyen THC, Andreoletti O, Prevot F, Grisez C, Bergaud JP et al. Haemonchus contortus (Nematoda:Trichostongylidae) infection in lambs elicits an unequivocal Th2 immune response. Vet Res 2006;37:607–622. [ Links ]
27. Pernthaner A, Cole SA, Morrison L, Hein WR. Increased expression of interleukin–5 (IL–5), IL–13, and tumor necrosis factor alfa genes in intestinal lymph cells of sheep selected for enhanced resistance to nematodes during infection with Trichostrongylus colubriformis. Infect Immun 2005;73:2175–2183. [ Links ]
28. Brown WC, Davies WC, Dobbelaere DA, Riceficht AC. CD4+ T–cell clones obtained from cattle chronically infected with Fasciola hepatica and specific for adult Word antigen Express both unrestricted and Th2 cytokines profiles. Infect Immun 1994; 62:818–827. [ Links ]
29. Flynn RJ, Mannion C, Golden O, Hacariz O, Mulcahy G. Experimental Fasciola hepatica infection alters responses to tests used for diagnosis of bovine tuberculosis. Infect Immun 2007;75:1373–1381. [ Links ]
30. Flynn RJ, Mulcahy G. Possible role of Toll–like receptors in interaction of Fasciola hepatica excretory/ secretory products with bovine macrophages. Infect Immun 2008;76:678–684. [ Links ]
31. Johnson DR, Sales J, Matthews JB. Local cytokine responses in Dictiocaulus viviparous infection. Vet Parasitol 2005;128:309–318. [ Links ]
32. Claerebout E, Vercauteren I, Geldhof P, Olbrechts A, Zarlenga DS, Goddeeris BM et al. Cytokine responses in immunized and non–immunized calves after Ostertagia ostertagi infection. Parasite Immunol 2005;27:325–331 [ Links ]
33. Swiderski CE, Klei TR, Folsom RW, Pourciau SS, Chapman A, Chapman RR et al. Vaccination against Strongylus vulgaris in ponies: comparison of the humoral and cytokine responses of vaccinates and nonvaccinates. Adv Vet Med Vet Vacc Diagn 1999;41:389–404. [ Links ]
34. Gomez Morales MA, Mele R, Sanchez M, Sacchini D, De Giacomo M, Pozio E. Increased CD8+–T–cell expression and type 2 cytokine pattern during the muscular phase of Trichinella infection in humans. Infect Immun 2002;70:233–239. [ Links ]
35. Maizels RM, Yazdanbakhsh M. Immune regulation by helminth parasites: cellular and molecular mechanisms. Nat Rev Immunol 2003;3:733–744. [ Links ]
36. Weinstock JV. Helminths and mucosal immune modulation. Ann NY Acad Sci 2006;1072:356–364. [ Links ]
37. Van Riet E, Hartgers FC, Yazdanbakhsh M. Chronic helminth infections induce immunomodula–tion: consequences and mechanisms. Immunobiology 2007; 212:475–490. [ Links ]
38. Fallon PG, Mangan NE. Suppresion of TH2–type allergic reactions by helminth infection. Nat Rev Immunol 2007;7:220–230. [ Links ]
39. Gordon S. Alternative activation of macrophages. Nat Rev Immunol 2002;3:23–35. [ Links ]
40. Anthony RM, Rutitzky LI, Urban Jr JF, Stadecker MJ, Gause WC. Protective immune mechanism in helminth infection. Nat Rev Immunol 2007;7:975–987. [ Links ]
41. Elliot DE, Summers RW, Weisntock JV. Helminths and the modulation of mucosal inflammation. Curr Opin Gastroenterol 2005;21:51–58. [ Links ]
42. Yazdanbakhsh M, Kremsner PG, Van Ree R. Allergy, parasites, and the hygiene hypothesis. Science 2002;296:490–494. [ Links ]
43. Klaus JE. Helminths, allergic disorders and IgE–mediated immune responses: Where do we stand? Eur J Immunol 2007;37:1170–1173. [ Links ]
44. STtanwell–Smith R, Bloomfield S. The hygiene hypothesis and implications for home hygiene. A report commissioned by The International Scientific Forum on Home Hygiene (IFH). Milano, Italy: Arti Grafiche Bazzi, 2004. [ Links ]
45. Fiasse R, Latinne D. Intestinal Helminths: a clue explaining the low incidence of inflammatory bowel diseases in Subsaharan Africa? Potential benefits and hazards of helminth therapy. Acta Gastroenterol Beld 2006;69:418–422. [ Links ]
46. Lima C, Perini A, Garcia ML, Martins MA, Teixeira MM, Macedo MS. Eosinophilic inflammation and airway hyper–responsiveness are profoundly inhibited by a helminth (Ascaris suum) extract in a murine model of asthma. Clin Exp Allergy 2002;32:1659–1666. [ Links ]
47. McConchie BW, Norris HH, Bundoc VG, Trivedi S, Boesen A, Urban Jr JF et al. Ascaris straw–derived products suppres mucosal allergic inflammation in an interleukin–10–independent manner via interference with dendritic cell function. Infect Immun 2006;74:6632–6641. [ Links ]
48. Schopf L, Luccioli S, Bundoc V, Justice P, Chan CC, Wetzel B et al. Differential modulation of allergic eye disease by chronic and acute Ascaris infection. Investig Ophthalmol Vis Sci 2005;46:2772–2780. [ Links ]
49. Imai S, Tezuka H, Fujita K. A factor of inducing IgE from filarial parasite prevents insulin–dependent diabetes mellitus in nonobese diabetic mice. Biochem Biophys Res Commun 2001;286:1051–1058. [ Links ]
50. Zaccone P, Fehervari Z, Phillips JM, Dunne DW, Cooke A. Parasitic worms and inflammatory diseases. Parasite Immunol 2006;28:515–523. [ Links ]
51. Saunders KA, Raine T, Cooke A, Lawrence CE. Inhibition of autoimmune type 1 diabetes by gastrointestinal helminth infection. Infect Immun 2007;75:397–407. [ Links ]
52. Cooke A, Tonos P, Jones FM, O'Shea H, Hutchings P, Fulford AJ et al. Infection with Schis–tosoma mansoni prevents insulin dependent diabetes mellitus in non–obese diabetic mice. Parasite Immunol 1999;21:169–176. [ Links ]
53. Mangan NE, Van Rooijen N, McKezie ANJ, Fallón PG. Helminth–modified pulmonary immune response protects mice from allergen–induced airway hyperresponsiveness. J Immunol 2006;176:138–147. [ Links ]
54. Elliot DE, Summers RW, Weinstock JV. Helminths as governors of immune–mediated inflammation. Int J Parasitol 2007;37:457–464. [ Links ]
55. Summers RW, Elliot DE, Qadir K, Urban JF Jr, Thompson R, Weistock JV. Trichuris suis seems to be safe and possibly effective in the treatment of inflammatory bowel disease. Am J Gastroenterol 2003;98:2034–2041. [ Links ]
56. Summers RW, Elliot DE, Urban JF JR, Thompson R, Weistock JV. Trichuris suis therapy for active ulcerative colitis: a randomixed controlled trial. Gastroenterology 2005:128:825–832. [ Links ]
57. Summers RW, Elliot DE, Qadir K, Urban JF JR, Thompson R, Weistock JV. Trichuris suis therapy in Crohn's disease. Gut 2005;54:87–90. [ Links ]
58. Reddy A, Fried B. The use of Trichuris suis and other helminth therapies to treat Crohn's disease. Parasitol Res 2007;100:1432–1955. [ Links ]
59. Bautista Garfias CR, Orozco M, Morales E. Modulación de la respuesta de anticuerpos a eritrocitos de pollo en ovinos infectados experimentalmente con Fasciola hepatica. Rev Mex Parasitol 1988; 1:14–18. [ Links ]
60. Brady MT, O'Neill SM, Dalton JP, Mills KHG. Fasciola hepatica suppresses a protective Th1 response against Bordetella pertussis. Infec Immun 1999; 67:5372–5378. [ Links ]
61. Urban JR JF, Steenhard NR, Solano–Aguilar GI, Dawson HD, Iweala OI, Nagler CR et al. Infection with parasitic nematodes confounds vaccination efficacy. Vet Parasitol 2007;148:14–20. [ Links ]
62. Flynn RJ, Mannion C, Golden O, Hacariz O, Mulcahy. Experimental Fasciola hepatica infection alters responses to tests used for diagnosis of bovine tuberculosis, Infect Immun 2007;75:1373–1381. [ Links ]
63. Macdonaldas, Araujo MI, Pearce EJ. Immunology of parasitic helminth infections. Infec Immun 2002;70:427–433. [ Links ]
64. Bashir MEH, Ansersen P, Fuss IJ, Shi HN, Nagler–Anderson C. An enteric helminth infection protects against an allergic response to dietary antigen. J Immunol 2002;169:3284–3292. [ Links ]
65. Weinstock JV, Summers RW, Elliott DE. Helminths and harmony. Gut 2004;53:7–9. [ Links ]
66. Artis D. New weapons in the war on worms: identification of putative mechanisms of immune–mediated expulsion of gastrointestinal nematodes. Int J Parasitol 2006; 36:723–733. [ Links ]
67. Anthony RM, Urban Jr JF, Alem F, Hamed HA, Rozo CT, Boucher JL et al. Memory Th2 cells induce alternatively activated macrophages to mediate protection against nematode parasites. Nat Med 2006;12:955–960. [ Links ]
68. Geiger SM, Caldas IR, Mc Glone BE, Campiazevedo AC, De Oliveira LM, Brooker S et al. Stage–specific immune responses in human Necator americanus infection. Parasite Immunol 2007;29:347–358. [ Links ]
69. Humphreys NE, Xu D, Hepworth MR, Liew FY, Grencis RK. IL–33, a potent inducer of adaptive immunity to intestinal nematodes. J Immunol 2008;180:2443–2449. [ Links ]
70. Pochanke V, Koller S, Dayer R, Hatak S, Ludewig B, Zinkernagel RM et al. Identification and characterization of a novel antigen from the nematode Nippostrongylus brasiliensis recognized by specific IgE. Eur J Immunol 2007;37:1275–1284. [ Links ]
71. Hunter MM, Mckay DM. Review article: helminths as therapeutic agents for inflammatory bowel disease. Aliment Pharmacol Ther 2004;19:167–177. [ Links ]
72. Proudfoot L. Parasitic helminths tip the balance: potential anti–inflammatory therapies. Immunology 2004;113:438–440. [ Links ]
73. Owyang AM, Zaph C, Wilson EH, Guild KJ, McClanahan T, Miller HRP et al. Interleukin 25 regulates type 2 cytokine–dependent immunity and limits chronic inflammation in the gastrointestinal tract. J Exp Med 2006;4:843–849. [ Links ]
74. Bautista–Garfias CR, Flores–Hernandez O, Quiroz–Romero H. Non–specific resistance of sheep against Haemonchus contortus with Freund's complete adjuvant. Parasite Immunol 1991; 13: 565–569. [ Links ]
75. Bautista–Garfias CR, Gómez Arroyo A, Morilla González A, Vera Montenegro Y, Ibarra Velarde F. Inducción de resistencia inespecífica contra la infección por Fasciola hepatica en ovinos con adyuvante completo de Freund. Rev Méx Parasitol 1992;3: 1–3. [ Links ]
76. Bautista–Garfias CR, Zeron F, De la Jara F, Flores R. Effect of three immunostimulants on the resistance against Trichinella spiralis infection in mice. (Preliminary Report). Arch Med Res 1995;26: 91–93. [ Links ]
77. Bautista–Garfias CR, Orduña M, Ixta O, Martinez F, Aguilar B, Cortes A. Enhancement of resistance in mice treated with Lactobacillus casei: Effect on Trichinella spiralis infection. Vet Parasitol 1999;80:251–260. [ Links ]
78. Bautista–Garfias CR, Ixta–Rodriguez O, Martinez–Gomez F, Lopez MG, Aguilar–Figueroa BR. Effect of viable or dead Lactobacillus casei organisms administered orally to mice on resistance against Trichinella spiralis infection. Parasite 2001; 8: S226–S228. [ Links ]
79. Bautista–Garfias CR, Ixta–Rodriguez O, Aguilar–Figueroa BR, Martinez–Gomez F, Miralrio–Flores L. Induction of resistance against Hymenolepis nana infection in NIH mice treated intra–peritoneally with Lactobacillus casei. Proceedings of the 10th Internacional Congress of Parasitology–ICOPA X; 2002 August 4–9; Vancouver, Canada. Bologna, Italy: Monduzzi Editore S.p.A. –Medimond Inc. 2002—:.645–648. [ Links ]
80. Bautista–Garfias CR, Posadas Beltrán A, Ixta Rodríguez O. Inmunización de ratones BALB/c con un antígeno de larvas musculares de Trichinella spiralis utilizando Lactobacillus casei como adyuvante. Vet Méx 2004; 35: 359–368. [ Links ]
81. Matsuzaki T, Yamazaki R, Hashimoto S, Yokokura T. The effect of oral feeding of Lactobacillus casei strain shirota on immunoglobulin E production in mice. J Dairy Sci 1998;81:48–53. [ Links ]
82. Kato I, Tanaka K, Yokokura T. Lactic acid bacterium induces the production of interleukin–12 and interferon–gamma by mouse splenocytes. Int J Immunopharmacol 1999:21:121–131. [ Links ]
83. Shibaki A, Katz SI. Induction of skewed Th1/Th2 T–cell differentiation via subcutaneous immunization with Freund's adjuvant. Exp Dermatol 2002;11:126–134. [ Links ]
84. Cervi L, Borgonovo J, Egea M, Chiapello L, Masih D. Immunization of rats against Fasciola hepatica using crude antigens conjugated with Freund's adjuvant or oligodeoxynucleotides. Vet Immunol Immunopathol 2004;97:97–104 [ Links ]
85. Agrawal A, Dillon S, Denning TL, Pulendran B. ERK1–/– mice exhibit Th1 polarization and increased susceptibility to experimental autoimmune encephalomyelitis. J Immunol 2006;176:5788–5796. [ Links ]
86. Rigano R, Buttari B, Profumo E, Ortona E, Delunardo F, Margutti P et al. Equinococcus granulosus antigen B impairs human dendritic cell differentiation and polarize immature dendritic cell maturation towards a Th2 cell response. Infec Immun 2007; 75:1667–1678. [ Links ]














