Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Veterinaria México
versión impresa ISSN 0301-5092
Vet. Méx vol.40 no.2 Ciudad de México abr./jun. 2009
Artículos científicos
Estudio histológico e inmunofenotípico de linfoma canino en el centro de México
Histological and immunophenotypic study of canine lymphoma in the center of Mexico
Francisco J. Álvarez Berger* Enrique Aburto Fernández** Gerardo Aristi Urista*** Gilberto Chávez Gris†
* Coral Springs Animal Hospital, 1730 University Drive, Coral Springs, FL 33071, Estados Unidos de América.
** Facultad de Medicina Veterinaria y Zootecnia, Universidad Nacional Autónoma de México, 04510, México, D. F.
*** Hospital General de México, Secretaría de Salud, Dr. Balmis 148, Col. Doctores, 06726, México, D. F.
† Unidad de Servicios y Diagnóstico y Constatación, Centro de Enseñanza, Investigación y Extensión en Producción Animal en Altiplano, Km 8.5, Tequisquiapan–Ezequiel Montes, 76750, Querétaro, Querétaro, México. Facultad de Medicina Veterinaria y Zootecnia, Universidad Nacional Autónoma de México, correo electrónico: gris@servidor.unam.mx
Recibido el 15 de enero de 2008
Aceptado el 20 de febrero de 2009.
Abstract
Immunophenotype constitutes an important factor in the prognosis of canine lymphoma. It has been demonstrated that dogs with B–cell lymphomas have a longer life span than those with T–cell lymphomas. CD3 and CD79a antigens are the most common markers used for the immunohistochemical determination of T–cell and B–cell on formalin–fixed paraffin wax–embedded canine lymphoma tissues. This study describes the morphological and immunophenotypic characteristics of 31 cases of lymphoma in Mexico, obtained from file of the Pathology Department of Veterinary Medicine and Animal Husbandry Faculty of the National Autonomous University of Mexico. The National Cancer Institute–Working Formulation (NCI–WF) classification system was used for the histological classification. Fourteen cases (45.16%) were B cell origin, 15 cases (48.39%) were T–cell origin and 2 cases (6.45%) presented an indeterminate origin. Histopathological diffuse large cell lymphoma (DL) was the most common found (38.71%), followed by lymphocytic (DSL), immunoblastic (IB), intermediate and high–grade lymphomas represented 77.42% of the cases. In this study there was higher prevalence of T–cell lymphoma. The results in this work could indicate prevalent differences in the immunophenotype of the canine lymphoma in Mexico compared with other geographical areas.
Key words: lymphoma, dog, neoplasia, immunohistochemistry.
Resumen
El inmunofenotipo constituye un factor importante en el pronóstico del linfoma canino. Se ha demostrado que perros con linfoma de células B presentan tiempos de sobrevivencia más largos que los perros con linfoma de células T. Los antígenos CD3 y CD79a son los marcadores más utilizados en inmunohistoquímica para la determinación del fenotipo celular T y B, respectivamente, en muestras fijadas en formalina y conservadas en bloques de parafina. En este estudio se describen las características morfológicas e inmunofenotípicas de 31 casos de linfoma en México, de casos del archivo del Departamento de Patología de la Facultad de Medicina Veterinaria y Zootecnia de la Universidad Nacional Autónoma de México. Para la clasificación histológica se utilizó el sistema del National Cancer Institute–Working Formulation (NCI–WF). Catorce casos (45.16%) correspondieron a células B, 15 (48.39%) a células T, y dos (6.45%) fueron de origen indeterminado. Histopatológicamente, el linfoma difuso de células grandes fue el tipo más común, representó 38.71% de los casos; le siguieron los siguientes linfomas: linfocítico, inmunoblástico y linfoblástico. Los linfomas de grado intermedio a alto representaron 77.42% de los casos. En este estudio se encontró mayor prevalencia de linfoma de células T. Los resultados en este trabajo pudieran indicar una diferencia en la prevalencia en el inmunofenotipo del linfoma canino en México, en relación con otras zonas geográficas.
Palabras clave: linfoma, perro, neoplasia, inmunohistoquímica.
Introducción
El linfoma canino representa una de las neoplasias malignas más comunes en el perro y es la neoplasia hematopoyética que se presenta con más frecuencia en esta especie.1–3 A pesar de que constituye una neoplasia que responde favorablemente a la quimioterapia, ciertos casos de linfoma responden mejor al tratamiento que otros, sin haberse establecido un protocolo quimioterapéutico específico para todos los casos. Entre los factores que de manera independiente definen el pronóstico se encuentran: el sexo, edad, peso corporal, raza, grado y subgrado clínicos, administración previa de corticosteroides, hipercalcemia, localización anatómica, respuesta inicial al tratamiento, anormalidades cromosómicas, clasificación histológica e inmunofenotipo celular.4–7 El inmunofenotipo celular es el factor más importante asociado con el pronóstico;8,9 sin embargo, son pocos los estudios en el ámbito mundial; en México no existen estudios publicados sobre la inmunofenotipificación del linfoma canino. Se ha sugerido que las características morfológicas e inmunológicas del linfoma canino varían dependiendo de las distintas zonas geográficas mundiales; asimismo, se han documentado diferencias morfológicas entre casos de linfoma canino presentes tanto en Europa como en Estados Unidos de América, así como diferencias entre distintas zonas geográficas dentro de esta nación.10 En México no se han realizado estudios que determinen las características histológicas e inmunofenotípicas del linfoma canino, que permitan una identificación más precisa de esta neoplasia, con el fin de establecer un programa óptimo para el manejo de estos casos. Los objetivos de este estudio son: clasificar, con base en las características histológicas e inmunofenotípicas, al linfoma canino en México, y determinar si existen diferencias o no entre las características histológicas e inmunofenotípicas descritas en este estudio con las descritas en otras áreas geográficas.
Material y métodos
Clasificación histológica
Los casos empleados para este estudio se tomaron de los casos de archivo, remitidos y diagnosticados como linfoma en el Departamento de Patología de la Facultad de Medicina Veterinaria y Zootecnia de la Universidad Nacional Autónoma de México. Todas las muestras fueron fijadas en formalina al 10%; sin embargo, el periodo de fijación para estos casos fue variable. Posteriormente, fueron incluidas en parafina, para realizar cortes a 4 µm de espesor, y teñidas con la tinción de rutina de hematoxilina–eosina (H–E). Se observaron las muestras y se les clasificó de acuerdo con sus características histológicas, tomando como referencia el esquema de clasificación del National Cancer Institute–Working Formulation (NCI–WF).11
Inmunofenotipificación
Para el estudio inmunohistoquímico se realizaron cortes de las muestras a 4 µm de grosor y se fijaron sobre laminillas para su posterior incubación a 60°C en incubadora seca eléctrica* por 30 minutos, seguido de tres cambios de tres minutos en xilol, tres minutos en acetona y tres minutos en alcohol absoluto. Para la inhibición de la peroxidasa endógena, se utilizó solución de 1 mL de peróxido de hidrógeno a 30% por cada 100 mL de metanol, por un periodo de 30 minutos, sumergiendo posteriormente las muestras en alcohol al 96% por cinco segundos y lavando con agua destilada por tres minutos. Para la exposición de antígenos, se sumergieron las muestras en solución de citratos (1 litro de agua destilada, 2.1 g de ácido cítrico, 13 mL de hidróxido de sodio) con pH de 5.7 a 6.0 para el CD3 (anticuerpo policlonal de conejo anti–CD3 humano)** y solución alcalina (10 mmol/L Tris amortiguador, 1mL mmol/EDTA) con pH 9.0 para el CD79a (anticuerpo monoclonal de ratón anti–CD79a humano).** Mediante un contenedor de plástico con tapa, las muestras fueron calentadas en microondas durante tres minutos (80 power), alcanzando 90°C aproximadamente, con reposo de 40 minutos y lavadas con agua destilada, luego se realizaron dos cambios de cinco minutos cada uno en solución amortiguadora (PBS) (6.17 g de fosfato de sodio dibásico, 0.89 g de fosfato de sodio monobásico, 9 g de cloruro de sodio y cbp un litro de agua destilada).
Para el bloqueo de la unión no específica del anticuerpo primario se utilizó suero normal de cabra a temperatura ambiente por 30 minutos en cámara húmeda, posteriormente se escurrió el suero de cabra, se aplicó el anticuerpo primario correspondiente en dilución 1:100 utilizando diluyente para anticuerpo comercial** y se incubó en cámara húmeda a 4°C por 24 horas. Después se enjuagaron con tres cambios de tres minutos cada uno en PBS con solución de Tween 20 (6.17 g de fosfato de sodio dibásico, 0.89 g de fosfato de sodio monobásico, 9 g de cloruro de sodio y cbp un litro de solución salina y se agregó 1 mL de solución Tween 20 por cada litro) a pH de 7.6 para la aplicación del anticuerpo secundario biotinilado** y se incubó en cámara húmeda por 30 minutos a temperatura ambiente. Se enjuagó en BFS con solución de Tween 20 tres veces de tres minutos cada una. Posteriormente, se aplicó el reactivo enzima Avidina–Biotina,*** y se incubó en cámara húmeda 30 minutos a temperatura ambiente, después se enjuagó en BFS con solución de Tween 20, tres veces de tres minutos cada una. Para el revelado, se utilizó solución de diaminobencidina (DAB) (5 mL de amortiguador Tris pH 2.4, cbp 50 mL de agua destilada, 0.0125 g de diaminobencidina y 30 µL de peróxido de hidrógeno al 30%), se sumergieron las laminillas dentro de una caja de Petri durante tres a cinco minutos, se enjuagaron con agua destilada por un minuto, agua corriente por tres minutos y se sumergieron en solución de sulfato de cobre a 1% diez minutos y se enjuagaron un minuto en agua corriente. Finalmente, las muestras se contrastaron con hematoxilina de Mayers por dos segundos, deshidratadas en solución Scott (3.5 g, de bicarbonato de sodio bicarbonato, 20 g de sulfato de magnesio, 1 L de agua destilada) dos minutos y en alcohol a 96% por diez segundos, finalmente, fueron montadas empleando medio DPX colocando el cubreobjetos.
De cada caso, se realizaron conteos de las células malignas marcadas positivamente para CD3 y CD79a, en cinco campos con el objetivo seco fuerte (40X), promediando los resultados de los cinco conteos y estimando el porcentaje aproximado para cada población celular.
Análisis estadísticos
Los resultados de la clasificación histológica fueron analizados estadísticamente con la prueba de Ji cuadrada con clasificaciones publicadas anteriormente por otros autores que utilizaron el sistema de clasificación NCI–WF basándose en los grados histológicos bajo, intermedio y alto.5,6,12–15
De acuerdo con el inmunofenotipo, los resultados fueron analizados estadísticamente con la prueba de Ji cuadrada de acuerdo con clasificaciones publicadas anteriormente por otros autores, que utilizaron el sistema de clasificación NCI–WF basándose en el origen celular T, B o no T/no B.8,13–19 Se estableció una significancia de P < 0.05 para el análisis de los datos. Se utilizó el programa de cómputo GraphPad Prism 4.0.****
Resultados
Se evaluaron 31 casos, de los cuales 18 fueron machos (58.06%) y 13, hembras (41.93%). La edad promedio de presentación fue de 6.5 años (rango: 2 a 12 años). Las razas con mayor frecuencia fueron: Mestizo, 4/31; Cocker Spaniel, 3/31; Cobrador de Labrador, 4/31; Rottweiler, 3/31; Cobrador Dorado, 2/31; Pastor Alemán, 2/31; Schnauzer Gigante, 2/31 (Cuadro 1). Histológicamente, los 31 casos seleccionados en el presente estudio, 6/31 (19.35%) fueron clasificados de acuerdo con el esquema NCI–WF11 como linfoma linfocítico de células pequeñas; 1/31 (3.22%), folicular mixto; 1/31 (3.22%), folicular de células grandes; 1/31 (3.22%), difuso de células pequeñas hendidas; 12/31 (38.71%), difuso de células grandes; 6/27 (19.35%), inmunoblástico; 3/31 (9.68%), linfoblástico y 1/31 (3.22%), linfoma de células pequeñas no hendidas.
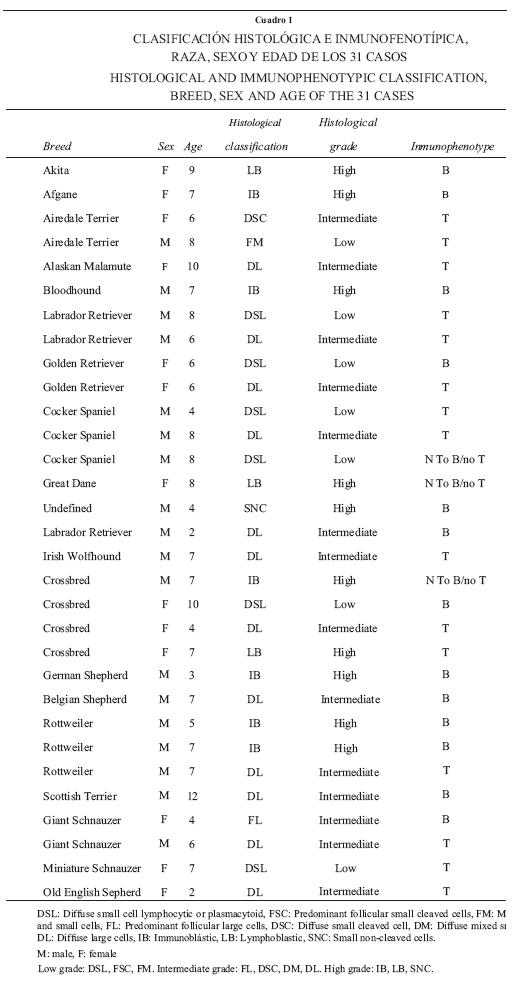
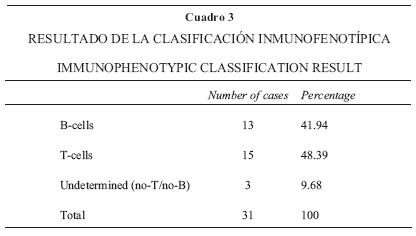
Al considerar el grado histológico de malignidad, 22.57% de los casos corresponden a grado bajo; 45.15%, a grado intermedio; y 32.25%, a grado alto (Cuadro 2). Inmunofenotípicamente, 13 casos (41.94%) fueron clasificados como linfomas de células B; 15 (48.39%), linfomas de células T, y tres (9.68%), linfomas no T/no B o indeterminado (Cuadro 3, Figuras 1–3).
De los seis casos clasificados como linfoma difuso de células pequeñas o linfocítico, dos fueron de inmunofenotipo B, tres de células T y uno no T/no B; un caso de linfoma folicular mixto de células T, uno de células pequeñas hendidas de células T y uno como folicular de células grandes de células B.
De los 12 casos de linfoma difuso de células grandes, tres fueron de células B y nueve de células T; cinco linfomas inmunoblásticos de células B y un caso no B/no T.
De tres linfoblásticos, uno de células T, uno de células B y uno de no B/no T, así como un caso de linfoma de células pequeñas hendidas de células B (Cuadro 4).
Los resultados histológicos del presente estudio presentaron una mayor proporción de linfomas de grado bajo con respecto a los demás estudios (Cuadro 5). Se encontró una diferencia estadísticamente significativa con dos estudios evaluados y no se encontró diferencia estadísticamente significativa con los demás estudios (Cuadro 6). Por otra parte, al evaluar el grado de malignidad en los estudios realizados con dos áreas geográficas, se presentó diferencia estadísticamente significativa con la región de Estados Unidos de América (P < 0.0001), mientras que no se encontró diferencia estadística con la región de Europa (P = 0.5984) con respecto a este trabajo (Cuadro 7). En este estudio se encontró mayor proporción de linfomas de origen celular T (CD3 +) con respecto a otros estudios (Cuadro 8). En los resultados de inmunofenotipo con respecto a las dos áreas geográficas, se presentó diferencia estadísticamente significativa con la región de Europa (P = 0.001) y no se encontró diferencia estadísticamente significativa con la región de Estados Unidos de América (P = 0.1158) (Cuadro 9).
Discusión
En la actualidad se han desarrollado diversos sistemas de clasificación del linfoma de tipo no Hodgkin; sin embargo, solamente los sistemas de clasificación de Kiel y del NCI–WF han demostrado mayor utilidad en la clasificación del linfoma canino debido a que son los más utilizados y no requieren de tinciones especiales para inmunohistoquímica.4–6,20 Para el presente estudio se seleccionó el sistema del NCI–WF, por su mayor aceptación y difusión en México, así como en otras regiones. 5,6,12–15,21
De los casos presentados, al evaluar estadísticamente los resultados del grado de malignidad con los estudios de otros autores, se encontró diferencia estadísticamente significativa con respecto a estudios realizados en Estados Unidos de América, mientras que no se encontró diferencia con el resto de los estudios evaluados.5,6,12–15,21 Al comparar los resultados con las dos áreas geográficas establecidas (Estados Unidos de América y Europa), se encontró diferencia estadísticamente significativa con la región de la Unión Americana, mientras que no se halló diferencia con la de Europa.14–16,19,25,28 Dicha diferencia pudiera deberse a que 22.57% de los casos fueron clasificados de grado bajo, encontrando mayor cantidad de éstos con respecto a otros trabajos, en donde se observó menor frecuencia de este tipo de linfoma, y que indican que entre 0% y 16.04% de casos pertenecieron al grado bajo; se observó una mayor diferencia con respecto a los estudios realizados en la zona geográfica de Estados Unidos de América que con los estudios realizados en Europa. Sin embargo, la mayoría de los casos fueron clasificados dentro de los linfomas de grado intermedio a alto, ello coincide con los resultados de otros estudios,5,6,8,12–15,19,21 lo que sugiere que en México, como en otras áreas geográficas, la mayoría de los casos de linfoma canino presenta un grado histológico de intermedio a alto; sin embargo, los resultados en este estudio muestran mayor proporción de casos de grado bajo de malignidad.
Como se ha mencionado, el sistema de clasificación NCI–WF no es un sistema ideal de clasificación histológica del linfoma canino, debido a que pueden encontrarse diferencias con otras zonas geográficas, por lo que se sugiere su evaluación con nuevos sistemas, como la Clasificación Histológica Internacional de Tumores Hematopoyéticos y Tejidos Linfoides de la Organización Mundial de la Salud.22 Los anticuerpos utilizados en este trabajo, anti–CD3 y anti–CD79a, confirman su utilidad en la inmunofenotipificación de los tejidos de linfoma canino preservados en parafina, como había sido empleado por otros autores.8,10,13,14,16,17,23–27 Al evaluar los resultados de los marcadores empleados, se encontró una diferencia estadísticamente significativa con respecto a siete de los ocho estudios realizados, cinco de ellos en regiones europeas y en dos de Estados Unidos de América.8,13–19
Al comparar los resultados con las dos regiones geográficas establecidas, se encontró una diferencia estadísticamente significativa sólo con la región de Europa. Esta diferencia pudiera deberse a que, en comparación con Europa y la Unión Americana, en el presente estudio se encontró mayor porcentaje de casos de linfoma de origen celular T que de origen B.8,13,14,17–19,27,28 Esto último sugiere que en México existe mayor proporción de casos de linfoma canino de células T; sin embargo, es pertinente realizar mayores estudios para confirmarlo. Asimismo, en México se encontró mayor porcentaje de linfomas de células no T/no B o células nulas con respecto a las dos zonas geográficas, diferencia más notoria con los estudios de Europa, lo que sugiere que en México, o en América, existe una mayor proporción de casos de células no B/ no T.
En tres casos del presente trabajo, uno clasificado histológicamente como linfoma linfoblástico, otro como inmunoblástico y uno más como linfoma linfocítico, no se logró marcar para ninguno de los anticuerpos utilizados (CD3 y CD79a), clasificándose como células nulas o no B/no T. Anteriormente se había informado sobre una baja incidencia de linfomas no B/ no T, independientemente del tipo histológico,8,19,27,28 dicho fenómeno también se ha reconocido en linfoma tipo no Hodgkin en humanos, donde se atribuye que el origen de este tipo de linfomas es a partir de células naturales citocidas o NK; para su confirmación, sería necesario utilizar otros anticuerpos específicos para antígenos de membrana de las células NK, que en humanos son: CD56, CD94 y CD16.29
Estos antígenos, en la revisión de la literatura, no han sido utilizados en perros; en este sentido, se desconoce si existe una reacción cruzada entre estas especies.8,14,18,28 Una segunda posibilidad del marcaje negativo a CD3 y CD79a, es que su origen fuera a partir de células precursoras B o inmaduras T, las cuales en este estado no presentan la expresión de CD79a y CD3 en sus membranas, por lo que sería necesario utilizar marcadores de membrana específicos para la expresión de antígenos de membrana en estas fases celulares. En humanos se informa la utilización de CD9 y CD10 para linfocitos precursores B y células pre B, así como CD44, CD25 y CD117 para precursores tempranos de linfocitos T y linfocitos inmaduros T.29
En un estudio, Greenlee et al.5 emplearon el CD25 como marcador en cinco, y todos ellos fueron negativos, por lo cual no fue posible determinar su utilidad en perros. Los marcadores CD9, CD10, CD44 y CD 117 no han sido utilizados hasta ahora en casos de cánidos.8,14,18,28 Es posible que las fallas para el empleo de estos inmunomarcadores se deba a la presencia de linfocitos malignos anaplásicos o mal diferenciados, que no expresen las mismas moléculas o proteínas presentes en las células bien diferenciadas.
Otra posibilidad del resultado negativo tanto a CD3 como a CD79a, es el de una fijación inadecuada de la muestra, que hubiera causado daños estructurales a los antígenos de membrana, propiciando que los anticuerpos no reconocieran a dichos antígenos.
El presente estudio, al ser de carácter retrospectivo, carece de control sobre la fijación y manejo de la muestra antes de ser procesada en parafina. Aquí, dos casos presentaron marcaje positivo para ambos anticuerpos. Existen informes de linfomas linfoblásticos T que demuestran la expresión conjunta de CD3 y CD79a en la misma célula;17 sin embargo, en estos casos las células malignas fueron reconocidas como positivas para los marcadores específicos y existía una predominancia en el porcentaje en la expresión de alguno de los antígenos de membrana, por lo que fueron clasificados en linfomas B o T, dependiendo de las células neoplásicas predominantes de cada marcador, con un estimado de 60% de células B con características neoplásicas, en uno de los casos, y 50% de células B neoplásicas en el segundo caso; este criterio ha sido tomado por otros autores.8,28 La utilización del criterio morfológico para la clasificación del linfoma canino, ha demostrado ser inadecuado en estudios previos.30 A diferencia del inmunofenotipo, ya sea por inmunohistoquímica o citometría de flujo, esta técnica ha demostrado ser de gran utilidad en el diagnóstico a través de la identificación de marcadores específicos de líneas celulares.
Recientemente se ha demostrado que en la mayoría de los linfomas y leucemias en humanos, existen perfile de expresión génica que caracterizan a los diferentes tipos de estas neoplasias; además, dentro de los distintos tipos histológicos e inmunofenotípicos de linfoma y leucemia, se pueden identificar diferentes subtipos con base en el perfil de expresión génica.31
En el futuro, este tipo de proyectos podrían ser realizados con mayor facilidad, obteniendo así mejor clasificación del linfoma canino, basada en características histológicas, inmunofenotípicas y genéticas.
Referencias
1. TESKE E. Canine Malignant Lymphoma: A Review and Comparisson with Human Non–Hodgkin's Lymphoma. Vet Q 1994;16: 209–219. [ Links ]
2. COUTO CG. Canine Lymphomas: Something Old, Something New. Compend Cont Ed Pract Vet 1985; 7: 291–302. [ Links ]
3. HAHN KA, RICHARDSON RC, HAHN EA, CRISMAN CL. Diagnostic and Prognostic Importance of Chromosomal Aberrations Identified in 61 Dogs with Lymphosarcoma. Vet Pathol 1994; 31:528–540. [ Links ]
4. MADEWELL BR. Canine Lymphoma. Vet Clin North Am: Small Anim Prac 1985; 15: 709–722 [ Links ]
5. GREENLEE PG, FILIPPA DA, QUIMBY FW, PATNAIK AK, CALVANO SE, MATUS RE et al. Lymphomas in dogs. A morphologic, immunologic, and clinical study. Cancer 1990; 66:480–490. [ Links ]
6. CARTER RF, VALLI VE, LUMSDEN JH. The Cytology, Histology and Prevalence of Cell Types in Canine Lymphoma Classified According to the National Cancer Institute Working Formulation. Can J Vet Res 1986; 50:154–164. [ Links ]
7. MORRIS JS, DUNN JK, DOBSON JM. Canine Lymphoid Leukemia and Lymphoma with Bone Marrow Involvement: A Review of 24 Cases. J Small Anim Practice 1993; 34:72–79 [ Links ]
8. DOBSON JM, BLACKWOOD LB, MCINNES EF, BOSTOCK DE, NICHOLLS P, HOATHER TM et al. Prognostic Variables in Canine Multicentric Lymphosarcoma. J Small Anim Pract 2001; 42: 377–384. [ Links ]
9. PAGE R. Canine and Feline Lymphoma: Review of Prognostic Factors and Treatment Options. 26th World Congress Proceedings of the World Small Animal Veterinary Association; 2001 August 8–11; Vancouver, British Columbia, Canada. Vancouver, British Columbia, Canada: WSAVA, 2001: 546–548. [ Links ]
10. RASKIN RE, FOX LE. An Interim Analysis of Geographic Differences in Morphology and Immunophenotype from 138 Cases of Canine Lymphoma. Mid–year Conference Proceedings of the 22nd Annual Conference of the Veterinary Cancer Society; 2002 April 11–14; Galena Illinois USA. Galeana Illinois USA: VCS, 2002: 11. [ Links ]
11. NATIONAL CANCER INSTITUTE. The Non–Hodgkin's Lymphoma Pathologic Classification Project. National Cancer Institute Sponsored Study of Classifications of Non–Hodgkin's Lymphomas: Summary and Description of a Working Formulation for Clinical Usage. Cancer 1982; 49: 2112–2135. [ Links ]
12. RUSLANDER D, MOORE AS, GLIATTO JM, L'HEUREUX D, COTTER SM. Cytosine Arabinoside as a Single Agent for the Induction of Remission in Canine Lymphoma. J Vet Inter Med 1994; 8:299–301. [ Links ]
13. FERRER L, FONDEVILA D, RABANAL R, TARRES J, RAMIS A. Immunohistochemical detection of CD3 Antigen (Pan T Marker) in Canine Lymphomas. J Vet Diagn Invest 1993; 5:616–620. [ Links ]
14. FOURNEL–FLEURY C, MAGNOL JP, BRICAIRE P, MARCHAL T, CHABANNE B, DELVERDIER A et al. Cytohis–tological and Immunological Classification of Canine Malignant Lymphomas: Comparison with Human Non–Hodgkin's Lymphomas. J Comp Path 1997; 117:35–59. [ Links ]
15. TESKE E, WISMAN P, MOORE PF, VAN HEERDE P. Histologic classification and immunophenotyping of canine non–Hodgkin's lymphomas: unexpected high frequency of T cell lymphomas with B cell morphology. Exp Hematol 1994; 22:1179–1187. [ Links ]
16. BURNETT RC, VERNAU W, MODIANO JF, OLVER CS, MOORE PF, AVERY AC. Diagnosis of Canine Lymphoid Neoplasia Using Clonal Rearrangements of Antigen Receptor Genes. Vet Pathol 2003; 40:32–41. [ Links ]
17. KOSAREK CE, KISSEBERTH WC, KOCIBA GJ. Use of Microarrays for Analysis of Canine Lymphoma. Proceedings of the 22nd Annual Conference of the Veterinary Cancer Society; 2002 april 11–14, Galena Illinois USA. Galeana Illinois USA: VCS, 2002:22. [ Links ]
18. CANIATTI M, ROCCABIANCA P, SCANZIANI E, PALTRINIERI S, MOORE PF. Canine Lymphoma: Immunocytochemical Analysis of Fine–needle Aspiration Biopsy. Vet Pathol 1996; 33:204–212. [ Links ]
19. FISHER DJ, NAYDAN D, WERNER LL, MOORE PF. Inmunophenotyping Lymphomas in Dogs: A Comparison of Results From Fine Needle Aspirate and Needle Biopsy Samples. Vet Clin Path 1995; 24:118–123. [ Links ]
20. VAIL DM, MACEWEN EG, YOUNG KM. Canine Lymphoma and Lymphoid Leukemias. In: WITHROW SJ, MACEWEN EG, editors. Small Animal Clinical Oncology. 3a ed. Philadelphia, EUA: WB Saunders Company, 2001: 558–590. [ Links ]
21. MILNER RJ, PEARSON J, NESBIT JW, CLOSE P. Immunophenotypic Classification of Canine Malignant Lymphoma on Formalin–Fixed Paraffin Wax–Embedded Tissue by Means of CD3 and CD79a Cell Markers. Onderstpoort J Vet Res 1996; 63:309–313. [ Links ]
22. VALLI VE, JACOBS RM, PARODI AL, VERNAU W, MOORE PF. Histological Classification of Hematopoietic Tumors of Domestic Animals. Washington DC, USA: Armed Forces Institute of Pathology, 2002. [ Links ]
23. KELLER ET. Immune–Mediated Disease as a Risk Factor for Canine Lymphoma. Cancer 1992; 70: 2334–2337. [ Links ]
24. DAY MJ. Immunophenotypic Characterization of Cutaneous Lymphoid Neoplasia in the Dog and Cat. J Comp Path 1995; 112: 79–96. [ Links ]
25. VERNAU B, MOORE P. Immunophenotyping in the Dog. Vet Cancer Soc Newsl 2001; 25:1–10. [ Links ]
26. KIUPEL M, TESKE E, BOSTOK D. Prognostic Factors for Treated Canine Malignant Lymphoma. Vet Pathol 1999; 36:292–300. [ Links ]
27. TESKE E. Prognostic Factors for Malignant Lymphoma in the Dog: an Update. Vet Q 1994;16:29–31. [ Links ]
28. THOMAS R, SMITH KC, GOULD R, GOWER SM, BINNS MM, BREEN M. Molecular Cytogenetic Analysis of a novel High–grade Canine T–Lymphoblastic Lymphoma Demonstrating Co–expression of CD3 and CD79a Cell Markers. Chromosome Res 2001; 9:649–657. [ Links ]
29. ABBAS AK, LICHTMAN AH, POBER JS. Maduración de los linfocitos B y expresión de los genes de las inmunoglobulinas. En: ABBAS AK, LICHTMAN AH, POBER JS, editores. Inmunología Celular y Molecular. 3ª ed. Madrid (España): Ed. Interamericana–McGraw Hill, 1999: 71–101. [ Links ]
30. VERNAU W, MOORE PF. An immunophenotypic study of canine leukemias and preliminary assessment of clonality by polymerase chain reaction. Vet Immunol Immunopathol 1999; 69:145–164. [ Links ]
31. ALIZADEH AA, EISEN MB, DAVIS RE, LOSSOS IS, ROSENWALD A, BOLDRICK JC et al. Distinct types of diffuse large B–cell lymphoma identified by gene expression profiling. Nature 2000: 403:503–511. [ Links ]
* Feli, S.A, México.
** Dako Cytomation, Estados Unidos de America.
*** Equipo Comercial ABC, Dako Citomation, Estados Unidos de América.
**** GraphPad Software Incorporated. Estados Unidos de América.














