Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Veterinaria México
versión impresa ISSN 0301-5092
Vet. Méx vol.39 no.4 Ciudad de México oct./dic. 2008
Artículos Científicos
Respuesta productiva, fermentación cecal y morbilidad diarreica en conejos alimentados con complementos bacterianos de Clostridium sordellii o Peptostreptococcus tetradius
Productive response, cecal fermentation and diarrheic morbidity in rabbits fed with bacterial supplements of Clostridium sordellii or Peptostreptococcus tetradius
Carlos Gutiérrez Olvera* Mario A. Cobos Peralta** Adriana Ducoing Watty*** David Hernández Sánchez** Raymundo Rodríguez de Lara
*Departamento de Nutrición Animal y Bioquímica, Facultad de Medicina Veterinaria y Zootecnia, Universidad Nacional Autónoma de México, 04510, México, D. F.
**Programa de Ganadería, Colegio de Postgraduados, 56230, Montecillo, Texcoco, Estado de México, México.
***Departamento de Genética y Bioestadística, Facultad de Medicina Veterinaria y Zootecnia, Universidad Nacional Autónoma de México, 04510, México, D. F.
 Departamento de Zootecnia, Universidad Autónoma de Chapingo, Km 38.5, carretera México–Texcoco, 56230, Chapingo, Estado de México, México.
Departamento de Zootecnia, Universidad Autónoma de Chapingo, Km 38.5, carretera México–Texcoco, 56230, Chapingo, Estado de México, México.
Recibido el 6 de septiembre de 2007
Aceptado el 25 de agosto de 2008.
Abstract
A bacterial strain of Clostridium sordellii and another one of Peptostreptococcus tetradius (isolated in a previous study, from the cecum of fattening rabbits) were evaluated as supplements, administered by means of food aspersion on a commercial feed for weaned fattening white New Zealand rabbits. The study was carried out in a rabbit fattening farm with 60% morbidity and 50% mortality due to unspecific diarrheas. Three experimental groups were formed: the first group was fed normal commercial feed, the second commercial feed inoculated with C. sordellii and the third, inoculated with P. tetradius. Daily weight gain, feed consumption and feed efficacy were evaluated during five weeks, and three tests of apparent digestibility were made. In addition, the mortality and the morbidity caused by unspecific diarrheas during the same period were quantified. After the rabbits were euthanized, total and cellulolytic bacteria concentration, pH and ammonium concentration were measured from samples taken from the cecal appendix, thirteenth cecal loop and colon. The results did not show significant difference (P > 0.05) between the treatments for any of the production variables measured. Statistical differences (P < 0.05) were found in pH and ammonium concentration in the cecal appendix between the group with C. sordellii and the other two groups, while in the thirteenth cecal loop differences were found (P < 0.05) in ammonium concentration between the group with P. tetradius and the other two groups. In regard to total bacteria, differences (P < 0.05) were found at the cecal appendix level between the control group and the one that received P. tetradius, and at the colon level between the group that received P. tetradius and the one that received C. sordelli. C. sordellii supplementation was associated with lower diarrheal morbidity (35%), as compared with that observed in the control group (80%), and that of the group receiving the P. tetradius supplement (80%) (P < 0.05).
Key words: Rabbits, Bacterial Supplements, Cecal Microflora, Cecotrophs, Clostridium Sordellii, Peptostreptococcus tetradius, Probiotics.
Resumen
Se evaluó una cepa bacteriana de Clostridium sordellii y otra de Peptostreptococcus tetradius (aisladas en un trabajo previo, a partir del ciego de conejos en engorda) como complementos, suministrados mediante aspersión en alimento comercial para conejos Nueva Zelanda, blancos, recién destetados y en etapa de engorda. El trabajo se llevó a cabo en un centro de engorda cunícola en el cual se presentaba morbilidad de 60% y mortalidad de 50% a causa de diarreas inespecíficas. Se crearon tres grupos experimentales: al primero se le proporcionó alimento comercial sin inocular, al segundo se le proporcionó alimento comercial adicionado con C. sordellii y al tercero, adicionado con P. tetradius. Se evaluó ganancia diaria de peso, consumo de alimento y eficiencia alimenticia durante cinco semanas, además se realizaron tres ensayos de digestibilidad aparente. Asimismo, se cuantificó la mortalidad y la morbilidad causada por diarreas inespecíficas durante el periodo señalado. Después del sacrificio de los conejos, se midió la concentración de bacterias totales y celulolíticas, pH y amonio en muestras del apéndice cecal, treceava asa cecal y colon. Los resultados no mostraron diferencia significativa (P > 0.05) entre los tratamientos para ninguna de las variables productivas medidas. Se encontraron diferencias estadísticas (P < 0.05) en el pH y la concentración de amonio a nivel del apéndice cecal entre el grupo al que se le suministró C. sordelliiy los dos grupos restantes, mientras que a nivel de la treceava asa cecal se encontraron diferencias (P < 0.05) en la concentración de amonio entre el grupo que recibió P. tetradius y los otros dos grupos. En lo referente a bacterias totales se encontraron diferencias (P < 0.05) a nivel de apéndice cecal entre el grupo testigo y el que recibió P. tetradius, y a nivel de colón distal entre el grupo que recibió C. sordellii y P. tetradius. La administración de C. sordelli estuvo asociada a una morbilidad diarreica más baja (35%) que la observada en el caso del grupo testigo (80%) y del grupo que recibió complemento de P. tetradius (80%) (P < 0.05).
Palabras clave: Conejos, Complementos Bacterianos, Microflora Cecal, Cecotrofos, Clostridium Sordellii, Peptostreptococcus tetradius, Probióticos.
Introducción
En 1998 la Unión Europea prohibió el uso de algunos antibióticos en la alimentación animal como promotores del crecimiento, creando la necesidad de buscar alternativas para sustituir esos productos. Una es la utilización de complementos microbianos viables (probióticos), enzimas exógenas y prebióticos que se aplican en el alimento.1,2 Los complementos microbianos son aditivos alimenticios que afectan benéficamente al portador, promoviendo a nivel entérico un balance microbiano adecuado.3 Tanto experimental como comercialmente se han evaluado diferentes bacterias (Lactobacillus spp, Bacillus subtilis y Streptococcus spp), hongos (Aspergillus oryzae) y levaduras (Saccharomyces cerevisiae).4 Entre los beneficios producidos por los complementos microbianos destaca el control de enfermedades entéricas,5,6 la estimulación y modulación del sistema inmune, el control de algunos tipos de cáncer,8,9 la exclusión competitiva de microorganismos patógenos,10 la recuperación de la microflora entérica después del tratamiento con antibióticos,11 así como el incremento en ganancia de peso,12 producción láctea,13,14 producción de carne15 y eficiencia alimenticia.16,17 Sin embargo, los resultados son variables e inconsistentes, lo cual muestra que todavía es necesario investigar su potencial profiláctico, terapéutico y como promotores del crecimiento.4
En conejos, los cultivos microbianos se han utilizado para reducir la incidencia y muerte por diarreas, así como para incrementar la eficiencia productiva. Los estudios se han encaminado hacia el control del pH intestinal utilizando bacterias ajenas a la micro–flora del conejo. Cheeke et al.18 evaluaron el efecto del Lacto–SaccMR* (Lactobacillus acidophilus, Streptococcus faecium y Bacillus subtilis) y Acid–Pak 4–WayMR* (Streptococcus faecium y Lactobacillus acidophilus), como complementos en la alimentación de conejos; la mortalidad posdestete se redujo 50% y 21%, respectivamente; además, Acid–Pak 4–Way mejoró la eficiencia alimenticia. Usando los mismos productos, Hollister et al.19,20 redujeron 45% y 22% la mortalidad por enteritis en conejos recién destetados y mejoraron entre 13.2% y 16.9% la eficiencia alimenticia con respecto al tratamiento testigo. La disminución en mortalidad posdestete, por enfermedades entéricas, se ha relacionado con un mecanismo de inhibición competitiva, que reduce la proliferación de patógenos, como Clostridium spp y E. coli, además de que favorece el crecimiento de microorganismos entéricos no patógenos.
La utilización de una mezcla de Lactobacillus bulgaricus y Streptococcus thermophilus o Streptococcus faecium, mejoró la salud, aunque sin efecto en el crecimiento y alimentación de los conejos en estudio.21
En un trabajo previo se aislaron dos bacterias: Clostridium sordellii y Peptostreptococcus tetradius a partir de cecotrofos obtenidos de conejos de la raza Nueva Zelanda.22 En otro estudio se determinó que la inoculación de estas bacterias en alimento comprimido para conejo no produce efectos nocivos o rechazo en consumo de alimento en conejos recién destetados. Además se encontró aumento en la concentración de bacterias celulolíticas en apéndice cecal y en la digestión in vitro de la materia seca.23 Sin embargo, no se evaluó su efecto en la incidencia de enfermedades infecciosas.
Experimentalmente, se ha evaluado el uso de metabolitos secundarios producidos por bacterias. Por ejemplo, la adición de toyocerina (producida por Bacillus toyoi) al alimento de conejos, disminuyó la incidencia de colitis e infecciones entéricas.24
Las enfermedades entéricas representan un problema relevante en la producción de conejos. Las pérdidas por enteritis son normalmente de 10% a 20% del total de animales; aunque se llegan a presentar procesos entéricos (enteropatías) que provocan pérdidas de 20%–60% de los animales destetados. La causa de estas enfermedades no se conoce perfectamente y las medidas de prevención y tratamiento no son siempre efectivas.25
La enteritis en los conejos puede ser causada por diversos microorganismos y algunos factores predisponentes. Entre los principales microorganismos causantes de enfermedades entéricas en conejos se encuentran Clostridium spiriforme, Escherichia coli, rota–virus y coccidias. Los factores que pueden predisponer a enfermedades entéricas son: alimenticios (bajos niveles de fibra, altos niveles de carbohidratos en la dieta), estrés, antibióticos y genéticos. 25
En el centro cunícola donde fueron alojados los animales utilizados en este estudio, se tenía el problema de enteritis inespecífica con morbilidad de 60% y mortalidad cercana a 50% en las primeras semanas posdestete. Los animales enfermos presentaban diarrea mucoide profusa, anorexia, ataxia, deshidratación y muerte entre uno y dos días después de presentados los signos clínicos. A la necropsia, los animales presentaban inflamación cecal y gran cantidad de gas acumulado en todo el intestino grueso, sin presencia de daños aparentes a otros órganos.
Con el proposito de buscar alternativas al uso de promotores del crecimiento ilegales, para disminuir la prevalencia de diarrea en conejos y mejorar sus parámetros productivos, el objetivo de este trabajo fue evaluar el efecto de Clostridium sordelli y Peptostreptococcus tetradius, administrados como complementos dietéticos.
Material y métodos
Este trabajo se llevó a cabo en los laboratorios de Microbiología Ruminal y Nutrición Animal, del Programa de Ganadería (IREGEP) del Colegio de Post–graduados, y en el Centro de Investigación Cunícola (COCICEMAC), en Montecillo y Coatlinchán, respectivamente, en Texcoco, Estado de México, México.
Se utilizaron 60 conejos machos de la raza Nueva Zelanda blanco, recién destetados, de 38 días de edad. Los animales no recibieron ningún tratamiento (desparasitantes, antibióticos) antes de entrar al trabajo experimental, con la finaldad de que se expresara cualquier proceso infeccioso.
Los conejos fueron alojados en jaulas de alambre galvanizado de 60 cm de ancho, 90 cm de largo y 40 cm de alto. Cada jaula contó con un bebedero automático y dos comederos de lámina galvanizada, con capacidad para 2 kg de alimento comprimido.
Bajo cada jaula se colocó una malla de poliéster, con el fin de detener el excremento de los animales para su posterior pesaje. Cada día se llevó a cabo la limpieza e inspección de los animales.
Se conformaron tres grupos experimentales de 20 conejos cada uno. Se alojaron cuatro animales por jaula (unidad experimental), por lo que cada tratamiento contó con cinco repeticiones.
Los animales fueron identificados mediante marcaje con tinta indeleble y distribuidos aleatoriamente en las jaulas, y éstas, a su vez, a los diferentes tratamientos experimentales.
A los animales se les proporcionó agua y alimento ad libitum. Como alimento se utilizó "Conejitina 715,** que contiene 88.72% de MS, 16.49% de PC, 23.95% de FDA, 42.45% de FDN y 10.01% de cenizas.
Los tratamientos evaluados consistieron en alimentar a los conejos destetados con alimento comercial comprimido para fase de engorda (T1), este grupo se consideró como testigo; alimento comercial comprimido previamente inoculado por aspersión con Clostridium sordellii a concentración de 1 x 108 bacterias g–1 de alimento (T2) y alimento comercial comprimido previamente inoculado por aspersión con Peptostreptococcus tetradius, a concentración de 1 x 108 bacterias g–1 de alimento (T3).
Se midieron como respuesta, las siguientes variables:
Consumo de alimento. Se pesó semanalmente el alimento ofrecido y el rechazado por jaula y se calculó la diferencia entre ambos. Los datos se dividieron entre el número de animales alojados en cada jaula, calculándose así el consumo promedio de alimento por animal.
Ganancia diaria de peso. Se calculó mediante la diferencia obtenida de dos mediciones de peso consecutivas de cada animal y la división de ésta entre el número de días transcurridos entre cada pesaje (siete días). Los conejos se pesaron al principio del trabajo experimental y después semanalmente; el pesaje se llevó a cabo por la mañana antes de proporcionar el alimento.
Eficiencia alimenticia. Se calculó a partir de la ganancia de peso, dividida entre el alimento total consumido por cada animal.
Rendimiento de la canal. Se calculó con base en el peso de la canal caliente (sin cabeza, vísceras, piel y extremidades), y en relación con el peso total del animal antes del sacrificio.
Producción de heces. Durante el trabajo experimental se recolectaron las heces de los animales y se pesaron diariamente. Semanalmente se tomó una muestra de heces y del alimento ofrecido (20 g a 30 g) para determinar su contenido de materia seca (MS).
Digestibilidad aparente. Se evaluó la digestibilidad aparente de la MS, materia orgánica (MO), proteína cruda (PC), fibra detergente neutra (FDN) y fibra detergente ácida (FDA) a la quinta semana de comenzado el trabajo experimental. La determinación de MS, MO y PC en heces y alimento, se hizo mediante la metodología descrita por la AOAC y la FDN y FDA, siguiendo la metodología de Van Soest et al.26
Se verificó diariamente el estado de salud de los animales (presencia de diarreas, vómitos, depresión, estornudos, lagrimeo, tos, etc.) y se registraron las muertes.
Se sacrificaron cuatro conejos de cada tratamiento (12 conejos en total, elegidos aleatoriamente) cinco semanas depués de que inició el periodo de engorda. A cada conejo se le extrajo el tubo digestivo con el propósito de recolectar, de forma aséptica, muestras del apéndice cecal, ciego (tercer asa cecal) y colon (sección distal). Las muestras se depositaron en frascos estériles. A cada muestra se le determinó:
Bacterias totales. Se utilizó la técnica del número más probable (NMP).27 Se realizó una serie de diluciones de 10–1 hasta 10–14 para cada muestra recolectada de apéndice cecal, tercer asa cecal y colon distal de cada uno de los 12 animales sacrificados. Las diluciones se realizaron en tubos de cultivo de 13 x 100 mm, con 4.5 mL de medio de cultivo para bacterias anaerobias (Cuadro 1).
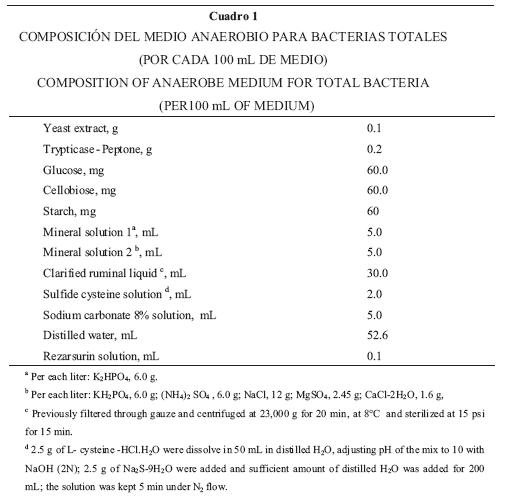
Bacterias celulolíticas. Se utilizó también la técnica del NMP. Se realizaron diluciones de 10–1 hasta 10–10, en tubos para cultivo de 13 x 100 mm con 4.5 mL de un medio de cultivo similar al utilizado para bacterias totales, en el cual se adicionó una tira de papel (0.5 x 1.5 cm) Whatman número 541, en lugar de glucosa, celobiosa y almidón.28
Amonio. Para determinar nitrógeno amoniacal se tomaron 2 g de cada muestra y se mezclaron con 0.5 mL de ácido metafosfórico, en viales de 2 mL. Posteriormente las muestras se centrifugaron*** a 16 500 g durante tres minutos y se depositó el sobrenadante en viales de 2.5 mL para luego analizarlo mediante absorbancia en un espectrómetro de luz ultravioleta visible.****
pH. Con el propósito de medir el pH se tomó un gramo de muestra, se diluyó en 9 mL de agua destilada, se homogeneizó y se dejó reposar durante 15 a 30 min, para después obtener la lectura del pH en un potenciómetro***** calibrado a pH 4 y 7.
El análisis de los datos corresponde al de un diseño completamente al azar con tres tratamientos (dietas) y cinco repeticiones por tratamiento (jaulas con cuatro animales cada una). El modelo que corresponde a dicho diseño es:
Yij = µ + Ti + εij
donde:
Yij = digestibilidad aparente de MS, MO, PC, FDN, FDA de los animales de la jaula j del tratamiento i.
j = 1,...5
i = 1,...3
µ = media general
Ti = efecto del tratamiento i
εij = error experimental de la jaula j del tratamiento i.
Para el caso de ganancia diaria de peso, consumo de alimento, eficiencia alimenticia y rendimiento de canal, se utilizó el peso vivo inicial como covariable.
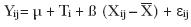
donde:
Yi = ganancia diaria de peso, eficiencia alimenticia, rendimiento de la canal de los animales de la jaula j del tratamiento i.
j = 1,...5
i = 1,...3
µ = media general
Ti = efecto del tratamiento i
β = efecto del peso inicial
εij = error experimental de lajaulaj del tratamiento i.
El análisis de la información se realizó mediante el paquete estadístico SAS,29 utilizándo el procedimiento GLM. Para comparaciones múltiples se usó la prueba de Tukey.
En los casos en los que los supuestos de homogeneidad de varianza y normalidad no se cumplieron, se realizó la prueba no paramétrica de Kruskall–Wallis.30
Para medir el número de bacterias celulolíticas y totales se utilizó la metodología propuesta por Harrigan y McCance. 26
Resultados
Los animales del T2 (C. sordellii) presentaron morbilidad de 35% por diarreas inespecíficas, que fue estadísticamente menor (P < 0.05) que la morbilidad encontrada en los otros dos grupos (80%). La mortalidad en T2 fue de 25%, menor que la de los otros dos grupos (45% para T1 y 75% para T2) con significancia de 0.067 (Cuadro 2).

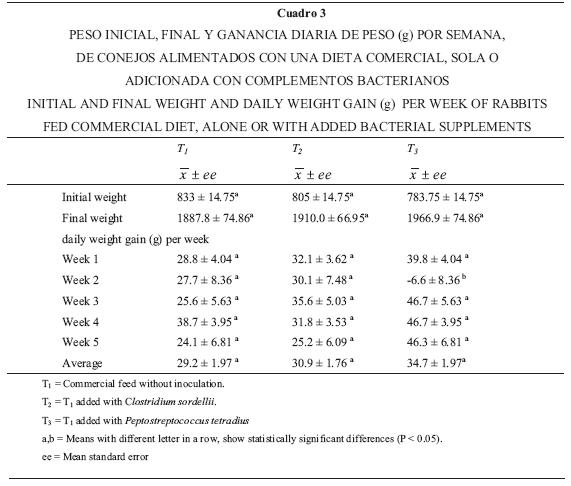
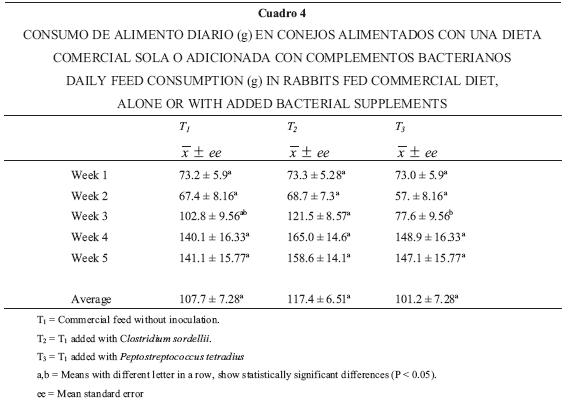
En general no se encontraron diferencias estadísticamente significativas entre los tratamientos (P > 0.05) para las variables productivas (ganancia de peso, consumo de alimento, eficiencia alimenticia y rendimiento de la canal) (Cuadros 3, 4 y 5).
El ensayo de digestibilidad aparente que se llevó a cabo a la quinta semana de iniciado el trabajo experimental, no mostró diferencias estadísticas significativas entre los tratamientos (Cuadro 6).
En lo referente a bacterias totales se encontraron diferencias (P < 0.05) a nivel de apéndice cecal entre el grupo testigo y el que recibió P. tetradius y a nivel de colón distal entre el grupo que recibió C. sordellii y P. tetradius (Cuadro 7).
En el apéndice cecal, tanto para pH (Cuadro 8) como para amonio (Cuadro 9) sí hubo diferencia estadística significativa entre el T2 (C. sordellii) y los otros dos tratamientos, mientras que a nivel de la 13 asa cecal se encontraron diferencias (P < 0.05) en la concentración de amonio entre el grupo que recibió P. tetradius y los otros dos grupos.
Discusión
Como menciona Mateos,31 la idea básica de la adición de complementos bacterianos a la dieta de los conejos es evitar, mediante un mecanismo de competición, la proliferación de gérmenes perjudiciales en el intestino del animal. Cheeke et al.32 comentan que varios estudios con complementos bacterianos han reducido la incidencia de infecciones entéricas y la mortalidad de los animales.
Los animales alimentados con C. sordellii mostraron mayor resistencia a infecciones entéricas, siendo menor la morbilidad (P < 0.05) y la mortalidad (P < 0.07) que en los otros dos tratamientos. La disminución en la morbilidad y mortalidad puede deberse a inhibición competitiva, a nivel del tubo digestivo, de C. sordellii hacia bacterias patógenas que ocupan los mismos nichos ecológicos. Una ventaja de C. sordellii sobre P. tetradius es que al tratarse de una bacteria formadora de espora, tiene mayor probabilidad de alcanzar el intestino grueso y colonizarlo, como lo registrado con complementos de Bacillus toyoi,24 que han mostrado capacidad para colonizar el intestino grueso del conejo y actuar como inhibidores competitivos de microorganismos patógenos como E. coli y varias especies de clostridios causantes de enteritis posdestete.
De acuerdo con los resultados, P. tetradius no tiene efecto importante en la prevención o protección contra enfermedades entéricas. Quizá la dosis utilizada de esta bacteria no compita contra otros microorganismos.
En las variables productivas, la única que mostró diferencia estadísticamente significativa entre tratamientos fue la ganancia de peso en la segunda semana (Cuadro 3) y ésta se debió a una pérdida de peso en los animales del grupo tres (P. tetradius), que fueron muy afectados por la enteritis; este resultado repercutió en forma directa en el consumo de alimento, que disminuyó de forma significativa para este tratamiento en la tercera semana (Cuadro 4). Aunque a partir de la tercera semana la eficiencia alimenticia se incrementó en T3 (P < 0.05), con respecto a los otros dos tratamientos (debido probablemente a un efecto compensatorio), en promedio, considerando todo el periodo de engorda, no se encontraron diferencias estadísticas significativas (P > 0.05) entre los tratamientos. Tampoco se observaron diferencias significativas en el rendimiento de la canal entre los tres tratamientos (P > 0.05). Al respecto, varios autores han registrado nulos beneficios con el uso de complementos bacterianos en variables productivas, pero positivos en lo referente a la salud del animal.19–21
La presencia de altas cantidades de carbohidratos de fácil fermentación en el alimento pudo ser una de las causas de la proliferación de bacterias como Clostridium spp y E. coli, posibles causantes de las enteritis que afectaban al centro cunícula en donde se desarrolló este estudio. En este contexto, el complemento a base de C. sordellii usado posiblemente disminuyó la morbilidad mediante procesos de inhibición competitiva. Metabólicamente, el tratamiento con C. sordellii mantuvo un pH más alcalino (P < 0.05) con respecto a los otros dos tratamientos, a nivel apéndice cecal (en el cual se secretan los iones bicarbonato), lo que se relaciona con un incremento en la producción de sustancias amortiguadoras, debido a un estímulo en la producción de ácidos grasos volátiles a partir de carbohidratos rápidamente fermentables, los cuales son un sustrato ideal para bacterias del género Clostridium. Este mismo pH y mayor concentración de amoniaco en el tratamiento con C. sordellii (P < 0.05) en apéndice cecal pudieron promover el incremento en la cantidad de baterias totales a este nivel, en comparación con el tratamiento con P. tetradius (P < 0.05).
Se ha mencionado la participación de las bacterias cecales en el estímulo de la producción de inmunoglobulinas que a su vez aumentan las defensas del animal.33 Se observa relación entre la concentración de amonio y el pH para cada una de las tres regiones, en la que a un pH más alcalino la concentración de amonio se incrementa y viceversa, lo que podría señalar que para las bacterias presentes en estas regiones el pH del medio puede interferir en la utilización y aprovechamiento del amonio.
La menor concentración de bacterias totales a nivel de colon en el tratamiento de C. sordelli en comparación con P. tetradius (P < 0.05) pudo ser factor importante en el decremento de la morbilidad por diarreas inespecíficas (P < 0.05) que presentaron los animales de este tratamiento.
Ninguno de los dos complementos mostró capacidad para mejorar las variables productivas de los conejos; sin embargo, C. sordellii mostró capacidad para disminuir la presencia de enfermedades entéricas y mortalidad, en comparación con los otros dos grupos, ese resultado permite seguir considerando a C. sordellii como un complemento bacteriano con potencial para conejos. P. tetradius no benefició en ningún aspecto a los animales, por lo que se descarta cualquier posible efecto benéfico.
Aunque el uso de un complemento a base de C. sordellii muestra potencial como complemento alimenticio, hacen falta más estudios sobre dosis efectiva, duración del efecto de protección contra enfermedades entéricas, estimulación del sistema inmune y repercusión económica en diferentes sistemas de producción, antes de considerar su posible uso comercial.
Referencias
1. Mitsuoka T. History and future prospects of intestinal flora research, in Intestinal Flora and Immunity. Special Anniversary Edition of Healthist. Tokio Japan: Ed. Yakult Honsa Co. Ltd,1997. [ Links ]
2. Escalante LA. El potencial de la manipulación de la flora intestinal por medios dietéticos sobre la salud humana. Enferm Infect Microb 2001; 21:106–114. [ Links ]
3. Fuller R. Probiotics in man and animals. J Appl Bacteriol 1989; 66:365–378. [ Links ]
4. Ewing WN, Cole DJA. The living gut. An introduction to microorganisms in nutrition. British library cataloguing, Dungannon, UK: Context Publication, 1994 [ Links ]
5. Armuzzi A, Cremonini F, Bartolozzi F, Canducci F, Candelli M. The effect of oral administration of Lactobacillus GG on antibiotic–associated gastrointestinal side–effects during Helicobacter pylori eradication therapy. Aliment Pharmacol Ther 2001; 15: 163–169. [ Links ]
6. Pothoulakis C, Kelly CP, Joshi MA, Gao N. Saccharomyces boulardii inhibits Clostridium difficile toxin A binding and enterotoxicity in rat ileum. Gastroenterology 1993; 104: 1108–1115. [ Links ]
7. Pestka JJ, Ha CL, Warner RW, Lee JH, Ustunol Z. Effects of ingestion of yogurts containing Bifidobacterium and Lactobacillus acidophilus on spleen and Peyer's patch limphocyte populations in the mouse. J Food Prot 2001; 64: 392–95. [ Links ]
8. De Roos NM, Kattan MB. Effects of probiotic bacteria on diarrhea, lipid metabolism and carcinogenesis: A review of papers published between 1988 and 1998. Am J Clin Nutr 2000; 71: 405–11. [ Links ]
9. Wollowski I, Rechkemmer G, Pool–Zobel BL. Protective role of probiotics and prebiotics in colon cancer. Am J Clin Nutr 2001;73: S451–S455. [ Links ]
10. Fuller R. Nature of the determinant responsible for the adhesión of lactobacilli to chicken crop epithelial cells. J Gen Microbiol 1975; 87: 245–250. [ Links ]
11. Mazza P. The use of Bacillus subtilis as an antidiarrhea microorganism. Boll Chim Farm 1994;133:3–18. [ Links ]
12. Apgar GA, Kornegaay ET, Lindemaann MD, Wood CM. The effect of feeding various levels of Bifidobacterium globosum A on the performance, gastrointestinal measurements, and immunity of weanling pigs and on the performance and carcass measurements of growing–finishing pigs. J Anim Sci 1993; 71: 2173–2179. [ Links ]
13. Jaquette RD, Dennis RJ, Coalson JA, Were DR, Manfredi ET, Red PI. Effect of feeding viable Lactobacillus acidophilus (BT1386) on the performance of lactating dairy cows. J Dairy Sci 1988; 71: 1968–1972. [ Links ]
14. Were DR, Red PI, Manfredi ET. Lactation performance of two large dairy herds of Lactobacillus acidophilus strain (BT1386). J Diry Sci 1988; 71 (Suppl 1): 219 (Abstract). [ Links ]
15. Fellner V, Phillip LE, Sebastian S, Idziak ES. Effects of a bacterial inoculant and propionic acid on preservation of high–moisture ear corn, and on rumen fermentation, digestion and growth performance of beef cattle. Can J Anim Sci 2001; 81: 273–280. [ Links ]
16. Chesson A. Probiotics and other intestinal mediators. In: Cole DJA, Wiseman J, Varley MA, editors. Principles of pig science. Nottingham: Nottingham University Press, 1994: 197–214. [ Links ]
17. King JLO. Lactobacillus acidophilus as a growth stimulant for pigs. The Veterinarians 1968; 5: 273–280. [ Links ]
18. Cheeke PR, Hollister AG, Robinson KL. Improving feed efficiency and reducing mortality in rabbits: A case study for use in all species. In: Lyons TP, editor. Biotechnology in Feed Industry. Nicholasville Kentuky USA: Alltech Technical Publications, 1989: 253–259. [ Links ]
19. Hollister AG, Cheeke PR, Robinson KL, Patton NM. Effects of water administered probiotics and acidifers on growth, feed conversion and enteritis mortality of weanling rabbits. J Appl Rabbit Res 1989; 12:143–147. [ Links ]
20. Hollister AG, Cheeke PR, Robinson KL, Patton NM. Effects of water administered probiotics and acidifers on performance of weanling rabbits. J Appl Rabbit Res 1990; 13:6–9. [ Links ]
21. Masoero G, Auxilia MT, Caroppo S, Toppino PM. The use of lactic acid bacteria in rabbit diet containing dried whey. Dairy Sci (Abstract) 1981; 43:8419. [ Links ]
22. Cobos PMA, Gutiérrez OC, Hernández SD, González MSS, Mendoza MGD. Aislamiento y caracterización de dos bacterias cecales con potencial de uso en la alimentación del conejo. Vet Méx 2004; 35: 109–120. [ Links ]
23. Hernández SD, Cobos PMA, González MSS, Bársena GR, Arcos GJL, Gallardo LF. Poblaciones microbianas y fermentación en el ciego de conejos en crecimiento alimentados con suplementos de bacterias cecales. Interciencia 2004; 29:442–446. [ Links ]
24. Hattori Y, Kozasa M, Brenes J. Effect of Toyocerin® (Bacillus toyoi) on the intestinal bacterial flora of rabbits. Proceedings of the 3rd World Rabbit Congress;, 1984 April 4–8; Rome, Italy: World Rabbit Science Association, 1984: 279–286. [ Links ]
25. Cheeke PR. Alimentación y nutrición del conejo. Zaragoza, España: Ed. Acribia, SA, 1995. [ Links ]
26. Van Soest PJ, Roberton JB, Lewis BA. Methods for dietary fiber, neutral detergent fiber, and nonstarch polysaccharides in relation to animal nutrition. J Dairy Sci 1991; 74:3583–3597. [ Links ]
27. Harrigan WF, McCance E. Métodos de Laboratorio en Microbiología de Alimentos y Productos Lácteos. León, España: Ed. Academia, 1990. [ Links ]
28. Cobos PM, Yokoyama MT. Clostridium paraputrificum var. ruminantium: colonization and degradation of shrimp carapaces in vitro observed by scanning electron microscopy. In: Wallace RJ, Lahlou Kassi A, editors. Rumen Ecology Research Planning. Proceedings of a Workshop; 1995 March 13–18; Addis Abeba, Ethiopia. Addis Abeba, Ethiopia: The International Livestock Research Institute, 1995:151-162. [ Links ]
29. SAS. Institute Inc. SAS/STAT. Guide for Personal Computer. Version 6. Cary NC:SAS Institute. Inc, 1987. [ Links ]
30. Daniel WW. Bioestadística. Base para el análisis de las ciencias de la salud. 4a ed. México DF: Ed. Limusa SA de CV, 2002. [ Links ]
31. Mateos GG. Minerales, vitaminas, antibióticos, anticoccidiósicos y otros. En: De Blas BC, editor. Alimentación del Conejo. Madrid, España: Ed. Mundi–Prensa, 1989; 96–98. [ Links ]
32. Cheeke PR, Grobner MA, Patton N M. Fiber digestion and utilization in rabbits. J Appl Rabbit Res 1986; 9: 25–30. [ Links ]
33. Green DH, Wakeley PR, Page A, Barnes A, Baccigalupi L, Rica E et al. Characterization of two Bacillus probiotics. Appl Eviron Microbiol 1999; 65:4288–4291. [ Links ]
*Lacto–Sacc® y Acid–Pak 4–Way®, Alltech Inc., Estados Unidos de América.
**Hacienda, México.
***Centrifuga Eppendorf Centrifuge 5804, Alemania.
****Perkin Elmer Lambda 40, Estados Unidos de América.
*****Orion, Modelo 250ª, Estados Unidos de América.














