Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Veterinaria México
versión impresa ISSN 0301-5092
Vet. Méx vol.39 no.3 Ciudad de México jul./sep. 2008
Artículo de revisión
Epilepsia en perros
Canine epilepsy
Gabriela Goiz–Márquez* Sara Caballero Chacón* Hugo Solís Ortiz** Héctor Sumano López*
* Departamento de Fisiología y Farmacología, Facultad de Medicina Veterinaria y Zootecnia, Universidad Nacional Autónoma de México, 04510, México, D. F.
** Departamento de Neurofisiología, Departamento de Anatomía, Facultad de Medicina, Universidad Nacional Autónoma de México, 04510, México, D. F.
Recibido el 2 de marzo de 2007
Aceptado el 27 de febrero de 2008.
Abstract
Idiopathic epilepsy (IE) and other convulsive disorders represent at least 14% of neurological consultations in veterinary medicine. In spite of this, there is a gap in the information usually handled by the small animal clinician, because the pathophysiological aspects of this disease are still not completely understood. Since there is no specific method for diagnosing IE, exclusion criteria are used to reach diagnosis. Although the electroencephalogram (EEG) can provide diagnostic elements, abnormalities in the EEG record are not always found. Pharmacologic treatment options are reduced and not void of ad verse effects. The possibility of encountering IE refractory to antiseizure pharmacological treatment is high and it has been concluded that non pharmacological treatment options should be explored through systematic clinical studies. Up to date, early diagnosis, appropriate pharmacological treatment, owners' education and a combination with non pharmacological options represent the only way to improve prognosis for dogs with IE.
Key words: Idiopathic Epilepsy, Dog, Seizures, Review.
Resumen
La epilepsia idiopática (EI), así como otras enfermedades convulsivas representan al menos 14% de las consultas neurológicas en la medicina veterinaria. A pesar de esto último, se reconoce que existe un vacío en la información que maneja el clínico especialista en pequeñas especies porque aún no se han elucidado todos los aspectos patofisiológicos de ese padecimiento. Debido a que no existe un método diagnóstico específico, se llega a él por exclusión. Aunque el electroencefalograma (EEG) brinda algunos elementos diagnósticos no siempre se tiene la fortuna de ubicar anormalidades en el registro. Las alternativas terapéuticas farmacológicas son reducidas y no carentes de efectos adversos. Es mucha la posibilidad de encontrar EI refractaria al tratamiento farmacológico y se ha concluido que deben evaluarse las alternativas de tratamiento no farmacológico mediante estudios clínicos sistemáticos. El diagnóstico temprano, la instauración de un tratamiento farmacológico, la educación de los propietarios de animales y la combinación con terapias no farmacológicas representan a la fecha la única forma de mejorar el pronóstico de perros afectados con EI.
Palabras clave: Epilepsia Idiopática, Perros, Convulsiones, Revisión.
Introducción
La epilepsia afecta de 1% a 2% de la población mundial humana1,2 y constituye uno de los problemas neurológicos más comunes.1 Algo similar ocurre con perros, en los que se considera el problema neurológico más común.3–5 La frecuencia de este tipo de casos de EI fluctúa desde 0.5% a 5.7% de las consultas,6–8 además es la causa más frecuente de convulsiones en perros,9 ya que representa 14% de las consultas con signos neurológicos; de éstos, 80% son epilepsia idiopática (EI).10 Sin embargo, a menudo es mal entendida y, por ende, tratada equívocadamente. La EI y la epilepsia en general requieren tratamiento a largo plazo, por ello precisan de reevaluación periódica y de constantes ponderaciones de la efectividad del tratamiento.3
Mucho de lo que se sabe acerca de las convulsiones se deriva de la observación y estudio de padecimientos convulsivos en humanos.8 En contraste, la literatura veterinaria contiene pocos estudios profundos y metódicamente completos que refieran su evaluación sistemática.11 Un primer paso para el estudio de la epilepsia en perros debe ser el análisis documental del acervo médico formal; así, este trabajo ofrece una revisión y análisis detallado de lo que a la fecha se conoce sobre epilepsia en perros.
Definiciones
Para mejor comprensión respecto de la epilepsia, se define a continuación parte de la terminología utilizada por los neurólogos.
Según la Liga Internacional contra la Epilepsia (ILAE) la epilepsia se define como una condición neurológica crónica caracterizada por convulsiones epilépticas recurrentes.
Otros conceptos relacionados son:
Convulsión. Problema de la función cerebral con características de paroxismo (acceso violento) transitorio, con tendencia recurrente y terminación espontánea.5
Crisis epiléptica. Crisis cerebral que resulta de una descarga neuronal excesiva. Puede dividirse en generalizadas, parciales, unilaterales y no clasificadas.12
Status epilepticus: Convulsión que dura entre 20 y 30 minutos, que es la estimación del tiempo necesario para causar daño cerebral13 o dos o más convulsiones discretas sin recuperación total de la conciencia entre convulsiones.13
Convulsiones en racimo. Dos o más convulsiones que ocurren en un periodo corto (minutos a horas), pero, en este caso, el paciente recobra la conciencia entre convulsiones.13 Otros autores consideran convulsiones en racimo si ocurren dos o más en un periodo de 24 horas o en dos o tres días.3 También llamadas convulsiones seriadas, convulsiones agudas repetitivas.
Clasificación
Las convulsiones pueden clasificarse de varias maneras dependiendo del sitio donde se origina la actividad convulsiva, las áreas cerebrales afectadas, o según la etiología de la convulsión.5 Las convulsiones se caracterizan como sintomáticas o reactivas. Las primeras ocurren como consecuencia de un daño cerebral estructural (trauma cerebral, hidrocefalia, encefalitis, neoplasias). Las segundas son consecuencia de un daño metabólico o tóxico.14 Asimismo, a la sospecha de epilepsia sintomática o reactiva, pero cuyo origen no se identifica, se le denomina criptogénica.12 Cuando se descarta un problema metabólico o estructural y no se identifica causa subyacente, se le conoce como idiopática.12
Según el tipo de crisis y los hallazgos electroencefalográficos, se reconocen tres grupos diferenciados de crisis: a) parciales (focales o locales); b) generalizadas, y c) inclasificables por falta de datos.12,14
En las crisis parciales, la primera manifestación clínica y electroencefalográfica indica activación inicial de un sistema de neuronas limitado. Cuando la conciencia no se halla alterada, a este tipo de crisis se le llama parcial simple.8,12 Cuando está alterada se denomina parcial compleja.8,12 Se entiende como alteración de la conciencia la incapacidad de responder de manera normal a estímulos exógenos por alteraciones de la sensibilidad o de las capacidades cognitivas.12
Las convulsiones parciales deben alertar al clínico a buscar la etiología (tumores, malformaciones congénitas, encefalitis focal), ya que es más probable que se encuentren asociadas con daño cerebral estructural.5 Sin embargo, también pueden presentarse en EI;3 en este orden de ideas, es posible que se presenten como una forma abortiva de una convulsión tónico–clónica generalizada3 durante el tratamiento con fármacos antiepilépticos.
En las crisis generalizadas la primera manifestación clínica indica el compromiso inicial de ambos hemisferios.3,12 La conciencia se encuentra alterada y puede ser el primer signo clínico presente. Las manifestaciones motoras son bilaterales y las alteraciones electroencefalográficas ictales son, al inicio, bilaterales y reflejan una descarga neuronal que rápidamente difunde a ambos hemisferios.12 Se piensa que éste es el tipo de convulsión que ocurre con mayor frecuencia en perros, pero esta apreciación puede deberse a que es la más fácilmente reconocida por los veterinarios, mientras que otras menos reconocidas pueden pasar desapercibidas.5
Las crisis generalizadas pueden ser precedidas por un periodo durante el cual el animal se torna intranquilo, muy excitado o ansioso, y pueden observarse comportamientos como lamido, salivación, búsqueda de escondites, búsqueda de atención o andar sin rumbo; a ese tipo de conducta se le denomina "aura". El aura raramente se ve antes de una crisis parcial. El evento convulsivo se conoce también como ictal y en este periodo existe pérdida de conciencia, actividad tónico–clónica y otros eventos motores involuntarios,14 como movimientos de carrera (automatismos) que generalmente vienen después de la fase clónica. La fase ictal dura entre 30 y 90 segundos en la mayoría de los casos.14 En el periodo posictal hay agotamiento, desorientación, intranquilidad o todo lo anterior, varía de minutos a días y puede no estar relacionado con la severidad y duración del periodo ictal.14 Es común observar aumento del apetito y sed excesiva, pueden ser evidentes ataxia, marcha en círculos, problemas propioceptivos, demencia, pérdida transitoria del reflejo de amenaza con o sin ceguera. La visión puede tomar de horas a días para regresar a su estado preictal.14 La presencia de signos neurológicos asimétricos persistentes indica lesión estructural.14
La fase ictal se resume en el Cuadro 1, a partir de las observaciones de Pellegrino,12 March14 y Bollinger–Schmitz y Kline.9
Etiología
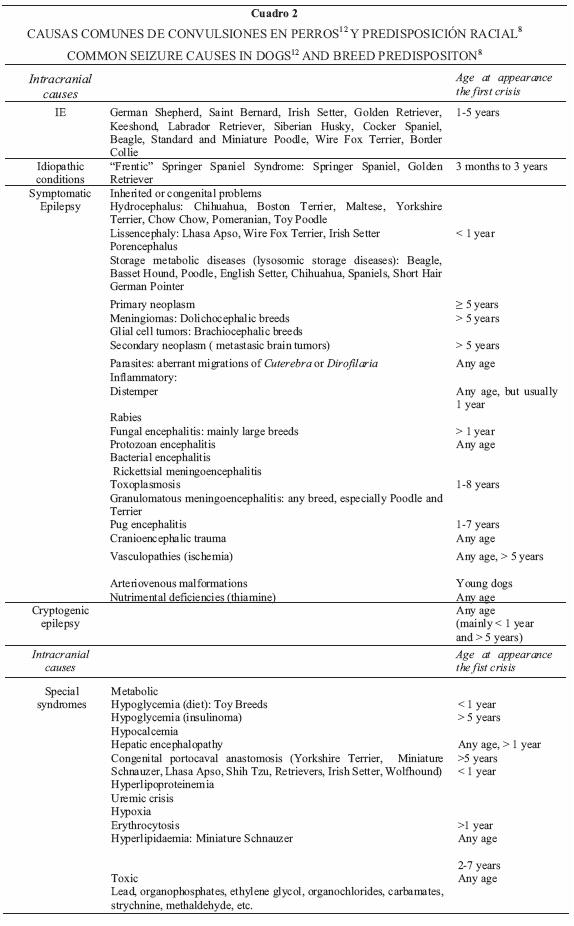
Uno de los aspectos importantes de la epilepsia consiste en que son pocos los casos en que se conoce su etiología. Por ejemplo, en humanos, entre 55% y 85% de los casos no se llega a precisar la causa del padecimiento.16 En el Cuadro 2 8,12 se presentan causas comunes de convulsiones en perros y su predisposición racial.
Las crisis epilépticas se originan por una descarga paroxística excesiva de una población neuronal; sin embargo, se desconoce el mecanismo íntimo de producción de esta descarga, se sabe que las crisis epilépticas pueden manifestarse en diversas circunstancias: a) durante el curso de una crisis cerebral aguda, subaguda o transitoria;12 b) por la descarga de una lesión cerebral fija, como secuela de una antigua agresión que formó su sustrato anatomofuncional en el cerebro. En ocasiones los antecedentes de la lesión cerebral tienen su origen en eventos que han transcurrido por lo menos dos años, como en el caso de epilepsias secundarias a traumatismos o anoxias fetales o neonatales; c) como expresión de una enfermedad cerebral progresiva subyacente. Por esta razón, ante toda epilepsia recurrente se debe pensar en la posibilidad de una enfermedad evolutiva; por ejemplo, un tumor; en este caso la actividad convulsiva quizá se deba a la lesión progresiva que sufren las neuronas adyacentes a la masa tumoral (por edema y hemorragia); d) en casos en que se presume una causa específica, pero no se identifica la etiología (epilepsia criptogénica);5 o e) con manifestación espontánea, sin causa aparente que la desencadene. En situaciones como ésta pueden encontrarse antecedentes familiares de EI.
En todos los casos, las convulsiones epilépticas son autolimitantes en cuanto a la duración de cada episodio, excepto cuando ocurre status epilepticus. La mayoría de las formas de epilepsia recurren con mayor o menor frecuencia, a no ser que se traten de modo adecuado. Las causas que determinan la aparición de la crisis y su recurrencia aún no están esclarecidas, pero se postula que hay dos factores esenciales en la producción y expresión de la epilepsia: la agresión cerebral presente o como secuela, y el condicionamiento genético.
Mecanismo
Es importante aclarar que se desconoce el mecanismo preciso de la epileptogénesis.14,16 La mayor parte del conocimiento de la epilepsia se ha generado a partir de estudios de convulsiones parciales o convulsiones parciales con generalización secundaria como consecuencia de daño cerebrocortical estructural.14 A continuación se describen algunos de los mecanismos causantes de convulsiones epilépticas.
Las convulsiones son resultado de un aumento en la excitabilidad o sincronización neuronal. Los cambios en la excitabilidad normal de circuitos neuronales por aumento de la excitabilidad neuronal progresiva, aumento de excitación recurrente, o deficiente inhibición, pueden propiciar actividad epileptiforme.14
La epiletogénesis focal se debe a la capacidad de ciertas poblaciones neuronales de generar descargas eléctricas excesivas, sincrónicas y de alta frecuencia que representan un campo eléctrico prominente y de gran amplitud asociado con cambios despolarizantes prolongados en el potencial de membrana celular y paroxismos de potenciales de acción en grandes grupos de neuronas.12 Pequeñas áreas de la corteza cerebral funcionan con actividad anormal como focos generadores de convulsiones que se esparcen a otras regiones conectadas sinópticamente.1 Las descargas epileptogénicas focales se originan por la interacción de varios factores que incluyen las propiedades de ciertas subpoblaciones neuronales (por ejemplo, en el hipocampo y en la neocorteza) de actuar como marcapasos para eventos epileptiformes espontáneos, sinapsis excitatorias entre las neuronas de la región epileptogénica, la reducción de mecanismos inhibitorios de control como consecuencia del agotamiento de la disponibilidad de Cl – extracelular y por disminución de la acción inhibitoria del ácido gammaaminobutírico (GABA) en la presinapsis.12 La inhibición es considerada como un mecanismo básico de funcionamiento neural, En circunstancias normales, estos circuitos inhibitorios locales y regionales modulan la actividad dentro de la corteza cerebral y previenen la propagación anormal de la actividad excitatoria.14
Cuando hay actividad epiléptica el tejido neural presenta disminución significativa de los mecanismos inhibitorios. De hecho existen estudios que proponen que la actividad paroxística normalmente está frenada o bloqueada por la inhibición sináptica y que la disminución, por cualquier causa, de la potencia del control neural inhibitorio es causa primaria de las crisis convulsivas en el hipocampo y en otras estructuras cerebrales.17 Se ha descubierto que el cerebro epiléptico tiene receptores GABAérgicos con comportamiento anormal que impiden la transmisión inhibitoria y pueden incrementar la susceptibilidad de convulsionar en humanos con epilepsia del lóbulo temporal18 y se ha visto también que en circunstancias como ésta el GABA tiene actividad aberrante y se comporta como un neurotransmisor excitatorio.19
La actividad anormal genera cambios plásticos en los circuitos corticales, estos factores son fundamentales para la patogenia de la enfermedad.1 Se reconoce que las convulsiones sin control pueden ocasionar excitotoxicidad.14,20 Esto es, se ha visto que las convulsiones repetidas e intensas dañan a otros grupos neuronales. Lo anterior se debe, al menos en parte, a la habilidad del glutamato y a compuestos relacionados con éste para destruir neuronas por transmisión sináptica excitatoria prolongada. De manera normal, la concentración de glutamato liberado en los espacios sinápticos se eleva a aproximadamente 1 mM, pero permanece a esa concentración sólo durante algunos milisegundos. En caso de que haya niveles anormalmente elevados en los espacios sinápticos, la activación excesiva de receptores neuronales para glutamato podrán sobreexcitar a las neuronas hasta ocasionar muerte celular.1
El GABA es el neurotransmisor inhibidor más importante en el cerebro y ocasiona potenciales postsinápticos inhibitorios (PPSI) cuando se liga con los receptores GABA. Los receptores GABAB se encuentran ligados a canales de potasio en las dendritas, también existen canales para potasio dependientes de calcio en los procesos axonales y dendríticos.14 Asimismo, en el soma, canales para cloro unidos a receptores GABAa provocan hiperpolarización rápida por entrada de cloro a la célula causando un PPSI. En el cono dendrítico los canales para potasio dependientes de receptores GABAB también causan hiperpolarización de la neurona .
Patogénesis de las convulsiones
Convulsiones parciales
En este tipo de eventos, los registros electrofisiológicos de neuronas individuales en un foco epiléptico revelan periodos de despolarización exagerada y prolongada, ésta se denomina despolarización paroxística (DP), que es el inicio de la descarga convulsiva, ya que es el momento en que las neuronas son fácilmente excitables (Figura 1).21 Se cree que se origina en las dendritas de la neurona mediante la entrada de calcio por canales de calcio dependientes de voltaje y entrada de sodio por canales de tipo no N metil–d–aspartato (NMDA). Estos eventos, dependientes del calcio, son también responsables de las descargas en espiga que se superponen al DP. Estas espigas intracelulares representan potenciales de acción que se generan en procesos dendríticos. Durante el periodo entre convulsiones o estado interictal, el DP es seguido por una fase de espiga de hiperpolarización, posterior a la despolarización, provocada por salida de potasio a través de canales de calcio dependientes de voltaje y retroalimentación inhibitoria de la neurona (mediada por receptores GABAA y GABAB). Durante la transición del periodo interictal al ictal, la actividad sincrónica de muchas neuronas epileptogénicas y la falla de sistemas inhibitorios normales provocan la desaparición de la fase de hiperpolarización y la aparición de despolarizaciones neuronales repetitivas y de comportamientos de espiga.14 Este fenómeno se esquematiza en la Figura 2.


Una zona focal de neuronas hiperexcitables sugiere presencia de agregado de neuronas con propiedades de membranas anormales y capacidad inherente de disparo. Aunque no se ha identificado la identidad exacta de esta población de células marcapasos, se considera esta propiedad como requisito para la epileptogénesis focal de subpoblaciones neuronales en regiones específicas. Las neuronas piramidales en la lámina V de la corteza cerebral tienen esta característica de disparo bajo condiciones fisiológicas normales. Después de recibir un estímulo umbral, estas células producen una serie de potenciales de acción capaces de excitar neuronas piramidales vecinas de la lámina V y por medio de proyecciones subcorticales son capaces de reclutar otras regiones del cerebro.14 De manera normal, los sistemas inhibitorios previenen la excitación excesiva de las zonas corticales adyacentes, pero se ha encontrado que las neuronas piramidales en estas zonas neocorticales poseen el umbral más bajo para la epileptogénesis.
Por otro lado, el daño cerebral causado por las convulsiones puede aumentar la excitabilidad inherente de las neuronas glutaminérgicas por alteración en el número, distribución espacial y sensibilidad de los receptores para glutamato, o por alteración de la sensibilidad de los canales para calcio dependientes de voltaje y, en consecuencia, incrementar la excitabilidad neuronal.14
También puede ocurrir una reorganización sináptica en los circuitos neuronales, ya que en los axones excitatorios dañados o en aquellos que han perdido sus células blanco, se desarrolla el crecimiento de ramas colaterales axonales que forman conexiones aberrantes con otras neuronas excitatorias o con procesos dendríticos de la misma neurona que sufrió el daño.14 Esto último genera un sistema autopropagante. Más aún, aunque los sistemas GABAérgicos limitan el tiempo y la extensión anatómica de los eventos excitatorios, el daño cerebral (por hipoxia, trauma, isquemia) está asociado con pérdida funcional y morfológica progresiva de neuronas, así como con sinapsis inhibitorias. Hay pérdida de neuronas GABAérgicas con reducción de las concentraciones de GABA en tejidos y en líquido cefalorraquídeo, así como disminución de la expresión y sensibilidad de receptores GABA.14 La disfunción GABAérgica facilita la conversión de una neurona que forma espigas intermitentemente en el estado interictal a una neurona que dispara de manera repetida en el estado ictal.
Hay otros mecanismos que contribuyen al reclutamiento y sincronización de neuronas excitatorias. La presencia de niveles extracelulares elevados de potasio generada por fallas en el funcionamiento de la bomba Na–K ATPasa, que se presentan después de la actividad neuronal excesiva, induce despolarizaciones de terminales axónicas vecinas y reduce la salida de potasio durante la fase de hiperpolarización que le sigue a la DP. El bloqueo de la salida de potasio aumenta la duración del DP y permite que se presenten espigas más rápidamente.14 Además, también hay mala recaptación de glutamato acumulado en las sinapsis excitatorias debido a fallas en la recaptación de este neurotransmisor por parte de los astrositos. Asimismo, para el caso de que existan grandes corrientes despolarizantes generadas por neuronas marcapasos, pueden expandirse a neuronas vecinas por paso directo de descargas entre células cercanas sin necesidad de que se encuentren conectadas.14
El reclutamiento de poblaciones neuronales adicionales es un proceso dinámico. La progresión de desórdenes convulsivos puede ocurrir por mecanismos como la potenciación a largo plazo (LTP) o fenómenos como el kindling, que se refiere al incremento de excitabilidad de neuronas y el potencial para que ocurra actividad convulsiva en regiones no afectadas inicialmente con estimulación repetida.8 Los estímulos excitatorios persistentes (experimentales o no) en áreas corticales conectadas al foco primario, refuerzan las sinapsis excitatorias y pueden ocasionar la aparición de nuevos focos epileptogénicos autónomos por reclutamiento neuronal adicional. Si el foco secundario se desarrolla en un área cerebrocortical homóloga en el hemisferio opuesto, se le conoce como "foco de espejo".8,14 Este foco puede desarrollar actividad epiléptica independiente del foco primario.8
Convulsiones generalizadas
Las convulsiones generalizadas primarias involucran ambos hemisferios de manera difusa y simétrica, desde el inicio hasta la terminación del episodio. Se postula un origen en la corteza cerebral como generador primario de convulsiones tónico–clónicas generalizadas.14 Sin embargo, la ausencia de lesiones histológicas obvias en la EI generalizada ha sido el mayor obstáculo en el entendimiento de ese padecimiento. Hay informes en los cuales no se han encontrado lesiones en el cerebro de perros con EI, aun con status epilepticus. Aunque se han descubierto hemorragias perivasculares en la corteza cerebelar, éstas se atribuyen al ataque convulsivo final y como causantes de las convulsiones.22 Sin embargo, pueden existir cambios neuronales geométricos o en la conectividad neuronal. Un ejemplo de anormalidad morfológica multifocal en algunos pacientes epilépticos es la displasia cortical o microdisgénesis, que se caracteriza por amontonamiento anormal de células piramidales en zonas corticales grises y zonas de neuronas ectópicas en localizaciones anormales. En teoría, las conexiones recurrentes y anormales entre estos grupos de neuronas pueden ocasionar descargas epileptiformes paroxísticas. Otra explicación neuroanatómica para las convulsiones generalizadas es la pérdida primaria de neuronas inhibitorias y de sus conexiones.14
Concurrentemente puede haber defectos funcionales neuroquímicos o sinápticos. Por ejemplo, se han encontrado concentraciones reducidas de GABA en el líquido cefalorraquídeo23 de perros epilépticos, pero se desconoce si esto es causa o consecuencia de las convulsiones recurrentes.23 También se ha propuesto que valores elevados de glutamato y aspartato en el espacio extracelular pueden estar relacionados con el desarrollo de convulsiones.20
Ciertos déficits funcionales a nivel de las sinapsis, en receptores de membranas y canales iónicos, pueden alterar la excitabilidad neuronal intrínseca. Por ejemplo, una disfunción difusa de canales iónicos dependientes de voltaje o de ligandos puede predisponer a convulsiones. Así, un aumento en la sensibilidad de los receptores para glutamato y disminución de la sensibilidad de receptores GABA puede producir cambios dinámicos que ocurren en los focos epilépticos a causa de actividad sináptica recurrente. Se ha observado que en la transición de una convulsión única a status epilepticus autosostenido, los receptores GABAA se mueven de la membrana sináptica al citoplasma, donde no poseen actividad funcional. Esto reduce el número de receptores GABAA disponibles para unirse con GABA o fármacos GABAérgicos y puede explicar la resistencia farmacológica a las benzodiacepinas, dependiente de tiempo, al igual que la tendencia de las convulsiones a ser autosostenidas.24 También hay subunidades de receptores AMPA y NMDA que se mueven de sitios subsinápticos a la membrana sináptica, causan mayor hiperexcitabilidad y posiblemente explican la sensibilidad a bloqueadores de receptores NMDA que persiste durante el status epilepticus.24
Estos cambios pueden ocurrir también durante el desarrollo cerebral. Normalmente, durante éste hay axones y colaterales axónicos que están sobreexpresados, ello propicia la formación de proyecciones excitatorias exuberantes y aberrantes, seguida de una remodelación extensiva debido a reforzamiento y debilitamiento dependiente de actividad de estas rutas neuronales. Si un error en el desarrollo cerebral causa retención de estas rutas excitatorias redundantes, puede desarrollarse un estado de hiperexcitabilidad. De esta manera, al igual que en el caso de la epilepsia parcial, la actividad excitatoria redundante y recurrente podría potencializar las sinapsis excitatorias y deprimir las inhibitorias, aumentando aún más la excitabilidad de la corteza cerebral. De hecho, se postula que defectos en los canales iónicos o defectos en el desarrollo que afecten la corteza cerebral de manera difusa son la causa más probable de los casos de epilepsia primaria.14
La liberación excesiva y persistente de glutamato inicia una cascada de eventos intracelulares mediados por calcio que llevan a la excitotoxicidad neuronal1,20 en el hipocampo, amígdala, neocorteza y tálamo. La disfunción neuronal y muerte celular en estas áreas vulnerables del cerebro son consecuencia común después de la actividad convulsiva prolongada.
Umbral convulsivo y descripción de las convulsiones
El umbral convulsivo está determinado por el estado de excitabilidad en reposo, por la sincronización neuronal preexistente y por la facilidad o rapidez con la que pueda ser alterado, de tal suerte que la facilidad con la que se puede inducir una convulsión varía entre los animales. Un umbral bajo está ligado a la combinación de un estado de excitabilidad aumentado y baja sincronización neuronal, un potencial aumentado para realzar aún más la excitación y sincronización neuronal, añadido de un requerimiento bajo de modificación del estado basal.3
Epilepsia idiopática
Según la literatura, la EI es, en la mayoría de los casos (80%–90%), generalizada8,11 y simétrica desde el inicio;11,25,26 las convulsiones tónico–clónicas con pérdida de la conciencia (gran mal) son recurrentes en los perros.3,8 Las convulsiones constan de cuatro fases: a) la fase prodrómica (que precede a la convulsión por horas o incluso días),27 que es una indicación a largo plazo de una convulsión cercana y que en perros puede presentarse como agitación o ladridos sin control;13 b) el aura o fase preictal (que dura minutos a horas y también se define como la sensación inicial de la convulsión antes de que haya signos observables y que son causadas por la actividad eléctrica anormal inicial en el cerebro);13 c) ictus (la convulsión como tal); y d) fase posictal (que dura minutos a horas),27 que se caracteriza por anormalidades clínicas transitorias en la función cerebral que son causadas por la severidad del ictus.13 El periodo interictal constituye el tiempo entre la resolución de cualquier signo posictal y el comienzo del siguiente ictus. Los periodos sin convulsiones pueden durar días o meses.10
La patofisiología de los prodromos aún no se ha comprendido, pero, a diferencia de las auras, aquéllos son de larga duración y no están asociados con actividad electroencefalográfica anormal.13 Las personas con epilepsia describen varias sensaciones durante sus auras, incluyendo mareos, cosquilleos y ansiedad, pero como generalmente el aura es subjetiva, es difícil de caracterizar en perros.13 Sin embargo, muchos propietarios se percatan de que sus animales se comportan de forma extraña antes de una convulsión y pueden esconderse, presentar agitación o vómitos.13 Hay estudios en los cuales se indica que este periodo preictal se observa en más de la mitad10 o hasta en dos terceras partes de los perros,11 puede durar desde algunos segundos hasta un promedio de tres horas (de 45 minutos a 12 horas10). En 50% de los perros, esta etapa inicia mientras duermen, más comúnmente en la noche,11 y los signos clínicos ordinarios incluyen ansiedad seguida de miedo, micción, búsqueda del dueño, ladridos sin control,6,11 salivación, mirada fija11 y a veces vómito, salivación, temblores.10
Se dice que la mayoría de las convulsiones ocurren en la casa del paciente o inmediatamente después de un periodo de descanso o de sueño y rara vez cuando el animal está activo.11,25 Algunas razas, en especial Pastor Alemán, Setter Irlandés y San Bernardo, tienen frecuentemente convulsiones seguidas y luego un periodo posictal con depresión; se ha mencionado que en estas razas puede ser difícil controlar el padecimiento con medicación.10,11 De la misma manera, las razas grandes frecuentemente presentan convulsiones en racimo o status epilepticus, una condición que puede ser difícil de controlar.3 Asimismo, algunos animales tienen un umbral convulsivo más bajo que otros. Aunque la mayoría de las convulsiones parecen ocurrir de manera espontánea, pueden ser propiciadas por varios factores, como privación de sueño, falta de administración de una dosis de anticonvulsivo a la hora necesaria, estrés emocional y alteraciones metabólico–fisiológicas,13 como fiebre, hiperventilación, fatiga. Además, es frecuente que se presenten las convulsiones a mitad de la noche; se sugiere que el letargo, el dormir sin ensoñaciones y la disminución de la actividad en la formación reticular, permiten la sincronización de circuitos reverberantes entre el tálamo y la corteza cerebral, además de que grupos neuronales que están levemente hiperactivos durante la vigilia se vuelven excitables y se presentan constantemente durante el sueño.5 Algunos fármacos como las fenotiacinas (v.gr., acepromacina) o las ciclohexilaminas (v.gr., ketamina, tiletamina) también pueden provocar convulsiones en perros susceptibles.27,28 Además, existen convulsiones sensibles a estímulos (convulsiones reflejas) que son desencadenadas por ellos o por eventos específicos. En humanos, el desencadenador más común es la luz centelleante, usualmente proveniente de la televisión; pero también pueden ser otros como la lectura, algunos sonidos, alimentarse, y en perros se han asociado con sonidos (como motores de cortadoras de pasto), viajes en auto, o visitas al veterinario.13 En estos casos el tiempo entre el desencadenador y la convulsión es corto, usualmente de segundos a minutos.13
Comúnmente los perros con EI tienen la primera convulsión entre los seis y nueve meses o un año;3 pero otros autores sitúan este evento entre los tres y cinco años de edad.3,5,10,11,13,15 Ocasionalmente sucede antes de los seis meses3,10,11,13,15 y excepcionalmente a los diez años.5,10,11,13,15 Por esta diversidad, Jaggy y Bernardini11 sugieren que la EI debe ser considerada como parte de los diagnósticos diferenciales de convulsiones recurrentes en perros de cualquier edad. Incluso hay informes en que cachorros de Cobrador de Labrador cuyos padres tenían historia de EI, presentaron convulsiones entre las ocho y nueve semanas de edad3 y Podell y Fenner3 observaron que el diagnóstico de EI era estadísticamente más probable en perros de raza grande (> 15 kg) entre uno y cinco años de edad, o cuando el intervalo entre la primera y segunda convulsión era mayor a cuatro semanas. El tipo más común de convulsiones en perros son las tónico–clónicas del denominado tipo gran mal,5,10,11,13,15 aunque es probable que esto último se deba a que es el tipo de convulsión más fácilmente identificable por los veterinarios.5 En un estudio se observó que más de 25% de los casos analizados presentaban convulsiones generalizadas o parciales sin pérdida de la conciencia y también se observaron anormalidades EEG focales, por lo que los autores creen que la patofisiología de la EI no es uniforme y que puede haber diferentes expresiones fenotípicas.11 La primera parte de la convulsión generalizada tipo gran mal es la tónica, durante la cual hay contracción sostenida de los músculos. El animal generalmente pierde la conciencia y se cae de lado, en opistótono, con los miembros extendidos, la respiración es irregular o ausente y es común que ocurra cianosis, salivación, defecación y micción. La fase tónica dura alrededor de un minuto y es seguida por la fase clónica, durante la cual hay contracción rítmica de los músculos, que se manifiesta como movimiento de remos o tirones de los miembros y movimientos masticatorios. Otros signos que se han descrito durante esta fase son defecación, tremores generalizados, pupilas midriáticas y vómito.11 La duración de esta fase es variable11,13 y se han descrito duraciones de entre 30 segundos a cinco minutos y rara vez mayores a diez minutos.11 Algunos animales sufren convulsiones tónico–clónicas más leves en las cuales no hay pérdida de conciencia.10,11 En humanos son comunes las crisis de ausencia, pero en medicina veterinaria son raras o poco reconocidas.30 Algunos individuos tienen más de un tipo de convulsión.10,11,13,15
Otro tipo de convulsión generalizada es la tónica, en la que la actividad motora consiste únicamente de rigidez muscular sin la fase clónica.10,11 Las menos comunes son las clónicas, en las cuales no hay componente tónico; las atónicas, donde hay una pérdida breve y súbita pérdida de tono muscular; y las mioclónicas, que se caracterizan por contracciones musculares breves que pueden generalizarse o estar confinadas a grupos musculares individuales.30
En cuanto a las convulsiones focales o parciales, cualquier parte del cuerpo puede estar involucrada dependiendo de la región del cerebro que está afectada. Puede haber signos motores o sensoriales asimétricos, como contracciones rítmicas de músculos faciales o masticatorios, comportamientos en los que los perros lamen o se mastican una región del cuerpo, o convulsiones "atrapa–moscas".5,10,13,15 En perros también se han descrito convulsiones focales manifestadas con signos autonómicos como vómito, diarrea o dolor abdominal aparente.13 Además se pueden manifestar convulsiones focales complejas que incluyen conciencia alterada y comportamientos extraños, como agresión o miedo sin razón.13,31 Existen casos de hipersialosis que responden a tratamiento con fenobarbital, por lo que se ha recomendado que en todos los casos de hipersialosis idiopática se practique EEG para determinar si la condición es o no epilepsia de origen límbico.32 El término de epilepsia límbica es sinónimo de epilepsia psicomotora, automática, rinencefálica, comportamental, del lóbulo temporal y autonómica, existen informes de casos de epilepsia límbica canina con cambios clásicos en el EEG.32
Una convulsión focal puede permanecer localizada o esparcirse a otras áreas de la corteza y progresar a convulsión focal compleja15 o esparcirse a ambos hemisferios, resultando una convulsión focal con generalización secundaria, esto puede suceder tan rápido que no se aprecia el componente focal.13 Según algunos autores, muchos perros con EI sufren convulsiones focales con generalización secundaria.10,11,13,15
El periodo posictal puede caracterizarse por fatiga, ceguera central, hambre y sed, midriasis, desorientación, caminar compulsivo, tambaleos, miedo y ladridos, con duración de algunos minutos hasta cuatro o más horas.10,11,13,15
La diferencia entre convulsiones tónico–clónicas y puramente tónicas se basa en la actividad motora predominante durante la convulsión; aquellas donde hay episodios de aumento generalizado de tono muscular, alternados con episodios de contracción muscular uniforme, rítmica y rápida de las extremidades se definen como tónico–clónicas.10 A su vez, las contracciones clónicas de los miembros se distinguen de los automatismos, donde hay movimientos coordinados de carrera. En las convulsiones tónicas en perros, la actividad motora está caracterizada únicamente por un aumento marcado, generalizado y de larga duración del tono muscular.10
Se ha llegado a la conclusión de que factores como instalaciones, hábitos de limpieza, época del año, hora del día, día de la semana, clima, etc., son poco importantes como desencadenadores de las convulsiones en pacientes con EI.8
Cabe mencionar que ya se conoce el genoma del perro de raza Boxer39 y hay informes de una mutación en epilepsia canina en el gen Epm2b que causa epilepsia fatal.40 Algunas razas de perro tienen mayor incidencia de EI, por ejemplo: Pastor Alemán, Cobrador Dorado, Keeshond,33 Beagle, Dachshund, Tervuren Belga, Cobrador de Labrador,8,10,13,34 Cocker Spaniel, Setter Irlandés, Schnauzer Miniatura, Poodle, San Bernardo, Husky Siberiano, Fox Terrier de pelo de alambre3 y Collie.3,5 Las convulsiones ocurren generalmente en ambos sexos con la misma frecuencia; sin embargo, los machos parecen afectados más comúnmente con EI,3,10,11,13,15 especialmente en algunas razas como el Cobrador Dorado.8 Algunos estudios indican que las proporciones entre machos y hembras es de 3.5:1 y hasta 5:1.8 Se cree que algunos perros tienen un umbral convulsivo bajo, que está determinado genéticamente.3,8 Se ha descrito predisposición familiar para la EI basada en la alta incidencia de este padecimiento en las razas mencionadas.10 Por ejemplo, se ha descubierto que la enfermedad tiene un modo de heredabilidad autosómico recesivo multifactorial en el Cobrador Dorado,10,34 Bernés de la Montaña,35 Vizsla36 y Springer Spaniel,37 y un modo de heredabilidad autosómico recesivo ligado al sexo en Beagle, Collie, Keeshond, Cobrador Dorado y Cobrador de Labrador.8 Se ha descartado un modo de heredabilidad dominante simple, ya que el padecimiento puede saltarse varias generaciones y algunos padres no afectados pueden producir descendientes con EI. En un estudio de camadas provenientes de dos progenitores con EI se estima del 30% al 100% de afectación.38 Evidentemente la consanguinidad puede incrementar la tasa de EI en los descendientes, y también cambiar el tiempo que tarda en expresarse, los cachorros pueden comenzar a convulsionar antes de los seis meses de edad.8
Diagnóstico
Aun para un neurólogo veterinario experimentado es difícil distinguir entre EI y epilepsia secundaria,34 especialmente si el paciente se presenta por primera vez. El diagnóstico clínico de EI está basado en la edad de aparición, ausencia de anormalidades interictales y exclusión de otras causas,13 el EEG puede auxiliar en la confirmación.
La información de la historia clínica es sumamente importante para determinar el diagnóstico.13 Además de las preguntas generales se debe pedir al dueño que describa el episodio convulsivo, pues es común que confundan un evento intermitente con una convulsión: el dolor, colapso debido a problemas cardiacos o respiratorios, signos vestibulares y síncopes pueden ser confundidos con convulsiones.8 También debe investigarse la frecuencia y duración del evento, y el comportamiento del perro entre convulsiones.13
Se debe instruir al dueño para que observe detalladamente si la crisis es generalizada de entrada o en forma secundaria.12 También debe preguntársele acerca de signos focales al inicio de la convulsión, así como determinar si los eventos ocurren a cierta hora del día o en asociación con ciertas circunstancias, como ejercicio o alimentación.13
Es importante conocer la historia del perro respecto de las convulsiones, enfermedades o traumatismos importantes, estado vacunal, dieta o posible exposición a tóxicos. También es necesario conocer acerca de cualquier medicamento de prescripción o no que esté recibiendo el paciente, así como cambios en comportamiento, ambulación, apetito, peso y hábitos de sueño.13
Por otro lado, la fecha en que se presentó la primera crisis es muy útil para comenzar a restringir los diagnósticos diferenciales. En animales con EI, es común que la primera crisis se presente desde los seis meses8 hasta los cinco años de edad, como ya se detalló,8,12,13 con la mayoría de los casos iniciando entre uno y tres años de edad.9 La frecuencia con que ocurren los episodios convulsivos es variable, pudiendo presentarse desde una vez al día hasta una vez cada seis meses.8 Cuando el inicio de la crisis ocurre antes o después de esa edad, generalmente las crisis epilépticas son el síntoma de otra enfermedad primaria,12 incluyendo típicamente los problemas inflamatorios, neoplasias, enfermedades metabólicas, vasculares o por enfermedades como hiperadrenocorticismo;9 se tiende a descartar EI cuando las convulsiones comienzan antes del primer año de edad o después de los cinco años, cuando el paciente sufre de crisis focales; si existe aparición súbita de múltiples convulsiones o si hay anormalidades interictales detectadas dentro de la historia, examen clínico–neurológico o pruebas de laboratorio.13
Asimismo, es sumamente importante clasificar el tipo de crisis, ya que la existencia de crisis parciales orienta el diagnóstico hacia otra enfermedad primaria o hacia una epilepsia sintomática relacionada, por lo general, con una enfermedad intracraneal.12 Sin embargo, ciertas epilepsias con localización anatómica definida y caracterizadas por crisis parciales simples con sintomatología compleja (psicomotoras) en las que la principal o única característica clínica es la agresividad, podrían tener un sustrato genético, particularmente en la raza Cocker Spaniel Inglés. Los trastornos de este tipo pueden aparecer a los seis meses.12 Se ha sugerido un origen similar para ciertos problemas observados en perros de la raza Springer Spaniel Inglés, sobre todo machos, que comienzan entre los tres meses y los cuatro años de edad, y que se caracterizan por episodios de mordeduras repentinas, midriasis y agresión hacia personas u objetos. Se le ha denominado síndrome del Springer Spaniel "frenético". Un cuadro similar se ha descrito en el Cobrador Dorado.12
También se han descrito casos con evidencia electroencefalográfica positiva de epilepsia del lóbulo temporal, en la que se han encontrado espigas y los pacientes han respondido favorablemente al feno–barbital, por esta razón se ha diagnosticado epilepsia límbica como causa de síndrome de descontrol episódico.41 En estos casos se han observado signos de disfunción del sistema nervioso autónomo, como dilatación pupilar, salivación, problemas gastrointestinales asociados con incidentes de agresión.41 La persecución de cola en perros de raza Bull Terrier ha sido descrita como un problema convulsivo, que puede estar relacionado con deficiencia de zinc y ser hereditario.42 En los Bull Terrier existen patrones de comportamiento aberrantes que aunque no son únicos de la raza, son prevalentes en ella.30 Entre éstos, destacan la persecución de cola, comportamientos de tipo cazamoscas, agresión, comportamientos parecidos a trance, miedos, hiperactividad, sensibilidad sonora y fotofobia. Se ha encontrado actividad epileptiforme con espigas relacionada con estos comportamientos y también se ha asociado con cambios hormonales y estrés, similar a lo que se describe como epilepsia temporal en humanos.31 Asimismo, algunos individuos al término de las crisis generalizadas presentan automatismos (crisis parciales complejas) que tienen valor localizador de la lesión epileptógena. También es común observar animales que al ser medicados controlan las crisis generalizadas pero comienzan a padecer crisis focales, cambiando el patrón crítico. En todos los casos, a pesar de mostrar focalización de las crisis, se mantiene el diagnóstico de EI.12
En la Figura 3 se presenta un algoritmo con la información que debe ser recabada durante la anamnesis y la posible orientación diagnóstica. Para facilitar el diagnóstico se presentan las pruebas necesarias (esenciales y opcionales) en el Cuadro 3.
Se debe realizar un examen neurológico completo13 que incluya evaluación de conciencia y conducta, locomoción, reacciones posturales, de los reflejos y de los nervios craneales12 para detectar cualquier déficit neurológico persistente.13
La presencia de deficiencias neurológicas asimétricas (marcha circular, hemiparesia, ceguera unilateral, alteraciones sensitivas faciales unilaterales, disminución en la propiocepción consciente en un lado del cuerpo, etc.)12,13 en el periodo interictal, sugiere la aparición de una lesión intracraneana focal, como en el caso de trastornos inflamatorios, vasculares o neoplásicos. Se debe tener cuidado al interpretar el examen neurológico después de la convulsión, ya que déficits generalizados como ataxia, depresión o ceguera pueden ser resultado de disturbios posictales y no necesariamente una enfermedad cerebral subyacente.13 En estos casos puede ser necesario repetir el examen de 24 a 48 horas después para ver si los déficits persisten.3,13
El animal con EI no presenta, en general, ningún tipo de deficiencia neurológica en el periodo interictal;8 en este sentido, cualquier anormalidad en dicho periodo sugiere una alteración adquirida.12
Los exámenes de diagnóstico clínico deben incluir hemograma, bioquímica sanguínea y urianálisis, para detectar fundamentalmente alteraciones de tipo metabólico.12 Alteraciones como insuficiencia renal o hepática, anastomosis portocava, alteraciones en glándulas endocrinas (hipotiroidismo, insulinoma, etc.) pueden causar alteraciones electrolíticas (hipocalcemia, hiperpotasemia), alteraciones en el metabolismo de los carbohidratos (hipoglucemia), de los lípidos (hipercolesterolemia, hiperlipidemia) o acumulación de metabolitos tóxicos (amoniaco, mercaptano, indoles, ácidos grasos de cadena corta, animas biógenas) que se manifiestan clínicamente por crisis cerebrales.12
Si es posible, se puede recurrir al estudio de imágenes por medio de tomografía axial computada (TAC) o resonancia magnética (RM).12 La TAC es útil para descartar hidrocéfalo oculto y la RM es la herramienta diagnóstica de elección para detectar la mayoría de lesiones estructurales de tejidos blandos.3 Las radiografías de cráneo son útiles en caso de defectos óseos evidentes o fracturas de cráneo.3
Como consecuencia de que el diagnóstico confirmatorio de EI es difícil de realizar, la detección del origen de las crisis cerebrales consiste en tratar de identificar cualquier enfermedad primaria, la EI entonces se diagnostica mediante ausencia de signos positivos.12
El análisis de líquido cefalorraquídeo no está indicado, a menos que el animal presente signos de inflamación del SNC, como coriorretinis activa, fiebre y dolor de cuello.4
En el Cuadro 4 se presentan los diagnósticos diferenciales para eventos paroxísticos no epilépticos que pueden ser malinterpretados como convulsiones.3,5,13
Electroencefalograma (EEG)
Es el examen más importante para el diagnóstico de epilepsia en humanos y proporciona evidencia acerca de la naturaleza parcial o generalizada de la convulsión.3 Aunque no es una técnica que se haya generalizado, el EEG constituye una prueba confirmatoria de epilepsia en perros. Recientemente se ha propuesto un sistema de registro electroencefalográfico con 12 electrodos que incorporan electrodos especiales para obtener trazos de la actividad eléctrica de la región temporal, no sólo de la neocorteza sino también de la paleocorteza (lóbulo piriforme y cuerpo amigdalino) y de la arquicorteza (hipocampo).43 Con el EEG se pretende definir y clasificar el tipo de crisis, cuantificar las descargas epileptiformes (y los efectos de los fármacos antiepilépticos) y localizar el foco epileptógeno;12 es útil cuando el veterinario no sabe de manera segura si los eventos son o no convulsivos.13 El EEG posee un alto índice de detección de alteraciones en epilepsias sintomáticas por neoplasias cerebrales, isquemias agudas, accidentes cerebrovasculares y aun alteraciones del desarrollo que provoquen incremento del líquido cefalorraquídeo, aunque los signos clínicos sean leves.12
El EEG de rutina debe ser realizado con una duración mínima de 20 a 30 minutos. Esta corta duración dificulta muchas veces la detección de eventos paroxísticos epileptiformes interictales, pero en humanos, realizando hasta cuatro EEG de rutina, se detectan fenómenos interictales en cerca de 90% de los pacientes. Estos valores son más o menos coincidentes con la experiencia clínica en perros, referida por Pellegrino.12
Inicialmente se pensó que era difícil identificar anormalidades electroencefalográficas específicas y diagnósticas para EI en el perro.34,44 Se dice que 28% de los perros epilépticos tienen registros EEG interictales normales.31,45 Sin embargo, Srenk y Jaggy34 encontraron anormalidades EEG con características de actividad epiléptica caracterizada por patrones transitorios con distribución asimétrica y con gran variación en amplitud y duración, por lo que concluyeron que estos husos en pacientes epilépticos reflejaban descargas neuronales provocadas por la EI. Estos autores adscriben al EEG gran importancia en la verificación de un diagnóstico de EI.
Se pensaba que era necesario evitar el uso de anestesia para realizar EEG en perros epilépticos, pensando que las anormalidades podrían quedar enmascaradas.11 Sin embargo, Jaggy y Bernardini11 encontraron dos patrones en todos los casos en que registraron un EEG interictal bajo anestesia con medetomidina y propofol: un patrón A caracterizado por baja frecuencia y alta amplitud, y un patrón B con alta frecuencia superimpuesta y actividad de baja amplitud, además 86% de los pacientes mostraron descargas paroxísticas caracterizadas por actividad de espigas de alta frecuencia que ocurrió de manera aleatoria de 3% a 5% del registro. Estas descargas paroxísticas nunca se observaron en los perros sanos utilizados como testigos con o sin medicación.11 Estos autores concluyen que tales características EEG eran confirmatorias de EI en perros. Algo importante a destacar en este estudio es que a pesar de que se cree que las anormalidades EEG tienen distribución generalizada en perros con convulsiones tipo gran mal, muchos de los pacientes en este estudio presentaron un patrón EEG focal, por lo que es posible que algunos pacientes comiencen con convulsiones parciales que posteriormente se generalizan.11
Tratamiento
A la fecha no existe cura ni tratamiento preventivo ni tratamiento ideal para la epilepsia, pero es necesario controlar las convulsiones para evitar los cambios plásticos permanentes ya descritos.1 El tratamiento reduce los signos clínicos de la enfermedad, pero no cura la causa.8 Comúnmente el tratamiento consiste en farmacoterapia,4 pero no todos los tratamientos permiten un control absoluto de las convulsiones.4
El objetivo ideal del tratamiento es restaurar una vida normal para el perro y para su propietario mediante un control completo de las convulsiones, para minimizar los efectos adversos.3,13 En ocasiones no es posible la eliminación completa de las crisis convulsivas, pero al menos se debe lograr reducir su frecuencia, severidad y duración al punto que sean aceptables para el dueño,8,13 sin incrementar en demasía los efectos indeseables de los fármacos antiepilépticos, ya que éstos pueden ser factor limitante.3,13 Se dice que la mayoría de los autores consideran que una convulsión aislada cada seis u ocho semanas es aceptable y que el control de las convulsiones es un aumento del 100% en la duración del periodo interictal (50% de disminución en la frecuencia de las convulsiones sin efectos adversos de los fármacos).3
Las terapias farmacológicas que inhiben las convulsiones de manera exitosa están basadas en dos estrategias generales. Una incrementa la función de sinapsis inhibitorias que utilizan GABA como neurotransmisor; otra limita la despolarización neuronal actuando sobre canales de Na dependientes de voltaje con la finalidad de estabilizar las membranas neuronales y disminuir los potenciales de acción asociados con las convulsiones clínicas.1,8
Para los casos en que los animales presentan un "aura" y el dueño la puede identificar, es muy útil focalizar su atención en alguna actividad determinada, como ofreciéndoles comida, mostrándoles su correa de paseo, incitándolos al juego, o cualquier actividad que atraiga con fuerza su atención como forma de evitar la sincronización de la descarga epileptogénica y su posterior generalización, se dice que da excelentes resultados en buen porcentaje de los casos.12 Contrario a lo que se indica en medicina humana, en la que se instaura rápidamente un esquema terapéutico anticonvulsivo a la primera crisis, en perros la decisión de iniciar una terapia farmacológica anticonvulsiva, según Pellegrino12 y Thomas,13 debe basarse en la frecuencia y gravedad de las convulsiones, en las características del EEG interictal, la preocupación del propietario. Algunos autores recomiendan no medicar a un animal que presente crisis epiléptica única u ocasional, convulsiones aisladas separadas por periodos largos o convulsiones provocadas. En contraparte, Knowles3 recomienda, desde un punto de vista práctico y para evaluar la eficacia del tratamiento, que la terapia anticonvulsiva se inicie después de la segunda convulsión aislada, si el intervalo entre convulsiones es menor de seis a ocho semanas. Sin embargo, si se toman en cuenta los fenómenos de kindling y la formación de "focos espejo", se debe considerar la terapia anticonvulsiva después de la primera o segunda convulsión.8 La terapia anticonvulsiva está indicada lo más pronto posible en animales con EI o criptogénica,12 en pacientes con status epilepticus, convulsiones múltiples que ocurran en un periodo corto (24 a 72 horas3) o en el caso de que exista un problema progresivo subyacente responsable de las convulsiones.13 Además, se recomienda el tratamiento oportuno en perros de razas grandes con EI, ya que las convulsiones que presentan suelen ser difíciles de controlar9 y aunque algunos autores mencionan que no hay información acerca del riesgo de recurrencia de convulsiones ni estudios que muestren que el tratamiento temprano tiene efectos favorables en el proceso epileptogénico, o si altera el pronóstico,3,13 hay un estudio que sugiere que los perros tratados de manera oportuna durante el curso de EI tienen, a largo plazo, mejor control de las convulsiones, comparados con perros que presentan muchas convulsiones antes de iniciar el tratamiento.10 Las crisis resultantes de problemas cerebrales estructurales requieren terapia adicional según la causa. Si el origen de la crisis es extracraneano, debe adecuarse el uso de los anticonvulsivos, según el caso, poniendo énfasis en la terapia de la causa primaria de la convulsión.12
La educación del cliente es respecto del conocimiento de sus animales casi tan importante como el diagnóstico, porque el éxito del tratamiento depende más del propietario que de cualquier otra variable.3 El propietario debe enterarse que la EI es un problema de salud crónico y que su curso y pronóstico son difíciles de predecir. Por tanto, un punto clave para el tratamiento consiste en que se explique al propietario que quizá el perro siga sufriendo convulsiones aun con medicación antiepiléptica, además de explicarle las ventajas y desventajas del tratamiento prescrito, la dosis y efectos adversos.3 El propietario debe entender el compromiso económico, emocional y de tiempo que requiere el tratamiento, ya que si no se compromete por completo al tratamiento prescrito, es poco probable que se logren resultados favorables,13 pues aplicar el medicamento irregularmente equivale a no aplicarlo.3 También es importante que sepa que en caso de que se salte una dosis, ésta debe administrarse tan pronto se percate de la omisión y la siguiente dosis se dará en el momento en que le corresponda.13 El propietario debe tener una reserva de medicamento, ya que suspender la administración de anticonvulsivos de manera súbita puede precipitar la aparición de convulsiones severas.13 Para reducir la subjetividad de la evaluación de eficacia, el propietario debe tener un control con el tiempo, fecha y características de cada episodio y de la aparición de efectos adversos, en caso de que ocurran.3,13 Deben programarse seguimientos para medir concentraciones séricas de los fármacos antiepilépticos, hemograma, bioquímica sanguínea, evaluación de función hepática para ajustar la dosis si hay cambio en peso corporal, diarreas que reduzcan la biodisponibilidad; además de que los seguimientos sean útiles para resolver cualquier duda que tenga el propietario del animal.3,13
El clínico debe informar al dueño que la terapia anticonvulsiva probablemente reduzca la frecuencia y gravedad de las convulsiones, pero en 20% a 30% de los casos las crisis no pueden ser controladas en forma adecuada8,12 y los perros pueden morir por complicaciones como consecuencia de las convulsiones recurrentes.27 Puede ser útil mencionar que una situación parecida ocurre en humanos, en los que los fármacos antiepilépticos inhiben convulsiones sólo entre 60% y 70% de los pacientes.1
Idealmente se prefiere utilizar un solo fármaco anitepiléptico para reducir las posibles interacciones farmacológicas y efectos adversos.3,46 Empero, las combinaciones de fármacos antiepilépticos permiten controlar de 10% a 15% más de pacientes.3 Es importante destacar que muchos anticonvulsivos utilizados en humanos no se emplean en animales debido a que tienen muy rápida depuración, a que son potencialmente hepatotóxicos3,46 y a menudo se ha identificado el desarrollo de tolerancia.3 Por ejemplo, además del costo de la gabapentina, su corta vida media de eliminación en perros limita que se realicen estudios más profundos sobre su eficacia anticonvulsiva. No obstante, es posible subsanar la rápida depuración con preparaciones farmacéuticas de liberación sostenida.
Cuando se tiene éxito limitado con un fármaco, se recurre a la combinación de fármacos, pero de cualquier manera no debe abandonarse el tratamiento inicial,12 ya que los fármacos antiepilépticos poseen un efecto antiepileptógeno y neuroprotector que aumenta la resistencia a la apoptosis a la que llevan las crisis cerebrales por diversos mecanismos.12 En otras palabras, el daño que las convulsiones provocan en presencia de un fármaco antiepiléptico será menor si los pacientes se encuentran medicados, esto último evita el deterioro neuronal progresivo.12
Los fármacos anticonvulsivos pueden clasificarse de acuerdo con su mecanismo de acción en tres categorías: a) reforzamiento de procesos inhibitorios que facilitan la acción del ácido gamaaminobutírico (GABA); b) reducción de la transmisión excitatoria; c) modulación de la conducción catiónica de la membrana plasmática, que inhibe la conductancia de sodio e impide la despolarización de la membrana presináptica y la liberación de glutamato.46 En el Cuadro 5 se presentan los principios activos conocidos y su mecanismo de acción.2
Fenobarbital
El fenobarbital es considerado como el fármaco de primera elección en perros.3,47 Los informes clínicos indican que puede calificarse como exitosa la terapia con fenobarbital sólo en 60%–80% de los perros epilépticos si se mantienen las concentraciones séricas óptimas.3,8,13 Según Lord y Podell48 muchos propietarios están dispuestos a mantener a sus perros con terapia con fenobarbital durante periodos prolongados y refieren que los animales todavía tienen buena calidad de vida.
Entre las desventajas del fenobarbital destaca su efecto sedante–hipnótico y el potencial para causar daño hepático.13 El tratamiento debe iniciarse a 2.2 mg/kg bid o tid8 o 2.5 mg/kg bid;3 se menciona que la dosis lenta de inducción en perros es de 2–4 mg/ kg,13,47 pero puede ser necesario incrementar las dosis subsecuentes al pasar algunas semanas o meses debido a la inducción microsomal hepática del citocromo P–450 que favorece la biotransformación del principio activo y reduce las concentraciones séricas por debajo del nivel terapéutico,13 que puede medirse desde la segunda semana.47 El fenobarbital incrementa su propia eliminación hasta 50% durante los primeros tres a seis meses de terapia.47 Debido a la larga vida media del fenobarbital (24–36 horas), el estado estable se alcanza de 10 a 15 días después del inicio de la terapia.8 Por ello, para alcanzar su nivel terapéutico en sangre deben pasar al menos de siete a diez días, por lo que este periodo es necesario para el ajuste de la dosis. En este tiempo, aun sin alcanzar niveles terapéuticos, se pueden observar efectos colaterales como sedación, ataxia, polifagia, poliuria, polidipsia, pero luego del periodo de acumulación, el animal se acostumbra y deja de presentar ataxia y sedación.12 Paradójicamente, pueden presentarse hiperexcitabilidad e inquietud durante las primeras semanas de la terapia.13 La tolerancia a los efectos adversos generalmente se desarrolla en dos semanas.8 Algunos efectos colaterales pueden persistir, en especial polifagia,12,13 poliuria y polidipsia.13 Ocasionalmente se desarrolla hiperactividad paradójica que se resuelve con un incremento en la dosis.8 En algunos pacientes la inducción microsomal hepática puede reducir la vida media a 36 horas o menos, por ello se indica la administración tres veces al día, lo que minimiza las fluctuaciones de las concentraciones terapéuticas séricas.13 Muchos perros requieren y toleran dosis de 11 mg/kg bid.3
Si el animal padece crisis seriadas o con recurrencia frecuente que impida la acumulación del fenobarbital, se puede optar por acumular el fármaco en forma rápida o combinarlo con un anticonvulsivo de acción inmediata; por ejemplo, benzodiacepinas. La acumulación rápida se realiza vía endovenosa con la fórmula: peso x 0.8 x concentración sérica deseada.12
La dosis debe ajustarse con base en el análisis del suero recolectado inmediatamente antes (alrededor de una hora) de la siguiente dosis.12 La concentración sérica recomendada de mantenimiento es de 15 a 45 µg/mL8,12 durante dos meses, cuando se valorará el efecto del fenobarbital.12 Cada animal tiene su nivel óptimo dentro de este rango.8 Una dosis nueva puede calcularse mediante la fórmula: dosis nueva = dosis actual x concentración deseada/concentración media.
La dosis de fenobarbital se puede incrementar paulatinamente hasta 18–20 mg/kg antes de considerar a un individuo refractario al tratamiento,12 aunque otros autores recomiendan no administrar concentraciones mayores a 10 mg/kg bid y argumentan que a esta dosis puede presentarse toxicidad.8 Cuando las concentraciones superan los 45 ug/mL se observa ataxia y sedación.12 Si se inicia la terapia con dosis de 4 mg/kg o mayores, algunos perros pueden presentar depresión, letargo o ataxia durante el primer mes de terapia.47 Estas discrepancias permiten observar que los valores mencionados deben servir como guía únicamente, algunos animales pueden manejarse bien con concentraciones séricas por debajo del rango recomendado y otros pueden sufrir efectos colaterales con concentraciones inferiores al rango mencionado.12 Antes de considerar que el tratamiento con fenobarbital falló, debido a los efectos sedantes o al control inadecuado de las convulsiones, se recomienda ajustar la hora a la que se administra el fenobarbital; por ejemplo, si 75% de las convulsiones ocurren entre medianoche y 6 am, puede darse una dosis más alta en la noche; además, si el paciente está muy sedado con una dosis administrada bid, se administra la misma dosis total diaria distribuida a intervalos de ocho horas.3
El uso prolongado de fenobarbital puede propiciar incremento moderado en las concentraciones séricas de fosfatasa alcalina (FA),8,13 alanito–amino–transferasa (ALT) y glutamato deshidrogenado,8 por lo que se aconseja el seguimiento de estas variables,8 así como de hemograma completo, bioquímica sanguínea y determinación del nivel sérico de fenobarbital.12 Al parecer no es común la hepatotoxicidad severa pero sí la elevación de las enzimas hepáticas, y es más probable que esto ocurra con niveles séricos superiores a 35 µg/mL.13 En contraparte, si hay hepatotoxicidad con aumento de las concentraciones séricas, se manifiesta con anorexia, sedación, ataxia, ictericia y ascitis,13 aumento de ALT mayor a la FA y elevaciones en ácidos biliares.13,47 También puede observarse disminución de albúmina, urea y colesterol sérico,47 neutropenia, anemia y trombocitopenia reversibles en pacientes sensibles a los barbituratos,13 lo que ocurre generalmente durante los primeros cinco meses de terapia con fenobarbital.47
Cuando se sospeche de hepatotoxicidad debe utilizarse un fármaco alternativo que no se metabolice en hígado.12 Con este propósito se aconseja disminuir la dosis de fenobarbital e iniciar con bromuro.8 De hecho, se recomienda que cuando las concentraciones séricas de fenobarbital de 30 a 35 ug/mL no logren controlar las crisis epilépticas, se considere la adición de un segundo fármaco, como el bromuro. Es importante recordar que en animales tratados con fenobarbital, la concentración de otros fármacos metabolizados en hígado puede reducirse debido a que hay mayor excreción biliar y mayor actividad microsomal hepática.8 La hepatotoxicidad detectada a tiempo es reversible, pero puede ser fatal si se persiste en su uso.13 Por ello, es razonable añadir el bromuro antes de llegar al límite de concentraciones terapéuticas.47
Los ajustes de la dosis deben ser graduales. El retiro súbito de cualquier fármaco antiepiléptico puede precipitar el status epilepticus, aunque se esté utilizando otro fármaco.3
La terapia con fenobarbital combinada con fenitoína o primidona puede incrementar peligrosamente el riesgo de hepatotoxicidad.13
Bromuro de potasio
El bromuro de potasio constituye la primera alternativa en el tratamiento de perros con epilepsia refractaria a la terapia con fenobarbital.12 Se ha observado una mejoría dramática en el control de las convulsiones en perros resistentes al fenobarbital con el uso de la combinación de fenobarbital/bromuro de potasio, incluso al grado de suprimirlas con terapias prolongadas.3 En particular, se recomienda esta combinación en perros de raza grande con convulsiones en racimo3 y convulsiones de tipo gran mal. Aproximadamente la mitad de los perros refractarios al fenobarbital se benefician con la adición de bromuro de potasio,8,47 se dice que hay mejora hasta de 70% en el control de las convulsiones.13 Esto último puede permitir disminución en la dosis de fenobarbital.13,47 Incluso, hay autores que indican que el bromuro es útil como monoterapia, de tal suerte que algunos clínicos lo consideran el fármaco de elección para perros con EI.13,47
El bromuro de potasio, por su estructura química sencilla, no sufre metabolismo hepático ni se une a proteínas plasmáticas.8,12 Es el anticonvulsivo de elección para perros con EI con enfermedad hepática concurrente.8,13 Su ruta principal de eliminación es la filtración glomerular,12,13 y sufre reabsorción extensa en los túbulos renales en competencia con el cloro, por lo que su nivel en sangre está en relación directa con la ingesta de sal. Cuando ésta se incrementa, aumenta también la concentración sérica de bromuro.12 Este último es relativamente seguro y la mayoría de los efectos adversos son reversibles con disminución en la dosis,13,47 además de que está contraindicado sólo en perros con insuficiencia renal.47
El bromuro se administra principalmente como bromuro de potasio, pero también hay bromuro de sodio, en cápsulas o en solución; esta última facilita ajustes de la dosis. No hay diferencia entre las sales de sodio y potasio en cuanto a su eficacia, pero se prefieren las sales de potasio cuando se requiere el control de la ingesta de sodio como en casos de insuficiencia cardiaca congestiva. En contraparte, se usa bromuro de sodio cuando debe restringirse el consumo de potasio, como en casos de hiperadrenocorticismo.13
El rango terapéutico del bromuro de potasio sérico es entre 70 y 200 mg/dL (0.7 a 2 µg/mL),12 pero muchos perros toleran dosis de 2.5 µg/mL.3
Según algunos autores, la dosis inicial para perros es de 20 mg/kg bid,47 aunque otros recomiendan 100 mg/kg bid durante dos días, antes de establecer la dosis de mantenimiento.8 Se recomienda administrar con la comida para reducir la náusea.47 La dosis oral de mantenimiento recomendada es de 20–30 mg/kg sid13 o de 20–40 mg/kg sid o bid para alcanzar concentraciones séricas de 2 a 5 mg/mL.13 Algunos perros requieren y toleran dosis de mantenimiento de 70 mg/kg/día.3 Una peculiaridad en el uso del bromuro de potasio o sodio es que no alcanza concentraciones séricas que lleguen al estado estable durante varios meses debido a su larga vida media, por lo que es posible que no se logren reducciones marcadas en la intensidad o duración de las convulsiones durante varios meses.3 Esto último hace que muchos propietarios retiren a sus animales del tratamiento.
Las dosis de carga están ligadas a efectos indeseables, por lo que es preferible incrementar paulatinamente la dosis. Sólo se usan dosis de carga en perros con convulsiones frecuentes y severas o cuando se cambia rápidamente de fenobarbital a bromuro a causa de la toxicidad.47 Para administrar las dosis de carga se administran 400 a 600 mg/kg de bromuro de potasio en cuatro dosis en un periodo de 24 horas47 o en otro de tres a cinco días,3 mezcladas con el alimento para reducir náusea y vómito. Al día siguiente se administra la dosis regular de mantenimiento.47 La dosis de carga se relaciona con sedación profunda y vómito severo con complicaciones secundarias, como neumonía por aspiración. Algunos perros presentan enfermedad inflamatoria del intestino y signos gastrointestinales.3
Si se utiliza bromuro de sodio la dosis debe disminuirse 15% con respecto a la dosis de bromuro de potasio.13 Se ha informado que algunos perros requieren y toleran niveles hasta de 4 mg/mL de bromuro utilizado como único fármaco anticonvulsivo; sin embargo, la dosis máxima está establecida por la respuesta clínica del paciente.13
Cuando se utiliza en politerapia junto con el fenobarbital se recomienda alcanzar concentraciones séricas de 25 µg/mL y de 1–1.5 a 2 mg/mL para el fenobarbital y el bromuro de potasio, respectivamente.12,13 Otros autores mencionan que la dosis de fenobarbital puede permanecer igual, a menos que los niveles séricos sean mayores a 40 µg/mL; sin embargo, también se aconseja que la dosis debe reducirse 50% al añadir bromuro de potasio8 cuando las concentraciones séricas de bromuro sean de al menos 1.5 mg/mL.13 En este caso, la disminución debe ocurrir gradualmente en un lapso de tres semanas.8 En los perros que todavía requieren fenobarbital para el control adecuado de las convulsiones, las concentraciones séricas de fenobarbital pueden estar por debajo del rango terapéutico.47 El fenobarbital puede ser descontinuado por completo en cerca de 20% de los perros.13 Si la meta es reducir o descontinuar el uso del fenobarbital, se debe esperar a que las concentraciones de bromuro lleguen al estado estable (aproximadamente cuatro meses) y después reducir el fenobarbital de 10% a 25% cada cuatro a seis semanas.47
Según Dowling47 la dosis nueva de fenobarbital y de bromuro de potasio se puede ajustar de acuerdo con la fórmula: dosis nueva = (dosis actual x concentración deseada)/concentración media. Esta fórmula también puede utilizarse para ajustar la dosis de bromuro de potasio.47
El efecto adverso más común (25% de los casos) con el bromuro es la polifagia, ésta puede ser tan dramática que requiera una dieta baja en contenido calórico.47 La toxicidad por bromuro de potasio se manifiesta con irritabilidad, búsqueda de atención, deambulación, sedación, anorexia, constipación,8 poliuria y polidipsia, ataxia,8,13 debilidad o espasticidad de miembros, incoordinación,47 en casos raros, estupor, depresión, anisocoria; en casos extremos, dolor muscular.8 La debilidad y espasticidad musculares se asemejan a los signos asociados con enfermedades ortopédicas,3,13 como osteoartritis.47 Si no se reduce la dosis, los signos progresan a cuadriplegia y apariencia de enfermedad generalizada de unidad motora con reflejos normales, semejando miastenia gravis.47 Puede presentarse náusea quizá por la irritación gástrica directa causada por las sales hipertónicas de bromuro, ello se previene administrando el fármaco con comida, dividiendo la dosis en dos o más, o utilizando las sales de sodio en lugar de las de potasio.13 Estos efectos adversos se resuelven alrededor de una semana después de la disminución de la dosis.46 Según Knowles,3 la sedación y debilidad de miembros pélvicos se vuelven problemas significativos en terapias de combinación de bromuro y fenobarbital; cuando las concentraciones de fenobarbital son mayores de 35 ug/mL y las concentraciones de bromuro son de 2.5 mg/mL, la debilidad puede mejorar disminuyendo las dosis de fenobarbital.
Tanto al fenobarbital como al bromuro de potasio se les ha asociado con el desarrollo de pancreatitis; pero aún no se establece una correspondencia clara.8
Existe variabilidad en las concentraciones terapéuticas y tóxicas para el bromuro, por lo que se debe instruir al propietario del animal para que esté atento a la aparición de signos tempranos de toxicidad. Cuando se presenten signos de toxicidad severa, puede tratarse al paciente con solución de cloruro de sodio a 0.9% iv a dosis de mantenimiento durante 12 horas.47
Las dietas con alto contenido de cloruro, como algunas calculolíticas, aumentan la eliminación del bromuro, y con ello una pérdida en el control de las convulsiones.8,13,49 Dowling47 menciona que los perros que consumen dietas altas en sales pueden requerir dosis de 50 a 80 mg/kg para mantener concentraciones séricas adecuadas.
La insuficiencia renal disminuye la eliminación del bromuro, por lo que en perros con isostenuria persistente o azotemia, la dosis inicial debe dividirse a la mitad y las concentraciones séricas se vigilarán con atención.13
Primidona
Es un análogo del fenobarbital, cuyo metabolito primario es el fenobarbital. Se estima que más de 85% del efecto anticonvulsivo de la primidona se debe al metabolito, por ello su uso no es alternativa terapéutica; además, es más hepatotóxico.8,13 Sin embargo, se pondera que algunos perros se benefician más con la primidona o sus metabolitos (fenobarbital y feniletilmolonamida) que con el fenobarbital solo. Con el fin de cambiar de fenobarbital a primidona, se deben administrar 250 mg de primidona por cada 65 mg de fenobarbital, para mantener concentraciones séricas similares al fenobarbital.3
Benzodiacepinas
Las benzodiacepinas, como el diacepam, loracepam, clonazepam y clorazepato, son potentes anticonvulsivos, pero tienen muchas limitantes para su uso como terapia de mantenimiento. Las benzodiacepinas son eficaces para el tratamiento de emergencia en casos de status epilepticus o en convulsiones seriadas; también cuando hay probabilidad de que ocurran convulsiones, como en el caso de las precipitadas por estrés o privación de sueño. Tienen un periodo de acción corto, por lo que se requiere administración frecuente para mantener niveles séricos adecuados. Asimismo, se desarrolla tolerancia (incluyendo tolerancia cruzada) a su actividad anticonvulsiva. Así, su uso crónico provoca que el tratamiento de convulsiones con diacepam en casos de emergencia sea menos eficaz.13
Se usa diacepam iv en casos de status epilepticus o convulsiones en serie como tratamiento de primera elección. En algunos casos será necesario utilizar la administración intrarrectal, pero aumentando la dosis en 25%–30%.12 La administración vía rectal logra picos séricos más elevados en comparación con la administración oral o intramuscular. La dosis por esta vía va de 0.5–2 mg/kg en perros con terapia crónica con fenobarbital, ya que éste aumenta la eliminación de benzodiacepinas. Esta vía se utiliza cuando el perro presenta convulsión generalizada inicial o cuando se presentan dos o tres convulsiones generalizadas 24 horas después de la convulsión inicial.47
En los perros con predisposición a convulsiones en racimo, el diacepam vía rectal disminuye significativamente el número de convulsiones en racimo en un periodo de 24 horas, así como el número total de eventos convulsivos.47 Puede repetirse la administración hasta tres veces en 24 horas. La cola del perro debe ser mantenida contra el ano por casi tres minutos después de la administración para evitar expulsión del fármaco.47 En caso de que el perro siga convulsionando o presente depresión severa, dificultad para respirar o sangre alrededor de la región anal, será necesario instaurar un tratamiento de urgencia.13,47
El clorazepato a dosis de 0.5 a 1 mg/kg tid contribuye al control de EI añadido a la terapia de fenobarbital. Se ha observado que las cápsulas de liberación sostenida–prolongada no tienen ventaja en comparación con las de liberación regular en perros, además los niveles séricos disminuyen con el tiempo, por ello se requiere incrementar la dosis. El clorazepato puede aumentar las concentraciones de fenobarbital, ello puede inducir la aparición de efectos adversos, por lo que se recomienda vigilar las concentraciones séricas de ambos a las dos y a las cuatro semanas.47
Felbamato
Es útil en el tratamiento para perros con convulsiones refractarias a bromuro y al fenobarbital. Su vida media de eliminación en perros es de cinco a seis horas, por lo que es necesario administrarlo cuando menos tres veces al día.50 Su costo es elevado y se requieren dosis hasta de 70 mg/kg tid en perros. Algunos de éstos han desarrollado toxicidad hepática con el felbamato administrado junto con otros fármacos hepatotóxicos, como el fenobarbital, por lo que se debe evaluar la función hepática periódicamente.13 Otros efectos adversos incluyen anormalidades hematológicas.50
Gabapentina
Según Thomas,13 este fármaco es útil en pacientes con convulsiones focales y refractarias a otros fármacos. Su vida media de eliminación es de tres a cuatro horas.50 Los efectos adversos son raros pero su costo es elevado.13 Se ha utilizado conjuntamente con fenobarbital y bromuro de potasio; se ha observado que esta combinación incrementa el periodo interictal y disminuye el periodo de recuperación en algunos pacientes epilépticos. Los efectos adversos de esta combinación incluyeron sedación y ataxia en miembros pélvicos.51
Levetiracetam
El levetiracetam tiene vida media de cuatro a seis horas en perros. Su metabolismo es independiente del citocromo P450 y tiene excreción renal. En ensayos en perros refractarios al tratamiento con fenobarbital y bromuro de potasio, al adicionar levetiracetam la frecuencia de convulsiones disminuyó en 54%, pero aún presentaban un promedio de seis convulsiones cada tres meses.
Zonisamida
Se estima que la vida media de eliminación de este fármaco es de 15 horas. En un estudio con perros con epilepsia refractaria se observó reducción de 81.3% en la frecuencia de las convulsiones, aunque otros perros del mismo estudio sufrieron aumento en la frecuencia de éstas. Los efectos adversos incluyeron sedación, ataxia y vómito.
Otros
La fenitoína, difenilhidantoína, el ácido valproico, la carbamazepina y las benzodiacepinas tienen efecto anticonvulsivo corto en el perro, como consecuencia de lo anterior se les considera poco indicados para el control de EI en perros.52 Algo similar se ha descrito para la carbamazepina por su corta vida media y dificultad para alcanzar niveles séricos efectivos.3 Otros anticonvulsivos que se han probado en perros incluyen gammavinil–GABA (GV–GABA), que es inhibidor de la enzima GABA transaminasa, por lo que bloquea la biotransformación del GABA. Así, a diferencia de benzodiacepinas y barbitúricos, el GV–GABA permite los efectos del GABA endógeno y como es un bloqueador irreversible del metabolismo del GABA, su tiempo de acción podría ser mayor que el tiempo que permanece en tejidos. Aún no se ha evaluado meticulosamente su eficacia en perros. Entre los efectos adversos que han sido detectados para GV–GABA se distingue la microvacuolización reversible de la mielina, anemia hemolítica cuando se administra en combinación con fenobarbital, y también provoca desorientación.53
En el Cuadro 6 se presentan los datos clínicos relevantes de los principales fármacos anticonvulsivos en perros.13,54,55
Las concentraciones séricas de los fármacos anticonvulsivos no siempre muestran relación predecible con su dosificación. Se recomienda determinar su concentración cada seis a 12 meses y en situaciones clínicamente relevantes.3 Lo más importante es que estos valores sean individualizados en cada caso, los cambios en la dosis deben estar basados tanto en observaciones clínicas como en concentraciones séricas.3 La medición debe realizarse en la hora del día en la que se cree que la concentración es más baja a fin de interpretar el intervalo de dosificación y el periodo en que la protección es más baja en pacientes con falla renal o hepática y para correlacionar concentraciones séricas con signos clínicos de toxicidad.3
En el Cuadro 7 se resume la información sobre los efectos adversos de los fármacos antiepilépticos en perros.8,13,25–27,29,47,49,54–67
Vigilancia de la terapia
En la mayoría de los casos, los fármacos anticonvulsivos deben ser administrados varias semanas antes de obtener los efectos anticonvulsivos máximos. Es difícil evaluar el control de las convulsiones en perros que las presentan con intervalos muy amplios.13 Una de las razones por las que puede haber un mal control es cuando no se maximiza la dosis antes de descartar un fármaco en particular.13
La vigilancia de las concentraciones séricas puede ayudar a determinar la dosis óptima. Se recomienda realizar este procedimiento cuando existan cambios en la dosificación, cuando las convulsiones no se controlen adecuadamente para determinar si es necesario ajustar la dosis antes de cambiar de fármaco o añadir otro al protocolo terapéutico, así como cuando hay signos de toxicidad relacionados con la dosis, y cada seis a 12 meses para verificar que los cambios en la farmacocinética no ocasionen variación en las concentraciones séricas óptimas.13
En la mayoría de los casos es suficiente una muestra recolectada justo antes de que se administre la dosis. Si el intervalo de dosificación es mayor a 33% de la vida media del fármaco, una muestra a nivel pico (cuatro a cinco horas después de la administración) y otra de la concentración inferior en el intervalo de dosificación ayuda a documentar la proximidad a las concentraciones tóxica y subterapéutica, así como a estimar la vida media para que se modifique el intervalo de dosificación, si fuera necesario.13 Es mejor que las muestras se tomen en ayunas, ya que la lipemia puede interferir al realizar las mediciones de la concentración del fármaco. No deben usarse tubos de separación de suero, ya que el silicón puede unirse al fármaco y alterar los resultados de las mediciones.13
Interrupción de la terapia
La decisión de cuándo debe detenerse la administración de un fármaco antiepiléptico es tan importante como la de comenzarla.3 Datos provenientes de medicina humana indican que si un paciente tratado se mantiene libre de crisis durante un periodo prolongado (tres a cinco años), con EEG periódicos dentro de parámetros razonablemente normales, se puede disminuir la dosis del medicamento anticonvulsivo. Se dice que algunos animales con EI o criptogénica pueden lograr este objetivo,12 y que los animales con EI se consideran en remisión si ha transcurrido un periodo de entre uno a dos años sin convulsiones.3 Puede intentarse el retiro del tratamiento en perros que no han presentado convulsiones en periodos de uno a dos años.13 En estos casos la dosis se disminuye gradualmente durante un periodo de seis meses a un año.3 Sin embargo, lo más frecuente es que se requiera medicación diaria por el resto de vida del paciente.3,12 No existe información acerca de los riesgos de recurrencia en perros, por lo que es imposible predecir en qué pacientes puede ser retirada la terapia con éxito.3,12 Es importante señalar que la suspensión de la medicación anticonvulsiva puede resultar en convulsiones o status epilepticus. Si existiera recurrencia de las convulsiones durante el periodo de retiro, debe reiniciarse el tratamiento.13
Epilepsia refractaria
Un individuo epiléptico refractario es aquel en el que persisten las crisis a pesar de que posea concentraciones de los fármacos antiepilépticos en plasma dentro del rango terapéutico. También se define como epilepsia refractaria aquella en la que se ejerce un control insatisfactorio de las crisis a pesar de su tratamiento adecuado, con las máximas dosis toleradas y efectos adversos aceptables.12 En algunos casos, las convulsiones pueden ser controladas, pero el precio es una sedación excesiva.3 Generalmente a los animales con epilepsia refractaria se les aplica la eutanasia.9
Aproximadamente 25% de los perros con epilepsia nunca pueden ser controlados con fármacos anticonvulsivos.13,46 Muchos de éstos presentan convulsiones en racimo o status epilepticus que requieren tratamiento de urgencia.47 En caso de pacientes con epilepsia refractaria, deben buscarse errores en el diagnóstico (como falla al reconocer problemas paroxísticos no epilépticos o causas subyacentes que puedan provocar convulsiones) o manejo (como uso de fármacos poco efectivos, dosis incorrectas, intervalos de dosificación muy largos, falla en la administración por parte de los propietarios) a los cuales pudiera atribuírseles la falla del tratamiento.13 Los factores en el diagnóstico que afectan el control de las epilepsias incluyen errores en el reconocimiento de la crisis,12,13 así como en la clasificación del tipo de epilepsia, presencia de enfermedades cerebrales progresivas o de factores precipitantes.12 En cuanto a los factores en el tratamiento que afectan el control de las crisis, son la elección incorrecta del fármaco,12,13 empleo de dosis inadecuadas, tratamientos que no son suficientemente largos,12,13 asociación inapropiada de fármacos, interacciones farmacocinéticas, coexistencia de otras enfermedades, carencia de información por parte del propietario, entre otros aspectos.12
En muchos casos puede encontrarse dosis inadecuadas, intervalos de dosificación incorrectos o fallas en la obtención de niveles séricos elevados.3 La dosificación inadecuada por parte del propietario puede descartarse fácilmente midiendo las concentraciones inferiores en el intervalo de dosificación. También debe considerarse la farmacocinética de tratamiento, así como todos los otros fármacos que toma el paciente; por ejemplo, los corticosteroides, que al causar inducción de enzimas hepáticas pueden disminuir el efecto de los anticonvulsivos. Asimismo, la actividad proconvulsiva de los estrógenos es ignorada cuando se revisa la historia médica de un paciente, los estrógenos pueden exacerbar las convulsione, por lo que deben evitarse.3
Entre 20% y 40% de los perros epilépticos son refractarios al tratamiento con fenobarbital y aproximadamente 40% de ellos también son resistentes al bromuro de potasio.12,68 Como el fenobarbital potencia la acción inhibitoria mediada por GABA, aumentando la frecuencia de apertura de los canales de Cl –, la condición de refractariedad al fenobarbital podría estar relacionada con las concentraciones cerebrales de GABA;12 es posible que los animales con baja concentración inicial de GABA tengan mala respuesta a la terapia con fenobarbital.69
Otros tratamientos
Según Thomas,13 mientras 25% de los pacientes con epilepsia no respondan a medicación anticonvulsiva, todos los esfuerzos para ayudarlos están justificados.
Las alternativas al tratamiento farmacológico son pocas, pero muchas están en estudio.9 Una de ellas es la división longitudinal quirúrgica del cuerpo calloso, que ha sido realizada con éxito en humanos, en teoría disminuye la posibilidad de que haya "focos espejo" y de que ocurra kindling, que comúnmente aumenta la frecuencia, severidad y duración de las convulsiones.9 Esta técnica ha sido descrita y utilizada en algunos perros, pero los resultados en el largo plazo no han sido descritos.13 Sin embargo, las posibles complicaciones son muchas y hay poca factibilidad de realizar este procedimiento en perros.9 En humanos también se realiza la resección cortical focal utilizando electroencefalografía y otras técnicas para identificar el foco epiléptico, pero en perros la habilidad para localizar el foco es limitada, por lo que la técnica no ha sido muy investigada.13
También se ha recurrido a la estimulación del nervio vago utilizando un generador de pulso similar a un marcapasos.13 El mecanismo anticonvulsivo no se ha comprendido del todo, pero se cree que la estimulación de fibras aferentes del vago probablemente modifica la actividad eléctrica cerebral y disminuye la susceptibilidad a convulsiones. Se ha observado que esta técnica es efectiva para inhibir en perros convulsiones inducidas experimentalmente.13
La compresión ocular se ha utilizado en algunos casos de manera efectiva para tratamiento de convulsiones en perros,13,70 y quizá el mecanismo de acción de este procedimiento esté relacionado con el estímulo vagal. Uno de los mecanismos para el efecto antiepiléptico de la estimulación vagal en ratas que se ha descubierto es la desincronización de los patrones electroencefalográficos y, por tanto, desincronización de neuronas de la corteza cerebral.70 En este caso se comprime manualmente alguno de los globos oculares aplicando presión digital al párpado superior durante 10 a 60 segundos, y repitiendo este procedimiento a intervalos de cinco minutos durante periodos variables, dependiendo del control de las convulsiones.13,70 Tal procedimiento tiene diversas tasas de éxito, pero no de manera consistente, aun con el mismo perro. Al parecer previene el inicio de las convulsiones, en algunos casos las detiene o las acorta, y aunque algunos perros continúan convulsionando cuando se detiene la compresión ocular, el hecho de disminuir temporalmente la actividad anticonvulsiva facilita la administración de fármacos o el transporte de los pacientes al hospital.70
Otro tipo de tratamientos que deben considerarse,3,8 y que se han utilizado para el tratamiento de epilepsia es la acupuntura,4,13 que es un método no farmacológico sin efectos adversos o riesgos serios para el paciente, si es aplicado por un acupunturista veterinario entrenado.4
Una de las formas de estimular los puntos de acupuntura consiste en introducir algún material en el punto de acupuntura y que se mantenga ahí durante breve periodo. Este material consiste en agujas, balines, hilos metálicos, suturas o algún otro. Dicho método causa activación prolongada del punto de acupuntura.4
Hay informes en que se menciona la acupuntura como método de tratamiento para la epilepsia.4 La acupuntura tradicional para enfermedades convulsivas en perros involucra utilizar agujas en puntos de acupuntura situados en los meridianos de vesícula biliar (GB), vejiga urinaria (BL), bazo–páncreas (SP), hígado (LIV), vaso concepción (CV), vaso gobernador (GV)71 y puntos extraordinarios, incluyendo puntos auriculares o implantación de balines de oro en puntos de acupuntura.4 En dichos informes se describió éxito parcial o total para el tratamiento de las convulsiones.4 Se ha descrito que la acupuntura ha sido efectiva para el tratamiento de EI temprana, además de aumentar la habilidad de la carbamecepina para controlar este padecimiento,72 aunque en ese mismo estudio la acupuntura no fue efectiva para el tratamiento de convulsiones inducidas como secuelas de infección por virus de distemper canino.53
Aunque todavía no se conocen por completo los mecanismos de acción de la acupuntura, hay estudios que han demostrado la cadena neuronal que forma la conexión somato–visceral entre un punto de acupuntura y el órgano blanco.73
En cuanto al manejo dietético, en humanos se ha reconocido el efecto benéfico del ayuno y se ha sugerido que la cetoacidosis resultante de aporte calórico disminuido produce efectos anticonvulsivos.13 Las dietas cetogénicas se utilizan principalmente en niños con epilepsia refractaria; sin embargo, éstas son poco degustables y requieren un cálculo preciso de los nutrimentos y vigilancia constante. Aún se desconoce si las dietas cetogénicas son útiles en perros con epilepsia.13 Es importante considerar que los perros son más resistentes a la cetosis inducida por ayuno; además, es posible que las dietas que producen cetosis en humanos no lo hagan en perros. Aún más, los posibles efectos adversos, como inducción de pancreatitis, limitan su uso y no se recomiendan para perros mientras no existan evaluaciones de su seguridad y eficacia.13
Asimismo, la alergia alimentaria ha sido implicada en el desarrollo de convulsiones en humanos y existen informes de perros cuyas convulsiones han cesado con dietas restrictivas, pero se carece de detalles de pruebas diagnósticas y de seguimiento. A pesar de que hay poca evidencia que sugiera que la alergia alimentaria es causa de convulsiones en perros, Thomas13 sugiere la introducción de una dieta hipoalergénica como opción razonable en pacientes con epilepsia refractaria.
Conclusiones
La EI es un padecimiento al que el clínico de pequeñas especies seguramente se enfrentará y cuyo diagnóstico, tratamiento y manejo representan retos importantes. Es esencial, que se encuentre bien informado acerca de la manera de hacer un diagnóstico y de las opciones terapéuticas disponibles, considerando ventajas, efectos adversos y limitaciones. Por ejemplo, se considera éxito en el tratamiento y manejo de la EI al lograr reducción de al menos 50% de la frecuencia de las convulsiones, pero es poco lo que se ha cuantificado respecto de la intensidad de la fase ictal, punto clave para mejorar la calidad de vida de un paciente. En contraparte con lo que sucede en el tratamiento farmacológico de la epilepsia en el humano, las opciones farmacológicas para la EI en perros son muy reducidas; sólo se cuenta con datos farmacológicos y clínicos abundantes en el caso del fenobarbital y del bromuro de potasio. No obstante, el diseño farmacéutico de liberación sostenida de muchos otros principios activos (ácido valproico, gabapentina, carbamacepina, felbamato, entre otros), podría modificar esta circunstancia y contribuir a mejorar el pronóstico de la EI. Contrario a lo que sucede en epilepsia humana, la posibilidad de encontrar pacientes con EI refractaria a fármacos anticonvulsivos es más elevada. Además, las opciones mencionadas como primeras opciones para el control de EI en perros tienen efectos adversos e interacciones farmacológicas negativas bien definidas, ello obliga al clínico a elegir entre dos males. Finalmente, la intención de este trabajo es proporcionar una visión integral de dicha patología y dar opciones terapéuticas en cuanto a eficacia y seguridad.
Agradecimientos
Este trabajo fue realizado con apoyo del proyecto PAPIIT 222906–3 de la Universidad Nacional Autónoma de México.
Referencias
1. Purves D, Augustine G, Fitzpatrick D, Hall W, LaMantia A, McNamara J et al. Neuroscience. 3rd ed. Massachusets: Sinauer Associates Inc., 2004. [ Links ]
2. López–Hernández E, Bravo J, Solís H. Epilepsia y antiepilépticos de primera y segunda generación. Aspectos básicos útiles en la práctica clínica. Rev Fac Med UNAM 2005, 48:201–209. [ Links ]
3. Knowles K. Idiopathic epilepsy. Clin Tech Small Anim Pract 1998; 13:144–151. [ Links ]
4. Janssens LA. Ear acupuncture for treatment of epilepsy in the dog. Prog Vet Neurol 1989; 1:89–94. [ Links ]
5. Bagley R. Fundamentals of Veterinary Clinical Neurology. Iowa: Blackwell Publishing, 2005. [ Links ]
6. Holliday T, Cunningham J, Gutnick M. Comaparative clinical and electroencephalographic studies of canine epilepsy. Epilepsia 1970; 11:281–292. [ Links ]
7. Muñana K, Vitek S, Tarver W, Saito M, Skeen T, Sharp N et al. Use of vagal nerve stimulation as a treatment for refractory epilepsy in dogs. J Am Vet Med Assoc 2002; 221:977–983. [ Links ]
8. Bollinger–Schmitz K, Kline K. An overview of canine idiopathic epilepsy for the small animal practitioner. Iowa:Iowa State Univers Vet 2000; 62:23–29. [ Links ]
9. Chang Y, Mellor DJ, Anderson TJ. Idiopathic epilepsy in dogs: owner's perspectives on management with phenobarbitone and/or potassium bromide. J Small Anim Pract 2006, 47:574–581. [ Links ]
10. Heynold Y, Faissler D, Steffer F, Jaggy A. Clinical, epidemiological, and treatment results of idiopathic epilepsy in 54 labrador retrievers: a long term study. J Small Anim Pract 1997; 38:7–14. [ Links ]
11. Jaggy A, Bernardini M. Idiopathic epilepsy in 125 dogs: a long–term study. Clinical and electroencephalographic findings. J Small Anim Pract 1998; 39:23–29. [ Links ]
12. Pellegrino F. Epilepsia y síndromes epilépticos. En: Pellegrino F, Suraniti A, Garibaldi L, editores. El Libro de Neurología para la Práctica Clínica. Argentina: Intermédica, 2003:255–280. [ Links ]
13. Thomas WB. Idiopathic epilepsy in dogs. Vet Clin North Am Small Anim Pract 2000; 30:183–206. [ Links ]
14. March PA. Seizures: Classification, etiologies, and pathophysiology. Clin Tech Small Anim Pract 1998; 13:119–131. [ Links ]
15. Berendt M, Gram L. Epilepsy and seizure classification in 63 dogs: a reappraisal of veterinary epilepsy terminology. J Vet Intern Med 1999; 13:14–20. [ Links ]
16. López–Hernández E, Bravo J, Solís H. Epilepsia y antiepilépticos de primera y segunda generación. Aspectos básicos útiles en la práctica clínica. Rev Fac Med UNAM 2005; 48:201–209. [ Links ]
17. Solís H, Bravo J, Galindo–Morales J. Modificación de la inhibición recurrente por la estimulación eléctrica iterativa o por aplicación local de fármacos convulsionantes al hipocampo. En: Otero–Siliceo E, editor. Epilepsia Experimental. México (DF): Academia Mexicana de Neurología, 1991:211–223. [ Links ]
18. Palma E, Spinelli G, Torchia G, Martinez–Torres A, Ragozzino D, Miledi R et al. Abnormal GABAa receptors from the human epileptic hippocampal subiculum microtransplanted to Xenopus oocytes. Proc Natl Acad Sci 2005; 102:2514–2518. [ Links ]
19. Palma E, Amici M, Sobrero F, Spinelli G, Di Angelantonio S, Ragozzino D et al. Anomolous levels of Cl– transporters in the hippocampal subiculum from temporal lobe epilepsy patients make GABA excitatory. Proc Natl Acad Sci 2006; 103:8465–8468. [ Links ]
20. Morita T, Takahashi M, Takeuchi T, Hikasa Y, Ikeda S, Sawasa M et al. Changes in extracellular neurotransmitters in the cerebrum of familial idiopathic epileptic Shetland Sheepdogs using an intracerebral microdyalisis technique and immunohisto chemical study for glutamate metabolis. J Vet Med Sci 2005; 67:1119–1126. [ Links ]
21. Solís H, Bravo J, Galindo–Morales J, López E. Participación de la inhibición recurrente en algunos modelos de convulsiones generalizadas. En: Feria A, Martínez D, Rubio F, editores. Epilepsia. Aspectos neurobiológicos, médicos y sociales. México (DF): Instituto Nacional de Neurología y Neurocirugía. Departamento de Publicaciones Científicas, 1997:66–80. [ Links ]
22. Palmer AC. Pathological changes in the brain associated with fits in dogs. Vet Rec 1972; 90:167–172. [ Links ]
23. Ellenberger C, Mevissen M, Doherr M, Scholtysik G, Jaggy A. Inhibitory and excitatory neurotransmitters in the cerebrospinal fluid of epileptic dogs. Am J Vet Res 2004; 65:1108–1113 [ Links ]
24. Chen J, Naylor D, Wasterlain C. Advances in pathophysiology of status epilepticus. Acta Neurol Scand Suppl 2007; 186:7–15. [ Links ]
25. Center S. Seizures in the dog and cat. Kal Kan Forum 1986; 5:11–18. [ Links ]
26. Schwartz–Porsche D. Seizures. In:. Braund K.G, editor. Clinical syndrome in veterinary neurolgy. 2nd ed. St. Louis: Mosby Year Book 1994:234–251. [ Links ]
27. Shell LG. Understanding the fundamentals of seizures. Vet Med 1993; 88:622–628. [ Links ]
28. Le Couteur RA. Seizures and Epilepsy. In: Wheeler SJ, editors. Manual of Small Animal Neurology. 2nd ed. Gloucestershire: British Small Animal Veterinary Association Publishing, 1995:95–111. [ Links ]
29. Podell M, Fenner WR, Powers JD. Seizure classification in dogs from a nonreferral–based population. J Am Vet Med Assoc 1995; 206:1721–1728. [ Links ]
30. Podell M. Seizures in dogs. Vet Clin North Am Small Anim Pract 1996; 4:779–809. [ Links ]
31. Dodman N, Knowles K, Shuster L, Moon–Fanelli A, Tid–well A, Keen C. Behavioral changes associated with suspected complex partial seizures in Bull Terriers. J Am Vet Med Assoc 1996; 208:688–691. [ Links ]
32. Stonehewer J, Tasker S, Simpson W, Mayhew IG. Idiopathic Phenobarbital–responsive hypersialosis in the dog: an unusual form of limbic epilepsy? J Small Anim Pract 2000, 41:416–421. [ Links ]
33. Wallace M. Keeshonds: a genetic study of epilepsy and EEG readings. J Small Anim Pract 1975; 16:1–10. [ Links ]
34. Srenk P, Jaggy A. Intertictal electroencephalographic findings in family of Golden Retrievers with idiopathic epilepsy. J Small An Pract 1996; 37 (7):317–321. [ Links ]
35. Kathmann I, Jaggy A, Busato A, Bartschi M, Gaillard C. Clinical and genetic investigations of idiopathic epilepsy in the Bernese mountain dog. J Small Anim Pract 1999; 40:319–325 [ Links ]
36. Patterson E, Mickelson J, Da Y, Roberts M, McVey S, O'Brien D et al. Clinical characteristics and inheritance of idiopathic epilepsy in Vizslas. J Vet Intern Med 2003; 17:319–325 [ Links ]
37. Patterson E, Armstrong P, O'Brien D, Roberts M, Johnson G, Mickelson J. Clinical description and mode of inheritance of idiopathic epilepsy in English Springer Spaniel. J Am Vet Med Assoc 2005; 226:54–58. [ Links ]
38. Gerard V, Conrack C. Identifying the cause of an early onset of seizures in puppies with epileptic parents. Vet Med 1991; 86:1060–1061. [ Links ]
39. Lindbald–Toh K, Wade C, Mikkelsen T, Karlsson E, Jaffe D, Kamal M et al. Genome sequence, comparative analysis and haplotype structure of the domestic dog. Nature 2005; 438:803–819 [ Links ]
40. Lohi H, Young E, Fitzmaurice S, Rusbridge C, Chan E, Vervoort M et al. Expanded repeat in canine epilepsy. Science 2005; 307:81. [ Links ]
41. Dodman N, Miczek K, Knowles K, Thalhammer J, Shuster L. Phenobarbital–responsive episodic dyscontrol (rage) in dogs. J Am Vet Med Assoc 1992, 201:1580–1583. [ Links ]
42. Dodman N, Bronson R, Gliatto J. Tail chasing in a Bull Terrier. J Am Vet Med Assoc 1993, 202:758–760. [ Links ]
43.Pellegrino F. Electroencefalografía clínica en pequeños animales. En: Pellegrino F, Suraniti A, Garibaldi L, editores. El Libro de Neurología para la Práctica Clínica. Argentina: Intermédica, 2003:571–600. [ Links ]
44. Klemm W. Electroencephalography in the diagnosis of epilepsy. Probl Vet Med 1989; 1:1895–1899. [ Links ]
45. Holliday T, Cunningham J, Gutnick M. Comparative clinical and electroencephalographic studies of canine epilepsy. Epilepsia 1970; 11:281–292. [ Links ]
46. Podell M. Antiepileptic drug therapy. Clin Tech Small Anim Pract 1998, 13:185–192. [ Links ]
47. Dowling P. Update on therapy on canine epilepsy. Can Vet J 1999; 40:595–598. [ Links ]
48. Lord L, Podell M. Owner perception of the care of long–term Phenobarbital–treated epileptic dogs. J Small Anim Pract 1999; 40:11–15. [ Links ]
49. Shaw N, Trepanier L, Center S, Garland S. High dietary chloride content associated with loss of therapeutic serum bromide concentrations in an epileptic dog. J Am Vet Med Assoc 1996; 208:234–235. [ Links ]
50. Platt S, Adams L, Garosi C, Abramson J, Penderis J, De Stefani A et al. Treatment with gabapentin of 11 dogs with refractory idiopathic epilepsy. Vet Rec 2006; 159:881–884. [ Links ]
51. Govendir M, Perkins M, Malik R. Improving seizure control in dogs with refractory epilepsy using gabapentin as an adjunctive agent. Aus Vet J 2005; 83:602–608. [ Links ]
52. Boothe DM: Anticonvulsant therapy in small animals. Vet Clin North Am Small Anim Pract 1998; 28:411. [ Links ]
53. Speciale J, Dayrell–Hart B, Steinberg S. Clinical evaluation of γ–vinyl–γ–aminobutyric acid for control of epilepsy in dogs. J Am Vet Med Assoc 1991; 198:995–1000. [ Links ]
54. Vaughan–Scott T, Taylor JH. Drug choice and therapeutic monitoring in the management of canine primary epilepsy. J S Afr Vet Assoc 1999; 70:172–176 [ Links ]
55. Platt S. Anticonvulsant use for epileptics. Proceedings of the 30th World Congress of The World Small Animal Veterinary Association; 2005 May 11–14; Mexico DF. Mexico DF: World Small Animal Veterinary Association 2005:845–849. [ Links ]
56. Inzanza KD, Allyn M, Davies C. Pancytopenia in three dogs associated with phenobarbital therapy (abstract). Proceedings of the 16th American College of Veterinary Internal Medicine Forum; 1998 May 31, San Diego, USA. San Diego (USA): American College of Veterinary Internal Medicine 1998:725–728. [ Links ]
57. Jacobs G, Calvert C, Kaufman A. Neutropenia and thrombocytopenia in three dogs treated with anticon–vulsants. J Am Vet Med Assoc 1998; 212:681–684. [ Links ]
58. Dayrell–Hart B, Steinberg S, Van Winkle T, Farnbach G. Hepatotoxicity of phenobarbitol in dogs: 18 cases (1985–1989). J Am Vet Med Assoc 1991; 199:1060–1066. [ Links ]
59. Parent J. Clinical management of canine seizures. Vet Clin North Am Small Anim Pract 1988; 18:605–622. [ Links ]
60. Podell M, Fenner WR. Bromide therapy in refractory canine idiopathic epilepsy. J Vet Intern Med 1993, 7:318 [ Links ]
61. Yohn SE, Morrison WB, Sharp PE. Bromide toxicosis (bromism) in a dog treated with potassium bromide for refractory seizures. J Am Vet Med Assoc 1992; 201:468–470. [ Links ]
62. Scherkl R, Kurundi D, Frey H–H. Anticonvulsant effects of clonazepam in the dog: Development of tolerance and physical dependence. Arch Int Pharmacodyn Ther 1985; 278:249–260. [ Links ]
63. Scherkl R, Kurundi D, Frey H–H. Clorazepate in dogs: Tolerance to the anticonvulsant effect and signs of physical dependence. Epilepsy Res 1989; 3:144–150. [ Links ]
64. Loscher W. Plasma levels of valproic acid and its metabolites during continued treatment in dogs. J Vet Pharmacol Ther 1981; 4:111–119. [ Links ]
65. Lorenz MD. Neurologic history and examination. In: Lorenz MD, Kornegay J, editors. Handbook of Veterinary Neurology. 4 ed. St. Louis: WB Saunders, 2004:3–38. [ Links ]
66. Ruelhman D, Podell M, March P. Treatment of partial seizures and seizure–like activity with felbamate in six dogs. J Small Anim Pract 2001; 42:403–408. [ Links ]
67. Holland C. Succesful long term treatment of a dog with psychomotor seizures using carbamazepine. Austr Vet J 1988; 65:389–392 [ Links ]
68. O'Brien D, Simpson ST, Longshore R, Kroll RA, Goetze L. Nimodipine for treatment of idiopathic epilepsy in dogs. J Am Vet Med Assoc 1997; 210:1298–1301. [ Links ]
69. Podell M, Hadjiconstantinou M. Low concentrations of cerebrospinal fluid GABA correlate to a reduced response to Phenobarbital therapy in primary canine epilepsy. J Vet Intern Med 1997; 58:451–456. [ Links ]
70. Speciale J, Stahlbrodt J. Use of ocular compression to induce vagal stimulation and aid in controlling seizures in seven dogs. J Am Vet Med Assoc 1999; 214:663–665. [ Links ]
71. Van Niekerk J. The use of acupuncture in canine epilepsy. J S Afr Vet Assoc 1988; 59:5. [ Links ]
72. Sumano H, Ocampo C, González M. Evaluación del efecto de la acupuntura y carbamacepina en el tratamiento de la epilepsia idiopática y las convulsiones epileptiforme causadas por distemper canino. Vet Méx 1987; 18:27–31. [ Links ]
73. Wynn S, Luna S, Liu H, Xie H, Nam T, Chien C. Global acupuncture research: previously untranslated studies. In: Schoen A. Veterinary Acupuncture. Ancient art to modern medicine. 2nd ed. St. Louis: Mosby Inc, 2001:53–77. [ Links ]














