Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Veterinaria México
versión impresa ISSN 0301-5092
Vet. Méx vol.39 no.3 Ciudad de México jul./sep. 2008
Artículos científicos
Evaluación de la calidad bacteriológica del alimento vivo (Artemia, Daphnia, Tenebrio y Tubifex) para peces en los sitios de su recolección, producción y venta
Bacteriological quality evaluation of live food (Artemia, Daphnia, Tenebrio and Tubifex) for fishes in collection, production and selling sites
Pilar Negrete Redondo* Carmen Monroy Dosta* Jorge Romero Jarero**
* Universidad Autónoma Metropolitana–Unidad Xochimilco, Departamento El Hombre y su Ambiente, Calzada del Hueso 1100, Col. Villa Quietud, 04950, México, D. F.
** Instituto de Ciencias del Mar y Limnología, Universidad Nacional Autónoma de México, 04510, México, D. F.
Recibido el 8 de marzo de 2007
Aceptado el 14 de marzo de 2008.
Abstract
Cichlids constitute the group of fishes of greatest importance for ornamental aquaculture. To increment the production of these species, producers have to satisfy the metabolic necessities that will give to the fish greater tolerance to the variations in the physicochemical factors of their surroundings, as well as resistance to diseases. Aquaculturists include live food as part of their diet for its high protein content, mainly in their first development phases. The organisms of greatest use in aquaculture as live food are: Artemia, Daphnia, Tubifex and Tenebrio; nevertheless, and in spite of being a probable source of ichthiopathogenic contamination, the bacterial charge they carry is not considered, which is incorporated to the culture system with the food. For this reason, in the present study a diagnosis of the sanitary conditions of live fish food management: Artemia, Daphnia, Tubifex and Tenebrio, during its collection, production and selling process was done. A qualitative and quantitative analysis on the bacterial charge in each one of these foods was performed. The isolated strains, in different specific microbiological agars, were purified and identified using API–20E and API– 20NE systems. To establish the significant difference between sanitary conditions and defined bacterial charge, per food and per commercial process phase, an analysis of variance and the comparison test of multiple means by the method of Tukey was performed. Significant differences in sanitary management conditions and in the count of ufc/mL different food samples were observed. In different phases of commercialization process three different levels were identified: good, bad and worst, according to the sanitary management and count of cfu/mL of each feed.
Key words: Live Food, Artemia, Daphnia, Tubifex, Tenebrio, Icthiopathogens, Enterobacteria, Bacterial Charge, Ornamental Aquaculture.
Resumen
Los cíclidos constituyen el grupo de peces de mayor importancia para la acuicultura de ornato. Con el propósito de incrementar la producción de estas especies, los productores deben satisfacer las necesidades metabólicas que proporcionarán a los peces mayor tolerancia a las variaciones en los factores fisicoquímicos del medio ambiente que los rodea, así como más resistencia a las enfermedades. Los acuicultores incluyen alimento vivo, como parte de la dieta de los peces, por su alto contenido en proteína, sobre todo en las primeras etapas de su desarrollo. Los organismos de mayor uso en la acuicultura como alimento vivo son: Artemia, Daphnia, Tubifex y Tenebrio; sin embargo, y a pesar de ser una probable fuente de contaminación de ictiopatógenos, no se considera la carga bacteriana que portan, la cual es incorporada al sistema de cultivo junto con el alimento. Como consecuencia de lo anterior, en el presente estudio se efectuó el diagnóstico de las condiciones sanitarias de manejo del alimento vivo para peces: Artemia, Daphnia,Tubifex y Tenebrio, durante su proceso de recolección, producción y venta. Se efectuó el análisis cualitativo y cuantitativo de la carga bacteriana en cada uno de estos alimentos. Las cepas aisladas, en diferentes agares microbiológicos específicos, se purificaron e identificaron utilizando los sistemas API–20E y API–20NE. Para establecer la diferencia significativa entre las condiciones sanitarias y carga bacteriana definida, por alimento y por fase del proceso de comercialización, se aplicó el análisis de varianza y la prueba de comparación de medias múltiples por el método de Tukey. Se observaron diferencias significativas en las condiciones sanitarias de manejo y en el conteo de ufc/mL de las muestras de los diferentes alimentos. Se identificaron en las diferentes fases del proceso de comercialización tres niveles: bueno, malo y pésimo, de acuerdo con el manejo sanitario y conteo de ufc/mL de cada alimento.
Palabras clave: Alimento vivo, Artemia, Daphnia, Tubifex, Tenebrio, Ictiopatógenos, Enterobacterias, Carga bacteriana, Acuicultura Ornato.
Introducción
La acuicultura se define como el cultivo de organismos acuáticos, incluye peces, moluscos, crustáceos y plantas, en cuyo proceso de siembra, desarrollo, reproducción y recolección, interviene el hombre,1 con el principal propósito de producir grandes cantidades de organismos acuáticos dentro de volúmenes limitados de agua, con los siguientes fines: a) obtener proteína de origen animal a bajo costo para consumo humano, b) conseguir peces de ornato para comercio, y c) industrializar productos derivados de la acuicultura, como harina de pescado y alimento procesado.2
El incremento en la producción de especies de ornato induce a los productores a cubrir las necesidades de las especies en cultivo, entre ellas la alimentación, que es importante para el buen desarrollo de los organismos, que al ser mal alimentados son susceptibles a enfermedades y menos tolerantes a las variaciones en los factores fisicoquímicos de su medio.2 Por tal motivo se ha suscitado interés en producir alimento para cubrir los requerimientos metabólicos de los peces en cultivo.
Como parte de la dieta de las especies cultivadas, los acuicultores incluyen alimento vivo sobre todo en las primeras fases del desarrollo de los individuos, por el alto contenido nutrimental que poseen.3 En la actualidad los organismos más utilizados como alimento vivo para peces son Artemia, Daphnia, Tubifex y Tenebrio, que mejoran el crecimiento y reproducción de aquéllos.4–6
A pesar de las bondades que el alimento vivo presenta para los organismos en cultivo, de acuerdo con Wheaton,7 también podría ser un vector para la entrada de agentes patógenos; sin embargo, no se ha tomado en cuenta la carga bacteriana que poseen.
En el caso de Artemia se registró la presencia de diferentes especies de Vibrio y Pseudomonas;8–14 Específicamente Thompson et al.15 aislaron Vibrio splendidus en dicho crustáceo.
Tubifex o lombriz acuática se considera portador de bacterias, como Salmonella, Shigella y Escherichia coli, debido a que estos gusanos viven en ambientes ricos en materia orgánica, con poco oxígeno, alimentados principalmente de residuos orgánicos en descomposición. 8,16,17 En este contexto, Nenoph y Uhleman encontraron Micobacterium marinum en ese gusano.
Daphnia o pulga de agua es un alimento natural con alto valor proteínico, ya que su contenido en base seca es de 53.6%; se ha comprobado que tiene efectos ventajosos sobre la coloración en peces Pterophyllum scalare;4 en este contexto, Morse y Duncan19 registraron Salmonella en ese alimento.
Tenebrio es un coleóptero conocido como escarabajo de la harina de maíz en estado larval se usa como alimento para peces y reptiles.20
La cadena de comercialización de tales insumos para la acuicultura sigue diferentes fases de un proceso largo en cuanto a su comercialización (venta y consumo): recolección, extracción o producción, exportación–transporte. Este tipo de comercio lo desarrollan, en 99%, acuaristas y aficionados y sólo 1% se realiza en acuarios públicos e institutos de investigación. Esta situación permite que cantidades importantes de organismos, utilizados como alimento vivo, sean movilizadas por personal no calificado, sin conocimiento de los requerimientos sanitarios del producto en las diferentes fases del proceso y en diferentes condiciones ambientales, lo que implica alto riesgo para la salud de los peces alimentados con estos organismos, y para el personal involucrado en esa larga cadena de comercialización.21
Debido a la presencia de bacterias en las dietas administradas a especies en cultivo, es de gran importancia conocer las condiciones sanitarias de manejo de los organismos utilizados como alimento vivo para peces, así como identificar bacterias de interés ictiopatógeno y de riesgo en salud pública en este tipo de alimento.
Con base en lo anterior, el objetivo de este trabajo consistió en determinar cualitativa y cuantitativamente la carga bacteriana de los alimentos vivos para peces: Artemia, Daphnia, Tubifex y Tenebrio, durante sus fases de recolección, producción y venta.
Material y métodos
Se efectuó el diagnóstico de las condiciones sanitarias de manejo, producción y comercialización de alimento vivo para peces (Artemia, Daphnia, Tubifex y Tenebrio). Se efectuaron prospecciones en diferentes sitios de recolección en Texcoco, Estado de México; y Río Atoyac, Puebla; sitios de producción en Guadalajara, Jalisco; y San Luis Potosí, San Luis Potosí, así como en en los mercados de peces "Mixhuca" y "Emilio Carranza" en la Ciudad de México. Con la finalidad de sistematizar la información se diseñó el cuestionario y guía de observaciones que definieron las condiciones de manejo desde la perspectiva de la sanidad acuícola, con base en los criterios de Piper22 y Negrete y Romero23 sobre la infraestructura con la que cuenta el centro, condiciones de bodega, servicios, estado de la estanquería, limpieza e higiene de las instalaciones, historial etiológico, recursos humanos, parámetros fisicoquímicos de importancia para la especie que se cultiva y los puntos críticos de manejo sanitario de organismos acuáticos establecidos en las normas sanitarias mexicanas: NOM 021–PESC, NOM–011–PESC, PROYECTO NOM–020–PESC y PROYECTO NO–022–PESC.24–27
Cada aspecto considerado se calificó por el cumplimiento o no de la condición teórica esperada, llegando a sumar 100 puntos máximos, calificación expresada en porcentaje para cada uno de los sitios visitados. Simultáneamente se tomaron muestras de alimento vivo (Artemia, Daphnia, Tenebrio y Tubifex) en los sitios mencionados.
Las muestras de Artemia y Daphnia se recolectaron con redes manuales de malla fina de nailon, se trasvasaron en botes con cuatro litros de agua del mismo lugar y con aireadores de pilas para su traslado al Laboratorio de Microbiología Acuática, de la Universidad Autónoma Metropolitana–Unidad Xochimilco.
Tubifex se recolectó en bolsas de plástico estériles.* Los tenebrios se extrajeron con pinzas estériles desde las charolas de producción y se transportaron en botes de unicel de 250 mL. Las muestras procedentes de los mercados de peces se obtuvieron en las condiciones en que se encuentran empacadas para su venta.
Se pesó 1 g de alimento y se homogeneizó con 99 mL de agua destilada estéril durante 5 min en un homogeneizador,** se efectuaron diluciones a la décima (desde 10–2 y hasta 10–6) en frascos lecheros con tapa de rosca de baquelita y con una pipeta automática se extrajo, de cada una de las diluciones, 0.1 mL y se sembró por duplicado en cajas de agar de tiosulfato–citrato–sales biliares (TCBS), eosina azul de metileno (EMB) e infusión cerebro corazón (BHI).
Con una varilla de vidrio acodada se esparció homogéneamente sobre cada una de las superficies de las placas de agar. Del homogeneizado original se sembró 1 mL en medio de enriquecimiento de caldo lactosado, caldo de tetrationato al que se le agregó 1 mL de yodo yoduro y agua peptonada a pH 8, en tubos de ensaye con tapón de rosca de baquelita y se dejaron incubar durante 24 h; posteriormente, 0.1 mL de este cultivo se sembró por duplicado en medios de EMB, Salmonella–Shigella (S–S) y TCBS,28 respectivamente. Transcurridas 24 h de incubación se efectuó el conteo de las unidades formadoras de colonias (ufc/mL) con un contador;*** asimismo, se observó la morfología de caja (color, forma, tamaño de las colonias) para cada dilución y medio de cultivo. La tinción de Gram se efectuó después de una serie sucesiva de resiembras en medio BHI y hasta que se obtuvieron cepas puras, lo cual se estableció por crecimiento homogéneo de las colonias, confirmado por observación de la morfología celular homogénea de las colonias con un microscopio de contraste de fase.
Luego que se obtuvieron cepas puras, se procedió a la identificación bacteriana mediante los sistemas API–20E y API–20NE29,30 y Manual de Merck,31 según las instrucciones del productor. Todo el proceso se replicó con cepas de la American Type Culture Collection,**** (ATCC); Escherichia coli (ATCC 25922), Pseudomonas cepaciae (ATCC 9056), Aeromonas caviae (ATCC 15468), Aeromonas hydrophila (ATCC 35654), Vibrio alginolyticus (17802 ATCC), Vibrio fluvialis (NCTCC 35654) y Vibrio furnissii (ATCC 35016).
Se aplicó el análisis de varianza para establecer diferencias significativas entre las condiciones sanitarias por organismo y por fase del proceso de comercialización, y entre la calidad bacteriológica de cada tipo de alimento; después se aplicó la prueba de comparación múltiple de medias por el método de Tukey.32,33
Resultados
A partir de cuestionarios y guía de observación implementado en este trabajo, se obtuvieron los siguientes resultados: en los sitios de recolección en Texcoco, Estado de México; y en Río Atoyac, Puebla, el diagnóstico de las condiciones sanitarias de manejo de alimento vivo fue deficiente debido a que no se cuenta con la infraestructura necesaria. Los recolectores, habitantes de poblaciones cercanas que no conocen nada sobre el manejo de estos organismos, no tienen otra alternativa para obtener ingresos económicos, por lo que se han dedicado a esta actividad, y la llevan a cabo sin aplicar medidas de higiene a los utensilios utilizados en la recolección, tampoco aplican tratamiento preventivo o profiláctico a los organismos antes de venderlos en los mercados de peces. El alimento es transportado en botes de plástico de 16 L, sin etiquetado que indique las características del producto. Tampoco se cumple con los rubros de infraestructura, higiene de instalaciones, personal calificado, servicios y control de enfermedades. Estos sitios obtuvieron 29% y 36 %, respectivamente, del total de puntos previamente establecidos para calificar el manejo sanitario de los organismos acuáticos (Cuadro 1).
La granja productora de Tenebrio, en Guadalajara, Jalisco, México, desde la perspectiva de la sanidad acuícola, cumple satisfactoriamente con los aspectos de calidad del agua, control de parámetros fisicoquímicos, alimentación de organismos, limpieza general de la granja y contenedores de fibra de vidrio con características adecuadas para las especies que se cultivan: poseen contenedores de cuarentena, y se observan la densidad de población de los organismos y sus enfermedades. En cuanto a la bodega, se encuentra bien ventilada, limpia y aislada de fauna nociva. Cuentan también con el personal calificado para el manejo de los organismos. El alimento es envasado y etiquetado con las instrucciones de manejo, uso y fecha de empaque. Este centro de producción cumple con 92% de los criterios (Cuadro 1).
En el centro de producción de Artemia, localizado en Las Salinas Hidalgo, San Luis Potosí, México, en donde se recolecta y procesa quiste de este organismo, se observó que los estanques de cultivo son revisados diariamente para mantener las condiciones adecuadas de cultivo, además de que se cuenta con personal calificado para efectuar las labores de cultivo. El centro posee un laboratorio en donde se produce el alimento que se les proporciona a los organismos que cultivan. Se controla la densidad de población, se efectúa la separación de los organismos de acuerdo con su estadio; los utensilios, redes y contenedores son desinfectados sistemáticamente. Las condiciones de bodega, almacenamiento y distribución del producto cumplen con las indicaciones de las especies que se cultivan. Con ello se asegura la calidad e inocuidad del producto, de acuerdo con los estándares establecidos en esta investigación, por lo que cubre 90% del puntaje de evaluación total (Cuadro 1).
En los mercados "Mixhuca" y "Emilio Carranza," ninguno de los criterios establecidos previamente se cumple. Se cuenta con servicios como drenaje, luz, agua, personal suficiente. Sin embargo, en ambos sitios no se llevan a cabo acciones de higiene, los contenedores donde almacenan a los organismos están sucios; no se aplica a los organismos en cultivo ningún tratamiento profiláctico ni preventivo antes de su venta; no separan los individuos enfermos y el producto que no se vende y muere es desechado al basurero del mismo mercado; tampoco cuentan con bodega. No alimentan a los peces de acuerdo con los requerimientos de la especie. En el mismo espacio se venden otros animales como aves, roedores y reptiles, entre otros, lo que ocasiona contaminación cruzada. El producto empacado no porta etiqueta que indique las características nutrimentales, forma de manejo y administración del producto. Estos sitios registraron 48% y 24% de calificación, respectivamente, con base en lo establecido por las normas (Cuadro 1).
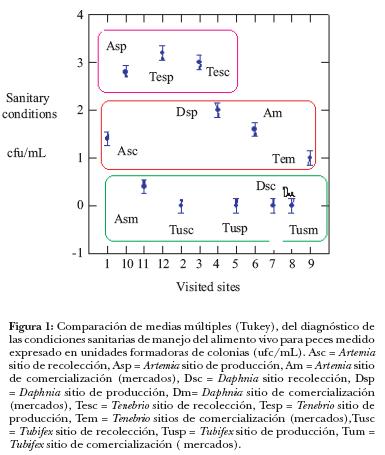
El análisis de varianza de las condiciones sanitarias del manejo, por organismo y fases del proceso productivo, muestra diferencias significativas (P < 0.001), F = 71.315, G1 = 11.48. Al efectuarse la prueba de comparación de medias múltiples por el método de Tukey, se observaron diferencias significativas en las condiciones de manejo de los alimentos y se identificaron tres niveles de condiciones (Figura 1): a) en condiciones pésimas, las fases de comercialización de Artemia; recolección y comercialización de Daphnia, y la fase de recolección, producción y comercialización de Tubifex; b) en malas condiciones, las fases de recolección de Artemia; producción de Daphnia y comercialización de Tenebrio; c) en buenas condiciones, las fases de: producción de Artemia, Tenebrio; y recolección y producción de Tenebrio.
En los cuatro tipos de alimento: Artemia, Daphnia, Tubifex y Tenebrio, se aislaron bacterias de las familias Aeromonadaceae, Vibrionaceae, Pseudomonadaceae y Enterobacteriaceae. Se identificaron 17 especies diferentes de los géneros: Aeromonas, Vibrio, Pseudomonas, Salmonella, Proteus, Pantoea, Enterobacter, Escherichia, Pasterurella, Citrobacter, Klebsiella y Providencia (Cuadro 2).
Del género de Aeromonas se identificaron: A. hydrophila y A. salmonicida; del género Vibrio tres especies, V. fluvialis, V. cholerae El Tor y V. algynolyticus. Se registró mayor número de enterobacterias de las especies Salmonella arizona, Salmonella spp, Proteus rettgeri, Pantoea spp, Enterobacter agglomerans, Enterobacter sakazakii, Escherichia coli, Pasteurella peumotropica, Citrobacter freundii, Klebsiella oxytoca y Providencia spp (Cuadro 2).
La fase de comercialización presentó mayor contaminación bacteriana en cuanto a ufc/mL y a número de especies identificadas se refiere. En esta fase, en Artemia, Daphnia, Tubifex y Tenebrio se identificaron 15, 12, 17 y 7 especies diferentes de bacterias, respectivamente. En la fase de recolección se aislaron 14, 10,14 y 1 especies en los mismos alimentos, respectivamente.
El menor número de especies bacterianas se aisló e identificó en las fases de producción con 4, 3 y 2 especies en Artemia, Daphnia y Tenebrio; en estos casos y fases, la diversidad de especies bacterianas fue menor: 23% 46% y 11.7% del total de especies. Tubifex registró 17 especies diferentes en esta fase, esto es, 100% de las especies aisladas e identificadas.
Tubifex presentó intervalos altos de contaminación bacteriana: 1 x 107 ufc/ mL en la fase de recolección, 6 x 107 ufc/mL en la fase de producción, y 7 x 107 ufc/mL en la de comercialización en agar de BHI. En agar de TCBS se contaron 5 x 107 ufc/mL, 4 x l08 ufc/mL, y 4 x 107 ufc/mL de colonias cuya morfología de caja correspondió a Vibrio cholerae El Tor, Vibrio fluvialis, Aeromonas hydrophila, Aeromonas salmonicida y Pseudomonas en las fases de recolección, producción y comercialización, respectivamente. En agar de EMB el registro fue de número incontable de ufc/mL en las fases de recolección y de producción; y 1 x 108 ufc/ mL con crecimiento de colonias con brillo metálico y color violeta, que corresponde a Escherichia coli y Salmonella, respectivamente, en la fase de comercialización. Por último, en agar de S–S se obtuvo cantidad incontable de ufc/mL, con crecimiento de colonias transparentes con centro negro e incoloras con viraje del medio a amarillo, correspondiente a Salmonella y Proteus, durante las tres fases del proceso de comercialización (Cuadro 3).

La cuantificación de la carga bacteriana de las muestras de Daphnia en agar de BHI obtuvo, para la fase de recolección, 1 x 108 ufc/mL; en la fase de comercialización, 3 x 107 ufc/mL; y en la fase de su producción, 3 x 106 ufc/mL. En agar de TCBS se registro número incontable de ufc/mL en la fase de recolección; y en las fases de producción y comercialización, 7 x 107 ufc/mL y 4 x 107 ufc/mL, respectivamente, de diferente forma de crecimiento, correspondiente a bacterias de las especies V. fluvialis y V. cholerae El Tor, A. hydrophila, A. salmonicida y Pseudomonas.
En agar de EMB se registró también número incontable de ufc/mL en la fase de recolección y 3 x 107 ufc/mL, así como 1 x 107 ufc/mL con crecimiento de Escherichia coli y Salmonella. Igualmente en agar de S–S se obtuvieron cifras incontables de ufc/mL en las fases de recolección y producción, y 4 x 107 ufc/mL en la fase de comercialización (Cuadro 3).
De igual forma, en agar de BHI, en Artemia, en los proceso de recolección y comercialización se registró 6 x 107 ufc/mL y 5 x 107 ufc/ mL, respectivamente, manteniendo durante su producción 1 x 107 ufc/mL. En agar de TCBS se contaron, en la fase de recolección, 5 x 107 ufc/mL con crecimiento de Vibrio cholerae El Tor, Vibrio fluvialis, 5 x 107 ufc/mL con crecimiento de Aeromonas hydrophila y Pseudomonas. En las fases de producción, el conteo registrado fue de 3 x 106 ufc/ mL de crecimiento de las mismas especies que fueron identificadas en la fase anteriormente descrita; de igual forma, en la fase de producción se registró presencia de estas especies, pero en cantidades de 6 x 107 ufc/mL. En agar de EMB las cifras de 7 x 107 ufc/mL y 8 x 106 ufc/mL correspondieron a las fases de recolección y comercialización, con formas de brillo metálico, que indicó presencia de E. coli, y colonias rosadas con centro oscuro, correspondientes a Klebsiella oxytoca.
Por último, en este alimento se cuantificó, en agar de S–S, presencia de Salmonella con 5 x 106 ufc/mL y 6 x 106 ufc/mL, con crecimiento transparente con centro negro, en las fases de recolección y comercialización. La fase de producción se registró libre de bacterias en EMB y S–S (Cuadro 3).
En las muestras obtenidas en los sitios de comercialización de Tenebrio, el conteo de ufc/mL en agar de BHI registró 7 x 107 ufc/mL, y en las fases de recolección y producción se registró 1 x 107 ufc/mL. En placas de agar de TCBS, EMB y S–S no se registró crecimiento bacteriano.
El análisis de varianza del conteo de ufc/mL de las muestras de los diferentes alimentos, contadas en agar de BHI, por cada una de las fases del proceso de comercialización, indicó que existen diferencias significativas entre ellas (P < 0.001, F = 39.306, GL = 11.168), registrando estas diferencias en la carga bacteriana de cada alimento (Figura 2). Se identificaron tres grupos principales: a) Pésimo, > a 100 x 106 ufc/ mL, formado por Tubifex en sitio de recolección; b) malo, entre 50–100 x 106 ufc/mL por Artemia en sitio de recolección y comercialización, Tubifex en sitios de producción y comercialización y Daphnia en sitio de recolección y comercialización, y c) bueno < a 50 x 106 ufc/mL, Artemia, Daphnia y Tenebrio en producción, así como Tenebrio en sitios de comercialización.

Discusión
La familia de las enterobacterias fue el grupo con mayor representatividad en las fases de recolección, producción y comercialización, en los cuatro tipos de alimento, con 10 géneros diferentes: el género Proteus sp pertenece a la tribu Proteea, son bacterias importantes en la descomposición de materia orgánica; se aíslan a partir de muestras de agua contaminada, Proteus rettggeri ha sido aislada de órganos internos y lesiones de carpa plateada (Hypophthalmichthys molitrix) en estanques de Israel;34 Citrobacter freundii, registrada por Edwards y Erwing35 en diferentes especies de animales de compañía, animales salvajes y marinos; en pájaros, insectos y humanos ha sido registrada por Hansen et al.36 y ha sido asociada como patógeno de peces por Swiderski y Jedrsekowsla;37 Klebsiella oxytoca no se ha registrado como patógena de animales o plantas, pero sí del humano; las diferentes especies de Salmonella se asocian con infecciones intestinales de humanos. Le Minor38 informa aislamientos de esta bacteria en peces extraídos de aguas contaminadas, pero sin manifestar signos de salmonelosis. Algunas enfermedades de plantas han sido atribuidas al género Erwinia arboricola, la cual es conocida también como Enterobacter agglomerans;39 algunos otros géneros de Erwinia pueden ser patógenos de animales, pero no son reconocidos como tal, como el caso de la llamada Klebsiella oxytoca, considerada nociva por médicos y ambientalistas, y puede llegar a ser referida como Erwinia por los fitopatólogos.40
La familia Aeromonadaceae se encontró en 11.6% de las especies, una de ellas, A. hydrophila, es reconocida como patógeno en gran variedad de animales como ranas,41 lagarto,42 serpientes y camarones,43 y en diferentes especies de peces;44 otra especie aislada en el presente trabajo, A. salmonicida, se asocia con síndromes de enfermedades ulcerativas en salmónidos.45,46
Las especies V. fluvialis, V. aglynolyticus y V. cholerae El Tor, de la familia Vibrionaceae, manifestaron 17.5% del total de las especies. V. algynolyticus es patógeno marino de peces asociados con cuadros agudos de septicemia bacteriana y lesiones focales crónicas;47,48 V. cholera El Tor, conocido como patógeno de humanos,49 V. fluvialis es aislada por primera vez, en muestras de vómito de humano, por Lee et al.,50 posteriormente Negrete y Romero51 comprueban experimentalmente su capacidad infecciosa en peces de ornato Carassius auratus.
Las muestras de alimento analizadas de los diferentes sitios de recolección, producción y comercialización, presentaron diferentes niveles de calidad sanitaria en su manejo y en cuanto a la carga bacteriana que portan. De esta forma, en las diferentes fases del proceso de comercialización se encontró que en el manejo sanitario únicamente la fase de recolección de Tenebrio cumple con un nivel bueno, condición que se confirma al establecer el mismo grado de calidad en índices de baja carga bacteriana identificada en este alimento, representado únicamente por la especie de Pseudomonas cepaciae, que se aíslan en muestras de agua y suelo, esta especie ha sido identificada como causante de la enfermedad de soft–red en cebollas;52 en humanos se ha registrado como causante de fiebres ligeras que desaparecen espontáneamente53,54 y se ha aislado también de fluidos humanos como saliva, sangre y orina.55
La fase de producción de Artemia, Daphnia y Tenebrio, cumple con buen nivel de calidad en el manejo sanitario, que se refleja en la carga bacteriana en cuanto al número y cantidad de especies aisladas en estos alimentos; 60% son enterobacterias, entre ellas destacan E. coli y S. arizona, que también pueden ser patógenos oportunistas de peces asociados con diferentes bacteriosis, que al cambiar las condiciones ambientales se manifiestan como virulentas y ocasionan pérdidas graves en la producción de especies acuáticas susceptibles al estrés ambiental.56
La fase de comercialización, en general, presentó niveles pésimos y malos, tanto en las condiciones de manejo como en el conteo de ufc/mL de todos los alimentos, ya que en esta fase se incrementa a niveles incontables la carga bacteriana de un número de 12 a 16 especies de bacterias de las 17 aisladas, con géneros representantes de las familias Aeromonadaceae, Vibrionaceae, Enterobacteriaceae y Pseudomonadaceae, con representantes patógenos de peces de las tres primeras, en cantidades que representan alto riesgo sanitario para los peces que consumen ese tipo de alimento; asimismo, si estos peces son destinados para consumo humano se estará implicando un problema de salud pública, al ser consumidos con una importante carga de bacterias entéricas como E. coli, S. arizona, C. freundii y vibrios y aeromonas como V. fluvialis, V. alginolyticus V. cholerae El Tor, A. hydrophila y A. salmonicida.
Es necesario que las normas de sanidad, tanto acuícola como de productos y servicios de la pesca, contemplen una vigilancia más estricta en los puntos de comercialización de estos productos, ya que se detectó fuerte contaminación fecal.
Por ello es necesario continuar con investigaciones que diseñen sistemas de purificación de los organismos que son suministrados como dieta a las especies acuáticas en cultivo.
En el presente trabajo se concluye que desde el punto de vista de la sanidad acuícola, Tenebrio representa la opción más recomendable, como alimento vivo para peces.
Referencias
1. Food and Agriculture Organization. Estadísticas de la producción de acuicultura. México D F : FAO, Circular de pesca N° 815, Revisión 2001; 11:203. [ Links ]
2. Vallat B. Organización Mundial de Sanidad Animal. El papel de la OIE, en las enfermedades de animales acuáticos. México D F: Boletin del Programa Nacional de Sanidad Acuícola y la Red de Diagnóstico, 2002; 12:19–24. [ Links ]
3. Fernández AA. Crecimiento de crías de peces utilizando alimento vivo. Acuario. México D F: Facultad de Estudios Superiores Iztacala UNAM, 2001:17. [ Links ]
4. Luna–Figueroa J. Influencia de alimento vivo sobre la reproducción y crecimiento de pez Ángel Pterophyllum scalare (Perciforme:Cichlidae). Guanajuato, Guanajuato: Acta Universitaria Autónoma de Guanajuato 1999; 9:2. [ Links ]
5. Luna FJ , Soriano SM. Efecto de diferentes tipos de alimento en el crecimiento de pez Ángel (Pterophyllum scalare). XII Congreso Nacional de Zoología; 2001 oct 28 a nov 1; Cuernavaca (Morelos) México. Cuernavaca (Morelos) México: Universidad Autónoma del Estado de Morelos. Centro de Investigaciones Biológicas, 2001:98. [ Links ]
6. Soriano SMB, Luna–Figueroa J, Figueroa TJ, Hernández OD. Efectos de diferentes dietas sobre el crecimiento de Pterophyllum scalare (Perciforme:Cichlidae) en condiciones de laboratorio. Estado de México (México): Universidad Ciencia y Tecnología. Universidad Autónoma del Estado de México, 1993;3:1. [ Links ]
7. Wheaton FW. Acuicultura, diseño y construcción de sistemas. México DF: Ed. AGT. 1993. [ Links ]
8. Dehasque M, Veronch L, Sorgeloos P, Swings J, Leger P, Kkerster P. Determination of the bacterial contamination in live food production systems in marine fish hatcheries in southern Europe. In: Lavens P, Sorgeloos P, Jaspers E, Ollevier F, editors. Larci'91. Fish & Crustacean Larvicultures Symposium; 1991 julio12–17; Belgium. Belgium: European Aquaculture Society, Special Publications No 15, 1991; 339–402 [ Links ]
9. Sorgeloos P, Lavens P, Leger Ptackert W, Versichele D. Manual para el cultivo y uso de Artemia en acuicultura. Bélgica: FAO, 1986. [ Links ]
10. Muroga K, Higashi M, Keitoku H. The isolation of intestinal microflora of farmed red seabream (Pagrus major) and black seabream (Acanthopagrus schlegeli) at larval and juvenile stages. Aquaculture 1987; 65:79–88 [ Links ]
11. Murghelano RA, Bishop J. Bacterial counts of commercial fish diets. J Fish Res 1975; 32: 739–745. [ Links ]
12. Nicolas JL, Robic E, Ansquer D. Bacterial flora associated with a trophic chain consisting of microalgae, rotifers and turbot larvae: influence of bacteria on larval survival. Aquaculture 1989; 83:237–248. [ Links ]
13. Tanasomwang V, Muroga K. Intestinal microflora of marine fish and their larval and juvenile stages. In: Hirano R, Hanyu I, editors. The 2nd Asian fisheries Forum; 1990 octubre 10–15; Manila (Philippines). Manila (Philippines): Asian Fisheries Society, 1990; 345–350. [ Links ]
14. Vanderberghe J, Thompson FL, Gomez–Gil B, Swings J. Phenotypic diversity amongst Vibrio isolates from marine aquatic systems. Aquaculture 2003; 2:14:1–4. [ Links ]
15. Thompson R, Macpherson HL, Riaza A, Birkbeck TH. Vibrio splendidus biotype 1 as a cause of mortalities in hatchery–reared larval turbot, Scophthalmus maximus (1). J Appl Microbiol 2005; 99: 2–12. [ Links ]
16. Acuavisión. Explotación del gusano de fango en Hidalgo. Acuavisión 1988; 13:19–23. [ Links ]
17. Martínez JF, Ramírez GR, Villaseñor CR, Tios BG, Espinoza Ch. Cultivos de Apoyo para la acuicultura. Producción de alimento vivo. Acuavisión 1988; 3:14. [ Links ]
18. Nenoph P, Uhlemann R. Mycobacterosis in Mangrove killi fish (Rivuluv magdaleane) caussed by living fish food (Tubifex tubifex) infected with Mycobacterium marinum. Deutsche Tierartlich Wonchenschrift rinum 2006; 113: 25–37. [ Links ]
19. Morse EV, Duncan MA. A survey of aquarium fish. Their foods and environmental water of Salmonella. Lab Anim Sci 1976; 26: 3–15 [ Links ]
20. Mendoza FJ. Estudio de coleópteros que infestan la harina (tesis de licenciatura). México DF: UNAM. Facultad de Ciencias, 2001. [ Links ]
21. Aston RJ, Milner AGP. Conditions required for the culture of Branchiura sowerbyi (Oligochaeta: Tubificidae) in activated sludge. Aquaculture 1981; 26: 155–160. [ Links ]
22. Piper GR. Fish management. Department of interior. Washington DC: Fish and Wildlife Service, 1992. [ Links ]
23. Negrete RP, Romero JJ. Estudio cualitativo de las condiciones sanitarias de producción y manejo de granjas acuícolas en los estados de México y Morelos. Hidrobiológica 1998; 8:43–54. [ Links ]
24. Diario Oficial de la Federación, 1994. Norma Oficial Mexicana –NOM– 021–PESCA. SEMARNAT. 1994. Aplicación de Cuarentenas. Secretaría del Medio Ambiente y Recursos Naturales. Julio 1994. [ Links ]
25. Diario Oficial de la Federación, 1994. Norma Oficial Mexicana –NOM– 011–PESCA. Importación y movilización de organismos acuáticos vivos. Secretaría del Medio Ambiente y Recursos Naturales. Julio 1994. [ Links ]
26. Diario Oficial de la Federación, 1994. Norma Oficial Mexicana –NOM– 020–PESCA. Requisitos para establecer enfermedades en organismos acuáticos. Secretaría del Medio Ambiente y Recursos Naturales. Julio 1994. [ Links ]
27. Diario Oficial de la Federación, 1996. Norma Oficial Mexicana. ANTEPROYECTO–NOM– 022–PESCA. Puntos críticos. Secretaría del Medio Ambiente y Recursos Naturales. Octubre 1996. [ Links ]
28. APHA.Standard methods for examination of water and waste water. 17th ed. Washington DC: American Public Health Association, 1992. [ Links ]
29. Analytical Profile Index. Enterobacteriaceae and other Gram negative Bacteria. 9thed. Paris (France): Biomerieux, 1992. [ Links ]
30. Analytical Profile Index. Enterobacteriaceae and other Gram negative Bacteria. 9th ed. Paris (France): Biomerieux, 1997. [ Links ]
31. Merck. Manual de medios de cultivo. Darmstadt (Alemania): Merk, 1994. [ Links ]
32. Kachigan SK. Multivariables statisstical analysis. A conceptual introduction. New York: Radius press,1991. [ Links ]
33. Tatsuoka MM. Selected topics in advanced stadistics. An elementary approach. N0 6 Disciminant Analysis. Illinois: Ed. IPAT 1970. [ Links ]
34. Bejerano Y, Saragi S, Horn E, Roberts J. Mass mortalities in silver Hypophthalmichthys molitrix (Valencienses) associated with bacterial infection following handling. J Fish Dis 1979; 2:40–56. [ Links ]
35. Edwards PR, Erwing WH. Identification of Enterobacteriaceae. 3rd ed. Mineapolis: Burgess Publishing Co, 1976. [ Links ]
36. Hansen GH, Raa JK, Olafsen JA. Isolation of Enterobacter agglomerans from dolphin fish, Coryphaena hippurus. L J Fish Dis 1990;13:93–96. [ Links ]
37. Swiderski M, Jedrzekowskla I. Infekcyjna lekoopornose i wirulecia patecczek Citrobacter orgniska intoksykacji prosiat. (with English summary). Med Wet 1976; 32: 665–668. [ Links ]
38. Le Minor. The Genus Salmonella. In: Starr P, Stolp H, Truper G, Balows A, Schlegel HG, editors. The prokaryotes. A handbbook of habitats, isolation and identification of bacteria. Berlin: Springer–Verlag, 1981;92:1149–1159. [ Links ]
39. Erwin WH, Fife MA. Enterobacter agglomerans (Bjeijerinck) comb.nov. (the herbicolalathyri bacteria). Int J Sys Bacteriol 1972; 22: 4–11. [ Links ]
40. Starr PM. The Genus Erwinia. In: Starr P, Stolp H, Truper G, Balows A, Schlegel HG, editors. The prokaryotes. A handbbook of habitats, isolation and identification of bacteria. Berlin: Springer–Verlag 1981; 102:1261–1271. [ Links ]
41. Gibbs EL. An effective treatment for red–leg diseases in Rana pipiens. Lab Anim Care 1963; 13:781–783. [ Links ]
42. Shotts E, Gaines JL, Martin L. Prestwood AK. Aeromonas induced death among fish and reptiles in a euthrophic inland lake. J Ame Vet Med Ass 1972; 161:603–607. [ Links ]
43. Mead AR. Aeromonas hydrophila in the leukoderma syndrome of Achatina fulica. Malacologia 1969; 9:43. [ Links ]
44. Figuereido De J, Plumb JA.Virulence of different isolates of Aeromonas hydrophila in channel catfish. Aquaculture 1971; 11:349–354. [ Links ]
45. Roberst RJ. Introduction fish. In: Inglis W, Roberts RJ, Bromage RN, editors Bacterial diseases of fish. London: Academic Press, 1994:735. [ Links ]
46. Snieszko SF, Griffin PJ, Friddle S . A new bacterium (Haemophilus piscium n sp.) from ulcer diseases of trout. J Bacteriol 1950; 59:699–710. [ Links ]
47. Colorni A, Paperna I, Gordin H. Bacterial infections in gilthead sea bream (Sparus aurata) cultured at Elat. Aquaculture 1981; 23: 257–267. [ Links ]
48. Hjeltnes B, Roberts JR. Vibriosis. In: Inglis V. Roberts RJ, Bromage NR, editors. Bacterial diseases of fish. New York: John Wiley & Sons. INC,1994 . [ Links ]
49. Sakazaki R, Balows A. The genera Vibrio, Pleisomonas and Aeromonas. In: Starr P, Stolp H, Truper G, Balows A, Schlegel HG, editors. The prokaryotes. A handbook of habitats, isolation and identification of bacteria. Berlin: Springer–Verlag 1981; 103:1272–1302. [ Links ]
50. Lee JV, Shread P, Furniss AI, Bryant TN.Taxonomy and description of Vibrio fluvialis sp. Nov. (Synonym. Group F. Vibrios EF6) J Appl Bacteriol 1981; 50: 73–94. [ Links ]
51. Negrete RP, Romero JJ. Estudio cualitativo de las condiciones sanitarias de producción y manejo de granjas acuícolas en los estados de México y Morelos. Hidrobiológica 1998; 8:43–54. [ Links ]
Notas
* Millipore, Estados Unidos de América. regresar
** Virtis. Virtis Company, Estados Unidos de América. regresar
*** Québec, Fisher, Estados Unidos de América. regresar
 Zeiss, Alemania. regresar
Zeiss, Alemania. regresar
**** Rockville, MD, Estados Unidos de América. regresar














