Servicios Personalizados
Revista
Articulo
Indicadores
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Veterinaria México
versión impresa ISSN 0301-5092
Vet. Méx vol.39 no.2 Ciudad de México ene./jun. 2008
Artículos científicos
Estudio de la consolidación ósea en rata por microscopía electrónica de barrido ambiental
Study on the osseous consolidation in rat by environmental scanning electron microscopy
Rosario Neri Basurto* Lilia Solís Arrieta* Hilda Villegas Castrejón*
* Servicio de Morfología Celular y Molecular, Instituto Nacional de Rehabilitación, Calzada México–Xochimilco 289, Col. Arenal de Guadalupe, Tlalpan, 14389, México, D. F., Tel. 5999–1000, ext. 19107, Fax: 5603–9197, correo electrónico: mneri@inr.gob.mx
Correspondencia:
Rosario Neri Basurto,
Servicio de Morfología Celular y Molecular,
Instituto Nacional de Rehabilitación,
Calzada México–Xochimilco 289,
Col. Arenal de Guadalupe, Tlalpan,
14389, México, D. F.
Recibido el 6 de diciembre de 2006
Aceptado el 29 de febrero de 2008.
Abstract
The environmental scanning electron microscope (ESEM) has been recently applied to orthopedics, for which a study was performed on the modes of operation of this electron microscope. Optimal conditions were determined to obtain the best topographic image and to perform chemical analysis by X–ray dispersion during the process of bone consolidation. Fifteen male Wistar rats were used, grouped in three per each experimental day. Tibia l fracture was provoked and a Kirschner wire was positioned. Rats were euthanized 0 (control), 7, 14, 21 and 28 days after surgery. According to the results, the best bone image was observed with retrodispersed electrons under high vacuum. In the chemical element determination lower variation coefficients were obtained under low vacuum for carbon and calcium; for phosphorus, under high vacuum, and in environmental mode, for magnesium, sodium, potassium and iron. In the process of bone consolidation, calcium levels in cortical bone diminished compared to controls, while the calcified bone callus was observed until day 14. Phosphorus concentration increased with time, in both cortical bone and bone callus. Magnesium presented a peak on day 14, and decreased drastically until day 28. Sodium rose continuously until day 28. The study of the chemical composition of bone by the ESEM is optimal in the environmental mode, since values of the elements present in lesser concentrations (1%) showed a lower variation coefficient. In bone consolidation process, calcium and phosphorus levels were found at a ratio of 2:1.
Key words: Bone Cosolidation, Bone Enviromental Scannig Electron Microscopy, Bone Chemical Analysis.
Resumen
La aplicación del microscopio electrónico de barrido ambiental (ESEM) en ortopedia no se había desarrollado hasta ahora, por lo que se realizó un estudio sobre los modos de operación del microscopio electrónico; así se determinaron las condiciones óptimas de obtención de la mejor imagen topográfica y del análisis químico por dispersión de rayos X durante el proceso de la consolidación ósea. Para ello se utilizaron 15 ratas macho de la cepa Wistar, que se agruparon en tres por cada día experimental, se les produjo una fractura en la tibia y se les colocó un alambre Kirschner; se efectuó eutanasia a los 0 (testigo), 7, 14, 21 y 28 días después de la cirugía. De acuerdo con los resultados, la mejor imagen del hueso se observó con electrones retrodispersados en alto vacío. En la determinación de elementos químicos se obtuvieron los menores coeficientes de variación en bajo vacío para carbono y calcio; en alto vacío, para fósforo, y en modo ambiental, para magnesio, sodio, potasio y fierro. En el proceso de la consolidación ósea los niveles de calcio en hueso cortical disminuyeron en comparación con el testigo, mientras que el callo óseo calcificado se observó hasta el día 14. La concentración de fósforo incrementó con el tiempo, tanto en hueso cortical como en callo óseo. El magnesio presentó un pico el día 14 y bajó drásticamente hasta el día 28; por último, el sodio subió de manera sostenida hasta el día 28. El mejor modo de estudiar la composición química del hueso en el ESEM es el modo ambiental, pues los valores de los elementos que están en menor concentración (1%) presentaron coeficiente de variación más bajo. En el proceso de consolidación ósea, los niveles de calcio y fósforo se encontraron en relación 2:1.
Palabras clave:Consolidación Ósea, Microscopía Electrónica de Barrido Ambiental de Hueso, Análisis Químico en Hueso.
Introducción
Los materiales biológicos contienen cantidades significativas de agua y tienen baja o nula conductividad eléctrica, por ello no pueden ser observados en su estado natural en los microscopios electrónicos de barrido convencionales. El agua de la superficie se evapora, lo que provoca que la muestra se colapse y se distorsione. Además, el vapor del agua de la cámara disminuye el vacío y contamina al detector y a la columna. La baja conductividad puede dar como resultado que la muestra se cargue eléctricamente, lo cual interfiere con el haz de electrones y la emisión de los electrones secundarios de la muestra.1,2 Por tanto, las muestras biológicas deben ser fijadas, deshidratadas y cubiertas con un material conductor, para ser observadas en este tipo de microscopios.3–5
Para observar las muestras biológicas en estado natural y sin una cubierta conductora, el ESEM presenta dos Modificaciones.6,7 La primera es una apertura que limita la presión que se encuentra bajo la lente objetiva y separa la muestra de la columna de vacío; esto permite que la columna esté en alto vacío, mientras la cámara tenga presión de hasta 50 Torr. La temperatura y humedad de la muestra pueden ser manualmente reguladas para proporcionar un ambiente adecuado y mantener la muestra en su estado natural, sin que altere su morfología aun en periodos largos de observación. La segunda característica es la presencia de un detector de electrones secundarios gaseosos (GSE), que evita el efecto de carga.1,2,8
Los materiales biológicos pequeños semejantes a protozoarios, microorganismos, algas y hongos, presentan alto porcentaje de agua y son difíciles de procesar de manera convencional, por lo que el ESEM permite observarlas sin previo tratamiento. Hasta ahora la aplicación de este microscopio ha sido limitada en biología, debido a que es una tecnología reciente y se ha aplicado al estudio del cultivo de tejidos, en el que se ha manipulado la presión y temperatura y se han observado sin dificultad.7 En medicina también se ha utilizado para detectar metales pesados en los tejidos mediante dispersión de rayos X (EDX), por ejemplo: cobre en tejido hepático de pacientes con enfermedad de Wilson, plomo en eritrocitos de pacientes con saturnismo, mercurio en piel, arsénico en intoxicaciones y carcinomas de piel, tetraóxido de osmio en traumatismos de piel, etc.9,10 También es posible analizar la composición de cristales urinarios, litiasis renal y vesicular.11 Además se ha realizado inmunomarcaje para diferenciar entre células dendríticas y microglia en el ojo de la rata.12
Sin embargo, en ortopedia no hay informes de su aplicación, por lo que se realizó un estudio para determinar las condiciones óptimas en el microscopio electrónico de barrido ambiental, para evaluar la morfología y para la cuantificación de elementos químicos por dispersión de rayos X (EDX), durante el proceso de consolidación ósea en rata. Actualmente hay diferentes metodologías para abordar la evolución de este fenómeno, como: radiografías, densitometrías y, de manera indirecta, la determinación de iones en sangre, pero no informan sobre el porcentaje de cada uno de los componentes minerales y cómo van cambiando a través del tiempo. Además, el microanálisis con EDX del ESEM presenta varias ventajas: a) se realiza in situ, b) es cuantitativo (a diferencia de otras técnicas que son cualitativas) y c) es específico para cada zona del hueso (cortical y callo óseo).
Material y métodos
Se utilizaron 15 ratas macho de la cepa Wistar, adultas, con peso en el rango de 300 a 400 g. Las ratas fueron alojadas en cajas de acrílico (tres en cada caja) a 22 ± 2°C, humedad y luz controladas (12 x 12 h). Se utilizaron sujetos con dicho peso porque se consideran animales adultos jóvenes que ya habían alcanzado su desarrollo óseo máximo, y sólo machos, para evitar algún efecto del ciclo estral. Los animales fueron tratados de acuerdo con la Norma Oficial Mexicana NOM 062–ZOO–98, para la producción, cuidado y uso de animales de laboratorio.
Se aplicó una dosis de pentobarbital sódico (50 mg/kg) intraperitonealmente. Se rasuró la pata derecha desde la articulación tibio–tarsal hasta la cadera, y se hizo incisión longitudinal de piel y músculos. Se colocaron separadores hasta exponer el hueso para realizar la fractura. El trazo de la fractura se realizó en la parte central de la diáfisis tibial con segueta de joyero, procurando no lesionar los tejidos blandos. Luego se introdujo alambre Kirschner (0.35 mm de diámetro), se unieron los fragmentos de la tibia (proximal y distal) para que coincidieran los trazos de corte. Los animales se distribuyeron en grupos de tres; de acuerdo con el día de evolución de la consolidación ósea, se efectuó la eutanasia con bióxido de carbono (CO2) a los días 0 (testigo), 7, 14, 21 y 28 días. Se obtuvieron las tibias y se fijaron en glutaraldehído al 2.5% en amortiguador de fosfatos (0.1 M, pH 7.4) durante tres horas, y se lavaron cuatro veces con el mismo amortiguador, durante cinco minutos cada uno. Se cortó un fragmento de 1 cm de longitud, de manera que abarcara la zona de fractura, y después se realizó un corte longitudinal para exponer el hueso cortical y callo óseo. Algunos de los fragmentos se lijaron para obtener una superficie lisa y otros no se lijaron dejando una superficie rugosa, después se secaron a 37°C por 72 horas. Para obtener mejor imagen, las muestras se observaron en el microscopio electrónico de barrido ambiental* en modo alto vacío (con electrones secundarios y electrones retrodispersados), en modo bajo vacío y en modo ambiental (con electrones secundarios gaseosos).
El ESEM está equipado con un dispersor de rayos X** para la cuantificación de elementos químicos. Se realizaron cinco análisis en un patrón cruzado en el hueso cortical y callo óseo. La determinación se realizó de manera semicuantitativa en modo alto vacío (en hueso cargado y no cargado) en modos bajo vacío y ambiental. Los elementos químicos analizados fueron: carbono (C), calcio (Ca++), fósforo (P), sodio (Na+) y magnesio (Mg++), de los cuales el C es considerado componente mayoritario de las muestras biológicas. También se realizó la distribución de los elementos químicos en el hueso, con un software de mapeo integrado al EDX en modo bajo vacío.
Los datos obtenidos de los diferentes modos de operación fueron analizados con estadística descriptiva y se aplicaron coeficientes de variación. También se aplicó ANDEVA para comparar los porcentajes de elementos químicos durante el proceso de la consolidación ósea, utilizando el paquete estadístico SPSS para Windows versión 10.0.
Resultados
La topografía del hueso se observó mejor en alto vacío con electrones retrodispersados que en bajo vacío; se distinguió claramente el hueso cortical y el callo óseo, en el cual aún hay zonas sin osificar (áreas más oscuras) el día 21 del proceso de consolidación ósea (Figura 1A). En el caso de la imagen de bajo vacío no se distingue entre zonas calcificadas y no calcificadas en el callo óseo (Figura 1B).
Considerando que el hueso contiene baja cantidad de agua (5%), a diferencia de otros tejidos, se observó en bajo vacío a presión máxima de 0.5 Torr y en modo ambiental se utilizó una presión de aproximadamente 2.3 Torr; a diferencia de las muestras con alto contenido de humedad, que requieren una presión de 5.5 Torr.
Las condiciones de trabajo en los análisis químicos realizados con el EDX fueron: 30 Kv, 5 de spot, 10% de tiempo muerto, 200 segundos vivos, 10 mm de distancia de trabajo y 2 200 cuentas por minuto (CPM). Sin embargo, al realizar las determinaciones en la zona rugosa, las cuentas bajaron alrededor de 350 CPM, por lo que se incrementó el spot a 5.3. La presión fue la misma para todos los análisis químicos en bajo vacío (0.5 Torr) y modo ambiental (2.3 Torr).
En el hueso analizado con el EDX en alto vacío en las zonas lisas y rugosas, se encontró que en las zonas rugosas el porcentaje de Ca++ (20.7%) y P (10.9%) bajaron y fueron estadísticamente significativas (P < 0.05), mientras que los porcentaje de Na+ y Mg++ permanecieron constantes (Figura 2).
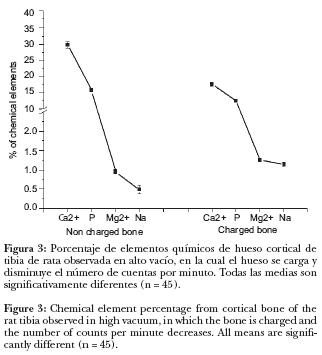
Al observar la muestra en alto vacío por tiempo prolongado, el hueso se cargaba; durante el análisis químico y el porcentaje de Ca++ y P, se observó disminución de 41% y 22.9%, respectivamente, en cambio los elementos de menor concentración incrementaron 31% el Mg++ y 135% el Na+, en el hueso cargado, en comparación con el hueso no cargado; todas las medias fueron estadísticamente significativas (P < 0.05) (Figura 3).
En el modo de bajo vacío, a diferencia del de alto vacío, en la zona lisa se observó que el Ca++, P y C incrementaron (P < 0.05), lo que no ocurre con los elementos minoritarios. Al comparar las medias de los porcentajes de estos iones en bajo vacío y modo ambiental, se encontraron cambios significativos en los porcentajes de C, Ca++, P y Fe+; al comparar los promedios de los grupos de alto vacío con modo ambiental se encontró que sólo hubo diferencias con el P, siempre y cuando la muestra no presentara carga (Figura 2). Sin embargo, con los coeficientes de variación los porcentajes de elementos químicos más confiables se obtuvieron en bajo vacío para C y Ca++, en alto vacío para P y en modo ambiental para Mg++, Na+, K+ y Fe+ (Figura 1).
Según los resultados, se decidió que durante el proceso de consolidación ósea, los análisis de elementos se realizaran en modo ambiental, pues el Mg++, Na+, K+ y Fe+ presentaron menor variabilidad y son difíciles de cuantificar por sus concentraciones menores a 1%.
Para demostrar la distribución de los elementos químicos se realizó el mapeo en modo ambiental. El calcio y el fósforo presentaron distribución densa y homogénea en la región cortical, mientras que el magnesio, el sodio y el zinc presentaron distribución escasa y heterogénea, lo cual concuerda con las concentraciones encontradas con el EDX. En el callo óseo todos presentaron distribución similar a los anteriores; sin embargo, se observaron zonas no calcificadas debido a que el hueso utilizado para el mapeo fue de una rata de 28 días de consolidación ósea (Figura 4).
En el proceso de consolidación ósea los porcentajes de calcio cortical del día 0 al 14 de evolución, presentaron baja significativa de 6.3% (P < 0.05), y del día 21 al 28 vuelve a bajar la concentración a 3.9% y 11.15%, respectivamente, en relación con el grupo testigo. En tanto que el callo óseo calcificado aparece hacia el día 14, cuando los niveles de calcio fueron elevados, comparativamente con los días 21 y 28, pero nunca fueron mayores al del día 0. El fósforo de 0 a 7 días baja significativamente 11.5% (P < 0.05) en el hueso cortical. En tanto que en los días posteriores (14–28) hay ligero aumento en hueso cortical y callo óseo. En el nivel basal (día 0), los porcentajes de calcio y fósforo corticales correlacionaron significativamente (r = 0.493, P < 0.05), pero la correlación se pierde del día 7 al 14, y se recupera hacia los días 21 y 28 (r = 0.725, P < 0.05). De acuerdo con los porcentajes determinados de calcio y fósforo, se encontró una relación 2:1, tanto en hueso cortical como en callo óseo, durante todo el proceso de la consolidación ósea. En cuanto al magnesio, en la región cortical sufrió incremento muy importante del día 0 al 14 (P < 0.05) y bajó drásticamente desde el día 21 al 28 (P < 0.05) a niveles basales, lo mismo ocurrió en callo óseo. El sodio cortical subió de manera sostenida desde el nivel basal hasta el día 28 (P < 0.05). En el callo óseo el porcentaje incrementó entre los días 14 y 21, para el día 28 disminuyó su porcentaje con respecto a su mismo grupo (P < 0.05), pero fue mayor que el grupo testigo (Figura 5).
Discusión
Los electrones secundarios de baja energía (< 50 eV), emitidos por la muestra, son los que se utilizan más comúnmente para los estudios morfológicos de los especímenes biológicos, pero prácticamente no proporcionan información de su composición, y la cantidad de electrones que llegan al detector depende de la morfología de la superficie del objeto y del ángulo entre esa superficie y el haz.5 Sin embargo, la mejor imagen de hueso la obtuvimos con electrones retrodispersados (de alta energía > 50 eV) en alto vacío, siempre y cuando la muestra no se cargue durante la obtención de la imagen. Una de las ventajas de las imágenes con electrones retrodispersados en alto vacío es que pueden dar información sobre la composición atómica de la región en estudio,13 lo cual es importante para diferenciar la evolución del callo óseo y hueso cortical durante el proceso de la consolidación ósea. Además, el detector de electrones secundarios gaseosos en modo ambiental no permite tener un campo de observación amplio como sucede en alto y bajo vacío. La imagen que se observó en bajo vacío presentó un poco de carga, debido a que es una presión baja (máximo 1.0 Torr) para eliminar tal efecto. Lo anterior no sucede en la imagen que se obtuvo en modo ambiental, a pesar de que la muestra se mantuvo en la cámara por tiempo prolongado.
La cuantificación de elementos químicos en el hueso se realizó en los tres modos de operación: alto vacío, bajo vacío y ambiental, para determinar el más adecuado. El análisis químico con el EDX varía según el modo de observación por varias razones: a) Porque depende de la conductividad de la muestra, en alto vacío se pueden estudiar muestras conductoras, en bajo vacío muestras poco conductoras y en modo ambiental muestras no conductoras, como las biológicas, debido a la utilización de un detector de electrones secundarios gaseosos que evita el artefacto de carga, lo cual tiene efectos benéficos sobre el análisis con rayos X, ya que la cubierta conductora aplicada a la muestra afecta el espectro característico de los elementos químicos;14,15 b) las superficies lisas se requieren para mantener el ángulo constante de los rayos X producido por el haz de electrones, puesto que las superficies rugosas afectan la reproducibilidad de los resultados;16 c) cuando se realizó el análisis químico en la muestra cargada y no cargada, la cuantificación en la muestra cargada disminuyó el porcentaje de Ca++ en 41% y de P en 20%. En cambio el Mg++ y el Na+ llegaron a 133% y 230%, respectivamente. Esto último se debe a que la carga induce variaciones locales en la emisión de los electrones secundarios y en la deflexión del haz primario, ambos interfieren con la obtención del espectro y de la imagen.14,17 Después de haber realizado el análisis químico en los tres modos de operación, se determinó que la mejor manera para realizarlos en hueso es en modo ambiental. Al considerar que los coeficientes de variación fueron menores para los elementos traza (Na+, Mg++, K y Fe+) y su concentración es menor a 1 %, la reproducibilidad no es tan precisa en los otros modos, a pesar de que los elementos mayoritarios presentaron coeficientes de variación menores en bajo vacío: Ca++ (r = 1.7), P (r = 0.9) y alto vacío: Ca++ (r = 2.0), P (r = 0.8).
La aplicación del mapeo de elementos químicos es útil para demostrar cómo se efectúa la distribución del calcio y fósforo en el callo óseo, en comparación con el hueso cortical en el que hay una distribución densa y homogénea, mientras que en el callo hay zonas aún sin osificar, debido a que no ha terminado el proceso de la consolidación ósea.18
El modelo de la consolidación ósea en rata se ha estudiado por densitometría ósea y determinación de elementos químicos en sangre.19,20 Sin embargo, no hay estudios in situ que indiquen el comportamiento de los iones óseos (calcio, fósforo, magnesio y sodio) durante el proceso de la consolidación ósea en la región cortical y callo óseo.
La información documentada en la bibliografía para este modelo indica que la concentración de calcio sérico incrementa de manera significativa con respecto al grupo testigo (22%–38%) durante los días 7, 12, 21 y 30, después de una fractura en la tibia de rata.20 En este estudio se encontró disminución de Ca++ durante el proceso de consolidación en el hueso cortical y callo óseo.
Se ha demostrado que la concentración de fósforo en sangre aumenta sólo a los 7 y 12 días (24% y 34%, respectivamente) después de una fractura.20 En este trabajo se encontró que el porcentaje de P disminuyó en los primeros siete días de la fractura en el hueso cortical. En los días subsiguientes hubo ligero incremento en hueso cortical y callo óseo, pero nunca fueron mayores que el testigo. La disminución del porcentaje de Ca++ y P que se encontró se debió al proceso de la reparación ósea, lo cual provoca que la concentración de ambos iones incremente en sangre, y correlaciona con lo antes mencionado.20
También hay correlación significativa de calcio y fósforo el día 0, que se restablece cuando la consolidación ósea está en fase avanzada (días 21 y 28), en proporción 2:1; la relación Ca++/P para diáfisis de rata adulta, varía de 1.86 a 1.88 en hueso totalmente consolidado; por tanto, los datos obtenidos con el EDX del microscopio electrónico de barrido ambiental son confiables para realizar experimentalmente estudios de consolidación ósea y osteoporosis.21
Además de los elementos mayoritarios, se informa presencia de otros elementos en el metabolismo óseo y no son parte de la estructura cristalina de la hidroxiapatita, como el magnesio y el sodio. De éstos, el primero incrementó en los primeros 14 días y bajó drásticamente hasta el día 28, a niveles basales en ambas zonas. En cambio, el sodio en el hueso cortical subió de manera sostenida desde el nivel basal hasta el día 28, y en el callo óseo el porcentaje también aumentó en los primeros días (14 y 21) y bajó el día 28. Sin embargo, la proporción y participación de estos elementos en el metabolismo y consolidación ósea no están bien definidos en la literatura. Se sabe que el magnesio es el cuarto catión más abundante del organismo y una vez absorbido, es transportado a diferentes tejidos: el óseo es donde se encuentra en mayor proporción, y se ubica en los cristales de hidroxiapatita.
De acuerdo con estudios experimentales se ha sugerido que la disminución de magnesio produce aumento de la resorción ósea, o bien inadecuada remodelación ósea, y su deficiencia está asociada con osteoporosis.22–24 El sodio es el catión que más abunda en el líquido extracelular, actúa con otros electrólitos, para regular la presión osmótica y mantener el equilibrio hídrico. En humanos se ha hallado que la pérdida de calcio óseo es proporcional al consumo de sal, además hay correlación negativa entre el consumo de sodio y la densidad mineral ósea. Sin embargo, el mecanismo que incrementa la resorción ósea inducida por la sal no se conoce.25,26 La información documentada en la literatura coincide con los resultados del presente trabajo, ya que los niveles de sodio incrementaron con la consolidación ósea y el Ca++ disminuyó durante todo el proceso, funcionando como antagonistas.25,27,28
De acuerdo con la evolución de la fractura en la tibia, el callo óseo calcificado apareció hasta el día 14, antes era únicamente material fibrilar,29 en el cual no se observaron depósitos de minerales. A los 30 días hay consolidación total;20,30 por tanto, los niveles de calcio y fósforo, a los 28 días en este caso, se acercaron a los valores basales.
En conclusión, el uso del ESEM en este modelo resultó adecuado, pues permite ver la evolución del callo óseo y la reparación de la fractura. Sin embargo, su aplicación en ortopedia es limitada, por necesitarse una biopsia para determinar patologías óseas. El diagnóstico de algunas de estas enfermedades se puede hacer mediante métodos no invasivos (densitometría ósea y tomografía axial computada).
Agradecimientos
Se agradece al Dr. Saúl Renán León Hernández su apoyo en el análisis estadístico de los datos; y al Lic. D. G. Miguel Ángel González Ocampo su apoyo en el trabajo fotográfico.
Referencias
1. Danilatos GD. Foundation of environmental scanning electron microscopy. Adv Electron Phys 1988; 71:109–250. [ Links ]
2. Goldstein JI, Newbury DE, Echlin P, Joy DC, Roming AD, Lyman CE et al. Scanning electron microscopy and X–ray microanalysis. 2nd ed. New York: Plenum Press, 1992. [ Links ]
3. Hayat MA. Principles and techniques of scanning electron microscopy. Biological aplications. New York: Van Nostrand Reinhold Co, 1978. [ Links ]
4. Yamada N, Nagato M, Murakami S, Ikeuchi M, Oho E, Baba N et al. Preparation for observation on the fine structure of biological specimens by high resolution SEM. J Electron Micros 1983; 32:321–330. [ Links ]
5. Vázquez Nin G, Echeverría O. Introducción a la microscopía electrónica aplicada a las ciencias biológicas. México DF: Fondo de Cultura Económica, 2000. [ Links ]
6. Danilatos GD. Enviromental scanning electron microscopy and microanalysis. Mikrochim Acta 1994; 114/115:143–155. [ Links ]
7. Tai SS, Tang XM. Manipulating biological samples for enviromental scanning electron microscopy observation. Scanning 2001; 23:267–272. [ Links ]
8. Danilatos GD. Introduction to the ESEM instrument. Microsc Res Tech 1993; 25:354–361. [ Links ]
9. Boyd AS, Seger O, Vannucci S, Langley M, Abraham JL. Exposición al mercurio y enfermedades cutáneas. J Am Acad Dermatol 2000; 43: 81–90. [ Links ]
10. Ligon JJ, Abraham JL, Boyd AS. Traumatic osmium tetroxide inoculation. J Am Acad Dermatol 2001; 45:949–952. [ Links ]
11. Schwille PO, Schmiedl A, Hermann U, Fan J, Gottieb D, Manoharam M et al. Magnesium, citrate magnesium and magnesium–alkali citrate as modulators of calcium oxalate crystallization in urine: Observation in patients with recurrent idiopathic calcium urolithiasis. Urol Res 1999; 27:117–126. [ Links ]
12. McMenanin PG, Djano J, Welthall R. Griffin BJ. Characterization of the macrophages associated with the tunica vasculosa lentis of the rat eye. Invest Ophthalmol Vis Sci 2002; 43:2076–2082. [ Links ]
13. Donald AM. The use of enviromental scanning electron microscopy for imaging wet and insulating materials. Nature Mater 2003; 2:511–516. [ Links ]
14. Griffin BJ, Suvorova AA. Charge–related problems associated with X–ray microanalysis in the variable pressure scanning electron microscope at low pressures. Microsc Microanal 2003; 9:155–165. [ Links ]
15. Tang X, Joy DC. Quantitative measurements of charging in a gaseous environment. Scanning 2003; 25:194–200. [ Links ]
16. Timofeeff NM, Lowenstein KT, Blackburn HW. ESEM–EDS: an improved technique for major element chemical analysis of fluid inclusions. Chem Geol 2000; 164:171–182. [ Links ]
17. Reid AP, Oates K, Potes WTW. The effects of aluminum coating on elemental signals in X–ray microanalysis. Micros Res Tech 1993; 24:168–172. [ Links ]
18. Villegas CH, Mayon GJ, González MG, González JM, Ibarra MG, Murillo UA. Estudio de la osteoporosis y osteopenia por medio de radiología, densitometría, morfometría, microscopía de barrido en la tercera vértebra lumbar en una muestra de hombres y mujeres en la Ciudad de México. Ginecol Obstet Méx 1998; 66: 187–201. [ Links ]
19. Quintana–Armenta A, Ruiz–Rosano L, Valdez MR, Diez GP, Isoard AF, Herrero BB et al. Medición del contenido mineral óseo en las vértebras lumbares L2–L5 de ratas Long Evans hembras por absorciometría de rayos X de doble energía y por análisis químico. Acta Ortop Mex 2003; 17:168–172. [ Links ]
20. Diez GM, Chávez AD, Mercado CR, Domínguez HV, Torres MA, Lomelí MP et al. Modelo experimental de fracturas y consolidación ósea en ratas. Rev Mex Ortop Traum 2002; 16:113–117. [ Links ]
21. Mendoza–Barrera C, Meléndez LM, García LE, Hernández FC. Caracterización estructural y biointegración del sustituto óseo BioOsteo. Rev Mex Fís 2004; 50:19–23. [ Links ]
22. Rude RK. Magnesium deficiency: a heterogeneous cause of disease in humans. J Bone Miner Res 1998; 13: 749–758. [ Links ]
23. Rude RK, Gruber EH, Wei YL, Frausto A, Mills GB. Magnesium deficiency: Effect on bone and mineral metabolism in the mouse. Calcif Tissue Int 2003; 72:32–41. [ Links ]
24. Rude RK, Gruber EH. Magnesium deficiency and osteoporosis: animal and human observations. J Nutr Biochem 2004; 15:710–716. [ Links ]
25. Lietz G, Avenell A, Robins SP. Short–term effects of dietary sodium intake on bone metabolism in post–menopausal women measured using urinary deoxypyridinoline excretion. Br J Nutr 1997; 78:73–82. [ Links ]
26. Lai–Ping E, Swaminathan R. Calcium metabolism and bone calcium content in normal and oophorectomized rats consuming various levels of saline for 12 months. J Nutr 1998; 128:633–639. [ Links ]
27. Chan AY, Poon P, Chan ELP, Fung SLM, Swaminathan R. The effect of high sodium intake on bone mineral content in rats fed normal calcium or low calcium diet. Osteop Int 1992; 3:341–344. [ Links ]
28. Massey LK, Whiting SJ. Dietary salt, urinary calcium and bone loss. J Bone Miner Res 1996; 11:731–736. [ Links ]
29. Hiltunen A, Vuorio E, Aro HT. A standardized experimental fracture in the mouse tibia. J Orthop Res 1993; 11:305–312. [ Links ]
30. Landry SP, Marino AA, Sadasivan KK, Albright AJ. Bone injury response. Clin Orthop 1996; 332:260–273. [ Links ]
NOTAS
* XL–30, Philips Electronics, Holanda. regresar
** EDAX–New XL–30, Estados Unidos de América. regresar














