Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Veterinaria México
versão impressa ISSN 0301-5092
Vet. Méx vol.39 no.2 Ciudad de México Jan./Jun. 2008
Artículos científicos
Detección de mastitis bovina subclínica por micoplasmosis mediante ELISA indirecta y aislamiento*
Detection of subclinical bovine mastitis caused by mycoplasmosis by indirect ELISA test and isolation
César Núñez D** Elizabeth Morales Salinas** José Juan Martínez Maya*** Laura Hernández A.
* Este trabajo forma parte de la tesis de licenciatura del primer autor.
** Departamento de Patología, Facultad de Medicina Veterinaria y Zootecnia, Universidad Nacional Autónoma de México, 04510, México, D. F.
*** Departamento de Medicina Preventiva y Salud Pública, Facultad de Medicina Veterinaria y Zootecnia, Universidad Nacional Autónoma de México, 04510, México, D. F.
 Centro Nacional de Investigación en Microbiología, Km 15.5, Carretera Libre México–Toluca, Colonia Palo Alto, 05110, México, D. F.
Centro Nacional de Investigación en Microbiología, Km 15.5, Carretera Libre México–Toluca, Colonia Palo Alto, 05110, México, D. F.
Recibido el 24 de octubre de 2006
Aceptado el 20 de febrero de 2008.
Abstract
The objective of this study was to determine the effectiveness of ELISA test in serum, for the diagnosis of subclinical bovine mastitis caused by Mycoplasma bovis, having as a reference test, the isolation of the microorganism in milk samples. Two hundred and twenty five blood and milk samples were obtained from herds from the State of Mexico, Coahuila and Hidalgo, all of them in Mexico. Using the Wisconsin test, 139 samples (61.8%) were positives to subclinical mastitis but only in six of them, Mycoplasma bovis was isolated. By ELISA test, 72 samples were positives (32.0%). All animals with positive isolation were also positive to the ELISA test. With a cut point higher or equal to 100, sensitivity and specificity were 83.3% and 83.56%, respectively, although the positive predictive value (PV) (+) was 12.2% and the negative predictive value (PV) (–) was 99.46%. The low PV (+) was associated to a low prevalence. ELISA test could be used as a screen test to detect mastitis associated to Mycoplasma bovis, particularly in herds with high frequencies (> 10%), this with the purpose to improve a positive predictive value (PV), which would allow to establish better diagnoses in cases where the most common tests do not give a specific result, mostly if ELISA test is considered as practical, fast and economic.
Key words: Mycoplasma bovis, Mastitis, Diagnostic Tests, Serology.
Resumen
El objetivo de este trabajo fue determinar la efectividad de una prueba de ELISA en suero para el diagnóstico de la mastitis bovina subclínica causada por Mycoplasma bovis, teniendo como prueba de referencia el aislamiento del microorganismo a partir de muestras de leche. Se obtuvieron 225 muestras de sangre y de leche provenientes de hatos del Estado de México, Coahuila e Hidalgo, todos en México. Ciento treinta y nueve muestras (61.8%) resultaron positivas a mastitis subclínica mediante la prueba de Wisconsin, y de ellas sólo en seis se aisló M. bovis. A través de la prueba de ELISA, 72 muestras resultaron positivas (32.0%). Todos los animales con aislamiento positivo también fueron positivos a la prueba de ELISA. Con un punto de corte mayor o igual a 100, se obtuvo sensibilidad de 83.3% y especificidad de 83.56%, aunque el valor predictivo (VP) (+) fue de 12.2%, y el VP (–) de 99.46%. El bajo VP (+) se asoció con baja prevalencia. La técnica de ELISA podría ser utilizada como prueba tamiz para la detección de mastitis asociada con M. bovis, particularmente en hatos con frecuencias elevadas (> a 10%), esto con el fin de mejorar un valor predictivo positivo, lo que permitiría establecer mejores diagnósticos en casos donde las pruebas más comunes no dan un resultado concreto, sobre todo si se considera que la prueba de ELISA es práctica, rápida y económica.
Palabras clave: Mycoplasma bovis, Mastitis, Pruebas Diagnósticas, Serología.
Introducción
La micoplasmosis es una enfermedad infecciosa que afecta a varias especies animales. Es causada por microorganismos del género Mycoplasma, que pertenece a la clase Mollicutes, orden Mycoplasmatales y familia Mycoplasmatacea.
Los micoplasmas son microorganismos pleomórficos, carecen de pared celular, miden de 200 a 500 nm, crecen en medios sólidos y líquidos, y utilizan glucosa como fuente de energía. Para su crecimiento se utilizan medios adicionados de proteínas y complejos nutrimentales, también se utiliza penicilina y acetato de talio como inhibidores de bacterias contaminantes.
En ganado bovino es posible aislar varias especies de Mycoplasma, de ellas, Mycoplasma alkalences, M. bovigenitalum, M. bovis, M. californicum y M. canadense provocan mastitis, artritis, neumonías, otitis y problemas reproductivos, entre otras manifestaciones.1,3 Sin embargo, M. bovis es el principal agente que causa mastitis.1–5
En México, Ávila et al.6 informaron sobre el aislamiento de Micoplasma spp en un hato lechero ubicado en el Estado de México; Hernández et al. describieron un brote de mastitis causado por M. bovis en un hato lechero del mismo estado; Barajas et al.8 observaron prevalencia de M. bovis mayor a 50% en bovinos en el trópico de México; Castro9 informa del aislamiento de M. spp proteolítico de un brote de mastitis en un hato lechero en Tizayuca, Hidalgo, México.
Entre las mastitis causadas por los micoplasmas, M. bovis es el más frecuente, además se le encuentra en mucosas y en secreciones de los tractos respiratorio y urogenital.
La infección puede ser introducida al hato por un animal infectado, o aparecer como consecuencia de la infección en glándula mamaria a través del equipo de ordeño; después se puede propagar por medio de los ordeñadores, las pezoneras de las ordeñadoras mecánicas y por soluciones que usualmente se emplean para el lavado de las ubres.2,4,5 Las épocas o condiciones frías y húmedas aumentan la incidencia de la infección, ya que los micoplasmas pueden sobrevivir más tiempo en esas condiciones.10
Los signos clínicos de mastitis aparecen días después de la infección, la cual puede darse en cualquier fase de lactancia; el antecedente es una mastitis aguda en uno o más cuartos, que a la palpación se perciben calientes, hinchados, edematosos o duros, las secreciones varían en su aspecto.2 Por lo regular, la primera secreción puede ser acuosa y tener "copos" de un material arenoso.11 Transcurridos varios días, las secreciones se pueden convertir en un exudado purulento. Si la enfermedad progresa, los conductos galactóforos desarrollan metaplasia escamosa, y algunos conductos y acinis se llenan de exudado granulomatoso.
La mastitis aguda por M. bovis se disemina en un periodo corto, la producción de leche disminuye drásticamente, salvo en los casos subclínicos.1,2
Tradicionalmente, el único método de diagnóstico de rutina ha sido el aislamiento e identificación de M. bovis, que requiere de dos a diez días. En la actualidad existen otras técnicas de diagnóstico: reacción en cadena de la polimerasa (PCR), hibridación in situ. Asimismo, hay técnicas inmunoenzimáticas (ELISA) para detectar antígenos y anticuerpos contra M. bovis.
La técnica de ELISA para detectar anticuerpos es rápida, requiere de uno a dos días para obtener resultados, su alta especificidad y sensibilidad es mayor a otros métodos como la inhibición de la hemoaglutina–ción.12,13 Existen paquetes comerciales de la técnica de ELISA que utilizan antígenos de proteínas variables de superficie (PVS), en particular la proteína variable de superficie "A" (PVSA), que es específica para toda infección provocada por M. bovis.14 La prueba detecta anticuerpos de los 13 a los 720 días posinfección. La especificidad no revela reactividad cruzada con sueros hiperinmunes de otras especies de Mycoplasma, excepto una pequeña reacción con Mycoplasma arginini.15 Con reactivos comerciales de ELISA para detectar anticuerpos en contra de otras especies de Mycoplasma, se ha observado sensibilidad de 96% y especificidad de 98%.16
El diagnóstico de mastitis asociada con M. bovis representa un problema, ya que por lo regular suele realizarse sólo hasta después de haber descartado otras etiologías; además, el tiempo que transcurre para ello hace que generalmente cuando se determina la causa, ya existen signos clínicos y lesiones graves, por lo que resulta más complicado y costoso su tratamiento. Por esta razón, es necesario buscar alternativas de diagnóstico que identifiquen la infección en casos de mastitis subclínicas, de manera fácil, rápida y económica. Por lo anterior, se buscó evaluar una prueba de ELISA indirecta, para determinar su efectividad en el diagnóstico de mastitis subclínica asociada con M. bovis.
Material y métodos
Ubicación espacial y temporal
El estudio se realizó en el primer trimestre de 2004 en tres hatos lecheros ubicados en lugares diferentes: a) en Torreón, Coahuila, b) en Melchor Ocampo, Estado de México, ambos con antecedentes de micoplasmosis; c) en Atitalaquia, Hidalgo, que no tenía ese tipo de antecedente.
Obtención de muestras
En los tres hatos evaluados y durante el ordeño, se realizó la prueba de Wisconsin modificada a todas las vacas en producción.17 A las que resultaron con cuartos positivos a mastitis subclínica (> 500 000 células somáticas) se les tomó una muestra de leche para realizar el aislamiento. En los casos donde la mastitis subclínica involucró más de un cuarto, se tomó la muestra al azar de cualquier cuarto, además se obtuvo una muestra de sangre de 10 mL de la vena coccígea; la sangre se centrifugó para la obtención de suero. Como testigos se tomaron 86 muestras de sangre de animales con conteos normales de células somáticas (< 500 000 células somáticas), por lo que se consideraron negativos a la prueba de Wisconsin.
Detección de anticuerpos contra M. bovis
La detección de anticuerpos contra M. bovis se realizó mediante la prueba de ELISA indirecta utilizando el reactivo Checkit,* siguiendo las instrucciones según lo especificado por el fabricante; esta prueba incluye sueros testigo positivos y negativos, con los cuales se puede determinar el punto de corte.
Aislamiento de M. bovis en leche
Para el aislamiento e identificación de M. bovis en leche se tomaron 10 mL de leche de cada cuarto que resultó positivo a la prueba de Wisconsin modificada. La toma de muestra se realizó en tubos de ensayo estériles y se conservaron entre 2°C–4°C.18
El aislamiento del microorganismo se realizó en el Centro Nacional de Investigaciones en Microbiología Veterinaria (CENID–Microbiología), del Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias (INIFAP). Las muestras de leche se sembraron en medio líquido de Friis modificado y se realizaron diluciones de 1:10 y 1:100, se incubaron a 37°C y se examinaron diariamente. A los siete días se cultivaron en medio sólido de Friis y se incubaron a 37°C en atmósfera húmeda, con 5% a 10% de CO2. El crecimiento característico con aspecto de "huevo frito" se observó en un microscopio estereoscópico. La identificación de la especie Mycoplasma se realizó mediante la prueba de digitonina,19 para diferenciarla de Acholeoplasma. Además se realizó la identificación serológica con la prueba de inhibición del crecimiento con antisueros de M. bovis, M. bovigenitalum y Acholeoplasma laidlawii.20
Análisis de resultados
Se determinó la concordancia entre el aislamiento del microorganismo y la prueba de ELISA a través del estadístico Kappa. Con el fin de determinar si hubo un mejor punto de corte que el referido en el reactivo comercial, los resultados serológicos de densidad óptica (DO) se agruparon en grupos con intervalos de 5%. Además se determinó para cada estrato los valores estimados de sensibilidad (Se), especificidad (Es), valor predictivo positivo (Vp(+)) y valor predictivo negativo (Vp(—)). Se buscó el mejor punto de corte mediante la elaboración de una curva con características operantes de receptor (ROC). 21
Resultados
Se obtuvieron 225 muestras de sangre y leche, de las cuales 98 (43.6%) provenían del hato del Estado de México, 77 (34.2%), de Coahuila y 50 (22.2%) de Hidalgo.
Prueba de Wisconsin modificada
De las 225 muestras evaluadas, 139 (61.8%) resultaron positivas a mastitis subclínica (> a 500 000 células somáticas); se registró mayor positividad en el hato del Estado de México (80.6%) (P < 0.01) (Cuadro 1).
Prueba de ELISA indirecta para la identificación de anticuerpos contra M. bovis
Del total de las muestras, 72 fueron positivas (32.0%) y con cuatro sospechas (1.8%) (Cuadro 2). En relación con los lugares de procedencia, el porcentaje de positividad fue mayor en el hato del Estado de México (38.8%), aunque no hubo diferencia estadística significativa entre los grupos (P>0.05)
Aislamiento e identificación de M. bovis
De las 139 muestras positivas a la prueba de Wisconsin, sólo se aisló M. bovis en seis muestras (4.3%), de las cuales tres provenían del Estado de México y tres de Coahuila. Los seis aislamientos que se obtuvieron de animales también fueron positivos a la prueba de ELISA (Cuadros 3 y 4).
Determinación de la sensibilidad y especificidad de la prueba de ELISA indirecta evaluada en suero para la detección de M. bovis en leche
Con el punto de corte recomendado por el fabricante (80%), se obtuvo sensibilidad de 83.3%, especificidad de 72.15%, valor predictivo positivo de 7.58% y valor predictivo negativo de 99.37%.
Al agrupar los resultados de la prueba de ELISA en rangos de 5%, se encontró que un mejor punto de corte fue igual a 100, con el cual se presentó sensibilidad de 83.3% y especificidad de 83.56%. Aun así, el valor predictivo positivo fue de 12.2% y el valor predictivo negativo de 99.46%, la proporción obtenida bajo la curva del análisis ROC fue de 0.9075 (Figura 1)
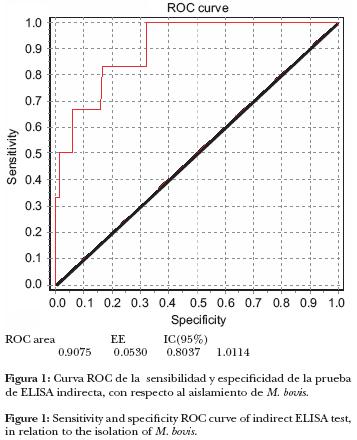
Discusión
La mastitis subclínica registrada con la prueba de Wiscosin (61.8%) fue mayor en comparación con otros estudios realizados en México, como el efectuado en Tres Marías, Morelos, donde se encontró prevalencia que varió de 19.6% a 52.9%,22 o en el Complejo Agroindustrial de Tizayuca, Hidalgo, donde se observó frecuencia de 20.82%.23 En Estados Unidos de América, se han informado frecuencias de 48.5% en Nueva York y Pennsilvania.24
En el hato del Estado de México, el alto porcentaje de mastitis subclínica (80.6%) se asocia con prácticas inadecuadas de higiene y desinfección, además del mal manejo y falta de mantenimiento de la ordeñadora mecánica. A este respecto, Jaramillo et al.23 encontraron que la instrumentación de prácticas de higiene y desinfección contribuyeron a bajar la prevalencia de 17.1% a 14.26% en dos establos con diferentes sistemas de manejo. Asimismo, en ese estudio se informó que el mal manejo de la unidad ordeñadora, principalmente por sobreordeño, provocó aumento de la prevalencia de mastitis subclínica.
El porcentaje de positividad (32%) de la prueba de ELISA indirecta resultó menor al encontrado por Barajas et al.,8 quienes observaron prevalencia de 50% en un estudio realizado con animales de Veracruz, y de 43% según los resultados de Ghadersohi et al. en ganado lechero de Townsville, Australia.25
El porcentaje de aislamientos obtenidos de animales con mastitis subclínica en este estudio (4.3%) fue mayor en comparación con el porcentaje (0.1%) encontrado por Wilson et al.24 en 105 083 vacas estudiadas en Nueva York y Pennsylvania, y al porcentaje (1.8%) obtenido por González et al.26 en 9 884 muestras en Nueva York,; en ambos estudios las muestras provenían de vacas con mastitis subclínica. Sin embargo, es menor al porcentaje notificado (19.8%) por Ghadersohi et al.27 en 202 muestras de leche de vacas con mastitis subclínica en Australia. Un porcentaje similar (19.64%) fue registrado por Hernández et al.7 en 56 animales con mastitis clínica provenientes del Estado de México.
El escaso número de aislamientos puede estar relacionado con diversos factores. Al respecto, Nicholas y Ayling28 encontraron que en casos de mastitis crónicas el uso de antimicrobianos dificulta el aislamiento. Miranda et al.29 mencionan que bajas cantidades de micoplasmas en la muestra dificultan el aislamiento. Asimismo, Ghadersohi et al.25 indicaron que títulos altos de anticuerpos en la leche inhiben el desarrollo de M. bovis, aunado a la acción del complemento provocan lisis de éste.
La sensibilidad (83.3%) y especificidad (67.58%) de la prueba de ELISA para la detección de mastitis por M. bovis, con base en el punto de corte del fabricante podría considerarse razonable, ello concuerda con los resultados de Brank et al.,14 quienes elaboraron una prueba de ELISA indirecta a base de antígenos recombinantes que consisten en PvsA, que les permitió obtener una prueba serológica sensible, específica y rápida para la detección de M. bovis en sus diferentes manifestaciones. Gadhersohi et al.25 desarrollaron otra prueba de ELISA indirecta a base de anticuerpos monoclonales, para detectar anticuerpos de M. bovis en suero de animales con manifestaciones clínicas de mastitis y problemas respiratorios, y en animales infectados experimentalmente mediante esponjas nasales encontraron alta especificidad y buena sensibilidad.
A través de la curva ROC, la relación entre ambas pruebas fue razonablemente buena (0.9075). El punto de corte pudo mejorarse, como lo recomiendan Greenberg et al.30 y Fletcher et al.,21 ya que el resultado mantuvo la sensibilidad, pero se mejoró la especificidad (67.58% a 79%), lo que permitió obtener la medición global del rendimiento de la prueba. Sin embargo, con este punto de corte, uno de los seis aislamientos queda como negativo a la prueba.
El valor predictivo positivo se asoció con el número de aislamientos, por lo que no significa que la prueba sea mala, pues por definición una baja prevalencia de la enfermedad se refleja de igual manera en el valor predictivo positivo,31 por lo que sería recomendable realizar un número mayor de muestreos y aislamientos con la finalidad de encontrar el mejor rendimiento de la prueba. Ghadersohi et al.25 realizaron un estudio similar, pero en lugar de aislamientos se comparó la prueba de ELISA con la técnica de PCR para detectar M. bovis. La prueba de ELISA fue altamente específica, suficientemente sensible y la correlación fue significativa entre ambas pruebas (Kappa = 0.44, P = 0.0456).
La identificación mediante PCR es altamente sensible, específica y rápida; sin embargo, se requiere de equipo y de personal especializado, además de que el costo por muestra es más elevado,8 por lo que las condiciones que presentan los laboratorios de diagnósticos en el país permiten instrumentar con mayor facilidad la prueba de ELISA.
Con base en los resultados de la prueba de ELISA, ésta podría ser buena alternativa para el diagnóstico de mastitis por M. bovis; sin embargo, se requiere emprender más estudios con un mayor número de muestras que permitan mayor cantidad de aislamientos, obteniendo con ello mejores indicadores de la especificidad y sensibilidad y de los valores predictivos. Con los resultados obtenidos, la sensibilidad y especificidad son aceptables; aun con el punto de corte propuesto en este estudio, uno de los seis aislamientos queda como falso negativo, y tomando en cuenta la capacidad de M. bovis para diseminarse en un periodo corto entre los animales del hato,1,2,7 se recomienda tomar como sospechosas las muestras que queden entre los puntos de corte (100%–60%), y tomar luego nuevas muestras de suero y leche para volver a analizarlas con la prueba de ELISA y aislamiento, con el fin de confirmar el diagnóstico. Finalmente, la prueba podría ser utilizada para la detección de ganado bovino con mastitis asociada a M. bovis, particularmente en hatos con frecuencias elevadas (> al 10%), con el fin de garantizar un valor predictivo razonablemente alto, o como en este caso, donde la frecuencia fue de 2.66%, podría utilizarse como prueba tamiz, sumado a que la técnica de ELISA es práctica, rápida y económica.
Agradecimientos
Se agradece a la MVZ Tatiana Chávez Heres su apoyo en la revisión de este trabajo.
Referencias
1. Hirsh DC, Zee YC. Veterinary Microbiology. 2nd ed. USA (Massachusetts): Blackwell Science, 1999. [ Links ]
2. Rebhun WC, Guard C, Richards MC. Diseases of Diary Cattle. Philadelphia: Lippincott Williams & Wilkins, 1995. [ Links ]
3. Jones TC, Hunt RD. Veterinary Pathology of Domestic Animals. 6th ed. Philadelphia: Lea & Febiger, 1997. [ Links ]
4. Kirk HJ. Mycoplasma mastitis in Dairy Cows, The Compedium 1994; 16:541–546. [ Links ]
5. Gourlay RN, Thomas LH, Howar CJ. Pneumonia and arthritis in gnotobiotic calves following inoculation with Mycoplasma agalactiae subsp bovis. Vet Rec 1976; 98:506–507. [ Links ]
6. Ávila S, Domínguez J, Ruiz H, Valdivieso A, De la Peña A. Evaluación de un brote de mastitis por Mycoplasma bovis y otros agentes etiológicos en un hato productor de leche. Memorias del IX Congreso Nacional de Buiatría; 1983 Junio 21–23; Puebla (Puebla) México. México (DF): Asociación Mexicana de Médicos Veterinarios Especialistas en Bovinos, AC,1983:118–124. [ Links ]
7. Hernández AL, González GA, Campos RV, Payan RM, Jaramillo ML, Pérez DM. Reporte de un caso de mastitis provocado por Mycoplasma bovis en un hato lechero. Memorias del X Congreso Nacional de Buiatría; 1984 Agosto 19–22; Acapulco (Guerrero) México. México (DF): Asociación Mexicana de Médicos Veterinarios Especialistas en Bovinos, AC,1984:608–609. [ Links ]
8. Barajas RJA, Riemann HP, Franti CE. Application of enzyme linked immunosorbent assay for epidemiological studies of diseases of livestock in the tropics of Mexico. Rev Sci Tech Off Epiz 1993;12:717–732. [ Links ]
9. Castro MMJ. Concentración mínima inhibitoria en 3 antimicrobianos probados con cepas de Mycoplasmaspp. proteolíticas aisladas de mastitis bovina (tesis de licenciatura). México (DF) México: Facultad de Medicina Veterinaria y Zootecnia (FMVZ) Universidad Nacional Autónoma de México,1994. [ Links ]
10. Bayoumi FA, Farver TB, Bushnell B, Oliveria M. Enzootic Mycoplasma mastitis in a large dairy during and eightyear period. Cornell Vet 1992; 82:29–40. [ Links ]
11. Busnell RB. Mycoplasma mastitis. Vet Clin North Am (large Anim Pract) 1984; 6:301–312. [ Links ]
12. Sacase K, Pfützner H, Hotzem H. Comparison of various diagnostic methods for the detection of Mycoplasma bovis. Rev Sci Tech Off Epiz 1993; 12:571–580. [ Links ]
13. Grand D–le, Calavas D, Brank M, Citti C, Rosentgarten R, Bezille P. Serological prevalence of Mycoplasma bovis infection in suckling beef cattle in France. Vet Rec 2002; 150:268–273. [ Links ]
14. Brank M, Grand DL, Poumarat F, Bezille P, Rosengarten R, Citti C. Development of a recombinant antigen of Mycoplasma bovis infection in cattle. Clin Diagn Lab Immunol 1999; 6:861–867. [ Links ]
15. Le Grand D, Poumarat F, Bezille P. Assessment of a serological ELISA test for screening of Mycoplasma bovis infection within livestock. FEMS Microbiol1999; 173:103–110. [ Links ]
16. Nava NE. Análisis serológico de granjas porcinas tecnificadas ubicadas en tres estados de la República Mexicana con respecto a Mycoplasma hyopneumoniae (tesis de licenciatura.). Estado de México (México): Universidad Autónoma del Estado de México, 1987. [ Links ]
17. Blanco O M. Diagnóstico de mastitis subclínica bovina. Memorias de III Congreso Nacional de Mastitis y Calidad de la Leche; 2001 Junio 21–23; León (Guanajuato) México. México (DF): Consejo Nacional de Mastitis, AC, Asociación Iberoamericana de Médicos Veterinarios Especialistas en Producción Animal, 2001:7. [ Links ]
18. Harmon R J, Eberhart R J, Jasper D E, Langlois B E. Wilson R A. Microbiological Procedures for the Diagnosis of Bovine Udder Infection, 3rd ed. Virginia (USA): National Mastitis Council, 1990. [ Links ]
19. Tully JG. Test for digitonin sensitivity and sterol requirement. In: Razin S, Tully JG editors. Methods in Mycoplasmology. New York: Academic Press. 1983: 355–362. [ Links ]
20. Hernández AL. Comparación de tres técnicas para el diagnóstico de mastitis causada por Mycoplasma bovis (tesis de licenciatura). Estado de México (México): Facultad de Estudios Superiores Cuautitlán (FES–C) Universidad Nacional Autónoma de México,1987. [ Links ]
21. Fletcher HR, Fletcher WS, Wagner HE. Epidemiología clínica aspectos fundamentales. 2ª ed. España (Madrid): Masson–Williams & Wilkins, 1998 [ Links ]
22. Díaz RO. Eficacia del digluconato de clorhexidina al 0.5% utilizado como desinfectante después del ordeño considerando la prevalencia de mastitis subclínica (tesis de licenciatura). México (DF) México: Universidad Nacional Autónoma de México, 2003. [ Links ]
23. Jaramillo DC. Prevalencia de mastitis en un hato lechero y su relación con las prácticas de ordeño, manejo y medicina preventiva (tesis de licenciatura). México (DF) México: Universidad Nacional Autónoma de México, 1979. [ Links ]
24. Wilson DJ, Gonzalez RN, Das HH. Bovine mastitis pathogens in New York and Pennsylvania: Prevalence and effects on somatic cell count and milk production. J Dairy Sci 1997; 80: 2592–2598. [ Links ]
25. Ghadersohi A, Fayazi Z, Hirst RG. Development of a monoclonal blocking ELISA for the detection of antibody to Mycoplasma bovis in dairy cattle and comparison to detection by PCR. Vet Immunol Immunopathol 2005; 104,183–193. [ Links ]
26. Gonzalez RN, Sears PM, Merril RA, Hayes GL. Mastitis due to Mycoplasma in the state of New York during the period 1972–1990.Cornell Vet 1992;82:9–40 [ Links ]
27. Ghadersohi A, Hirs RG, Forbes–Faulkener J, Coelen RJ. Preliminary studies on the prevalence of Mycoplasma bovis mastitis in dairy in cattle in Australia. Vet Microbiol 1999; 65:85–194. [ Links ]
28. Nicholas RA, Ayling RD. Mycoplasma bovis: disease, diagnosis and control. Res Vet Sci 2003; 74: 105–112. [ Links ]
29. Miranda MR. Patogenicidad de Mycoplasmas involucrados en la mastitis bovina (tesis de maestría). México (DF) México: Universidad Nacional Autónoma de México, 1999. [ Links ]
30. Greenberg RS, Flanders WD, Eley JW, Dariels SR, Boring JR. Epidemiología médica. 3ª ed. México DF: Manual Moderno, 2002. [ Links ]
31. Riegelman RK, Hirsch RP. Cómo estudiar un estudio y probar una prueba: Lectura crítica de literatura médica. 2 ed. Washington DC: OPS–OMS,1992. [ Links ]
NOTAS
* Bomeli, Intervet, Suiza. regresar














