Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Veterinaria México
versión impresa ISSN 0301-5092
Vet. Méx vol.39 no.2 Ciudad de México ene./jun. 2008
Artículos científicos
La inoculación de Lactobacillus casei en ratones NIH induce una respuesta protectora contra la infección por Trypanosoma cruzi (cepa Ninoa)
The inoculation of Lactobacillus casei in NIH mice induces a protective response against Trypanosoma cruzi(Ninoa strain) infection
Carlos Ramón Bautista Garfias* María del Carmen Torres Álvarez** Federico Martínez Gómez**
*Centro Nacional de Investigación Disciplinaria en Parasitología Veterinaria, Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias, Km 11.5, Carretera Federal Cuernavaca–Cuautla, 62550, Jiutepec, Morelos, México.
**Departamento de Parasitología, Escuela Nacional de Ciencias Biológicas, Instituto Politécnico Nacional, Prolongación de Carpio y Plan de Ayala, 11340, México, D. F.
Recibido el 6 de noviembre de 2006
Aceptado el 7 de enero de 2008.
Abstract
The aim of the present study was to evaluate the effect of Lactobacillus casei administered orally or intraperitoneally to NIH mice, on the experimental infection with Trypanosoma cruzi Ninoa strain. Twenty three NIH mice were randomly distributed into three groups, which were treated seven days before the infection with 12 x 104 Trypanosoma cruzi, Ninoa strain. The animals in the control group (n = 7) received sterile saline solution by intraperitoneal (ip) route; those in the Lc–O group (n = 8) were treated with Lactobacillus casei by oral route, and those in the Lc–IP group (n = 8) received L. casei by ip. The mice treated with the lactobacilli showed a reduced number of blood parasites after challenge, as compared with those of the control group (P < 0.01). Similarly, the mice treated with L. casei by ip route showed a significant minor total number of parasites after challenge, than those of the group treated with L. casei by oral route (P < 0.05). The results suggest that the treatment of mice with L. casei, both orally and intraperitoneally, induces a protective response against the experimental infection with Trypanosoma cruzi Ninoa strain.
Key words: Trypanosoma cruzi, Lactobacillus casei, Adjuvant, Resistance.
Resumen
El objetivo del presente estudio fue evaluar el efecto de Lactobacillus casei administrado por vía oral o intraperitoneal a ratones NIH, en la infección experimental con Trypanosoma cruzi cepa Ninoa. Se distribuyeron al azar 23 ratones NIH en tres grupos, los cuales fueron tratados siete días antes de la infección con 12 x 104 Trypanosoma cruzi, cepa Ninoa. Los animales en el grupo testigo (n = 7) recibieron solución salina estéril por vía intraperitoneal (ip); los del grupo Lc–O (n = 8), Lactobacillus casei vía oral, y los del grupo Lc–IP (n = 8) recibieron L. casei vía ip. Los ratones tratados con lactobacilos mostraron un número reducido de parásitos sanguíneos después de la confrontación, en comparación con el grupo testigo (P < 0.01). A su vez, los ratones tratados con L. casei vía ip mostraron un número total significativamente menor de parásitos sanguíneos después de la confrontación, que el observado en el grupo tratado con L. casei vía oral (P < 0.05). Los resultados sugieren que el tratamiento de ratones, tanto por vía oral como ip con L. casei, induce respuesta protectora contra la infección experimental con Trypanosoma cruzi cepa Ninoa.
Palabras clave: Trypanosoma cruzi, Lactobacillus casei, Adyuvante, Resistencia.
Introducción
Trypanosoma cruzi es un protozoario parásito que produce la infección conocida como enfermedad de Chagas o tripanosomiasis americana, que es transmitida naturalmente por insectos vectores triatomineos hematófagos a cerca de 150 especies de mamíferos domésticos y silvestres. Esta enfermedad es una zoonosis que se encuentra presente en 18 países del continente americano en dos zonas ecológicas diferentes: la región del Cono Sur y la región de Centroamérica y México.1 Entre las especies de animales domésticos que infecta T. cruzi se encuentran: bovinos,2 cabras,3 cerdos4 y perros.4,5 En 2002, la Organización Mundial de la Salud informó que alrededor de 17.4 millones de personas estaban afectadas por la enfermedad de Chagas.6 En 2001 se estimó que 156 488 personas en México estaban infectadas con T. cruzi.7 En 2003 se determinó una prevalencia de la infección de 13 millones, de 3 a 3.3 millones de casos sintomáticos e incidencia anual de 200 mil casos en 15 países.1 Para 2005 se estimó que sólo en Guanajuato estaban en riesgo de infectarse 3 755 380 individuos, con una incidencia anual de 3 500 casos nuevos.8 Con base en lo anterior y en un análisis de información publicado en los últimos 76 años, se considera que en México la enfermedad de Chagas es de los males parasitarios más importantes.9
La tripanosomiasis es un problema de salud prioritario entre otras razones debido a: a) la necesidad de vigilancia y control en áreas donde los vectores silvestres pueden invadir las viviendas; b) los costos médicos y sociales del cuidado de la gente infectada, debido a la falta de una terapia bien tolerada, especialmente contra la forma crónica de la enfermedad.1 Asimismo, el tratamiento se debe administrar a los pacientes cuando la enfermedad se encuentra en la fase aguda, lo cual es muy difícil de detectar, no hay tratamiento preventivo, y hasta el momento no existe vacuna disponible,10 por lo que es necesario buscar alternativas para su control.
Diversos estudios han demostrado que es posible inducir resistencia no específica contra la infección por Trichinella spiralis y Babesia microti en ratones,11,12 y contra la infección por tres especies de Eimeria en pollos de engorda,13 por medio de la administración de la bacteria Lactobacillus casei. En este trabajo se evaluó el efecto de dicha bacteria sobre la infección por Trypanosoma cruzi en ratones NIH.
Material y métodos
Animales experimentales
En el estudio se usaron ratones NIH hembras, de dos y tres meses de edad, con peso promedio de 20 g, a los que se les practicó un examen coproparasitoscópico para verificar que no estuvieran parasitados. Luego, bajo condiciones adecuadas de bioterio, se alojaron en jaulas de acrílico con aserrín esterilizado y se les dio alimento comercial y agua ad libitum.
Parásito
Se utilizó la cepa Ninoa de Trypanosoma cruzi que se ha mantenido en criopreservación en nitrógeno líquido en el Departamento de Parasitología de la Escuela Nacional de Ciencias Biológicas, del Instituto Politécnico Nacional. Dicha cepa se reactiva regularmente por pases seriados en ratones NIH.
Microorganismos
Se utilizó la cepa ATCC7469 de Lactobacillus casei cultivada en medio MRS a 37°C durante 18 h. Los microorganismos fueron cosechados por centrifugación a 5 000 g por 10 min, se lavaron varias veces con solución salina estéril,11 luego se determinó la cuenta viable y finalmente se ajustó a la concentración deseada (ufc).11
Diseño experimental
Veintitrés ratones NIH fueron distribuidos al azar en tres grupos: los del grupo I (n = 7) fungieron como testigo y recibieron solución salina estéril por vía intraperitoneal (ip) el día 0. Los del grupo II (n = 8) fueron inoculados el día 0 por vía ip con 1 x 109 ufc de Lactobacillus casei, cepa ATCC–7469. A los animales del grupo III (n = 8) se les administró la misma dosis de L. casei, pero por vía oral, el día cero. Siete días después del tratamiento, cada uno de los ratones de los tres grupos fue inoculado por vía ip con 12 x 104 tripomastigotes sanguíneos de T. cruzi cepa Ninoa, que se obtuvieron de animales previamente infectados y luego se cuantificaron (en cámara de Neubauer) y se ajustaron con solución salina estéril a la concentración indicada. A partir del día tres posinfección (pi) se evaluó la parasitemia (número de parásitos/5 µL de sangre) cada tercer día, por medio de la cuantificación de parásitos sanguíneos.
Determinación de tripomastigotes sanguíneos
De acuerdo con Brener,14 se recolectaron 5 mm3 de sangre fresca de la cola de cada ratón, que fueron comprimidos entre un portaobjetos y un cubreobjetos para formar una sola capa de células sanguíneas. El número de tripanosomas en los 5 mm3 (µL) de sangre fue determinado contando los parásitos observados en 50 campos en el microscopio óptico y luego multiplicando ese número por 70.14
Análisis estadístico
Se practicó un análisis de varianza (bloques al azar) con los datos obtenidos, y cuando hubo diferencias, éstas fueron sometidas a la prueba de Tukey.15
Resultados
Los resultados indicaron que el tratamiento de ratones con Lactobacillus casei, tanto oral como intraperitoneal, redujo el número de parásitos sanguíneos, en comparación con el grupo testigo. Desde el día seis hasta el día 28 posconfrontación, se observó diferencia significativa (P < 0.01) en el promedio de tripomastigotes sanguíneos en 5 µL de sangre entre los ratones del grupo testigo y los de los grupos tratados con Lactobacillus casei (Figura 1). El máximo número promedio de parásitos (tripomastigotes en 5 µL de sangre) para los tres grupos se presentó los días 18 (30 070 + EE 7 206), 20 (2 966 ± EE 501) y 24 (6 116 ± EE 3 800), para los grupos testigo, L. casei: intraperitoneal y L. casei oral, respectivamente (Figura 1).
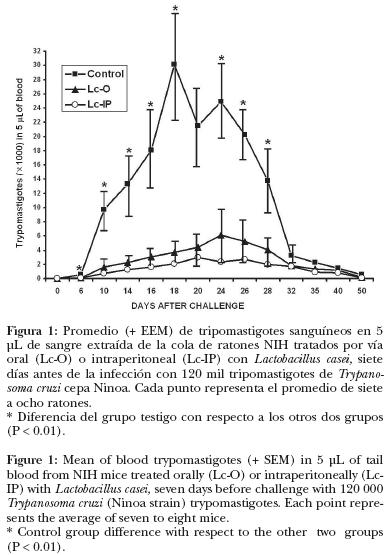
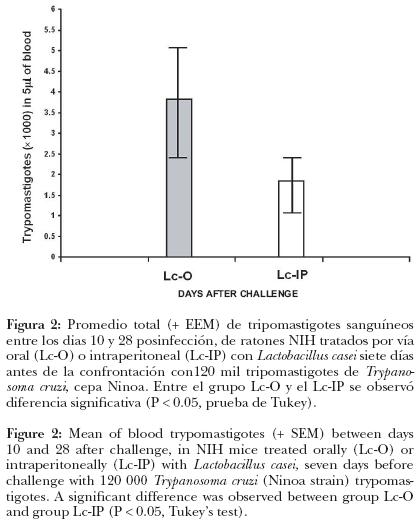
Cuando se comparó el promedio total de parásitos sanguíneos durante el periodo de parasitemia comprendido entre los días 10 y 28 posconfrontación, entre los grupos Lc–O (promedio: 3 820 + EE 1 351) y Lc–IP (promedio: 1 842.6 + EE 651.4) se observó diferencia significativa (P < 0.05) (Figura 2); este resultado indica que el tratamiento intraperitoneal con L. casei es más efectivo que el oral para generar resistencia contra Trypanosoma cruzi cepa Ninoa.
Discusión
Se ha señalado que la respuesta inmunitaria innata del portador es esencial para el control de la infección aguda por Trypanosoma cruzi16 y que es dependiente de los receptores tipo Toll (TLR, por sus siglas en inglés). Cabe señalar que los TLR son moléculas fundamentales para la activación de los mecanismos inmunitarios del portador, no sólo de la respuesta inmunitaria innata sino también de la respuesta inmunitaria adquirida.17 Estudios realizados en ratones indican que la administración oral de Lactobacillus casei estimula el sistema inmunitario a través de la inmunidad innata, que involucra la activación de los receptores tipo Toll.18 Las células NK son importantes para la respuesta inmunitaria innata, pues desempeñan un papel protector en la fase temprana de la infección por T. cruzi al producir interferón gamma, citocina que presumiblemente controla la replicación temprana del parásito en los macrófagos.19 En este contexto, en estudios previos se ha demostrado que la inoculación ip de L. casei en ratones antes de la infección con Trichinella spiralis induce la producción de interferón gamma.20 Con base en lo anterior, los resultados obtenidos aquí sugieren que la protección observada contra T. cruzi se debió a la activación de la respuesta inmunitaria innata por L. casei y son apoyados por otros estudios en los que se demostró que la administración de L. casei en pollos de engorda y en ratones NIH antes de la confrontación con protozoarios intracelulares, genera respuesta protectora contra Eimeria spp13 y Babesia microti,12 respectivamente.
La observación de que la administración de los lactobacilos por vía intraperitoneal generó mejor respuesta protectora que cuando fueron administrados por vía oral, quizá se deba a que el tejido linfoide asociado con el intestino (GALT, por sus siglas en inglés) fue directamente estimulado por las bacterias del inóculo intraperitoneal, mientras que los lactobacilos del inóculo oral estimularon al GALT de manera indirecta, o sea, la estimulación se realizó después de que las bacterias que colonizaban la mucosa intestinal murieron y luego fueron procesadas por las células inmunocompetentes del GALT.
De acuerdo con los resultados del presente estudio, se concluye que la administración de Lactobacillus casei por vía oral o intraperitoneal a ratones NIH induce respuesta inmunitaria inespecífica protectora contra la infección experimental por Trypanosoma cruzi, cepa Ninoa. Asimismo, se sugiere que se lleven a cabo más estudios para esclarecer los mecanismos involucrados en la generación de la respuesta protectora.
Referencias
1. Morel CM, Lazdins J. Chagas disease. Nat Rev Microbiol 2003;1:14–15. [ Links ]
2. Guzmán–Bracho C. Enfermedad de Chagas en Progreso, Jiutepec, Mor. I. Encuesta seroepidemiológica (tesis de especialidad). México DF: Instituto de Salubridad y Enfermedades Tropicales, Secretaría de Salud, 1985. [ Links ]
3. Rozas M, Botto–Mahan C, Coronado X, Ortiz S, Cattan PE, Solari A. Short report: Trypanosoma cruzi infection in wild mammals from a chagasic area of Chile. Am J Trop Med Hyg 2005;73:517–519. [ Links ]
4. Salazar–Schettino PM, Bucio MI, Cabrera M, Bautista J. First case of natural infection in pigs. Review of Trypanosoma cruzi reservoirs in Mexico. Mem Inst Oswaldo Cruz 1997;92:499–502. [ Links ]
5. Beard CB, Pye G, Steurer FJ, Rodriguez R, Campman R, Peterson AT et al. Chagas disease in a domestic transmission cycle in southern Texas, USA. Emerg Infect Dis 2003;9:103–105. [ Links ]
6. World Health Organization. Control of Chagas disease: second report of the WHO expert committee. UNDP/ WHO. Geneva: The Organization, 2002. [ Links ]
7. Guzman–Bracho C. Epidemiology of Chagas disease in Mexico: an update. Trends Parasitol 2001;17:372–376. [ Links ]
8. Lopez–Cardenas J, Gonzalez FE, Salazar PM, Gallaga JC, Ramirez E, Martinez J et al. Fine–scale predictions of distributions of Chagas disease vectors in the state of Guanajuato, Mexico. J Med Entomol 2005;42:1068–1081. [ Links ]
9. Cruz–Reyes A, Pickering–Lopez JA. Chagas disease in Mexico: an analysis of geographical distribution during the past 76 years – A review. Mem Inst Oswaldo Cruz, Rio de Janeiro 2006;101:345–354. [ Links ]
10. Anonimo. Department of Health and Human Services. Chagas disease. Centers for Disease Control and Prevention. Division of Parasitic Diseases. Facts sheet. 2004:1–3. [ Links ]
11. Bautista–Garfias CR, Ixta–Rodriguez O, Martinez–Gomez F, Lopez MG, Aguilar–Figueroa BR. Effect of viable or dead Lactobacillus casei organisms administered orally to mice on resistance against Trichinella spiralis infection. Parasite 2001; 8: S226–228. [ Links ]
12. Bautista–Garfias CR, Gomez MB, Aguilar BR, Ixta O, Martinez F, Mosqueda J. The treatment of mice with Lactobacillus casei induces protection against Babesia microti infection. Parasitol Res 2005;97:472–477. [ Links ]
13. Bautista–Garfias CR, Arriola MT, Trejo L, Ixta O, Rojas EE. Comparative effect between Lactobacillus casei and a commercial vaccine against coccidiosis in broilers. Téc Pecu Méx 2003;41:317–327. [ Links ]
14. Brener Z. Therapeutic activity and criterion of cure on mice experimentally infected with Trypanosoma cruzi. Rev Inst Med Trop Sao Paulo 1962;4:389–396. [ Links ]
15. Olivares Sáenz E. Paquete de diseños experimentales. Marín (NL) México: Facultad de Agronomía. Universidad Autónoma de Nuevo León, 1994. [ Links ]
16. Oliveira AC, Peixoto JR, de Arruda LB, Campos MA, Gazzinelli RT, Golenbock DT et al. Expression of functional TLR4 confers proinflammatory responsiveness to Trypanosoma cruzi glycoinositolphospholipids and higher resistance to infection with T. cruzi. J Immunol 2004;173:5688–5696. [ Links ]
17. Bautista Garfias CR, Mosqueda JJ. Papel de los receptores tipo Toll y su implicación en Medicina Veterinaria. Vet Méx 2005;36:453–468. [ Links ]
18. Maldonado Galdeano C, Perdigón G. The probiotic bacterium Lactobacillus casei induces activation of the gut mucosal immune system through innate immunity. Clin Vaccine Immunol 2006;13:219–226. [ Links ]
19. Cardillo F, Voltarelli JC, Reed SG, Silva JS. Regulation of Trypanosoma cruzi infection in mice by gamma interferon and interleukin 10: role of NK cells. Infect Immun 1996;64:128–134. [ Links ]
20, Bautista–Garfias CR, Ixta O, Orduña M, Martinez F, Aguilar B, Cortes A. Enhancement of resistance in mice treated with Lactobacillus casei: effect on Trichinella spiralis infection. Vet Parasitol 1999;80:251–260. [ Links ]














