ANTECEDENTES
En 1932 Wilson y Preece describieron, por primera vez, la historia de una mujer con fiebre reumática, con movimientos coreiformes durante el embarazo. Fue hasta 1961 que Horstiu incorporó el término corea gravidarum.1 En 1999, el American College of Rheumatology (ACR) compiló una nomenclatura estandarizada y reunió definiciones de casos para 19 síndromes neuropsiquiátricos en pacientes con lupus eritematoso sistémico, entre ellos los trastornos de movimiento.2
Suele aparecer durante el primer trimestre y remitir en el tercero; su pronóstico es bueno porque la gravedad disminuye conforme trascurren las semanas de embarazo. La corea gravídica es un padecimiento poco común, caracterizado por movimientos espontáneos irregulares, no predecibles, de duración breve, que cambian de localización sin secuencia definida3 y que poseen la particularidad de ser involuntarios. En la actualidad, su incidencia se estima en 1 caso por cada 2275 embarazos.4 Si bien su causa es idiopática se observan cuadros en los que se asocia con el síndrome de anticuerpos antifosfolipídicos, fiebre reumática, tirotoxicosis, lupus eritematoso sistémico, sífilis, enfermedad de Huntington y corea inducida por fármacos.4
En infantes, pocas veces la corea es causa de muerte. Sin embargo, en el siglo pasado se describió que en el embarazo sí suele provocarla y asociarse como causa entre el 20 al 25% de los casos. En la actualidad, gracias a las mejoras en el control prenatal no se considera, por sí sola, una enfermedad que amenace la vida, o que requiera la interrupción del embarazo, como ocurría en el pasado. En general, con las pruebas de laboratorio y los estudios de imagen se encuentra la causa de la corea. Algunos estudios asocian la corea con el lupus eritematoso sistémico como manifestación, principalmente, si la paciente no recibe tratamiento.5
El objetivo de reportar este caso clínico es sensibilizar al lector en la importante asociación entre la corea gravídica, la participación multiorgánica y el lupus eritematoso sistémico con o sin síndrome de anticuerpos antifosfolipídicos secundario para iniciar el estudio en pacientes con trastornos de movimiento de nueva aparición durante el embarazo y prevenir desenlaces perinatales catastróficos.
CASO CLÍNICO
Paciente de 30 años, en curso del primer embarazo, sin antecedentes heredofamiliares y personales patológicos relevantes, previamente sana.
El control prenatal se inició durante el segundo trimestre, previa inmunización para influenza y covid-19. El padecimiento actual dio comienzo con movimientos coreicos, pérdida ponderal y tricotilomanía a partir de las 12 semanas de gestación, momento en el que fue valorada por el neurólogo. Se le indicó tratamiento con escitalopram, clonazepam y tizanidina. Se documentó la titulación de anticuerpos antinucleares (anti-ANA) 1:320 y anticuerpos anti-ADN de doble cadena (anti-dsDNA) de 150 UI/mL, componente 3 de complemento (C3) en 126 mg/dL y componente 4 de complemento (C4) en 31 mg/dL. Posteriormente se agregó trombocitopenia de 132,000/uL y deterioro con aumento progresivo de duración y amplitud de los movimientos. Al esquema de medicación se agregaron inductores de maduración pulmonar, con betametasona a las 29.4 semanas de gestación.
Ingresó al servicio de Urgencias obstétricas del Hospital General Doctor Miguel Silva con 32 semanas de embarazo conforme al ultrasonido de la semana 19.4, con amenaza de parto pretérmino y exacerbación de los movimientos involuntarios. Durante la exploración física se encontró con alopecia difusa, funciones mentales superiores conservadas, labilidad emocional, habla hipofónica, escandida, con dificultad para recordar algunos hechos recientes, pupilas isocóricas, normorreflécticas, sin datos de focalización, sin úlceras orales. Frecuencia cardiaca de 136 lpm, peso 45 kg, talla 1.65 m, IMC 16.5, además de inconsistencia en la tensión arterial por movimientos involuntarios que impedían la toma adecuada, la que se consiguió reportó 110-78 mmHg. La frecuencia respiratoria 19 rpm, saturación de oxígeno 98%, abdomen globoso a expensas del útero gestante, con fondo uterino de 28 cm, feto único vivo, con frecuencia cardiaca fetal de 132 lpm (Figura 1). Se palpó actividad uterina irregular, al tacto vaginal el cuello del útero se sintió posterior, con 3 cm de dilatación y 50% de borramiento, de consistencia firme, feto libre, con amnios íntegro a la palpación, signos de Tarnier y Valsalva negativos. Las extremidades se encontraron íntegras, simétricas, pulsos distales palpables, adecuada fuerza, reflejos rotulianos +++/++++, sin dismetría o disdiadococinecia. Se observaron movimientos hipercinéticos en las cuatro extremidades, involuntarios, abruptos, irregulares, de duración breve, que se exacerbaban con el dolor de la contracción. El peso del feto se estimó, por ultrasonido, en 1699 gramos, percentil 16, frecuencia cardiaca fetal de 132 lpm, placenta corporal anterior y líquido amniótico con contenido máximo de 3.4 cc.
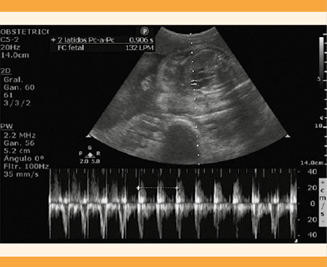
Figura 1 Ultrasonido obstétrico en modo Doppler pulsado y frecuencia cardiaca fetal de 132 latidos por minuto.
Estudios clínicos: glucosa 65 mg/dL, urea 24.7, ácido úrico 4.24 mg/dL, creatinina 0.4 mg/dL, leucocitos 8,300/µL, hemoglobina 13.9 g/dL, plaquetas 282,000/µL , hemotipo B positivo, TP 12.1 seg, INR 0.9, TPT 34.2 seg, examen general de orina con sangre 250,000, 25 mg/dL proteínas, esterasa leucocitaria 25, pH 5, densidad 1.025, DHL 683 U/L, AST 102 U/L, ALT 71 U/L, C3 1.33 mg/dL, C4 0.44 mg/dL, PCR 6.3 mg/L, bilirrubina total 0.41 mg/dL, proteínas en orina de 24 h 394 mg, CK 687, VDRL negativo, resto sin alteraciones patológicas para paciente obstétrica.
Con la clínica de ingreso se documentó con 12 puntos de los criterios de EULAR/ACR,6 que dan el diagnóstico de lupus eritematoso sistémico y 16 puntos del índice de actividad lúpica SLEDAI.7
Para continuar el protocolo de estudio y tratamiento se hospitalizó en el módulo de embarazo de alto riesgo. La neuroprotección fetal se inició con sulfato de magnesio, esquema de rescate de inductores de maduración pulmonar y uteroinhibición con calcio-antagonista. Se envió a valoración por parte del reumatólogo, neurólogo y nefrólogo y estudio de resonancia magnética de encéfalo, anticuerpos anti-P-ribosomales y nueva titulación de anticuerpos anti-dsDNA y anti-ANA y cuantificación de proteínas en 24 horas. Se indicó tratamiento con 1 mg/kg/día de prednisona, hidroxicloroquina, azatioprina, 1 mg de clonazepam por vía oral cada 8 horas y 10 gotas cada 24 horas de haloperidol.
La resonancia magnética no mostró realces anómalos luego de la administración de medio de contraste en los ganglios basales. En los bazos posteriores de la cápsula interna se identificaron depósitos minerales en ambos lados (que podría tratarse de calcificaciones). Figura 2

Figura 2 Resonancia magnética simple de encéfalo, en secuencias FLAIR, T2 GRE, T2, ADC y DWI (A-D) que muestran depósitos minerales en ambos brazos posteriores de la cápsula interna.
Al tercer día de hospitalización las cifras tensionales se reportaron en 160-100 mmHg, sin datos de encefalopatía hipertensiva; se corroboró en 150-100 mmHg, frecuencia cardiaca 99 lpm, frecuencia respiratoria 22 lpm, temperatura 36.7 ºC, frecuencia cardiaca fetal de 161 lpm, actividad uterina regular, cambios cervicales, en posición central con 4 cm de dilatación y 80% de borramiento, blando, amnios íntegro. Las extremidades se encontraron íntegras, simétricas, con pulsos distales palpables, adecuada fuerza, reflejos rotulianos +++/++++.
Continuó con la exacerbación de los movimientos hipercinéticos, involuntarios, en las cuatro extremidades con aumento de la amplitud y duración y dolor a la contracción. El informe bioquímico fue de: 250,000/uL plaquetas, CK2 476 U/l, DHL 514 U/L, AST 72 U/L, ALT 54 U/L, proteínas en orina de 24 h 394 mg, magnesio 1.9 mg/dL.
Ultrasonido renal: diferenciación corteza-médula alterada, espesor de 19 mm con ectasia pielocalicial moderada, sin evidencia de cálculos en su interior. Vascularidad en la aplicación de señal Doppler color. Figura 3
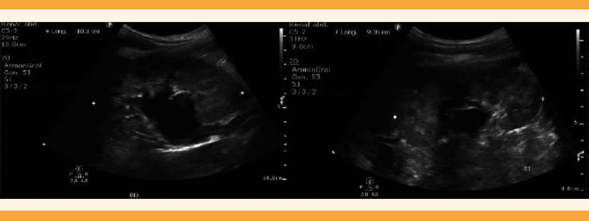
Figura 3 Ultrasonido renal bilateral en escala de grises; se observa ectasia pielocaliceal de predominio derecho, el parénquima de ambos riñones sin alteraciones morfológicas.
Se estableció el diagnóstico de preeclampsia con criterios de severidad, por cifras tensionales que se controlaron con 10 mg de hidralazina por vía intravenosa. Se agregó el deterioro neurológico, caracterizado por la exacerbación de los movimientos involuntarios. Se decidió la finalización del embarazo por cesárea, indicada por el peso estimado del feto y la rápida evolución del trabajo de parto pretérmino, a pesar de la uteroinhibición. El recién nacido, de sexo masculino, pesó1890 g, con 33 semanas de embarazo, por Capurro, Apgar al primer minuto de 7 y de 9 puntos a los 5 minutos, sin contratiempos durante la intervención. La paciente permaneció estable en sala de recuperación, con cifras tensionales de 97/65 mmHg.
Durante las primeras horas del puerperio inmediato, la paciente se encontró consciente, orientada en tiempo, espacio y persona, indiferente al medio, pupilas isocóricas, normorreflécticas, sin datos de focalización, con frecuencia cardiaca de 80 lpm, tensión arterial de 138-90 mmHg, tratada con 60 mg de nifedipino cada 12 horas, el abdomen sin datos de irritación peritoneal, con dolor a la palpación profunda en el área dela herida quirúrgica, tipo Pfannestiel, de bordes limpios y bien afrontados. No hubo rastros de sangrado activo o hematomas, las extremidades íntegras, simétricas, con pulsos distales palpables, adecuada fuerza, reflejos rotulianos ++/++++. No se observó dismetría o disdiadococinecia y disminución de los movimientos hipercinéticos involuntarios, de duración breve y de baja amplitud.
Análisis clínicos: elevación de C3 a 113 mg/dL, C4 35 mg/dL, depuración de creatinina de 115 mL/min, disminución de transaminasas y deshidrogenasa láctica: DHL 483 U/L, AST 50 U/L, ALT 50 U/L, CK 463 U/L, anticuerpos proteína P-ribosomal 0.55 unidades, anticuerpos anticardiolipina IgG e IgM menor a 2.0, anticuerpos anti-ANA 1:1280, anticoagulante lúpico 0.84, anticuerpo anti-dsDNA menor a 10 U/Ll, clínicamente con remisión de movimientos coreicos.
Se dio de alta del hospital al séptimo día de estancia intrahospitalaria por evolución satisfactoria, con tratamiento ambulatorio de 50 mg de prednisona cada 24 horas, 10 mg de escitalopram cada 24 horas, 10 gotas de haloperidol cada 24 horas, 60 mg de nifedipino cada 12 horas, con cita en la consulta externa de Neurología, Reumatología, Nefrología y Obstetricia crítica.
El recién nacido permaneció en la unidad de cuidados intensivos con requerimiento de oxígeno suplementario, con casco cefálico neonatal (FiO2 40%) y traslado al alojamiento conjunto al tercer día de vida, con frecuencia cardiaca de 133 lpm, frecuencia respiratoria 42 rpm, temperatura rectal 36.8 ºC, tensión arterial 67/42 mmHg y saturación de oxígeno de 98% aire ambiente.
Análisis de patología de la placenta: peso 351 g, corioamnionitis aguda inespecífica leve, microcalcificaciones ++, hialinización intervellosa +++, vellosidades coriales del tercer trimestre y cordón umbilical trivascular.
METODOLOGÍA
La búsqueda se emprendió en la base de datos de PubMed con los MeSH: “Chorea Gravidarum”, “Systemic lupus erythematosus”, “Neuropsychiatric lupus”, “Preeclampsia”, “Preterm labor”, “Anti-phospholipid antibody syndrome”. La búsqueda se limitó con los siguientes filtros: “Case Reports”, “Review” y “Systematic Reviews”, “Spanish and English”, de 1999 al 2023. Se encontraron 2098 estudios y se excluyeron: editoriales, reseñas, cartas al editor, artículos duplicados y estudios que reportaran otras causas de corea. Al final se seleccionaron 35 estudios, que incluían mujeres embarazadas y corea gravídica por causa autoinmunitaria y preeclampsia.
DISCUSIÓN
El lupus eritematoso sistémico es una enfermedad autoinmunitaria compleja, que causa disfunción de múltiples órganos y tejidos.8 Las anomalías patológicas dominantes esta enfermedad se atribuyen a la alteración de la respuesta inmunitaria adaptativa y a la acumulación de complejos antígeno-anticuerpo, lo que da lugar a respuestas autoinmunitarias graves y lesiones orgánicas.9,10 El lupus eritematoso sistémico afecta a mujeres de todas las edades, pero sobre todo a las de edad fértil.11,12 Se ha informado que esta afección no reduce la tasa de fertilidad,13,14 pero sí la de éxito del embarazo. Las mujeres embarazadas con lupus eritematoso sistémico son más propensas a desenlaces adversos del embarazo, caracterizados por complicaciones en la madre (brotes de lupus, lesión renal, preeclampsia, hipertensión y tromboembolismo venoso) y feto-neonatales (aborto espontáneo, parto prematuro, retraso del crecimiento intrauterino), bloqueo cardiaco congénito y lupus neonatal.14,15
En un embarazo saludable, el volumen intravascular aumenta, lo que conduce a un estado de hipercoagulabilidad, formación de tromboembolismo y secreción de citocinas inflamatorias y fibrinógeno. Sin embargo, estas manifestaciones promueven el inicio de los desenlaces adversos del embarazo asociados con lupus eritematoso sistémico.16
Para el diagnóstico de la paciente del caso se recurrió a los criterios de clasificación de la Liga Europea contra el Reumatismo y del American College of Rheumatism de 2019 donde ANA se define positivo en cualquier momento, como criterio de ingreso requerido ≥ 1:80 y se describe que no es necesario que se cumplan simultáneamente y si la puntuación es de 10 o más y cumple, al menos, un criterio clínico, la enfermedad se clasifica como lupus eritematoso sistémico.6
La corea es el trastorno del movimiento más común del lupus eritematosos sistémico que padecen del 2 al 3% de los pacientes17,18 e, incluso, en un mayor porcentaje los niños. El parkinsonismo, la ataxia y el hemibalismo son relativamente raros. La corea suele manifestarse durante los primeros años de la enfermedad. Todo parece indicar que los anticuerpos implicados cruzan la barrera hematoencefálica, se unen a los antígenos neuronales e inducen este síntoma. En la resonancia magnética nuclear del cerebro no se han podido demostrar cambios significativos en los pacientes con lupus neuropsiquiátrico coreico, como sucedió en la paciente del caso.19
En el lupus eritematoso sistémico sin síndrome antifosfolipídico secundario, (SLE-aPL) como sucedió en la paciente del caso, las manifestaciones clínicas se caracterizan por una corea aislada de las extremidades; en 39% de los casos se acompaña de otros signos neurológicos: ataxia, disartria, migraña, epilepsia, distonía y déficits cognitivos; las características psiquiátricas se describieron en el 30%.20
Los ataques de corea gravídica tienden a ser más graves en mujeres que tienen su primer episodio durante el embarazo. La tasa estimada de recaída entre los previamente afectados por corea gravídica es de entre 4 y 25%, pero esto no debería ser una contraindicación absoluta para futuros embarazos.21
En cuanto a los estudios complementarios, la resonancia magnética cerebral se reporta normal en un 50%, como sucedió en la paciente del caso. Algunas de las anormalidades informadas en la bibliografía son lesiones isquémicas de los ganglios basales (a veces ipsilaterales a la hemicorea y, por lo tanto, de relevancia incierta) e hiperintensidades T2 no específicas que involucran la sustancia blanca subcortical o los hemisferios cerebrales. En solo dos casos de síndrome antifosfolipídico secundario los hallazgos de imagen sugerían vasculitis.22
El-Sayed y sus colegas analizaron cinco embarazos con lupus neuropsiquiátrico, y tres resultaron con actividad neurológica durante el embarazo. En el primer caso hubo episodios frecuentes de convulsiones y cefalea, con déficit cognitivo, desorientación, alteraciones de la memoria y del habla en el plazo de un año. El embarazo trascurrió sin otras complicaciones maternas, pero se detectó oligohidramnios a las 39 semanas. El segundo caso tuvo convulsiones durante el embarazo y el puerperio, preeclampsia y signos de sufrimiento fetal crónico, lo que resultó en un parto prematuro. La última paciente resultó con corea y estado mental alterado desde las 11 semanas, con preeclampsia severa posterior y restricción del crecimiento fetal que requirió finalizar el embarazo a las 26 semanas; el neonato falleció a los 71 días de vida.23 De acuerdo con lo descrito en la bibliografía hay diferentes manifestaciones de lupus neuropsiquiátrico; los anticuerpos P-ribosomales son de valor diagnóstico limitado, sensibilidad del 21% y especificidad del 13% para psicosis lúpica, esto explicaría las bajas concentraciones séricas en la paciente del caso.24
Uno de los enigmas clínicos más desafiantes es diferenciar el brote de lupus de la preeclampsia. Incluso hasta el 20% de los embarazos con lupus se complican con preeclampsia. Esta diferenciación no es meramente académica porque la preeclampsia se trata con finalización inmediata del embarazo mientras que el brote de lupus se trata con inmunosupresión. Si bien ambas afecciones pueden manifestarse con hipertensión y proteinuria, es menos probable que el análisis de orina en la preeclampsia revele un sedimento activo que en un brote de lupus. La trombocitopenia es común en ambos, en la paciente del caso se observó la elevación sérica de las concentraciones de plaquetas; sin embargo, mantenía pruebas de función hepática elevadas aunado a la elevación de cifras tensionales que son más indicativas de preeclampsia que a nefritis lúpica. Las elevaciones también pueden observarse por el antecedente de tratamiento con tizanidina. En los brotes de lupus suele haber recuentos de leucocitos, concentraciones de complemento y ácido úrico más bajas que en la preeclampsia,25,26 que bioquímicamente pueden diferenciarse con la disminución de complemento, elevación de la titulación de anticuerpos anti-dsDNA. En este caso la paciente tuvo disminución en la titulación de anticuerpos y elevación del complemento durante el puerperio inmediato. La preeclampsia ocurre en 5 a 8% de la población general de embarazadas, pero aumenta a 13 a 35% en el embarazo con lupus. El riesgo de preeclampsia en el embarazo con lupus está relacionado con la prednisona y la nefritis lúpica. La causa o causas son inciertas, pero los factores angiogénicos y el sistema del complemento juegan un papel. La tirosina cinasa-1 similar a fms soluble, es un antagonista del factor de crecimiento endotelial vascular y está elevada en pacientes con lupus y preeclampsia.27,28La aspirina, en dosis bajas, iniciada antes de la semana 16 de embarazo redujo la preeclampsia en la población general embarazada.29
Desde el punto de vista numérico, el parto prematuro es mucho más frecuente que la pérdida del embarazo en la gestación lúpica. Son varios los factores que contribuyen, incluida la actividad de la enfermedad y la preeclampsia, pero a menudo no se encuentra ningún factor causal aparente.27 La paciente del caso reunió tres complicaciones asociadas con el embarazo secundarias a la actividad lúpica demostrada con la elevación de la titulación de anti-dsDNA: amenaza de parto pretérmino, avance del trabajo de parto a pesar de la uteroinhibición y preeclampsia con criterios de severidad.8
De Jesús y colaboradores, en un estudio de cohorte, sugieren que las manifestaciones neuropsiquiátricas del lupus durante el embarazo son poco frecuentes y no están directamente relacionadas con desenlaces obstétricos adversos. La superposición de enfermedades renales parece conferir un mayor riesgo a los desenlaces del embarazo. Se necesitan más estudios, con mayor cantidad de pacientes, para evaluar mejor el comportamiento de las pacientes con lupus neuropsiquiátrico durante el embarazo y optimizar el tratamiento.30
Elisa Menozzi y coautores revisaron múltiples informes de casos únicos de corea y los clasificaron en tres grandes grupos: síndrome primario de anticuerpos antifosfolipídicos, lupus eritematoso sistémico con síndrome antifosfolipídico secundario o no. En las pacientes del tercer grupo coexistió, respectivamente, la corea en el 82%. El tiempo entre el inicio de la corea y el diagnóstico de lupus fue después del inicio de la corea en 25%, afectación principal en 67%, solo en miembros aislados y 33% generalizado. El 32% de las pacientes tuvieron afectación psiquiátrica, 50% con resonancia magnética sin hallazgos patológicos, 75% con recuperación clínica satisfactoria en el puerperio y 30% con recurrencia posterior al primer episodio de corea.20 La coexistencia de corea con anticuerpos antifosfolipídicos positivos se asocia casi invariablemente. A pesar de ello el espectro clínico puede variar. La corea es uno de los 19 síndromes neuropsiquiátricos asociados de forma causal con el lupus eritematoso sistémico.31
Todas las mujeres con lupus, embarazadas, deben continuar con la hidroxicloroquina. En virtud del riesgo de preeclampsia se recomienda agregar aspirina, en dosis bajas, al final del primer trimestre. Para brotes no renales durante el embarazo se recomienda la dosis más baja posible de prednisona. Para los brotes renales es conveniente la terapia combinada de azatioprina con tacrolimus.32 La paciente del caso se trató con prednisona y azatioprina, por la disponibilidad hospitalaria, y su evolución fue favorable.
La patología placentaria de los embarazos con lupus ha demostrado características de vasculopatía inflamatoria comparables con la preeclampsia, quizá la enfermedad más grave y potencialmente mortal del embarazo. En particular, un infiltrado no infeccioso más sólido de neutrófilos intactos y trampas extracelulares de neutrófilos en el espacio intervelloso de la placenta coexistió tanto en el lupus como en la preeclampsia,33 en comparación con los embarazos de evolución normal. Un mecanismo propuesto recientemente para el aumento de la disfunción endotelial, la trombosis y la perpetuación del medio inflamatorio observado en el lupus implica el aumento de las trampas extracelulares de neutrófilos en la circulación, la piel y los tejidos renales.34,35 Este proceso inflamatorio agudo explica cómo, a pesar de la útero-inhibición, no fue posible remitir el fenotipo contráctil en la paciente del caso.
CONCLUSIÓN
Puesto que existe una gran variedad de manifestaciones clínicas propias del lupus eritematoso sistémico, es importante reportarlas para que el reto diagnóstico y terapéutico se vuelva un procedimiento menos complejo, que permita advertir las complicaciones mayores tardías asociadas con las enfermedades autoinmunitarias durante el embarazo.
El control prenatal del primer trimestre es decisivo para un desenlace favorable de las pacientes. El inicio temprano de la inmunoterapia determinará los desenlaces perinatales y disminuirá la morbilidad y mortalidad asociadas. La corea es una manifestación clínica incapacitante, de ahí la importancia de identificar su causa e indicar el tratamiento oportuno.
La relevancia de reportar este caso de corea gravídica, con ausencia de anticuerpos antifosfolipídicos positivos, consiste en sistematizar el estudio en pacientes con trastornos de movimiento de nueva aparición durante el embarazo, como una las manifestaciones clínicas asociadas con las enfermedades autoinmunitarias, como el lupus eritematoso sistémico, identificar los factores de riesgo desde el control prenatal, establecer el diagnóstico oportuno y prevenir desenlaces catastróficos asociados.











 nueva página del texto (beta)
nueva página del texto (beta)


