ANTECEDENTES
La diabetes mellitus gestacional es la que se inicia o diagnostica, de novo, durante el embarazo.1 Se origina por los cambios en el patrón de secreción de la insulina y las modificaciones en su sensibilidad de acción.2 La causa de la diabetes mellitus gestacional aún no se ha esclarecido del todo; algunos estudios se han enfocado en explicarla tomando en cuenta la susceptibilidad genética.
Los receptores activados por proliferadores proxisómicos (PPARs) son algunas de las moléculas vinculadas con la causa de la diabetes mellitus gestacional, que son los que controlan la expresión de genes que codifican a las proteínas implicadas en el metabolismo de la glucosa y de los lípidos.
El principal regulador de la diferenciación celular del adipocito y la modulación intracelular de eventos implicados en la expresión de la insulina es el tipo PPARg. Está demostrado que éste, y algunas de sus variantes genéticas, además de ser importante para la maduración de la placenta y el buen desarrollo fetal se asocia con: obesidad, diabetes y sensibilidad a la insulina y complicaciones obstétricas,3-7 específicamente el polimorfismo del PPARg de la prolina sustituida con una alanina en el aminoácido 12 (Pro12Ala) definida por un cambio del codón CCA de la prolina (Pro) por GCA de la alanina (Ala).8,9 El alelo Ala también se ha vinculado con una actividad reducida del PPARg; y en un metanálisis reciente se demostró que esta variante se asocia, también, con diabetes mellitus gestacional, con un riesgo reducido en asiáticas.10 En México, el polimorfismo y su frecuencia se han evaluado en población general y ha quedado de manifiesto su asociación con la ganancia de peso, obesidad central y alteraciones metabolicas;11-14 sin embargo, no se ha evaluado en diabetes mellitus gestacional. Por esto, el objetivo de la investigación fue: determinar la frecuencia del alelo Ala en una muestra de mujeres mexicanas con diabetes mellitus gestacional y asociar su repercusión en la glucemia.
MATERIALES Y MÉTODOS
Estudio ambispectivo, observacional, transversal y correlacional efectuado en una cohorte de pacientes con diabetes gestacional atendidas entre los meses de enero a junio del 2014 en el Hospital Militar de Especialidades de la Mujer y Neonatología de la Secretaría de la Defensa Nacional en la Ciudad de México. Criterios de inclusión: mujeres embarazadas, primigestas o multigestas, de cualquier edad, con único diagnóstico de diabetes mellitus gestacional basado en los criterios de la American Diabetes Association,15 que aceptaron participar voluntariamente en el estudio y que se hospitalizaron en la sala de alojamiento conjunto del Hospital Militar de Especialidades de la Mujer y Neonatología de la Secretaría de la Defensa Nacional en la Ciudad de México. Criterios de exclusión: mujeres con diagnósticos o complicaciones adicionales a la diabetes mellitus gestacional, pacientes con expediente obstétrico incompleto. Criterios de eliminación: muestras de ADN insuficientes para los análisis o sin amplificación en PCR.
Las pacientes firmaron el consentimiento informado y llenaron el cuestionario de recolección de datos clínicos y antecedentes de importancia. El protocolo fue aprobado por el comité de Bioética del hospital.
Detección del polimorfismo
Se obtuvieron muestras de ADN para evaluar el polimorfismo, a partir de mucosa oral mediante un cepillado del carrillo bucal que se sumergió en un tubo con buffer de extracción que se almacenó a -20ºC para su posterior análisis. Todos los procedimientos se llevaron a cabo con apego a los protocolos incluidos en los equipos y reactivos utilizados que describen y recomiendan los fabricantes. La extracción del ADN se efectuó con un equipo DNeasy Blood & Tissue (QIAGEN, UK) y posteriormente se cuantificó por espectrofotometría.16 Se utilizó como templado para llevar a cabo una reacción en cadena de la polimerasa (PCR). La PCR se llevó a cabo considerando las recomendaciones del fabricante en un volumen final de 25 µL que contenía: 0.5 U Taq polimerasa (Invitrogen, Life Technologies, USA), 2.5 mM de MgCl2, 0.2 mM de cada uno de los cuatro dNTPs, buffer para la enzima Taq polimerasa (Invitrogen, Life Technologies USA),1 M de cada uno de los cebadores sentido (5´CACAGCTGGCTCCTAATAGGACA3´ y antisentido 5´GCGATAGCAACGAGCTAAGCAT3’) diseñados en el programa Primer Express 2.0© desarrollado por Applied Biosystem (Applied Biosystems, USA) y 100 ng de ADN proveniente de las muestras. La reacción se efectuó con condiciones de reacción de 94 ºC, 5 min, 32 ciclos a 94 ºC 30 seg, 60 ºC 30 seg y 72 ºC 30 seg y finalizó a 72 ºC 5 min en un termociclador GeneAmp PCR System 9700 de Applied Biosystem (Applied Biosystems, USA).
Los productos de PCR se visualizaron en un gel de agarosa al 2%; posteriormente, los fragmentos se purificaron en un equipo ExoSAP-IT® (Applied Biosystems, US), enseguida se les realizó la PCR de secuencia con el equipo Big Dye (Applied Biosystems, USA), y finalmente se secuenciaron en un secuenciador automático 3130 de Applied Biosystems™(Applied Biosystems, USA). Las secuencias obtenidas se analizaron en el programa BioEdit Sequence Alignment Editor©. Ver 7.2.
Análisis estadístico de los datos
Los datos clínicos se expresaron con medias ± desviación estándar. La asociación del alelo Ala con la glucemia y otras variables clínicas se estableció por comparación entre los grupos con y sin el alelo Ala. Se aplicó la prueba de t de Student o Mann-Whitney según si las variables cumplían, o no, con la prueba de normalidad, respectivamente. La comparación de frecuencias entre grupos se hizo con la prueba de χ2. Los análisis estadísticos se procesaron en el programa Sigma Stat ver 2.03 SPSS, Inc. El valor de p menor a 0.05 se consideró con significancia.
RESULTADOS
Se estudiaron 81 pacientes; sus características se resumen en el Cuadro 1. Destaca el hecho de que las pacientes, a pesar de ser diabéticas, estaban debidamente controladas porque reportaron concentraciones de glucemia (93.5 ± 32.79 mg/dL) y valores de presión arterial (112/72 mmHg) en límites de normalidad. Los resultados del análisis del polimorfismo se representan en la Figura 1; se detectaron variantes homocigotas para ambos alelos además de heterocigotas. Las frecuencias de los genotipos encontrados se describen en el Cuadro 2, 10 de 81 pacientes eran portadoras del alelo Ala, 70 de 81 en forma heterocigota (Pro/Ala) y una paciente en forma homocigota (Ala/Ala). El Cuadro 3 compara las características clínicas entre pacientes con el alelo y sin éste; en quienes tenían el alelo Ala los valores de glucemia fueron mayores, lo mismo que los antecedentes de abortos.
Cuadro 1 Características de la población de estudio
| Característica | N=81 |
|---|---|
| Glicemia (mg/dL) | 93.5 ± 32.7 |
| Edad (años) | 29 ± 5.5 |
| IMC (kg/m2) | 29.1 ± 4.46 |
| Presión sistólica (mmHg) | 112 ± 21.9 |
| Presión diastólica (mmHg) | 72 ± 13.8 |
| Embarazos | 181 |
| Hijos nacidos a pretérmino | 14 |
| Abortos | 16 |
| Peso promedio del recién nacido (g) | 3322 ± 499 |
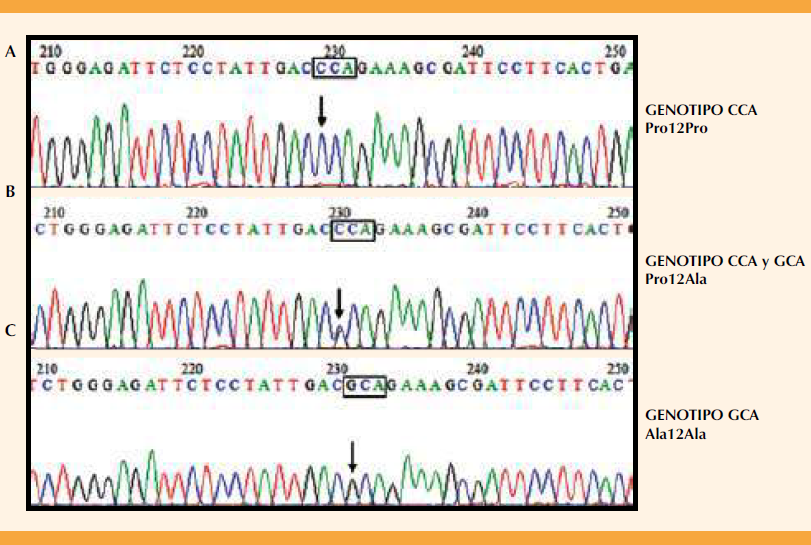
Figura 1 Electroferogramas representativos de los genotipos detectados. A. Genotipo Pro12Pro, B. Genotipo Pro12Ala, el *remarca los dos nucleótidos empalmados (G y C) en el electroferograma C. Genotipo Ala12Ala.
Cuadro 2 Frecuencia de genotipos y frecuencia del allelo Ala para el polimorfismo Pro12Ala del gen PPARg
| Polimorfismo Pro12Ala | Pacientes n (%) |
|---|---|
| n | 81 |
| Pro/Pro (CC) | 70 (86.4) |
| Pro/Ala (CG) | 10 (12.3) |
| Ala/Ala (GG) | 1 (1.2) |
| Frecuencia del alelo Ala | 6 (7.4) |
Cuadro 3 Caracteristicas clinicas de pacientes con y sin el alelo Ala
| Característica | Genotipo Pro12Pro (n=70) | Genotipo Pro12Ala y Ala12Ala (n=11) | p |
|---|---|---|---|
| Glicemia (mg/dl) | 101.1 ± 33.6 | 70.1 ± 49.7 | 0.044* |
| IMC (kg/m2) | 29.5 ± 4.7 | 28.6 ± 3.2 | 0.499 |
| Peso del bebe (g) | 3284 ± 498 | 3563 ± 456 | 0.095 |
| Presión sistólica (mmHg) | 112.8 ± 23.1 | 111.8 ± 12.5 | 0.783 |
| Presión diastólica (mmHg) | 71.6 ± 14.5 | 73.6 ± 8.1 | 0.805 |
| Antecedentes de abortos n (%) | 11 (7.2) | 5 (16) | 0.036** |
| Antecedentes de nacidos pretérmino n (%) | 13 (8.6) | 1 (3.3) | 0.392 |
p< 0.05, significancia estadistica, *cálculo con U de Mann-Whitney ** cálculo con χ2
DISCUSIÓN
En este estudio se exploró el polimorfismo Pro12Ala del gen PPARg en una población de mujeres con diabetes mellitus gestacional; se demostró un buen control médico se reflejó en una glucemia dentro de parámetros normales. La frecuencia de la variante Ala reveló valores muy similares a los datos reportados en México en análisis de poblaciones de nativos y mestizos mexicanos.12,13 Además, las frecuencias genéticas de los genotipos detectados fueron similares a las de mujeres con diabetes mellitus gestacional en algunas otras poblaciones estudiadas, como la española, brasileña y francesa17,18,19 La frecuencia de la variante Ala detectada en esta población fue más alta que en los reportes de mujeres con diabetes mellitus gestacional de origen asiático.10,20 Esto confirma la influencia de la etnia y diversidad de la población cuando coexiste la variante.
Los resultados demostraron menores concentraciones de glucosa en las pacientes con el alelo Ala. Este resultado sugiere que el alelo Ala puede tener un efecto protector en contra de la hiperglucemia en el embarazo. Prácticamente está descrito lo mismo en otros trabajos, como el de Taylor y colaboradores, en población brasileña.18 Quizá este comportamiento en el alelo Ala se deba a la influencia de la cercanía genética con esa población. Aunque también puede deberse a la interacción con otros genes, como se demostró en un estudio en el que se evaluó, en una población México-americana la interacción del alelo Ala con polimorfismos del gen HNF4, en el que se observó influencia en la sensibilidad de la insulina.21
Por lo que se refiere al índice de masa corporal, en este ensayo se observó similar en mujeres con y sin el alelo Ala, en contraste con otros reportes que han puesto en evidencia la ganancia de peso en madres con la variable Ala en el embarazo respecto de las madres sin el alelo.9,22 En reportes de población general mexicana que señalan a los portadores del alelo Ala asociados con ganancia de peso e, incluso, sobrepeso y obesidad.11-14 En ese estudio debe considerarse que el peso está modulado porque las mujeres tenían control de su dieta. En ese estudio solo se detectó un peso ligeramente mayor en hijos de madres portadoras del alelo Ala, pero no se demostró una diferencia estadísticamente significativa.
Por lo que se refiere a los antecedentes de las pacientes estudiadas, no se detectaron diferencias significativas entre la frecuencia del parto pretérmino entre mujeres con y sin el alelo Ala, pero sí se detectaron antecedentes de un mayor porcentaje de abortos en mujeres portadoras del alelo Ala que en las no portadoras. Este hallazgo pudiera respaldarse con el hecho de que se conoce que la variante Ala disminuye la actividad de PPARg 5 y se ha reportado en un modelo murino que la deficiencia de PPARg interfiere con la diferenciación terminal del trofoblasto y la vascularización placentaria, lo que lleva a un adelgazamiento miocárdico severo y a la muerte.23Sin embargo, lo aquí encontrado contrasta con el reporte de Meirhaeghe y colaboradores del 2007 en el que se muestra la asociación entre el alelo Ala con mayor riesgo de parto pretérmino y la evidencia de que el alelo Ala puede proteger, moderadamente, del aborto.24 Entonces, debido a que la información reportada al respecto de la variante Ala en este tipo de estudios es limitada, se requieren más evidencias para confirmar este hallazgo. Una limitante importante de este estudio fueron las pocas muestras exploradas.











 nova página do texto(beta)
nova página do texto(beta)


