ANTECEDENTES
La preeclampsia es un síndrome y una de las principales causas de mortalidad materna en el mundo;1 afecta del 5 al 9% de los embarazos.2 Solo en Latinoamérica y el Caribe está reportado que las enfermedades hipertensivas del embarazo fueron la segunda causa (22.1%) de muerte materna en el año 2015.3 Con base en esto puede concluirse que la preeclampsia tiene una repercusión importante en la mortalidad materna.
La preeclampsia incrementa el riesgo futuro de padecer hipertensión crónica, enfermedad cardiaca isquémica, accidente cerebrovascular y muerte por algún evento cardiaco, que puede suceder incluso hasta 15 años después del primer embarazo con preeclampsia.4,5 También se ha estudiado el antecedente de algún trastorno hipertensivo durante el embarazo: 1 de cada 5 mujeres con este factor tendrá preeclampsia en alguno de los próximos embarazos.6
De manera análoga sigue investigándose respecto de las posibles intervenciones preventivas para reducir el riesgo de preeclampsia; por el momento, el consumo de aspirina en bajas dosis es la única intervención farmacológica recomendada.7,8,9 Por lo anterior, el objetivo de esta revisión fue: sintetizar la evidencia disponible de los últimos 10 años respecto de la indicación de la aspirina para prevenir la preeclampsia y sus complicaciones en embarazos de alto y moderado riesgo.
METODOLOGÍA
Se llevó a cabo una revisión sistemática de artículos reunidos de fuente secundaria conforme a las directrices de la declaración PRISMA (Preferred Reporting Items for Systematic reviews and Meta-Analyses).10 La estrategia PICO se aplicó para cada base, se definió como población (P) a embarazadas con alto o moderado riesgo de preeclampsia; como intervención (I) la indicación temprana (inicio ≤16 semanas de embarazo) y diaria de bajas dosis de aspirina (≤150 mg), como comparación (C) mujeres embarazadas con alto o moderado riesgo que no reciben aspirina, la reciben en altas dosis o la toman después de las 16 semanas; y como desenlaces (O): preeclampsia en el embarazo actual.
Criterios de elegibilidad
Se seleccionaron publicaciones con población de embarazadas de alto o moderado riesgo de preeclampsia, que evaluaran la administración sola de aspirina en dosis bajas (≤150 mg) diarias y tempranas (≤16 semanas), de tipo experimental, con diseño de ensayo clínico aleatorizado, controlado a texto completo, con apego a la declaración de Helsinki o aprobado por una institución que resguarde los derechos humanos en las investigaciones. Se consideraron investigaciones primarias en idioma inglés o español publicadas entre el 1 de enero de 2010 y el 1 de enero de 2020.
Fuentes de información
Se revisaron cinco bases de datos electrónicas de acceso libre [Pubmed/Medline, ProQuest, Lilacs, HINARI y Cochrane Central Register of Controlled Trials (CENTRAL)]. Dos coautores de la revisión examinaron el título y el resumen de los estudios identificados y recuperaron las publicaciones de texto completo susceptibles de elección. Se evaluó la calidad y dos coautores de la revisión extrajeron, de forma independiente, los datos; los desacuerdos se resolvieron con la participación de un tercer coautor.
Búsqueda
La terminología de búsqueda fueron términos MESH (Medical Subject Headings) y DeCS (Descriptores en Ciencias de la Salud), disponibles en http://www.ncbi.nlm.nih.gov/meshy http://decs.bvs.br, respectivamente. Los descriptores seleccionados para cada componente de la estrategia inicial fueron: 1) para Población (P): “Pregnancy” y “Pregnancy, High risk”; 2) para Intervención (I): “Pre-Eclampsia”, “Aspirin” y “Randomized Controlled Trial”; y 3) para Resultados (O): “Aspirin” explode, “Pre-eclampsia” explode, “high-risk pregnancy” OR “high-risk pregnant women” OR “increased risk of pre-eclampsia”, “aspirin therapy” OR “aspirin prophylaxis” OR “low-dose aspirin”, “aspirin therapy” OR “aspirin prophylaxis” OR “low-dose aspirin”, “Pre-eclampsia” OR “Pre-eclampsia prevention”, “randomized controlled trial”. El algoritmo de búsqueda empleado fue: #1 AND #2 AND #3 que se usó en todas las bases de datos, excepto en Lilacs, pues dicho buscador usa, en español, los operadores booleanos.
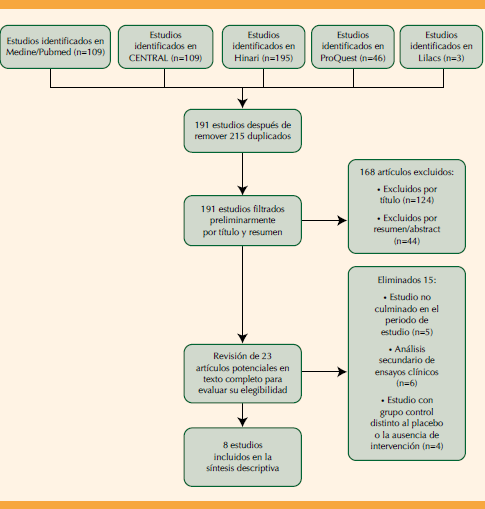
Después de aplicar la estrategia de búsqueda planteada se identificaron 410 artículos en las bases de datos (CENTRAL = 109; Medline/Pubmed = 57; HINARI = 195; ProQuest = 46; LILACS = 3) de los que se eliminaron 215 por duplicidad, 168 por tamizaje del título y resumen; y 15 por no cumplir con los criterios de elegibilidad priorizados. A partir de todo este proceso solo se incluyeron ocho artículos en la revisión; es decir, ensayos clínicos controlados, aleatorizados y con diseño analítico experimental (Figura 1). Para evaluar la calidad de los estudios seleccionados para la revisión se utilizó la escala de Jadad11 (Cuadro 1). Además, se revisaron otros artículos para ilustrar el tema, entre ellos algunos de revisiones sistemáticas con fines comparativos de esta revisión.
Cuadro 1 Evaluación de la calidad de los estudios seleccionados con la escala de Jadad11
| Escala de Validación de Ensayos Clínicos | P1 | P2 | P3 | P4 | P5 | P6 | P7 | P8 | |
|---|---|---|---|---|---|---|---|---|---|
| P1: Haapsamo et al12 P2: Jamal et al13 P3: Ayala et al14 P4: Villa et al15 P5: Odibo et al16 P6: Liu et al17 P7: Rolnik et al18 P8: Hoffman et al19 | |||||||||
| ¿Se describe el estudio como aleatorizado? (*) | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | |
| ¿Se describe el estudio como doble ciego? (*) | 1 | 0 | 1 | 1 | 1 | 0 | 1 | 1 | |
| ¿Se describen los abandonos y las exclusiones del estudio? (*) | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | |
| ¿Es adecuado el método de aleatorización? (**) | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | |
| ¿Es adecuado el método de doble ciego? (**) | 1 | -1 | 1 | 1 | -1 | 1 | 1 | 1 | |
| TOTAL | 5 | 2 | 5 | 5 | 4 | 4 | 5 | 5 | |
| (*) SÍ = 1 / NO = 0 (**) SÍ = 1 / NO = -1 Rango de puntuación: 0-5 Estudio de baja calidad: puntuación <3 | |||||||||
Elaboración propia.
RESULTADOS
El estudio se integró con mujeres que quedaron embarazadas durante procedimientos de reproducción asistida,12 pacientes con síndrome de ovario poliquístico, que es un factor de riesgo de preeclampsia13 y seis estudios seleccionados se integraron con embarazadas con algún factor de alto o moderado riesgo de preeclampsia.14-19 Cuadro 2
Cuadro 2 Características de los estudios seleccionados
| Autores | Diseño del estudio | Cegamiento | Población | País | Ámbito |
|---|---|---|---|---|---|
| Haapsamo M, et al12 | Ensayo clínico controlado aleatorizado multicéntrico | Doble ciego | Pacientes asistidas mediante fertilización in vitro (IVF) y microinyección intracitoplasmática espermática (ICSI). | Finlandia | 4 centros de infertilidad |
| Jamal A, et al13 | Ensayo clínico controlado aleatorizado | Simple ciego | Embarazadas con síndrome de ovario poliquístico. | Irán | Hospital Shariati de la Universidad de Teherán |
| Villa P, et al14 | Ensayo clínico controlado aleatorizado | Doble ciego | Gestantes con factores de riesgo para PEa y notch diastólico bilateral de segundo grado en ultrasonido Doppler color (12-14 semanas). | Finlandia | Clínicas de maternidad en 10 hospitales finlandeses |
| Ayala D, et al15 | Ensayo clínico controlado aleatorizado, prospectivo | Doble ciego | Gestantes de alto riesgo para HTA gestacional o preeclampsiab. | España | No registrado |
| Odibo A, et al16 | Ensayo clínico controlado aleatorizado | Doble ciego | Gestantes con alto riesgo de preeclampsia según escala de factores de riesgo efectuada en el primer trimestreC | Estados Unidos | No registrado |
| Liu F, et al17 | Investigación clínica aleatoria controlada unicéntrica | No registrado | Gestantes con alto riesgo de síndrome de HIEd. | China | Hospital de Shandong, China |
| Rolnik D, et al18 | Ensayo clínico controlado aleatorizado multicéntrico | Doble ciego | Gestantes con embarazo único en alto riesgo para preeclampsia pretérminoe. | Reino Unido, España, Italia, Bélgica, Grecia e Israel | 13 hospitales de maternidad |
| Hoffman M, et al19 | Ensayo clínico controlado aleatorizado multicéntrico | Doble ciego | Gestantes nulíparas con embarazo único. | India, Guatemala, Pakistán, Kenia, Zambia, República Democrática del Congo | 7 sedes de la Red Global para la Investigación en Salud de Niños y Mujeres (2 en India y 1 sede en cada país) |
| a) factores de riesgo (edad <20 o >40 U obesidad o hipertensión crónica o síndrome de Sjögren o antecedente de diabetes gestacional o preeclampsia o neonato pequeño para la edad gestacional o feto muerto) b ) Factor de riesgo: historia familiar o personal de hipertensión gestacional o preeclampsia o historia personal de aborto espontáneo U obesidad o nulípara adolescente o de la edad media (extremos) c) escala que mide la presencia de: historia de factores de riesgo (obesidad, diabetes mellitus, antecedente de preeclampsia, hipertensión crónica), doppler de arterias uterinas, medida de proteína A plasmática asociada al embarazo (< 0.52 MoM) d) edad ≥40 O IMC ≥35 o historia familiar de preeclampsia o historia de gestación múltiple o historia de trastorno hipertensivo o nefrosis crónica o enfermedad autoinmune como lupus eritematoso sistémico y síndrome de anticuerpos antifosfolípidos o diabetes tipo 1 o 2 o hipertensión crónica controlada e) El riesgo fue determinado mediante la combinación de diversos factores estructurados en un algoritmo de screening (factores maternos, presión arterial media, índice de pulsatilidad de la arteria uterina, factor de crecimiento placentario y proteína A plasmática asociada al embarazo). | |||||
Características de la administración de aspirina
La dosis media de aspirina administrada en las intervenciones de los 8 estudios fue de 99 mg, con una desviación estándar de 22.72; es decir, con límites de 80 y 150 mg. Los ocho estudios compararon la administración de la aspirina con placebo,12-19 uno de ellos tuvo dos grupos de intervención: aspirina y metformina,13 comparados con los de no intervención; mientras que otro estudio tuvo tres grupos de intervención e igual cantidad con placebo.(15)
En relación con el momento de la administración de la aspirina, en todos los estudios fue diaria, con inicio antes de las 16 semanas. Solo en un estudio12 su administración fue antes del inicio del embarazo porque la población intervenida era de mujeres en protocolos de reproducción asistida. De los siete estudios con asignación al azar, dos13,19 comenzaron la administración de aspirina antes o a las 12 semanas de embarazo. La media de semanas de embarazo al momento de la administración de la aspirina en los siete estudios fue de 11.88 (DE ± 1.7) semanas. La finalización de la administración de la aspirina señalada en los estudios fue en las últimas semanas previas al parto o en el momento del parto: un estudio hasta las 35 semanas,14 otro hasta las 36 semanas;18 dos hasta la semana 37;16,19 y cuatro hasta el momento del parto.12,13,15,17 Cuadro 3
Cuadro 3 Características de las intervenciones de los estudios seleccionados (continúa en la siguiente página)
| Autores | Participantes* | Grupo de intervención** | Grupo control | Detalles de la intervención y control |
|---|---|---|---|---|
| Haapsamo M, et al12 | 487 | Intervención: administración de 100 mg de aspirina por vía oral (n = 52a) | Placebo (n = 55b) | La intervención o el placebo se administraron a partir del primer día de la estimulación gonadotrópica hasta la menstruación o test de embarazo negativo. Si se dio el embarazo, ambos se continuaron hasta el parto. |
| Jamal A, et al13 | 105 | Intervención 1: administración diaria de 80 mg de aspirina por vía oral (n = 35c) Intervención 2: administración de 2000 mg de metformina, dos veces al día, por vía oral (n = 35c) | No intervención (n = 35c) | Ambas intervenciones se iniciaron a las 12 semanas de gestación, tiempo en el que se realizó el Doppler de arterias uterinas y se mantuvieron hasta el parto. |
| Villa P, et al14 | 152 | Intervención: administración diaria de 100 mg de aspirina por vía oral (n = 61d) | Placebo (n = 60d) | La intervención y el placebo se iniciaron entre las 12 y 14 semanas y se mantuvieron hasta las 35 semanas o hasta el parto, según fuera el caso. |
| Ayala D, et al15 | 350 | Intervención: administración diaria de 100 mg de aspirina por vía oral en tres momentos del día: al despertar (momento 1), a las 8 horas de haber despertado (momento 2) y al dormir (momento 3) [n = 176/ I1 (n = 58), I2 (n = 59), I3 (n = 59)] | Placebo [174/(n = 59), P2 (n = 57), P3 (n = 58)] | La aspirina y el placebo se iniciaron entre las 12 y 16 semanas, manteniéndose hasta el día del parto. Se reforzó la adherencia a cada modalidad del tratamiento, ya sea de aspirina o placebo, en cada visita de seguimiento. Se instó a las participantes a registrar las actividades cotidianas en un diario. |
| Odibo A, et al16 | 53g | Intervención: administración diaria de 81 mg de aspirina por vía oral (n = 16e). | Placebo (n = 14f) | La intervención y el placebo se iniciaron entre las 11 y 14 semanas y se mantuvieron hasta las 37 semanas o hasta el parto, según fuera el caso. La adherencia se evaluó mediante el retorno de los medicamentos no usados y los envases de los usados, además de instruir a las participantes a registrar la toma de medicamento en un diario. |
| Liu F, et al17 | 115 | Intervención: administración de 100 mg de aspirina por vía oral (n = 50l). | Placebo (n = 48m) | La intervención y el placebo se iniciaron antes de las 16 semanas y se mantuvieron hasta el inicio del trabajo de parto. |
| Rolnik D, et al18 | 1776 | Intervención: administración diaria de 150 mg de aspirina por vía oral (n = 798n) | Placebo (n = 822ñ) | La intervención y el placebo se iniciaron entre las 11-14 semanas y finalizaron a las 36 semanas de gestación. Se evaluó la adherencia mediante la devolución de tabletas por parte de las participantes en cada visita. Una adherencia ≥ 85% fue considerada buena; en tanto que, una adherencia entre 50%-84.9% fue moderada y <50%, pobre. |
| Hoffman M, et al19 | 11976 | Intervención: administración diaria de 81 mg de aspirina por vía oral (n = 5787o) | Placebo (n = 5771p) | Las participantes recibieron medicación durante dos semanas. Se evaluaron: el apego, efectos secundarios, los contactos médicos y medicaciones concomitantes. La adherencia ≥ 90% fue considerada alta. La intervención y el placebo iniciaron entre las 6 y 14 semanas y mantuvieron hasta las 36 semanas y 7 días o hasta el parto. Para asegurar la adherencia, las pacientes recibieron un respaldo de tabletas en caso de daño o pérdida de las entregadas cada 2 semanas. |
| * Cantidad total de participantes asignadas aleatoriamente a cada grupo de estudio. ** Participantes incluidas en el análisis. | ||||
| a) 242 tratadas inicialmente (transferencia de embrión exitosa en 227 y solo en 52 de ellas se logró un embarazo con feto vivo y fueron incluidas en el seguimiento) b) 245 tratadas inicialmente (transferencia de embrión exitosa en 229 y solo en 55 de ellas se logró un embarazo con feto vivo, las cuales fueron incluidas en el seguimiento) *TOTAL: 107 fueron estudiadas en el seguimiento c) no hubo pérdidas ni descontinuación del tratamiento d) 31 excluidas del análisis e) 26 inicialmente y 16 al final (10 abandonos) f) 27 inicialmente y 14 al final (13 abandonos) g) 74 declinaron y 16 no eran elegibles de 138 con screening positivo de un total de 1470 h) 12 excluidas de la asignación de 44 elegibles porque desistieron i) 8 excluidas y 5 pérdidas durante el seguimiento j) inicialmente asignadas 130, de las cuales 6 retiraron el consentimiento y dos se perdieron en el seguimiento k) inicialmente asignadas 127, se excluyeron 2 y se perdieron 3 en el seguimiento l) 58 casos inicialmente (2 desistieron del tratamiento, 2 pérdidas en el seguimiento, 4 con índice de prueba anormal) m) 57 casos inicialmente (4 desistieron del tratamiento, 5 pérdidas en el seguimiento) n) 78 retiraron el consentimiento y 2 se perdieron en el seguimiento de las 878 asignadas ñ) 74 retiraron el consentimiento y 2 se perdieron de las 898 asignadas o) dos tipos de análisis (intento modificado para tratar (n = 5787) e intento para tratar (n = 5794)) TOTAL: 5990 asignadas inicialmente p) dos tipos de análisis (intento modificado para tratar (n = 5771) e intento para tratar (n = 5979)) TOTAL: 5986 asignadas inicialmente. | ||||
La calidad de los estudios se evaluó mediante la escala de Jadad,11 que evalúa tres aspectos fundamentales de un ensayo clínico como parte de su validez interna: asignación aleatoria, cegamiento y el seguimiento de los participantes. Al aplicar la escala, el estudio de Jamal y coautores13 fue de baja calidad (p = 2) porque fue de cegamiento simple. En cuanto a los demás estudios, dos obtuvieron cuatro puntos, que fueron los de Odibo y colaboradores16 y Liu y su grupo.17 En el primero no se precisó el método de cegamiento, mientras que en el segundo no se describió como doble ciego, a pesar de mencionar que las aspirinas y placebos tuvieron la misma apariencia, color y sabor. Los cinco estudios restantes obtuvieron cinco puntos. Cuadro 3
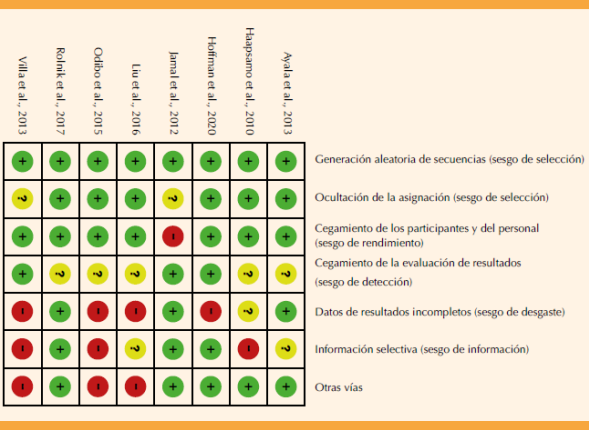
Evaluación del riesgo de sesgo
Al aplicar la herramienta propuesta por la colaboración Cochrane20 se obtuvieron los siguientes resultados. Figura 2
Sesgo de selección:
Generación aleatoria de la secuencia: todos los estudios con bajo riesgo de sesgo.
Ocultamiento de la asignación: seis estudios con bajo riesgo de sesgo, pero dos con riesgo de sesgo no claro.
Sesgo de realización: un estudio con riesgo de sesgo no claro y dos estudios con riesgo de sesgo no claro, las razones: el cegamiento de los participantes y el personal de investigación. El resto de los estudios fue de bajo riesgo de sesgo.
Sesgo de detección: cinco estudios con riesgo de sesgo no claro debido al cegamiento de los evaluadores y el resto con bajo riesgo de sesgo.
Sesgo de desgaste: tres estudios con bajo riesgo de sesgo por reporte de datos incompleto; mientras que cuatro tuvieron alto riesgo y uno riesgo no claro.
Sesgo de notificación: tres estudios con bajo riesgo de sesgo debido al reporte selectivo de resultados; tres estudios con alto riesgo de sesgo y dos, con riesgo no claro.
Otros sesgos: cinco estudios con alto riesgo de sesgo respecto a este ítem y los estudios restantes con riesgo bajo respecto al mismo ítem.
En síntesis, el 58.9% de los estudios seleccionados tenían bajo riesgo de sesgo, el 21.5% sesgo no claro y el 19.6% alto riesgo.
Características de las participantes
Se asignaron al azar, a cada uno de los grupos de estudio, un total de 15,014 participantes. Los límites de edad se detallan en el Cuadro 4
Cuadro 4 Edad de las participantes según grupo de estudio
| Autor | Edad | Criterio de inclusión | |
|---|---|---|---|
| Intervención aspirina | Grupo de comparación | ||
| Haapsamo, et al12 | 31.4 ± 3.4 (I) | 31.3 ± (P) | < 40 |
| Jamal, et al13 | Grupos homogéneos en edad | 18-40 | |
| Ayala, et al15 | 31.1 ± 5.2 (I) | 30.3± 5.3 (P) | ≥18 |
| p = 0.175, 30.7±5.3 | |||
| Villa, et al14 | 30.8 ±5.3 (I) | 31 ± 5.1 (P) | No especifica* |
| Odibo, et al16 | 30 ± 5 (I) | 31.6 ± 6.1 (P) | No especifica |
| p = 0.45 | |||
| Liu, et al17 | 26.6 ±5.2 (I) | 25.3 ± 5.8 (P) | No especifica** |
| Rolnik, et al18 | 31.5 (I) | 31.4 (P) | ≥18 |
| Hoffman, et al19 | Grupos homogéneos en edad | 14-40 | |
| I: intervención, I1: intervención 1, I2: intervención 2, P: placebo (consultar el Cuadro 2) | |||
| *Incluye participantes menores de 20 y mayores de 40 años porque fueron uno los factores de riesgo de inclusión **La mínima edad encontrada fue de 21 años y la máxima de 36. | |||
Elaboración propia.
Aspirina comparada con placebo y con no intervención
Incidencia de preeclampsia: de los 8 artículos analizados, 7 reportaron en sus resultados preeclampsia. Ayala,15 Liu y sus colaboradores17 comunicaron una reducción significativa de preeclampsia en las participantes del grupo que recibió aspirina. En el estudio de Ayala15 las participantes eran embarazadas con alto riesgo de preeclampsia e hipertensión gestacional, en el grupo de intervención asignado a recibir una dosis diaria de aspirina de 100 mg (desde antes de la semana 16 hasta el momento del parto) solo el 6.3% resultó con preeclampsia en algún momento del embarazo, mientras que el 12.6% del grupo que recibió el placebo, tuvo la misma complicación (p = 0.041, IC95%: RR = 0.49; IC95%: 0.25-0.97). Así que, la aspirina en dosis de 100 mg redujo en un 51% el riesgo de preeclampsia. Por el lado del estudio de Liu y colaboradores17 también se reportó menor incidencia de preeclampsia en el grupo asignado a recibir aspirina, las participantes eran embarazadas con alto riesgo de hipertensión inducida por el embarazo y recibieron una dosis diaria de 100 mg de aspirina o placebo antes de la semana 16 hasta el inicio del trabajo del parto. En el grupo que recibió aspirina, el 6% tuvo preeclampsia (3 de 50), mientras que el grupo que recibió placebo, un 20.8% (10 de 48) experimentó la complicación (p = 0.030, IC95%). En este estudio se registraron 17 pérdidas de participantes por lo que solo se analizó a 98 de 115 participantes, no se hizo la estimación de la repercusión de estas pérdidas en el resultado encontrado; por lo tanto, el riesgo relativo fue significativo (0.29) con un IC95%: 0.084-0.997, la conclusión a la que se llegó en este estudio fue que la aspirina, en dosis de 100 mg redujo el riesgo de preeclampsia en un 71%. En el resto de los estudios, si bien es cierto no reportó hallazgos significativos en la preeclampsia, la mayor parte muestra una menor frecuencia de preeclampsia en comparación con el placebo. Cuadro 5
Cuadro 5 Incidencia de preeclampsia en cada estudio
| Autor | Incidencia de preeclampsia | Definición del desenlace | |
|---|---|---|---|
| Aspirina | Placebo | ||
| Haapsamo, et al12 | 4/52 (7.7%) | 4/55 (7.3%) | Criterios ACOG |
| p = 0.7, IC 95% | |||
| Jamal, et al13 | 2/35 (5.7%) | 4/35 (11.4%) | PA ≥140/90 mmHg con albuminuria ≥0.3 g/24 h. |
| p = 0.58, IC 95% | |||
| Ayala, et al15 | 11/176 (6.3%) | 22/174 (12.6%) | Hipertensión gestacional con proteinuria ≥0.3 g/24 h después de las 20 semanas en una mujer previamente normotensa. |
| p = 0.041, IC 95%, RR = 0.49, IC 95%: 0.25-0.97 | |||
| Villa, et al14 | 8/61 (13.1%) | 11/60 (18.3%) | PA ≥140/90 mmHg en dos medidas consecutivas con albuminuria ≥0.3 g/24 h. |
| RR = 0.7, IC 95%: 0.3-1.7 | |||
| Odibo, et al16 | 3/16 (18.8%) | 3/14 (21.4%) | Criterios ACOG |
| RR = 0.88; IC95%: 0.21-3.66 | |||
| Liu, et al17 | 3/50 (6%) | 10/48 (20.8%) | Guías NICE 2010 |
| p = 0.030, IC95%, RR = 0.29, IC95%: 0.084-0.997 | |||
| Hoffman, et al19 | 150/5943 (2.5%) * | 141/5936 (2.4%) * | No especificado |
| RR = 1.06, IC 95%: 0.85-2.33, p = 0.591 | |||
| *Preeclampsia o eclampsia | |||
Elaboración propia.
Incidencia de preeclampsia con parto pretérmino en embarazadas con alto o moderado riesgo de preeclampsia: en dos estudios se reportó la ocurrencia de este evento. Rolnik y su grupo18 menores casos de preeclampsia pretérmino antes de las 17 semanas con relevancia estadística en embarazadas con gestaciones únicas y alto riesgo de preeclampsia pretérmino que recibieron aspirina en comparación con las que tomaron placebo. En los casos de parto pretérmino antes de las 34 semanas, no se reportaron hallazgos significativos. En el estudio de Hoffman y coautores19 se reportó una reducción significativa de la ocurrencia de trastornos hipertensivos con parto pretérmino antes de las 34 semanas en embarazadas nulíparas con gestación única.
Incidencia de preeclampsia con parto a término en embarazadas con alto o moderado riesgo de preeclampsia: solamente el estudio de Rolnik y colaboradores18 reportó la ocurrencia de preeclampsia con parto a término, sin significación estadística (p = 0.95; IC99%: 0.57-1.57).
Complicaciones de preeclampsia en embarazadas con alto o moderado riesgo de preeclampsia (Cuadro 6)
Cuadro 6 Complicaciones de preeclampsia en embarazadas con alto o moderado riesgo
| Complicación | Autor | Aspirina | Placebo | Definición del desenlace |
|---|---|---|---|---|
| Eclampsia | Liu, et al17 | 1/50 (2%) | 6/48 (12.5%) | |
| p = 0.044, IC95%, RR = 0.16, IC95%: 0.02-1.28 | ||||
| RCIU | Haapsamo, et al12 | 2/41 (4.9%) * | 3/40 (7.5%) * | Peso al nacer <percentil 5 en la curva de crecimiento de la población finlandesa |
| p = 0.68, IC95% | ||||
| Jamal, et al13 | 1/35 (2.9%) | 2/35 (5.7%) | Peso <percentil 10 para la edad gestacional | |
| p = 0.36; IC95% | ||||
| Ayala, et al15 | 16/176 (9.1%) | 32/174 (18.4%) | No especificado | |
| p = 0.011, IC95%, RR = 0.49, IC95%: 0.28-0.86 | ||||
| *Denominador: embarazos con feto único | ||||
| PEG | Villa, et al14 | 2/61 (3.3%) | 6/60 (10%) | Peso al nacer <-2 DE (desviación estándar) |
| RR = 0.3, IC95%: 0.1-1.6 | ||||
| Odibo, et al16 | 1/16 (6.3%) | 1/14 (7.1%) | Peso al nacer < percentil 10 para las semanas de gestación | |
| RR = 0.88, IC95%: 0.06-12.72 | ||||
| Rolnik, et al18 | 2/798* | 7/822* | Peso al nacer menos del percentil 5 | |
| OR = 0.29, IC99%: 0.03-2.48 | ||||
| 5/798** | 13/822** | |||
| OR = 0.41, IC99%: 0.10-1.63 | ||||
| 6/798*** | 9/822*** | |||
| OR = 0.71, IC99%: 0.18-2.82 | ||||
| Hoffman, et al19 | 1506/5492 (27·4%) | 1564/5467 (28·6%) | Estándares de la INTERGROWTH-21 st sobrecrecimiento fetal | |
| RR = 0.95, IC95%: 0.90-1.01, p = 0.171 | ||||
| *PEG con PE menos de 34 semanas, ** PEG con PE mensos de 37 semanas, ***PEG con PE ≥37 semanas | ||||
| HAP | Ayala, et al15 | 6/176 (3.4%) | 9/174 (5.2%) | |
| p = 0.415, IC95% | ||||
| Hoffman, et al19 | 26/5761 (0.5%) | 25/5746 (0.4%) | ||
| RR = 1.03; IC95%: 0.60-1.79, p = 0.900, IC95% | ||||
| HPP | Ayala, et al15 | 3/176 (1.7%) | 6/174 (3.5%) | |
| p = 0.303, IC95% | ||||
| Hoffman, et al19 | 54/5928 (0·9%) | 43/5907 (0·7%) | ||
| RR = 1.25, IC 95%: 0.84-1.86, p = 0.274, IC 95% | ||||
| pH umbilical | Haapsamo, et al12 | Aspirina (n = 52) | Placebo (n = 55) | |
| 7.25 (0.06) | 7.24 (0.07) | |||
| p = 0.98, IC 95% | ||||
| Mortalidad materna | Hoffman, et al19 | Aspirina (n = 52) | Placebo (n = 55) | |
| 9/5958 (0.2%) | 12/5948 (0.2%) | |||
| RR = 0.75; IC95%: 0.32-1.78, p = 0.514 | ||||
Elaboración propia.
Eclampsia: solo Liu y su grupo17 demostraron una reducción significativa en la ocurrencia de eclampsia en embarazadas con alto riesgo de trastorno hipertensivo que recibieron 100 mg de aspirina (1 de 50) desde antes de la semana 16 hasta el inicio del trabajo del parto en comparación con las embarazadas que recibieron placebo (6 de 48).
Síndrome de HELLP: solo Villa y colaboradores14 reportaron un caso de esta complicación en una embarazada con preeclampsia diagnosticada antes de la semana 34 en el grupo que recibió el placebo.
Restricción del crecimiento intrauterino: Ayala y colaboradores15 reportaron un hallazgo significativo relacionado con esta complicación. En la investigación se dieron 16 y 32 casos de restricción del crecimiento intrauterino de un total de 176 y 174 embarazadas con alto riesgo de preeclampsia que recibieron 100 mg de aspirina diaria por vía oral o placebo, respectivamente, desde antes de la semana 16 hasta el momento del parto (p = 0.011, IC95%). A partir de la estimación del riesgo relativo, se obtuvo una reducción significativa del riesgo de ocurrencia de restricción del crecimiento intrauterino de un 51% en el grupo de aspirina en comparación con el de placebo. Esta investigación demostró que la administración de aspirina nocturna u ocho horas después de despertar disminuye la ocurrencia de restricción del crecimiento intrauterino (5.1%) en comparación con la ingesta al despertar (18.1%, p < 0.001).
Pequeño para la edad gestacional: cuatro estudios14,16,18,19 reportaron el hallazgo de neonatos pequeños para la edad gestacional, pero ninguno alcanzó relevancia estadística.
Desprendimiento prematuro de placenta: ningún estudio incluyó la ocurrencia de desprendimiento prematuro de placenta como complicación de preeclampsia en el reporte de resultados. Rolnik y coautores18 reportaron casos de desprendimiento prematuro de placenta sin preeclampsia, por ello no se consideró.
Hemorragia anteparto: dos estudios15,19 reportaron esta complicación pero ninguno alcanzó relevancia estadística. En el estudio de Ayala y su grupo15 el desenlace se comparó en relación con el momento de la ingesta de aspirina: 8 horas después de levantarse o al momento de ir a dormir (3.4%), en comparación con el momento de despertar (4.7%); la diferencia no fue estadísticamente significativa (p = 0.555, IC95%).
En otros dos estudios se reportaron los volúmenes de sangre perdidos antes y después del trabajo de parto. En el ensayo de Hasspsamo y colaboradores12 las embarazadas del grupo que recibió aspirina perdieron una media de 682 ± 478 mL de sangre en comparación con ± 633 mL de sangre que perdieron las embarazadas del grupo placebo, sin diferencia significativa. En el caso de Liu y coautores17 las embarazadas que recibieron aspirina perdieron menor volumen de sangre antes, durante y después del trabajo de parto en comparación con las embarazadas del grupo placebo [(67.3 ± 15.2 mL en comparación con 92.5 ± 16.8 mL, p = 0.031, IC95%), (142.5 ± 24.3 mL en comparación con 235.4 ± 25.7 mL) y (125.8 ± 26.9 mL en comparación con 193.6 ± 25.8 mL, p = 0.017, IC95%), respectivamente].
Hemorragia posparto: solo dos15,19 estudios reportaron su ocurrencia pero ninguno alcanzó significación estadística. En el estudio de Ayala y su grupo15 el desenlace se comparó según el momento de la ingesta de aspirina en el día. Se demostró menor ocurrencia de hemorragia posparto en el grupo de embarazadas que tomó la aspirina 8 horas después de levantarse o al momento de ir a dormir (1.7%) en comparación con las embarazadas que tomaron aspirina al momento de despertar (3%); sin embargo, la diferencia no fue estadísticamente significativa (p = 0.460; IC95%).
pH del cordón umbilical: solo un estudio13 reportó la media del pH de la arteria umbilical, con una media similar entre los grupos (p = 0.98; IC95%).
Mortalidad materna: solo en el estudio de Hoffman y colaboradores19 se reportó una frecuencia total de 21 muertes maternas y una razón de mortalidad materna de 151 muertes maternas por cada 100,000 nacidos vivos en el grupo de aspirina en comparación con 202 muertes maternas por cada 100,000 nacidos vivos en el grupo que recibió placebo, pero la diferencia no tuvo relevancia estadística.
Preeclampsia con y sin criterios de severidad en embarazadas con alto o moderado riesgo de preeclampsia: solo dos estudios13,16 reportaron casos de preeclampsia severa o con criterios de severidad; sin embargo, ninguno de los resultados tuvo relevancia estadística. El ensayo de Haapsamo y su grupo12 consideró los criterios ACOG del 2002 para preeclampsia leve y severa, mientras que Villa y coautores14 consideraron la definición de preeclampsia severa como la coexistencia de hipertensión arterial sistólica ≥ 160 mmHg o diastólica ≥ 110 mmHg o proteinuria ≥ 5 g/24 horas. Cuadro 7
Cuadro 7 Preeclampsia con y sin criterios de severidad, según estudio
| Autor | Preeclampsia con criterios de severidad-severa | Preeclampsia sin criterios de severidad-leve | ||
|---|---|---|---|---|
| Aspirina | Placebo | Aspirina | Placebo | |
| Haapsamo, et al12 | 2/52 (3.8%) | 3/55 (5.5%) | 2/52 (3.8%) | 1/55 (1.8%) |
| p = 0.7, IC 95% | ||||
| Villa, et al14 | 3/61 (4.9%) | 8/60 (13.3%) | 5/61 (8.2%) | 3/60 (5%) |
| RR = 0.4; IC95%: 0.1-1.3 | ||||
Elaboración propia.
DISCUSIÓN
La dosis de aspirina indicada en cada una de las investigaciones varió de 80 a 150 mg por vía oral antes de las 16 semanas de embarazo. En un estudio, las dosis se administraron antes de la concepción12 debido a que se trató de una muestra de pacientes en protocolo de reproducción asistida. Se incluyeron tres estudios que iniciaron la administración de aspirina antes o en la semana 12 de embarazo. La finalización de la administración de la aspirina en los ocho estudios fue variable, mínima a las 35 semanas y máxima al momento del parto.
De los ocho artículos analizados y luego de la aplicación de la escala de Jadad, solo hubo un resultado de baja calidad.13 La evaluación del riesgo de sesgo tuvo mayor proporción de ítems de bajo riesgo; solo dos estudios (Villa y Odibo y sus correspondientes coautores14,16) tuvieron riesgo mayor, en comparación con otros.
Se analizaron ocho estudios que compararon la administración de aspirina sola con el placebo o la ausencia de intervención, de los que solo siete indagaron la incidencia de preeclampsia, pero solo los de Ayala15 y Liu y sus colaboradores15,17 evidenciaron una reducción significativa de preeclampsia a favor de las embarazadas tratadas con aspirina. En ambos estudios se expuso a embarazadas con alto riesgo de trastornos hipertensivos del embarazo a dosis diaria oral de 100 mg antes de las 16 semanas de gestación hasta cerca al parto. Los cinco estudios siguientes reportaron una menor frecuencia de preeclampsia en el grupo de aspirina en comparación con el placebo, pero sus desenlaces no alcanzaron relevancia estadística, quizá debido al riesgo de sesgo (Villa y Odibo y sus grupos14,16), a la calidad de los estudios (Jamal y colaboradores13), a ciertas características de intervención (dosis diarias de aspirina de 81 mg, que es menor a las administradas en los estudios con efectos significativos de Hoffman y coautores19 o bien a las características de las participantes (efecto en mujeres en protocolos de reproducción asistida e ICSI).12
Si bien es cierto que de los ocho estudios, seis no concluyen con un efecto significativo positivo de la aspirina en la reducción de la preeclampsia en comparación con placebo o la no intervención. Es importante considerar que los dos estudios restantes, sí concluyeron con significación estadística el efecto positivo de la aspirina; eran de buena calidad y menor riesgo de sesgo, según la escala de Chrocane.20 Estos resultados significativos guardan relación con lo comunicado por Seider y su grupo 21 (revisión sistemática de 22 ensayos clínicos) quienes estimaron un efecto reductor significativo de la incidencia de preeclampsia en dosis de aspirina ≤ 81 mg [RR = 0.92, IC95% : 0.85-0.99], además de un efecto reductor aún más pronunciado cuando las dosis superaban los 81 mg [RR = 0.74, IC95%: 0.60-0.92]; también Gan y colaboradores22 (revisión sistemática de 21 ensayos clínicos) publicaron una reducción significativa de preeclampsia al administrar bajas dosis de aspirina [OR = 0.20, IC95%: 0.11-0.35 en embarazadas del Este asiático, con OR = 0.84 e IC95%: 0.77-0.92 en embarazadas que no eran del Este asiático]. Se encontró un efecto positivo con la administración de aspirina iniciada ≤ 16 semanas en comparación con la reducción significativa del riesgo de preeclampsia en los estudios de Xu y su grupo,23 que se trató de un metanálisis de siete ensayos clínicos, [OR = 0.37, IC95%: 0.27-0.50, p < 0.00001, I2 = 44%, p = 0.05] y Cui y coautores,24 metanálisis de 10 ensayos clínicos [RR = 0.68, IC95%: 0.57-0.80; p < 0.00001, I2 = 0%, p = 0.51]. Sin embargo, los resultados no guardan relación con lo reportado en otras investigaciones, como la de Chaemsaithong y su grupo25 (metanálisis de seis ensayos clínicos aleatorizados) que concluyó que la administración de bajas dosis de aspirina antes de la semana 11, no reduce el riesgo de preeclampsia (RR = 0.52; IC95%: 0.23-1.17, p = 0.115). De igual forma, en el estudio de Roberge y colaboradores26 (metanálisis de tres estudios) no se reportó un efecto significativo con la administración de bajas dosis de aspirina iniciada ≤ 16 semanas en el riesgo de preeclampsia (RR = 0.93, IC95%: 0.75-1.15, p = 0.49, I2 = 0%, p = 0.78).
En relación con preeclampsia y parto pretérmino, dos estudios investigaron la ocurrencia de esta complicación (de buena calidad y con ítems calificados con sesgo de bajo riesgo). Hoffman y colaboradores19 reportaron una reducción significativa del 62% del riesgo de incidencia de esta complicación antes de la semana 34 en embarazadas nulíparas con gestación única que recibieron 81 mg de aspirina por vía oral, en comparación con el grupo de embarazadas con las mismas características que recibió el placebo (RR = 0.38, IC95%: 0.17-0.85, p = 0.015), de igual forma el estudio de Rolnik y coautores18 informó que la administración de 150 mg de aspirina entre las 11 a 14 hasta las 36 semanas de embarazo reduce, significativamente, el riesgo de preeclampsia con parto pretérmino antes de la semana 37 (OR = 0.38, IC95%: 0.20-0.74) en embarazadas con gestaciones únicas y con alto riesgo de parto pretérmino con características basales comparables. Los resultados guardan relación con lo informado en otros estudios, como el de Roberge y colaboradores26 que señala una reducción significativa del 48% de riesgo (RR = 0.62, IC95%: 0.45-0.87, I2 = 57%, p = 0.006) de ocurrencia de esta complicación cuando se administra una dosis ≥ 100 mg de aspirina y se inicia más o menos antes de las 16 semanas. Tambien Cui y su grupo24 (metanálisis de 6 ensayos clínicos) estimaron una reducción significativa del 65% del riesgo de ocurrencia de preeclampsia con parto pretérmino con aspirina en bajas dosis e iniciada ≤ antes de las 16 semanas (RR = 0.35, IC95%: 0.13-0.94, p = 0.04, I2 = 63%, p = 0.02). Seider y coautores21 (revisión sistemática y metanálisis de 22 ensayos clínicos aleatorizados) reportaron una reducción significativa de la incidencia de preeclampsia con parto pretérmino cuando las dosis de aspirina diaria fueron ≤ 81 mg (RR = 0.86, IC95%: 0.75-0.98). Hubo resultados contrarios cuando las dosis fueron mayores a 81 mg. A partir de la evidencia de los estudios encontrados se sugiere que la aspirina en bajas dosis reduce el riesgo de ocurrencia de preeclampsia con parto pretérmino en comparación con placebo o la no intervención.
En relación con la ocurrencia de preeclampsia con parto a término, Rolnik colaboradores18 reportaron este evento, pero sin resultados significativos, lo que guarda relación con lo hallado por Roberge y su grupo26 (metanálisis de seis ensayos clínicos) quienes no encontraron algún efecto positivo con relevancia estadística en la incidencia de preeclampsia con parto a término (RR = 0.92, IC95%: 0.70-1.21, I2 = 68%). De igual forma, Cui y coautores24 comunicaron hallazgos no significativos de la administración de aspirina en la incidencia del mismo evento (RR = 1.01, IC95%: 0.60-1.70, p = 0.96, I2 = 71%, p = 0.008). Entonces, según lo reportado por un estudio de buena calidad y bajo riesgo de sesgo, la evidencia indica que la aspirina no tiene una repercusión significativa en la ocurrencia de preeclampsia con parto a término en comparación con el placebo o la no intervención.
Por lo que se refiere al análisis de la ocurrencia y aparición de complicaciones de preeclampsia (eclampsia, síndrome de HELLP, restricción del crecimiento intrauterino, pequeño para la edad gestacional, desprendimiento prematuro de placenta, hemorragia anteparto, hemorragia posparto, pH umbilical y mortalidad materna) la incidencia reportada por Liu y su grupo17 fue de casos con menor eclampsia en el grupo de embarazadas que recibió por vía oral 100 mg/día de aspirina antes de la semana 16 hasta el inicio del trabajo de parto, en comparación con el grupo de embarazadas que recibió el placebo (p = 0.044, IC95%). Al calcular el riesgo relativo no fue significativo (RR = 0.16, IC95%: 0.02-1.28). Esta diferencia estadística puede explicarse porque en el estudio no se evaluó la repercusión de la cantidad de pérdidas y abandono de participantes desde la asignación aleatoria (14% del total de participantes). Estos resultados tienen relación con el estudio de Duley y colaboradores27 en el que se reportó que la administración de un agente antiplaquetario en comparación con placebo o la no intervención no reduce, significativamente, el riesgo de eclampsia (RR = 0.47, IC95%: 0.13-1.67). De acuerdo con la evidencia aportada por Liu y colaboradores,17 con hallazgos no significativos de la ocurrencia de eclampsia, es probable que por un sesgo de desgaste se haya subestimado el efecto de la aspirina.
En alusión a los dos estudios que investigaron la aparición del síndrome de HELLP, como complicación de la preeclampsia, solo el estudio de Villa y su grupo14 reportó un caso en el grupo que recibió el placebo, y éste fue un caso de preeclampsia temprana; sin embargo, no se pudo estimar alguna relevancia estadística, puesto que esta complicación es poco frecuente (1 a 9 casos en 1000 embarazos), pero es más frecuente en embarazos con preeclampsia severa (10 a 20%) o eclampsia (50%). Además, tiene un elevado riesgo de mortalidad materna (1 a 24%), por ello su prevención y diagnóstico temprano son decisivos.28 En esta investigación también hubo pérdidas de participantes (20.4%) asignadas aleatoriamente al inicio del estudio. Los resultados se reportaron sin estimar el efecto de estas pérdidas, la poca o nula incidencia de este evento se relaciona con lo mencionado por Duley colaboradores;27 por ello, la evidencia disponible no es clara en relación con el efecto de la aspirina en bajas dosis en la aparición del síndrome de HELLP en embarazadas con preeclampsia.
La incidencia de restricción del crecimiento intrauterino solo fue investigada en tres estudios, dos de ellos reportaron resultados no significativos y el estudio de Ayala y su grupo15 fue el único que informó menor incidencia significativa de restricción del crecimiento intrauterino en el grupo de embarazadas con alto riesgo de preeclampsia que recibió 100 mg de aspirina desde antes de la semana 16 hasta el parto, en comparación con el grupo que recibió el placebo (RR = 0.49, IC95%: 0.28-0.86). Las investigaciones al respecto reportan evidencia no clara del efecto de la aspirina en la reducción de la restricción del crecimiento intrauterino, como el estudio de Chaemsaithong y coautores25 que estimó que la aspirina en bajas dosis antes de las 11 semanas no reduce el riesgo de restricción del crecimiento intrauterino en comparación con placebo (RR = 1.10; IC95%: 0.58-2.07, p = 0.775). El ensayo de Roberge y colaboradores26 concluyó que la aspirina en un rango de 50 a 150 mg (con efecto dosis dependiente) reduce, significativamente, la restricción del crecimiento intrauterino siempre y cuando su administración inicie ≤ 16 semanas (RR = 0.56, IC95%: 0.44-0.70, p < 0.001, I2 = 0%, R2 = 100%, p = 0.044), de la misma forma Xu y su equipo23 demostraron que la aspirina en bajas dosis reduce, significativamente, un 20% el riesgo de restricción del crecimiento intrauterino en comparación con placebo (OR = 0.80, IC95%: 0.71-0.90, p = 0.0003, I2 = 37%, p = 0.08). También Cui y coautores24 demostraron que la aspirina reduce en un 29% el riesgo de la misma complicación (RR = 0.71, IC95%: 0.58-0.89, p = 0.002, I2 = 16%, p = 0.30). El ensayo de Xu y su grupo23 encontró que la aspirina en bajas dosis reduce la incidencia de preeclampsia severa en un 63% (OR = 0.37, IC95%: 0.23-0.61, p<0.0001, I2 = 11%, p = 0.35), pero no se pudo estimar si el efecto estaba relacionado con el momento de inicio de la administración (antes o después de la semana 16). La información de gran parte de estos estudios carece de resultados significativos. A partir de la información aportada por los estudios incluidos en la revisión y en comparación con lo encontrado en la bibliografía consultada no puede llegarse a un resultado concluyente porque la evidencia está dividida.
La ocurrencia de neonatos pequeños para la edad gestacional fue investigada por cuatro estudios, pero ninguno reportó resultados estadísticamente significativos. Los estudios de Villa y Odibo y sus grupos14,16 (con mayor cantidad de ítems calificados de bajo riesgo de sesgo) emplearon en sus intervenciones dosis de aspirina de 80 y 150 mg. A partir de los resultados, se asume que la aspirina no tiene un efecto significativo en la ocurrencia de neonatos con bajo peso en comparación con placebo. Estos resultados son similares a los encontrados en la bibliografía consultada, como los de Roberge y colaboradores29 que reportaron que la administración de aspirina en bajas dosis ≤ 16 semanas no reduce la incidencia del desenlace neonatal con peso bajo (RR = 0.84, IC95%: 0.56-1.26, p = 0.40, I2 = 0%, p = 0.72).
Ningún estudio evaluó la ocurrencia de desprendimiento prematuro de placenta como complicación de preeclampsia y en el caso de la bibliografía consultada la evidencia de este tema no es clara. Por un lado, Roberge y su grupo30 encontraron que la administración de aspirina con dosis inferiores a 100 mg o más o menos mayores de 100 mg iniciada antes de las 16 semanas no tuvo un efecto significativo en la incidencia de esta complicación en comparación con el grupo control (RR = 1.11, IC 95%: 0.52-2.36, p = 0.79, I2 = 0% para dosis menores de 100 mg y RR = 0.62, IC 95%: 0.31-1.26, p = 0.19, I2 = 0% para dosis ≥ 100 mg), mientras que Xu y colaboradores23 concluyeron que la aspirina en bajas dosis incrementó significativamente este evento en comparación con el grupo que recibió el placebo (RR = 1.35, IC95%: 1.05-1.73, p = 0.02, I2 = 0%, p = 0.80).
Los estudios de Ayala, Hoffman y sus correspondientes coautores,15,19 (ensayos de buena calidad y gran cantidad de ítems de bajo riesgo de sesgo) reportaron la ocurrencia de hemorragia anteparto después de la administración diaria de 81 mg o 100 mg de aspirina desde antes de la semana 16 hasta la 37 o el momento del parto, respectivamente, pero ningún resultado fue significativo. Los resultados revisados indican que la aspirina en bajas dosis no tiene un efecto significativo en la ocurrencia de hemorragia anteparto, a pesar de que el estudio de Liu y su grupo17 indica que la aspirina reduce, significativamente, el volumen de sangre perdido antes, durante y después del trabajo de parto en comparación con el placebo. Esto debido a la falta de evaluación de las pérdidas y abandonos (15%) en este efecto. Los registros de los volúmenes de sangre perdidos en el grupo placebo se consideraron normales. Estos resultados son similares a los de otras investigaciones, como la de Xu y colaboradores23 que encontraron que la administración de aspirina en bajas dosis no reduce la ocurrencia de hemorragia anteparto en comparación con el placebo (OR = 1.14, IC95%: 0.94-1.37, I2 = 12%, p = 0.34), también en el metanálisis de Roberge y coautores30 reportaron que la aspirina en dosis menores de 100 mg o ≥ 100 mg administrada ≤ 16 semanas no tiene un efecto significativo en la ocurrencia de hemorragia anteparto en comparación con el grupo control (RR = 1.11, IC 95%: 0.52-2.36, p = 0.79, I2 = 0% para dosis < 100 mg y RR = 0.62, IC 95%: 0.31-1.26, p = 0.19, I2 = 0% para dosis ≥ 100 mg).
Dos estudios investigaron la ocurrencia de hemorragia posparto (Ayala y Hoffman y sus respectivos coautores15,19) después de la administración diaria de 81 o 100 mg de aspirina desde antes de las 16 semanas hasta las 37 o el momento del parto, respectivamente. Sin embargo, sus resultados no fueron significativos. Entonces, los resultados encontrados luego de revisar estos estudios sugieren que la aspirina, en dosis bajas, no reduce la ocurrencia de hemorragia posparto en comparación con placebo. Lo mismo reportaron los estudios de Cui y Xu y sus correspondientes colaboradores23,24 en cuyos metanálisis no hallaron efectos significativos con las bajas dosis de aspirina en la ocurrencia de hemorragia anteparto (RR = 0.70, IC95%: 0.42-1.18, p = 0.18, I2 = 0%, p = 0.37 y OR = 1.03, IC95%: 0.94-1.12, respectivamente).
Ahora bien, la preeclampsia es un síndrome que se caracteriza por alta resistencia al flujo en las arterias uterinas, lo que de alguna manera afecta la circulación útero-placentaria que da lugar a la asfixia perinatal. En ese sentido, en esta revisión se investigó el efecto de la aspirina en los valores del pH umbilical porque su alteración (menos de 7) es un posible indicador de asfixia perinatal,31 también asociada con los trastornos hipertensivos del embarazo, específicamente con la preeclampsia o eclampsia. Si alguno de estos eventos sobreviene durante el embarazo, el riesgo de asfixia perinatal se incrementa en 2 a 3 veces.32 En relación con los valores del pH umbilical, solo el estudio de Haapsamo y colaboradores12 reportó la media de pH umbilical, sin diferencias significativas entre el grupo que recibió la aspirina y el que recibió placebo (p = 0.98, IC95%) y los valores fueron mayores a 7. Esto podría explicarse porque en el estudio se tuvo una incidencia similar de preeclampsia en los grupos comparados; por ello no habría una diferencia significativa de los valores de pH umbilical entre los grupos. Es posible que el pequeño tamaño de la muestra investigada no haya permitido notar las diferencias.
Solo el estudio de Hoffman y coautores19 reportó los casos de muerte materna, pero no encontró diferencias significativas entre el grupo que recibió la aspirina y el placebo (RR = 0.75, IC95%: 0.32-1.78, p = 0.514) a pesar del gran tamaño de muestra (n = 11976), tratarse del estudio con mayor proporción de ítems calificado con bajo riesgo de sesgo y de buena calidad. Los resultados son similares a los encontrados por Duley y colaboradores27 que reportaron que la evidencia no es clara respecto al efecto de los agentes antiplaquetarios en la mortalidad materna (RR = 1.75, IC95%: 0.51-5.96, I2 = 0%, p = 0.97). Por lo tanto, lo encontrado en esta revisión respecto de este evento sugiere que la aspirina no tiene un efecto significativo en la ocurrencia de muerte materna.
Los estudios de Haapsamo y Villa, y sus respetivos grupos de colaboradores12,14 (100 mg de aspirina oral antes de las 14 semanas) investigaron lo relacionado con preeclampsia con y sin criterios de severidad, pero no obtuvieron resultados significativos. Por lo tanto, se sugiere que la aspirina en bajas dosis no tiene una repercusión significativa en la ocurrencia de preeclampsia con criterios de severidad. Esto se relaciona con lo investigado por Roberge y colaboradores,30que no encontraron una reducción significativa en la incidencia de preeclampsia severa después de la administración de 60 mg de aspirina diaria iniciada ≤ 16 semanas (RR = 0.96; IC95%: 0.71-1.28, p = 0.77, I2 = 0%, p = 0.90). Sin embargo, en otro estudio de Roberge y coautores29 se reportó una reducción significativa en la incidencia de preeclampsia severa con efecto dosis dependiente en un rango de 60-150 mg de aspirina iniciada ≤ de las 16 semanas (RR = 0.47, IC95%: 0.26-0.83, p = 0.009, I2 = 60%, R2 = 100%, p = 0.008).
CONCLUSIONES
La evidencia científica señala que las bajas dosis de aspirina administrada diariamente antes de las 16 semanas reducen, significativamente, la incidencia de preeclampsia. Esto debido a su efecto reductor significativo en la incidencia de parto a término; sin embargo, la evidencia encontrada no es suficiente en cantidad y existen pocos estudios con bajo riesgo de sesgo. En relación con la indicación profiláctica de aspirina para prevención de las complicaciones de preeclampsia, la evidencia obtenida sugiere que las dosis bajas administradas diariamente antes de las 16 semanas de embarazo no tienen una repercusión significativa o su efecto no es claro en la incidencia de eclampsia, síndrome de HELLP, restricción de crecimiento intrauterino, neonato pequeño para la edad gestacional, desprendimiento prematuro de placenta, hemorragia anteparto, hemorragia posparto, pH de cordón umbilical y mortalidad materna. Además, la evidencia desprendida de esta revisión sugiere que las bajas dosis de aspirina administradas diariamente, antes de las 16 semanas, no tienen una repercusión clara en la incidencia de preeclampsia con o sin criterios de severidad.











 nova página do texto(beta)
nova página do texto(beta)