ANTECEDENTES
La enfermedad trofoblástica gestacional engloba una serie de procesos patológicos consecuencia de la proliferación aberrante del trofoblasto que resulta en una fecundación anómala. Se subdivide en dos grupos: molas hidatiformes (que incluye la mola hidatiforme completa, incompleta e invasiva) y neoplasias trofoblásticas gestacionales (la más prevalente es el coriocarcinoma), con capacidad de invasión local y metástasis.1 El National Institutes of Health y la Federation of Gynecology and Obstetrics clasifican la mola hidatiforme invasiva como neoplasia trofoblástica gestacional.2,3 Las estimaciones de incidencia de la enfermedad son inciertas. La incidencia mundial de mola hidatiforme se estima en alrededor de 1 caso por cada 1000 embarazos;1,2es mayor en países del sudeste asiático, como Malasia o Filipinas, donde la incidencia es de 7 caso por cada 1000 embarazos.1 Se estima que el 15% de los casos de enfermedad trofoblástica gestacional serán molas hidatiformes invasivas y el 5% terminarán en neoplasia trofoblástica gestacional.1 La prevalencia del coriocarcinoma en Europa es de 1 caso por cada 20,000 a 40,000 embarazos, mientras que en el sudeste asiático es de 9.2 por cada 40,000 gestaciones.4,5
Los factores de riesgo de enfermedad trofoblástica gestacional son: edad materna extrema y antecedente personal de la misma.1,2,6 Diversos estudios sostienen la implicación de alteraciones genéticas de herencia autosómica recesiva en el cromosoma 19q, que afectan al gen NLRP7 o al KHDC3L, como responsables de casos de gestación molar recurrente familiar.1,2,6 Los factores de riesgo de neoplasia trofoblástica, a partir de una enfermedad trofoblástica, son la edad materna mayor de 40 años, antecedente de la enfermedad, la cantidad de tejido trofoblástico en el momento de la evacuación, concentraciones de gonadotropina coriónica mayores de 100,000 mUI/mL, tamaño uterino mayor al esperado para las semanas de gestación y la existencia de nódulos miometriales con aumento de la vascularización.1
CASO CLÍNICO
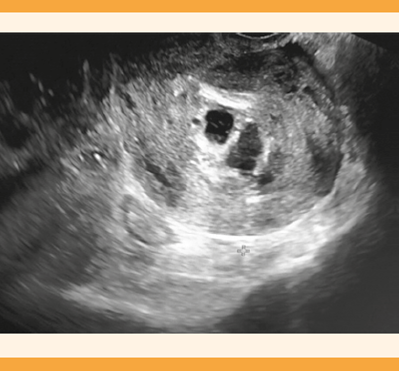
Paciente de 42 años, en el primer trimestre del embarazo, con grupo sanguíneo y Rh A positivo, fecha de la última menstruación desconocida, con antecedente de cinco abortos y un parto. Acudió a consulta por la sospecha diagnóstica de mola hidatiforme en el control rutinario de la gestación. Durante la exploración la paciente se encontró asintomática. En la ecografía transvaginal el útero se observó aumentado de tamaño, con endometrio vacuolado de 32 mm y signos de degeneración hidrópica. La cuantificación de la β-HCG fue de 205.897 UI/L. La radiografía de tórax no mostró hallazgos patológicos. Por lo tanto, se decidió practicar un legrado uterino para aspiración; el endometrio se comprobó lineal en la ecografía al finalizar intervención. Al alta hospitalaria, posterior al procedimiento, se observó disminución del 50% del valor de la β-HCG (100.788 UI/L).
En el estudio anatomopatológico de los restos evacuados se identificaron vellosidades coriales de gran tamaño con una intensa degeneración hidrópica, con formación de cisternas y una proliferación trofoblástica concéntrica que afectaba a una parte de las vellosidades. No se identificaron restos embrionarios.
El estudio inmunohistoquímico con p57 demostró la ausencia de expresión en células estromales y del citotrofoblasto, lo que confirmó el diagnóstico de mola hidatiforme completa precoz (Figuras 1 y 2). Durante el seguimiento en la consulta de Ginecología se practicaron controles semanarios de la β-HCG. Durante las dos primeras semanas las concentraciones de la β-HCG descendieron a 1.777 UI/L, posteriormente se registró un aumento superior al 10% (3.005 UI/L y 5.327 UI/L) en dos semanas. La semana previa a la determinación, la paciente comenzó con sangrado vaginal abundante y en la ecografía transvaginal coincidente con la última determinación, se objetivó un endometrio heterogéneo vacuolado de 29 mm (Figura 3). La resonancia magnética con contraste de cráneo y TAC de tórax, abdomen y pelvis no reportó hallazgos de enfermedad a distancia. Se informó a la paciente el diagnóstico de neoplasia trofoblástica gestacional y se le explicaron las diferentes posibilidades de tratamiento. La paciente se decidió por la histerectomía total, con salpingectomía bilateral en virtud de ya no desear más embarazos. El reporte anatomopatológico de la pieza quirúrgica fue de: mola hidatiforme completa sin infiltración al miometrio ni a las estructuras vasculares. La cuantificación de la β-HCG al día y a los tres días de la intervención fue de 2.976 UI/L y 900 UI/L, respectivamente. A las 3 semanas, la reducción fue notable: 34.6 UI/L. Al mes de la intervención, el valor de la β-HCG fue de 5 UI/L. La paciente permanece en seguimiento en la consulta de Ginecología general, asintomática, con determinaciones estables negativas de β-HCG y ecografías sin hallazgos.

Figura 1 (A y b). A poco aumento se observa un agrandamiento difuso de las vellosidades con formación de cisternas y edema estromal (a) H&E 4x; b) H&E 10x); c y d) A mayor aumento se observa con detalle una vellosidad con proliferación concéntrica del trofoblasto, con vasos en su estroma, sin eritroblastos (c) y d) H&E; 20x).
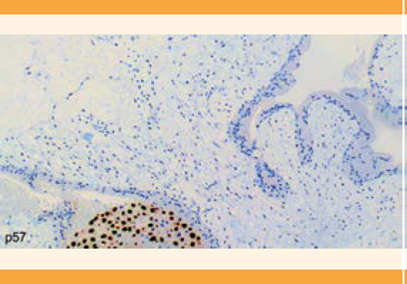
Figura 2 La tinción con p57 es positiva para el trofoblasto intermedio pero negativa para las células estromales y el citotrofoblasto que confirma el diagnóstico de mola completa (p57; 20x).
METODOLOGIA
Se efectuó una búsqueda bibliográfica en las bases de datos electrónicas: PubMed, Google Scholar y UpToDate con los términos “neoplasia trofoblástica gestacional’’, “diagnostico’’, “tratamiento’’ e “histerectomía’’. La búsqueda incluyó artículos en inglés y español publicados entre 2015 y 2022; además, se incluyeron artículos previos relacionados. Enseguida se expone la información recopilada.
DISCUSIÓN
La enfermedad trofoblástica gestacional surge a partir de una proliferación anómala del trofoblasto placentario, compuesto por citotrofoblasto, sincitiotrofoblasto y trofoblasto intermedio. El sincitiotrofoblasto invade el estroma endometrial en el momento de la implantación del blastocisto y es el tipo celular que produce la gonadotropina coriónica humana (hCG). El citotrofoblasto es responsable de la formación de las vellosidades coriónicas, mientras que el trofoblasto intermedio se localiza en las vellosidades, en el lecho de implantación y en el saco coriónico.7
La enfermedad suele tener buen pronóstico y su potencial agresivo se debe a la posible capacidad de invasión y persistencia. La clínica más frecuente es el sangrado vaginal, aunque otros síntomas suelen ser más característicos: hiperémesis, síntomas propios de hipertiroidismo o hipertensión.1 Ante la sospecha de enfermedad trofoblástica gestacional debe practicarse una ecografía transvaginal en la que puede observarse: útero aumentado de tamaño para las semanas de embarazo, trofoblasto con aspecto quístico, ausencia de partes fetales o imagen de ‘’tormenta de nieve’’ típica del segundo trimestre. La determinación de la hCG (o b-hCG en su defecto) es el marcador específico de las enfermedades trofoblásticas. La determinación de la hCG en la mola hidatiforme completa suele ser mayor de 100,000 U/L.1Ante una sospecha de enfermedad trofoblástica o una determinación de hCG mayor a la esperada para las semanas de gestación, la evacuación del producto gestacional y su posterior estudio anatomopatológico es obligada.1,2,4,8 La opción de elección es un legrado uterino evacuador con control ecográfico. Están contraindicadas las prostaglandinas como método de dilatación cervical.1,2 Es necesaria la administración de gammaglobulina anti-D en pacientes con Rh materno negativo como profilaxis de isoinmunización.1,2 Existen evidencias controvertidas con respecto a la práctica de un segundo legrado uterino evacuador en circunstancias en las que la evolución de la hCG no es descendente. Luego del diagnóstico de mola hidatiforme es necesario un estudio de extensión mediante radiografía de tórax.1
El diagnóstico de neoplasia trofoblástica gestacional se establece siempre que se de una de las siguientes circunstancias: diagnóstico anatomopatológico de tumor placentario, meseta en las concentraciones de hCG al menos durante 4 medidas en un periodo de tres semanas o por aumento de las concentraciones de hCG en tres mediciones consecutivas en un lapso de, al menos, dos semanas.1
Luego del establecimiento del diagnóstico de neoplasia trofoblástica es necesario ampliar el estudio de extensión con una TAC de tórax, abdomen y pelvis.1,5
Una vez obtenidos los datos completos de la paciente, conforme al sistema de estadiaje y factores pronóstico de la neoplasia trofoblástica propuesto por la OMS y la International Federation of Gynaecology and Obstetrics (Cuadro 1 y 2), la paciente del caso se catalogó como neoplasia trofoblástica gestacional estadio I de bajo riesgo.1,2 En función de los factores pronóstico y la estadificación, se propone un tratamiento determinado: una puntuación menor o igual a 6 supone una neoplasia trofoblástica de bajo riesgo y una puntuación mayor a 6 supone una neoplasia trofoblástica de alto o muy alto riesgo.1
Cuadro 1 Puntuación del riesgo en la NTG utilizados por la OMS y la FIGO1,2
| Variables | 0 | 1 | 2 | 4 |
|---|---|---|---|---|
| Edad | <40 | >40 | ||
| Embarazo anterior | Mola | Aborto | A término | |
| Periodo intergenésico (meses) | <4 | 4-6 | 7-12 | >12 |
| hCG al diagnóstico | <103 | 103-104 | 104-105 | >105 |
| Mayor diámetro tumoral (incluido el útero) en cm | 3-4 | 5 o >5 | ||
| Lugar de las metástasis | Pulmón | Bazo, riñón | Tracto gastrointestinal | Hígado, cerebro |
| Metástasis | 1-4 | 5-8 | >8 | |
| Quimioterapia previa | Monoterapia | 2 o más fármacos |
Cuadro 2 Estadio NTG según la FIGO1,2
| I | Enfermedad confinada al útero |
| II | Extensión de la enfermedad a los anejos o vagina |
| III | Metástasis en pulmón |
| IV | Cualquier otro lugar de metástasis |
El tratamiento recomendado para pacientes de bajo riesgo es la monoquimioterapia o cirugía en estadio I y la quimioterapia en estadios II a IV.1,9 Los agentes quimioterápicos con mayor evidencia son el metotrexato y la actinomicina D. La información disponible acerca de la superioridad de uno u otro es contradictoria.9 Una revisión de la base de datos Cochrane concluyó que la actinomicina D quizá sea superior al metotrexato; sin embargo, se asocia con mayor tasa de efectos adversos graves.10
La Sociedad Española de Ginecología y Obstetricia recomienda, como primera línea, al metotrexato,1 mientras que otras sociedades no han emitido una recomendación al respecto en cuanto a preferencia de uno u otro.9 Según la bibliografía disponible, el segundo legrado uterino evacuador en estadio I podría solucionar el cuadro sin posterior administración de quimioterápicos.4,8 La histerectomía con salpingectomía bilateral es una alternativa en la neoplasia trofoblástica de bajo riesgo. Se han descrito diversas utilidades de la cirugía en este subgrupo: tratamiento primario (22.2%), quimiorresistencia (44.4%) y sangrado-perforación uterina (33.3 %).11 Su utilidad como tratamiento primario se reserva para pacientes con enfermedad localizada en el útero y deseo genésico satisfecho.1,9 Se contempla, además, la necesidad de que haya un descenso inicial de la gonadotropina coriónica humana con posterior estabilización o elevación y deseo genésico cumplido.1 Se ha estimado una tasa de 82.4% de curación luego de una histerectomía con doble anexectomía como tratamiento primario.12 Una puntuación de riesgo mayor o igual a 5 se asocia con mayor riesgo de necesidad de quimioterapia posterior.12
En pacientes con neoplasia trofoblástica gestacional clasificadas con riesgo alto o ultra alto, el tratamiento inicial recomendado es la poliquimioterapia.1,9 La utilidad de la histerectomía, más doble salpingectomía, es opción ante una situación de quimiorresistencia, intolerancia a la quimioterapia o complicaciones como la metrorragia o el hemoperitoneo.11 Se ha propuesto la inmunoterapia (pembrolizumab) como tratamiento de la enfermedad resistente o recidivante.1,9,13
En este caso, la paciente cumplía con todos los requisitos para una histerectomía más doble salpingectomía. Fue informada de las diferentes opciones de tratamiento, sus ventajes y posibles complicaciones. La paciente se decidió por la modalidad quirúrgica.
El tratamiento inicial de la mola hidatiforme mediante histerectomía y salpingectomía bilateral sigue suscitando controversia. Con base en la evidencia disponible, en las pacientes con deseo genésico cumplido, el tratamiento quirúrgico inicial es una opción plausible; además, en pacientes mayores de 40 años podría disminuir el riesgo posterior de neoplasia trofoblástica.1,2,5,7,14,15
La bibliografía disponible acerca de la histerectomía con doble salpingectomía, como tratamiento primario en casos seleccionados de neoplasia trofoblástica gestacional, es escasa. La mayoría de los autores la consideran un co-tratamiento de la quimioterapia o en casos de quimiorresistencia.3,4,5,15,16,17
El seguimiento posterior al tratamiento quirúrgico es con determinaciones seriadas de hCG. Luego de tres determinaciones negativas se sugiere su repetición cada dos semanas durante tres meses, después cada mes hasta completar 12 meses.1,2 De la misma manera debe recomendarse un método anticonceptivo que no altera las concentraciones de la hCG con un nuevo embarazo y que permita el seguimiento correcto posterior.1,2,4
Se propone un esquema básico diagnóstico-terapéutico para pacientes con enfermedad trofoblástica gestacional. Figura 4
CONCLUSIÓN
La atención médica de pacientes con una neoplasia trofoblástica gestacional supone un reto por su relevancia clínica, sus implicaciones emocionales y repercusiones en el futuro genésico. El tratamiento histeroscópico con salpingectomía bilateral, con intención curativa de primera línea en la neoplasia trofoblástica gestacional de bajo riesgo, estadio I, en pacientes con deseo genésico cumplido es novedoso. Sin embargo, la evidencia actual acerca de su efectividad, ventajas e inconvenientes es escasa, por lo que hacen falta más estudios que ayuden a mejorar la calidad asistencial de las pacientes.











 nueva página del texto (beta)
nueva página del texto (beta)