ANTECEDENTES
En México, la tasa anual de abortos inducidos representa 33 abortos por cada 1000 mujeres entre 15 a 44 años, detrás de la mayoría de los abortos inducidos hay un embarazo no planeado y con ello el incremento en la utilización de análogos de prostaglandinas, como el misoprostol. La automedicación en etapas tempranas del embarazo se ha convertido en un problema de salud publica, donde no solo se incrementa la morbilidad materna, sino también el riesgo de malformaciones congénitas asociadas con la exposición prenatal; sin embargo, el misoprostol (como único medio farmacológico para inducción del aborto) tiene una tasa de falla del 10%. Por eso es posible que las mujeres que lo utilizan en el primer trimestre logren tener un embarazo a término.1
El misoprostol comenzó a comercializarse en Brasil en 1986, aprobado por la FDA como protector de la mucosa gástrica en pacientes con úlcera péptica asociada a la ingesta de antiinflamatorios no esteroideos. Es un análogo sintético de prostaglandina E1 que inhibe la secreción de ácido gástrico basal y nocturna mediante la estimulación directa de los receptores de prostaglandina E1 en las células parietales del estómago. Los efectos uterotónicos y bioquímicos de maduración cervical son secundarios y no terapéuticos.2,3
La exposición prenatal al misoprostol converge en un espectro de defectos congénitos que varían desde anomalías del sistema nervioso central, secuencia Moebius, defectos en la pared abdominal, defectos transversales en las extremidades hasta alteraciones fetales. Éstas se observan con más frecuencia en regímenes de solo misoprostol para inducción del aborto en comparación con el régimen secuencial en donde se indican mifepristona y misoprostol. Por lo anterior la historia clínica minuciosa es fundamental para poder identificar el antecedente de la exposición prenatal luego de un aborto fallido.4
Enseguida se comunica un caso de exposición prenatal al misoprostol asociado con malformaciones congénitas, complicación que debe considerarse en casos de aborto fallido en el proceso diagnóstico de defectos congénitos.
CASO CLINICO
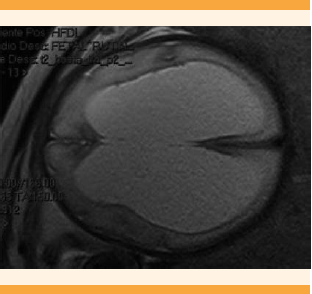
Paciente de 21 años, con 32 semanas de embarazo. Antecedentes ginecoobstétricos: parto eutócico, sin complicaciones y sin e malformaciones congénitas. Acudió al servicio de Medicina Materno Fetal con diagnóstico de feto con ventriculomegalia. En la evaluación ecográfica en la Clínica de Defectos Estructurales del INPer, sobresalió la ventriculomegalia triventricular severa simétrica, con atrio ventricular izquierdo de 28.2 mm y derecho de 30.9 mm, cisterna magna normal (Figuras 1 y 2) y angulación de ambas extremidades inferiores en varo. Puesto que se trataba de una ventriculomegalia severa se sospechó estenosis del acueducto de Silvio. La resonancia magnética reportó ventriculomegalia no comunicante severa bilateral simétrica, por probable estenosis del acueducto de Silvio (Figura 3). Como no se informó alguna otra alteración, se indicó maduración pulmonar.
A las 35 semanas, la paciente acudió al servicio de Urgencias debido a la percepción de contractilidad uterina regular. Se documentó trabajo de parto en fase latente y un registro cardiotocográfico intraparto categoría II, sin respuesta a las maniobras de resucitación intrauterina. Aunado a los diámetros craneales se decidió la interrupción del embarazo mediante cesárea. Se obtuvo un recién nacido de 34.6 semanas por Capurro, talla de 47 cm, peso de 2850 g, Apgar 8-9.
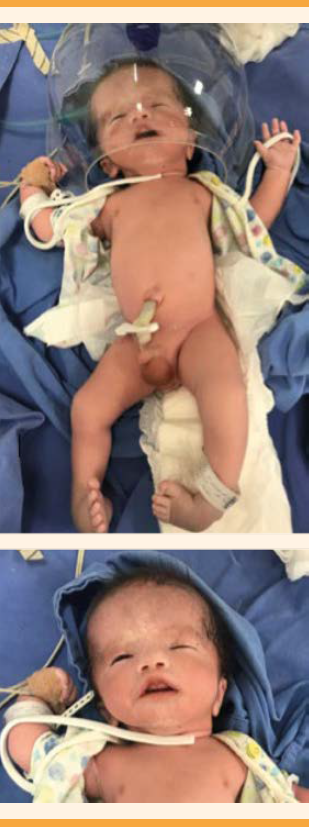
La evaluación genética perinatal documentó: macrocefalia, pie equino varo, parálisis facial y clinodactilia bilaterales del quinto dedo (Figura 4). Ante la coexistencia de defectos mayores, hidrocefalia y pie equino varo se solicitaron las determinaciones del cariotipo y del perfil TORCH. Se reportaron 46,XY, normal y negativo, respectivamente. Con esos hallazgos se procedió a la asesoría por genética perinatal y al reinterrogatorio acerca de la posible etiología causal. La paciente refirió haber sido tratada con misoprostol a las cinco semanas del embarazo, con fines abortivos, con una dosis única de 1200 mcg por vía sublingual. Al no documentarse alteraciones cromosómicas ni infecciosas se consideró la posibilidad de secuencia Moebius. El ultrasonido transfontanelar corroboró la ventriculomegalia severa, con incipiente daño vascular que ameritó la colocación de una válvula de derivación ventrículo peritoneal. El curso de la evolución fue estable, con secuelas propias de la enfermedad de base: leucoencefalomalacia. La recién nacida fue dada de alta a los 105 días de vida extrauterina, con tratamiento anticomicial y seguimiento en la consulta externa. La histopatología placentaria reportó: malperfusión vascular materna, caracterizada por maduración vellosa acelerada, con incremento de nodos sincitiales, fibrinoide perivelloso severo y fibroesclerosis de la placa coriónica.
DISCUSIÓN
Los efectos teratogénicos asociados con el misoprostol abarcan fenómenos de isquemia transitoria, acción mecánica por las contracciones uterinas y alteración vascular que da como resultado un espectro de múltiples defectos congénitos. En este caso, el primer hallazgo descrito fue la ventriculomegalia triventricular severa, corroborada mediante resonancia magnética como de etiología obstructiva. Su posible origen es secundario al daño vascular, lo que al provocar un edema periacuductal da como resultado estenosis del sistema acueductal.5,7 También hay que destacar que la ventriculomegalia concomitante con otras anomalías estructurales puede estar asociada con cromosomopatías, incluso hasta en 9 a 36% de las pacientes, además del amplio espectro de etiologías asociadas, como las infecciosas. Así, pues como parte del protocolo de estudio se determinaron el cariotipo y TORCH, ambos con reporte normal.8-15
Posteriormente, de acuerdo con la diplejía facial, genética y perinatal se propusieron, como diagnósticos diferenciales: distrofia miotónica, síndromes de Carey-Fineman-Ziter y oromandibular. Sin embargo, estos síndromes no se consideraron por los hallazgos clínicos principales que las caracterizan y que estuvieron ausentes en este caso en particular.16-19 Por lo tanto, los hallazgos ecográficos se interpretaron en el contexto de la historia clínica materna. Se documentó la exposición prenatal a prostaglandinas a las cinco semanas y se propuso, como diagnóstico de exclusión, la posibilidad de secuencia Moebius.
El efecto uterotónico del misoprostol produce, por acción mecánica, una flexión en la zona de los nervios craneales VI y VII. Esta flexión, junto con la posición del embrión en el momento de la exposición, podría resultar en una marcada vulnerabilidad de los núcleos craneales a la hemorragia y muerte celular.20
El daño vascular ocasionado reduce el suministro sanguíneo a la placenta y provoca hipoperfusión, hipoxia, fenómeno de tromboembolia y defectos en la angiogénesis, por lo que no sorprende que la plausibilidad biológica de la exposición al misoprostol puede ocasionar secuencia de Moebius. Ésta es una enfermedad congénita descrita en 1888, como un trastorno trombo-encefálico de etiología heterogénea. Su incidencia es de 1 caso por cada 150,000 nacidos vivos. Su recurrencia se reportado incluso hasta en el 2% de los casos, en un inicio como parálisis congénita del VII par craneal y limitación en la abducción de uno o ambos ojos. Su fenotipo es muy variable, incluida la afectación de otros pares craneales, dimorfismos craneales y extracraneales. Bell y sus colaboradores dividen en dos grupos al síndrome según las relaciones clínicas afectadas. El tipo 1 con una estrecha asociación entre micrognatia, anomalías en las extremidades y dificultades en la alimentación. El tipo 2 es más diverso, con problemas de aprendizaje, retraso en el desarrollo, déficit de nervios craneales y una anomalía cerebral identificable.21
La patogénesis es aún incierta. Una teoría describe una variante genética autosómica dominante, con mutación en los genes PLXND1 y REV3L y microdeleción del cromosoma 13.22 También se ha descrito una correlación importante con la ingesta del misoprostol administrado en el primer trimestre y el aborto fallido. Por tanto, la teoría propuesta como isquémica es la causa más prevalente en estos casos, con un periodo crítico para su desarrollo entre la quinta y octava semanas. En ese lapso el suministro de sangre arterial al tronco del encéfalo, desde un suministro carotídeo a uno vertebral, a través de la arteria subclavia, conduce a una inversión del flujo sanguíneo dentro de la arteria basilar. La insuficiencia circulatoria provoca lesiones del tronco encefálico y anomalías musculoesqueléticas.23 Debido a la insuficiencia vascular se origina la muerte neuronal en el VI y VII nervio craneal. Otros autores describen que el origen del daño vascular ocurre en la arteria subclavia hacia la cuarta a sexta semanas del desarrollo embrionario. Se refleja en eventos de isquemia en el tallo cerebral por las arterias basilares o vertebrales que dan lugar a necrosis y calcificación de los nervios craneales: facial, trigémino e hipogloso, como sucedió en la paciente del caso.
La facie inexpresiva relacionada con la parálisis facial bilateral, así como la interrupción de la arteria subclavia distal al origen de la arteria torácica interna, provoca defectos aislados terminales transversales de las extremidades. La afectación también puede resultar en hipoplasia de la arteria tibial y de la arteria plantar media. Ésta es la explicación del pie equino varo en estos pacientes.24 Silva Dal Pizzol y colaboradores25 llevaron a cabo un metanálisis que describió la estrecha asociación de la prostaglandina E1 con la secuencia Moebius con un OR de 26.48 (IC95%: 11.30 a 62.01) y para defectos transversales de las extremidades con un OR de 10.75 (IC95%: 3.93 a 29.41). Vargas y su grupo encontraron un exceso en la ocurrencia de artrogriposis y ventriculomegalia. Castilla y coautores describieron un alto riesgo de holoprosencefalia con un OR de 18.06 (IC95%: 3.99 a 81.79) y de extrofia vesical con un OR 46.83 (IC95%: 4.75 a 461.95).25 Así pues, la bibliografía admite una sinergia estrechamente asociada con el misoprostol como teratogénico en el intento de aborto y la subsecuente secuencia de Möbius en recién nacidos vivos. En el caso aquí comunicado los hallazgos prenatales ecográficos y la revisión al nacimiento, como la ventriculomegalia triventricular severa, parálisis facial, pie equino varo y la ausencia de anomalías cromosómicas aluden a esta entidad. Desde luego que hacen falta más investigaciones para dilucidar si este fármaco puede causar otros defectos congénitos por alteración vascular. Por ello, la administración del misoprostol durante el embarazo debe desaconsejarse sin lugar a dudas en virtud de la probabilidad de causar malformaciones fetales. Es importante concientizar a las pacientes de que, a pesar del marco legal del país, debe considerarse este riesgo plausible.
CONCLUSIÓN
La evidencia de la exposición prenatal al misoprostol se relaciona con la aparición de daño vascular en algunos fetos expuestos. Aún no se han determinado el espectro preciso de defectos congénitos asociados, ni la estimación potencial de teratogenicidad. Sin embargo, el fenotipo, en ausencia de anomalías cromosómicas e infecciosas, hace referencia a la secuencia de Moebius como una posibilidad diagnóstica viable, aunque deben descartarse otras alteraciones genéticas. La historia clínica juiciosa es el pilar para establecer la asociación en estos casos.











 nueva página del texto (beta)
nueva página del texto (beta)