ANTECEDENTES
La epilepsia se define como la predisposición del sistema nervioso central a producir ataques epilépticos.1 La prevalencia de epilepsia, según la Organización Mundial de la Salud, es 0.4 a 1%.2 Se estima que de 0.3 a 0.5% de los embarazos se producen en madres epilépticas.3
Se ha notificado que las embarazadas con epilepsia tienen mayor riesgo de descompensación de la enfermedad, más complicaciones obstétricas, mayor riesgo de malformaciones congénitas y alteraciones del neurodesarrollo en los recién nacidos.4,5
La bibliografía referente a mujeres embarazadas con epilepsia y su relación con fármacos es abundante y objeto de constantes cambios debido a la aparición de nuevas formulaciones de las que el conocimiento es escaso. El objetivo de esta revisión es conocer cómo el embarazo modifica el curso de la enfermedad, cómo la enfermedad modifica el curso del embarazo, cuán seguros son los tratamientos durante la gestación y los consensos obstétricos actuales a este respecto.
MATERIALES Y MÉTODOS
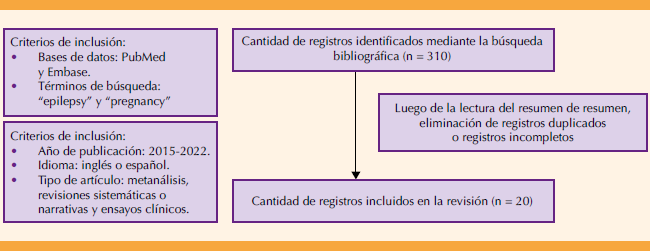
Revisión bibliográfica efectuada en dos bases de datos (PubMed y Scopus) con los siguientes criterios de búsqueda (MeSH): ‘’epilepsy’’ y ‘’pregnancy’’ de artículos publicados entre el 2015 y mayo del 2022, escritos en inglés o español: metanálisis, revisiones sistemáticas, narrativas o ensayos clínicos (Figura 1). Se incluyó un artículo relacionado (Shahla et al.) que no cumplía con los criterios de selección pero sí relacionado y relevante para el análisis.
RESULTADOS
Los artículos identificados mediante la búsqueda bibliográfica fueron 310. Después de la eliminación por duplicación y otras causas se seleccionaron 20 artículos, más otros utilizados como complemento del tema.
Etapa previa a la concepción. La percepción, por parte de las pacientes embarazadas y afectadas con epilepsia y su familia, acerca de la asistencia preconcepcional es pobre.6 Se ha observado que el aporte de información es una intervención útil a la hora de conocer la relación embarazo-epilepsia y para facilitar la toma de decisiones referentes a la idoneidad de iniciar el embarazo.7,8 La optimización de la medicación es otro objetivo de esta etapa, a fin de indicar el tratamiento más efectivo y con menos efectos adversos para la gestación, a la dosis mínima efectiva.9
En la etapa previa a la concepción resulta obligado evaluar la necesidad de suplementación con ácido fólico. El tratamiento de la epilepsia se incluye entre los factores ambientales causantes de defectos del tubo neural y otras anomalías sensibles al folato (labio leporino, enfermedad obstructiva del sistema urinario o malformaciones cardiacas).10 Se proponen, como prevención primaria en embarazadas con epilepsia y en tratamiento, dos opciones de suplementación:
De forma rutinaria suplementar con 0.8 a 1 mg cada 24 h a partir de los tres meses previos a la concepción hasta la semana 12 de embarazo y, posteriormente, reducir la dosis a 0.8 mg al día.10 Otras publicaciones recomiendan suplementar con 0.4 mg cada 24 horas a partir de la etapa previa a la concepción.9
Practicar un análisis de la concentración sanguínea de folatos antes de la concepción. Se estima que la concentración de folatos que disminuye los defectos del tubo neural se encuentra entre 28 a 30 nmol/L. La dosis se ajusta en función de los desenlaces.10
¿Cómo afecta el embarazo al curso de la enfermedad?
Un ensayo prospectivo estudió a 105 embarazadas con epilepsia. Describió episodios convulsivos en el 72.4% de las pacientes. Entre las pacientes con diagnóstico previo a la gestación, el 30.9% permanecieron sin convulsiones y el 51.1% tuvo un peor control de la enfermedad. Se observó un aumento del abandono del tratamiento antiepiléptico y en este grupo las crisis convulsivas se incrementaron con respecto al grupo que no abandonó el tratamiento de forma estadísticamente significativa. En las pacientes que en el último año no experimentaron convulsiones se notificó un menor riesgo de convulsión durante el embarazo.11
¿Cómo afecta la enfermedad al curso del embarazo?
El estudio de cómo la epilepsia y su tratamiento pueden afectar el desarrollo normal del embarazo ha sido objeto de numerosas publicaciones. En embarazadas con epilepsia se ha notificado un aumento del riesgo de aborto espontáneo, metrorragia anteparto, trastornos hipertensivos del embarazo, restricción del crecimiento intrauterino y parto pretérmino.12-15 La bibliografía acerca del aumento del riesgo de muerte fetal o diabetes gestacional en embarazadas con epilepsia es contradictoria.12,14
Al comparar el aumento del riesgo en función de la toma o no de tratamiento antiepiléptico se describe un mayor riesgo en las embarazadas con epilepsia en tratamiento de restricción del crecimiento, parto pretérmino o ingreso a una unidad de neonatos.12,13,15,16 En relación con la diferencia entre el tratamiento con un solo o varios fármacos se ha notificado aumento del riesgo de cesárea12 y de restricción del crecimiento intrauterino en embarazadas con epilepsia tratadas con más de un medicamento,15 sin diferencias significativas en cuanto a la aparición de otro tipo de afectación obstétrica durante el embarazo.12
La monoterapia con menor riesgo de retraso en el crecimiento intrauterino es la fenitoína, de parto prematuro es la oxcarbazepina y de pérdida fetal el fenobarbital.16
Se han descrito múltiples relaciones entre un fármaco antiepiléptico concreto y una afectación obstétrica concreta. Cuadro 1
Cuadro 1 Patología obstétrica asociada con la toma de fármacos antiepilépticos
| Pérdida fetal | Restricción del crecimiento | Parto prematuro | Aborto primer trimestre | |
|---|---|---|---|---|
| Ácido valproico | Veroniki et al. Metanálisis. Aumento significativo de riesgo.16 | |||
| Oxcarbazepina | Athar et al. Metanálisis. Aumento significativo de riesgo.24 | Tomson et al. Revisión bibliográfica. Fármaco seguro.26 | Veroniki et al. Metanálisis. Terapia más segura.16 | |
| Fenobarbital | Veroniki et al. Metanálisis. Terapia más segura.16 | Veroniki et al. Metanálisis. Aumento significativo de riesgo.16 | ||
| Topiramato | Veroniki et al. Metanálisis. Aumento significativo de riesgo.16 | Veroniki et al. Metanálisis. Aumento significativo de riesgo.16 | ||
| Lamotrigina | Pariente et al. Metanálisis. Sin aumento de riesgo.22 | Veroniki et al. Metanálisis. Sin aumento de riesgo.16 Pariente et al. Metanálisis. No aumento de riesgo.22 Tomson et al. Revisión bibliográfica. Fármaco seguro.26 | Pariente et al. Metanálisis. No aumento de riesgo.22 | Pariente et al. Metanálisis. No aumento de riesgo.22 |
| Levetiracetam | Tomson et al. Revisión bibliográfica. Fármaco seguro.26 | |||
| Primidona | Veroniki et al. Metanálisis. Aumento significativo de riesgo.16 | Veroniki et al. Metanálisis. Aumento significativo de riesgo.16 | Veroniki et al. Metanálisis. Aumento significativo de riesgo.16 | |
| Clozabazepam | Veroniki et al. Metanálisis. Aumento significativo de riesgo.16 | Veroniki et al. Metanálisis. Aumento significativo de riesgo.16 | ||
| Fenitoína | Veroniki et al. Metanálisis. Terapia más segura.16 |
No hay bibliografía disponible con los criterios de búsqueda descritos acerca del seguimiento obstétrico idóneo de mujeres embarazadas con epilepsia.
¿Cómo debe ser la atención del parto en una embarazada con epilepsia?
Se estima que la prevalencia de convulsiones asociadas con la epilepsia en el momento del parto es de entre 1.5 a 2.6%.17 Se ha observado una mayor tasa de inducción en embarazadas con epilepsia.12,14 En cuanto a la vía de nacimiento se ha notificado un aumento de la tasa de cesáreas (sobre todo en pacientes en tratamiento con varios fármacos),12,14 mientras que otras publicaciones notifican una tasa similar de parto y cesáreas en embarazadas con o sin epilepsia.18 Debido a la baja prevalencia de convulsiones durante el parto y la falta de evidencia se propone la finalización del embarazo por parto, como opción segura siempre que las condiciones materno-fetales lo permitan.17
Durante el posparto de embarazadas con epilepsia se ha notificado un aumento de hemorragia,12,14 sobre todo entre quienes reciben tratamiento antiepiléptico.12
Fármacos antiepilépticos y asociación con malformaciones
Enseguida se describen las malformaciones asociadas con cada uno de los fármacos antiepilépticos. Cuadro 2
Cuadro 2 Malformaciones y alteraciones del neurodesarrollo asociadas con la toma de fármacos antiepilépticos (continúa en la siguiente página)
| Malformaciones | Alteraciones del neurodesarrollo | |
|---|---|---|
| Ácido valproico | Veroniki et al. Metanálisis. Aumento del riesgo de malformaciones (hipospadias, malformaciones cardiacas, labio leporino, pie equino-varo).16 Weston et al. Metanálisis. Aumento de malformaciones mayores, defectos del tubo neural, craneofaciales, cardiacos y de tipo esquelético.19 Tomson et al. Revisión. Aumento de malformaciones.26 | Veroniki et al. Metanálisis. Asociado a autismo, dispraxia, trastornos del lenguaje, cognitivos y psicomotor.23 Tomson et al. Revisión. Aumento de alteraciones del neurodesarrollo.26 |
| Etosuximida | Veroniki et al. Metanálisis. Aumento del riesgo de malformaciones (labio leporino, pie equino-varo).16 | |
| Fenitoína | Veroniki et al. Metanálisis. Aumento del riesgo de malformaciones (cardiacas, labio leporino, pie equino-varo).16 Weston et al. Metanálisis. Aumento de malformaciones.19 | |
| Carbamazepina | Veroniki et al. Metanálisis. Aumento de malformaciones (cardiacas).16 Weston et al. Metanálisis. Aumento de malformaciones craneofaciales. Aumento no significativo de malformaciones del tubo neural, cardiacas o esqueléticas.19 | |
| Oxcarbazepina | Weston et al. Metanálisis. Sin aumento de malformaciones.19 Athar et al. Metanálisis. Sin aumento de malformaciones.24 Tomson et al. Revisión. Fármaco seguro.26 | Veroniki et al. Metanálisis. Asociado con autismo y dispraxia.23 Knight et al. Revisión. No se ha demostrado asociación. Evidencia escasa.20 |
| Fenobarbital | Veroniki et al. Metanálisis. Aumento de malformaciones (malformaciones cardiacas, labio leporino).16 Weston et al. Metanálisis. Aumento del riesgo de malformaciones mayores.19 | |
| Topiramato | Veroniki et al. Metanálisis. Aumento de malformaciones (labio leporino).16 Weston et al. Metanálisis. Aumento de malformaciones.19 Alsaad et al. Metanálisis. Aumento de defectos craneofaciales.25 | |
| Lamotrigina | Veroniki et al. Metanálisis. Sin aumento de malformaciones.16 Weston et al. Metanálisis. Sin aumento de malformaciones.19 Pariente et al. Metanálisis. Sin aumento de malformaciones.22 | Veroniki et al. Metanálisis. Asociado con autismo y dispraxia.23 Knight et al. Revisión. No se ha demostrado asociación.20 |
| Levetiracetam | Veroniki et al. Metanálisis. Sin aumento de malformaciones.16 Weston et al. Metanálisis. Sin aumento de malformaciones.19 Scheuerle et al. Revisión. Sin aumento de riesgo.21 | Knight et al. Revisión. No se ha demostrado asociación.20 |
| Gabapentina | Veroniki et al. Metanálisis. Aumento de malformaciones (hipospadias, malformaciones cardiacas).16 Weston et al. Metanálisis. No aumento de malformaciones.19 | Knight et al. Revisión. No se ha demostrado asociación. Evidencia escasa.20 |
| Primidona | Veroniki et al. Metanálisis. Aumento de malformaciones (hipospadias, labio leporino, pie equino-varo).16 Weston et al. Metanálisis. Sin aumento de malformaciones.19 | |
| Zinosamida | Weston et al. Metanálisis. Sin aumento de malformaciones.19 |
Carbamazepina. La prevalencia de malformaciones asociadas con la carbamazepina se estima en 4.93%.19 Se han descrito numerosas malformaciones asociadas, con algunas contradicciones al respecto en la bibliografía. Se ha notificado un aumento del riesgo de defectos del craneofaciales y malformaciones cardiacas.16,19 De la misma manera, un aumento estadísticamente no significativo de malformaciones tubo neural y esqueléticas.19 En función de la dosis se ha notificado una razón de momios de 2.5 con dosis entre 400 a 1000 mg al día y una razón de momios de 4.6 en dosis superiores a 1000 mg al día.19
Gabapentina. La prevalencia de malformaciones asociadas con la gabapentina se estima en 1.47%.19 La tasa de malformaciones en embarazadas controladas con gabapentina en comparación con un grupo control es similar.19 Algunos estudios sí encuentran un aumento significativo del riesgo de hipospadias y malformaciones cardiacas.16 La evidencia actual de la asociación entre la exposición intrauterina a la gabapentina y la alteración del neurodesarrollo es escasa, aunque sugiere que no existe.20 No se ha establecido relación entre la dosis y el riesgo de malformaciones o alteraciones del neurodesarrollo.19,20
Levetiracetam. La prevalencia de malformaciones asociadas con levetiracetam se estima en 1.77%.16,19 La tasa de malformaciones en embarazadas tratadas con levetiracetam en comparación con el grupo control es similar.19,21 No se han descrito alteraciones del neurodesarrollo en neonatos expuestos intraútero,20 ni se ha observado un aumento de malformaciones o alteraciones del neurodesarrollo con el incremento de dosis.19,20
Lamotrigina. La prevalencia de malformaciones asociadas con la lamotrigina se estima en 2.31%.19 La tasa de malformaciones en pacientes embarazadas tratadas con lamotrigina en comparación con el grupo control es similar.16,19,22 La evidencia actual de la asociación entre la exposición intrauterina a la lamotrigina y la alteración del neurodesarrollo es discordante porque se ha relacionado con autismo y dispraxia,23 mientras que otras publicaciones sugieren que no existe tal relación.20 En función de la dosis se ha notificado una prevalencia de malformaciones del 2% con dosis menores de 300 mg al día y del 4.5% con dosis superiores.19 No se ha demostrado relación entre la dosis del fármaco y la aparición de alteraciones del neurodesarrollo.20
Oxcarbazepina. La prevalencia de malformaciones asociadas con la oxcarbazepina se estima en 2.39%.19 La evidencia actual de la asociación entre la exposición intrauterina a la oxcarbazepina y la alteración del neurodesarrollo es escasa;20 se ha relacionado con autismo y dispraxia,23 mientras que otra publicación sugiere que no existe relación.20 No se ha establecido relación entre la dosis y el riesgo de malformaciones y alteraciones del neurodesarrollo.19,20
Fenobarbital. La prevalencia de malformaciones asociadas con el fenobarbital se estima en 7.10%.19 Este fármaco se ha asociado con un aumento significativo de malformaciones mayores: cardiacas y defectos orofaciales.16,19 En función de la dosis se ha notificado una prevalencia de malformación del 5.4% con dosis menores de 150 mg al día y del 13.7% con dosis mayores a 150 mg al día.19
Fenitoína. La prevalencia de malformaciones asociadas con la fenitoína se estima en 6.26%.19 La fenitoína se ha asociado con un aumento significativo de malformaciones mayores: cardiacas, labio leporino o pie equino-varo.16,19 No se ha establecido relación entre la dosis y el riesgo de malformaciones.19
Primidona. La prevalencia de malformaciones asociadas con la primidona se estima en 8.49%.19 Si bien algunas publicaciones no encuentran aumento de malformaciones,19 otras informan incremento de hipospadias, labio leporino y pie equino-varo.16 No se ha establecido relación entre la dosis y el riesgo de malformaciones.19
Topiramato. La prevalencia de malformaciones asociadas con el topiramato se estima en 4.28%.19 Este medicamento se ha relacionado con un aumento del riesgo de malformación mayor, como los defectos craneofaciales.16,19,25 La evidencia acerca de problemas del neurodesarrollo en recién nacidos expuestos intraútero al topiramato es contradictoria.20 No se ha establecido relación entre la dosis y el riesgo de malformaciones y alteraciones del neurodesarrollo.19,20
Ácido valproico. La prevalencia de malformaciones asociadas con el ácido valproico se estima en 10.93%.19 Su consumo durante el embarazo se ha asociado con un aumento de malformaciones mayores: defectos del tubo neural, craneofaciales, cardiacos, de tipo esquelético, hipospadias o pie equino varo.16,19.26 En el recién nacido, la exposición al ácido valproico intraútero se ha relacionado con autismo, dispraxia, trastornos del lenguaje, cognitivos y psicomotor.23,26 Se observa una tasa de malformación significativamente más baja (6.7%) con dosis menores de 600 mg al día en comparación con dosis mayores de 700 a 1500 mg al día (10.4%) y dosis mayores de 1500 mg al día (24.2%).19
Zonisamida. La prevalencia de malformaciones asociadas con este fármaco se estima en 0.28%.19 No se ha asociado con un aumento en la tasa de malformaciones.19
En la actualidad, la polifarmacia es frecuente. Se ha informado que el tratamiento con lamotrigina, levetiracetam en comparación con ácido valproico tiene menor tasa de malformaciones.23 Otras politerapias estudiadas (fenobarbital y fenitoína, carbamazepina y fenobarbital, carbamazepina y fenitoína, fenobarbital y valproato, fenitoína y primidona, fenitoína y valproato, carbamazepina y valproato, carbamazepina y clonazepam, fenobarbital y fenitoína y primidona y fenobarbital más primidona) tuvieron un aumento significativo de malformaciones respecto de los grupos control.16
DISCUSIÓN
El asesoramiento previo a la concepción de pacientes con enfermedades crónicas y con deseo genésico es fundamental. En particular, es necesario explicar la repercusión que el embarazo puede tener en la epilepsia y las consecuencias que la epilepsia y su tratamiento pueden tener en el embarazo.27,28,29 En el asesoramiento deben participar el obstetra y un neurólogo con experiencia en el tratamiento de pacientes con epilepsia. La Sociedad Española de Neurología recomienda adaptar el tratamiento previo a la concepción y no retirar o sustituir cuando ya se ha diagnosticado el embarazo.30
Otro elemento decisivo en la etapa prenatal es la suplementación con ácido fólico en pacientes con epilepsia y deseo genésico con el propósito de prevenir defectos del tubo neural y otras malformaciones asociadas con el déficit de folato. Con la bibliografía disponible en esta revisión, bastarían 0.4 a 1 mg cada 24 h.9,10 Sin embargo, el Royal College of Obstetricians and Gynaecologists recomienda la suplementación con 5 mg cada 24 h antes de la concepción y al menos hasta la semana 12 con el propósito de disminuir malformaciones mayores27 o la Sociedad Española de Ginecología y Obstetricia, que recomienda suplementar con 5 mg al día solo si las pacientes con la enfermedad están siendo tratadas con ácido valproico, carbamacepina o tuvieron un hijo con defectos del tubo neural.28 Recientemente se ha notificado que hasta el 34% de la población europea tiene mutaciones del gen MTHFR, implicado en el metabolismo del ácido fólico.31 Se ha informado que la acumulación de metabolitos intermedios inactivos tiene un potencial efecto oxidante y deletéreo sistémico.32 Por eso se propuso que el 5-MTHF, metabolito activo obtenido después del metabolismo completo del ácido fólico, como método idóneo de suplementación de ácido fólico.32
Debido a los potenciales beneficios y los escasos efectos secundarios reportados, parece necesaria la suplementación con ácido fólico desde la etapa preconcepcional. Se necesita más evidencia acerca de la dosis idónea en cada tipo de paciente; así mismo, deberá seguirse investigando acerca de la utilidad del 5-MTHF.
La evidencia disponible acerca de cómo el embarazo puede afectar al curso de la enfermedad es escasa según los criterios de inclusión de esta revisión. El Royal College of Obstetricians and Gynaecologists advierte que en el 66% de las embarazadas con epilepsia no se produce un empeoramiento clínico por la gestación, pero recomienda vigilar de forma estrecha a las embarazadas con epilepsia con un episodio convulsivo en el último año.27 La Sociedad Española de Neurología informa que, en forma general, no se altera la frecuencia de convulsiones durante la gestación, el parto y el puerperio.30
En la revisión no se encontró bibliografía referente al seguimiento idóneo del embarazo. Debido al reporte de una mayor tasa de malformaciones y patología obstétrica, parece lógico un seguimiento más estrecho de la gestación.30 La Sociedad Española de Neurología recomienda una ecografía temprana a las 14 a 16 semanas.30
La bibliografía disponible acerca del efecto de los fármacos antiepilépticos en el embarazo es amplia e incluye estudios de gran calidad. Lamotrigina, levetiracetam y oxcarbazepina quizá se asocien con el riesgo más bajo de efectos fetales adversos cuando se toman durante el embarazo.16,26 El ácido valproico y las politerapias deben evitarse debido a la alta tasa de malformaciones y afecciones obstétricas asociadas con estos tratamientos.16,27 Asociaciones científicas como The National Institute for Health and Care Excellence (NICE), recomienda no indicar el ácido valproico a pacientes en edad fértil, por sus efectos durante la gestación.29
A pesar de que se ha notificado un aumento en la tasa de inducción y cesárea en embarazadas con epilepsia,12,14 el parto parece una opción razonable.17 El Royal College of Obstetricians and Gynaecologists y la SEGO no recomiendan la inducción del parto en embarazadas con epilepsia asintomáticas y aconsejan el parto siempre que las condiciones obstétricas lo permitan.27,28 El Royal College of Obstetricians and Gynaecologists y la SEGO proponen medidas para evitar convulsiones durante el trabajo de parto: proteger en contra de la deshidratación, el insomnio o el dolor y continuar con la toma de medicación.27,28
CONCLUSIÓN
El embarazo de una paciente con epilepsia debe considerarse de alto riesgo y, por lo tanto, adecuar su seguimiento. La planificación del embarazo es decisiva para poder indicar el tratamiento antiepiléptico adecuado y el suplemento con ácido fólico si es necesario. El conocimiento minucioso de los fármacos y de los efectos adversos de cada uno de ellos es obligado para el obstetra y el neurólogo encargados del seguimiento de la paciente. Esta revisión debe servir para obtener información actualizada del tema, debiéndose actualizar con el paso del tiempo.











 nueva página del texto (beta)
nueva página del texto (beta)