INTRODUCCIÓN
El síndrome de Frasier es poco frecuente; su incidencia es de 1 caso por cada millón de recién nacidos vivos. Es parte de las anomalías del desarrollo sexual y se caracteriza por disgenesia gonadal acompañada de enfermedad renal de aparición temprana y rápido avance, que suele conducir a insuficiencia renal en adultos jóvenes. 1
La mutación específica del gen WT1 es la responsable de la enfermedad y se ubica en el cromosoma 11p23, constituido por diez exones que codifican un factor de transcripción con cuatro dedos de zinc encargados de participar en el desarrollo genital y renal normal. 2
La importancia de la integridad del gen WT-1 se identificó en el decenio de 1990. 3 Su expresión fetal es determinante para el desarrollo de la gónada bipotencial y del riñón. 4 Así, las mutaciones de éste se objetivaron, por primera vez, en el tumor de Wilms, y poco tiempo después se identificó la mutación parcial del gen como factor causal del síndrome de Denys-Drash. 4,5 Con respecto al síndrome de Frasier, el primer caso se reportó en 1964 en una paciente con disgenesia gonadal pura, gonadoblastoma y enfermedad renal. 6
La enfermedad renal suele iniciarse con una proteinuria rápidamente progresiva, que comienza entre la primera y segunda décadas de la vida, que evoluciona con mayor frecuencia a glomeruloesclerosis focal y segmentaria resistente a glucocorticoides y, finalmente, a una enfermedad renal crónica con necesidad de diálisis o de trasplante renal. 7-10
Puesto que esta enfermedad es parte de los trastornos de la diferenciación sexual es necesario tener en consideración, sobre todo en los pacientes con cariotipo 46 XY, el riesgo de tumores de células germinales (gonadoblastomas o disgerminomas) que pueden iniciarse incluso hasta en un 60% de los casos. 2
Por lo anterior es relevante reportar un caso clínico más que permita enriquecer el conocimiento disponible de esta enfermedad extremadamente rara y mejorar su atención multidisciplinaria respecto del diagnóstico diferencial y tratamiento.
CASO CLÍNICO
Paciente de 16 años que fue llevada a consulta debido a amenorrea primaria, sin desarrollo de caracteres sexuales secundarios. Antecedentes médicos: glomerulonefritis focal y segmentaria con atrofia tubular y fibrosis intersticial corticorresistente, con respuesta parcial a ciclosporina diagnosticada a los ocho años.
En la exploración física se objetivó la ausencia de desarrollo mamario y del vello axilar y púbico, correspondiente a un estadio 1 de Tanner. Los genitales externos eran de apariencia normal, con introito estrecho a la visualización. La ecografía por vía transrectal mostró a la vejiga de aspecto normal; el útero y los anejos no fue posible visualizarlos. El estudio se completó con una resonancia magnética nuclear abdominopélvica que permitió visualizar la vagina, que terminaba en el fondo de saco ciego, sin que se identificaran los ovarios ni el útero. Figura 1
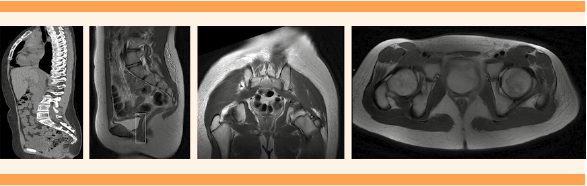
Figura 1 Diferentes cortes de la resonancia magnética nuclear abdominopélvica que evidencian que la vagina termina en el fondo de saco ciego, pero sin la identificación de ovarios ni útero (hallazgos compatibles con síndrome de Frasier).
El estudio hormonal puso de manifiesto un hipogonadismo hipergonadotrópico con hormona antimulleriana inexistente, y un cariotipo que demostró una disgenesia gonadal 46, XY (Figura 2). Con estos indicios se decidió el envío de la paciente al servicio de Nefrología, para estudio genético, que confirmó el diagnóstico de síndrome de Frasier (herencia autosómica dominante), debido al hallazgo de la mutación heterocigota del cambio patogénico c.1432+4C>T en el gen WT1 localizado en el brazo corto del cromosoma 11: Cr11p23.
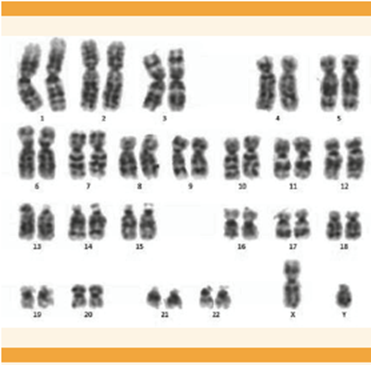
Figura 2 Cariotipo. Estudio citogenético de sangre periférica; se analizaron 15 metafases con resolución de 300 bandas. No se observaron anomalías numéricas ni estructurales. Fórmula cromosómica: 46,XY.
A pesar de no visualizarse las gónadas en la ecografía ni en la resonancia magnética se decidió proceder a la exploración quirúrgica del canal inguinal bilateral mediante laparoscopia diagnóstica-vaginoscopia y exéresis gonadal, si procedía debido al alto riesgo que asocia el síndrome de Frasier de gonadoblastomas o disgerminomas. Durante la intervención quirúrgica se observó, en la parte central de la pelvis, una pequeña estructura fibrosa compatible con un rudimento uterino de la que surgían dos delgadas estructuras tubulares compatibles con las trompas; por debajo de ellas se visualizaban estructuras acintadas, blanquecinas y fibrosas compatibles con gónadas.
En el extremo lateral de la pelvis se visualizaron unos anillos inguinales que daban entrada al conducto inguinal ciego y vacío. Se procedió a la salpingooforectomía bilateral y se enviaron ambas piezas por separado para estudio anatomopatológico, que posteriormente se reportó como: disgerminoma limitado al ovario derecho de 1.5 cm (estadio IA). La trompa derecha y el anejo izquierdo resultaron sin alteraciones. El primer control posquirúrgico se efectuó mediante tomografía axial computada abdominopélvica: destacó la ausencia de adenopatías de tamaño patológico en las cadenas ilíacas, inguinales ni obturatrices y la ausencia de líquido libre o de otras lesiones. Los marcadores tumorales posquirúrgicos se informaron en rango normal: AFP 2.1 ng/mL, βHCG 0.7 UI/L. Puesto que se trataba de un estadio IA, no requirió tratamiento adyuvante: se optó por el seguimiento estrecho, con imágenes de tomografía axial computada y marcadores tumorales, sin signos de recidiva. Además del control oncológico, la paciente permanece en seguimiento por un equipo multidisciplinario integrado por: ginecólogos, nefrólogos, endocrinólogos y genetistas. Luego de la intervención quirúrgica se inició la terapia hormonal sustitutiva con 100 mcg de levonorgestrel y 20 mcg de etinilestradiol para evitar los efectos secundarios cardiovasculares y osteopénicos; además, también se le indicaron colecalciferol y tratamiento inmunosupresor con ciclosporina para el control de la nefropatía.
DISCUSIÓN
El síndrome de Frasier es poco frecuente, de ahí que esté incluido en el grupo de las enfermedades raras. Hasta la fecha, la prevalencia estimada es de 150 casos, con base en los datos registrados en los informes de Orphanet. 11
Desde el punto de vista genético se descubrió que este síndrome guarda relación con defectos moleculares en el cromosoma 11p13 y comprende 10 exones en el gen WT1, con herencia autosómica dominante. Este gen se expresa en una amplia variedad de tejido embrionario, incluidas las células mesenquimales del riñón fetal y las células estromales de las gónadas y bazo. 6 Se han descrito cinco mutaciones diferentes: +2 T>C, +4 C>T (la más frecuente, 52% de los casos informados, entre ellos el de nuestra paciente), +5 G>A, +5 G>T y +6 T>A. 1 Estas mutaciones provocan una inclusión o exclusión de un triplete de aminoácidos específico, constituido por: lisina, treonina, serina (KTS), entre los dedos de zinc 3 y 4 y el empalme en el intrón 93. La isoforma KTS tiene una alta afinidad con el factor 1 esteroidogénico y controla el desarrollo testicular normal. Desde el punto de vista fisiológico la isoforma (KTS+) duplica la isoforma que carece de KTS (KTS). 1,6 En el síndrome de Frasier y las mutaciones del sitio de empalme suprimen la producción de la isoforma KTS+, lo que conduce a una relación KTS+/KTS- inversa.1,6,12-15
Si bien el descubrimiento de esta relación arroja luz acerca de la fisiopatología del síndrome, los mecanismos exactos que deterioran el desarrollo gonadal normal permanecen sin dilucidar. 12,13 No obstante, se sabe que la mayoría de los casos descritos son secundarios a mutaciones de novo, que ocasionan la enfermedad en pacientes sin antecedentes familiares, 16 como en la paciente del caso aquí informado.
La presentación clásica de la enfermedad es la observada en la paciente del caso; cariotipo 46, XY, pero con caracteres sexuales femeninos, útero y ovarios rudimentarios. No obstante, se han reportado casos con cariotipo 46, XX y fenotipo externo femenino normal, así como cariotipo 46, XY con fenotipo masculino normal, o casos con genitales externos ambiguos, como hipospadias y un seno urogenital descrito en el síndrome de Denys-Drash. 5 Estas variaciones fenotípicas han favorecido la especulación de que el síndrome de Frasier y el de Denys-Drash son variaciones de la misma enfermedad, puesto que las mutaciones en WT1 se han descrito en las dos entidades. 4 Ambas enfermedades derivan de la mutación heterocigota en el gen WT1 y pueden manifestarse en forma de enfermedad renal, función anormal de las gónadas y tumores, lo que determina que este síndrome es el principal diagnóstico diferencial del síndrome de Frasier. 2,16 Las diferencias fundamentales entre ambos residen en el tiempo hasta la aparición de la afectación renal, que en el síndrome de Denys-Drash es temprana, casi siempre antes de los cuatro años, y cursa como esclerosis difusa mesangial. En cambio, en el síndrome de Frasier suele manifestarse después de los ocho años de vida y se caracteriza por una glomeruloesclerosis focal y segmentaria. Además, el síndrome de Denys-Drash supone un alto riesgo de tumor de Wilms, que no es característico del síndrome de Frasier. 4,5,13,14
La manifestación clínica más frecuente y que constituye el principal motivo de consulta es la amenorrea primaria. El retraso puberal que suele afectar a pacientes con enfermedades crónicas puede suponer un retraso diagnóstico.
La mayoría de los casos de síndrome de Frasier tienen genitales externos femeninos, 15 como sucedió en la paciente del caso. La historia clínica, la exploración física y las pruebas complementarias son decisivas para orientar el diagnóstico. Las pruebas de imágenes, como la ecografía y la resonancia magnética son eficaces para establecer el diagnóstico diferencial con otras causas descritas de amenorrea primaria. Es primordial el estudio cromosómico que permita clasificar las anomalías de la diferenciación sexual. 2 Los individuos con anomalías de la diferenciación sexual portadores de un cromosoma Y tienen un riesgo incrementado de padecer tumores de células germinales. Se estima que incluso hasta el 60% de los casos pueden resultar con tumores tipo seminomas, gonadoblastomas y disgerminomas. 2,7 Este alto porcentaje descrito en la bibliografía es congruente con los hallazgos de la paciente del caso; por ello, en quienes tienen cariotipo XY es recomendable una cirugía exploradora. Durante la intervención deben valorarse las diferentes estructuras pélvicas y extirpar el tejido gonadal rudimentario, lugar de asiento del alto porcentaje descrito de tumores germinales. 7
Por lo que se refiere a la nefropatía que caracteriza al síndrome de Frasier, la glomeruloesclerosis focal y segmentaria con síndrome nefrótico es la manifestación renal más frecuente. La esclerosis mesangial difusa es el diagnóstico histológico más común en el síndrome nefrótico. 10 Ni la glomeruloesclerosis focal segmentaria ni la esclerosis mesangial suelen responder al tratamiento médico con corticosteroides. Por ello, es frecuente que los pacientes requieran un tratamiento inmunosupresor más agresivo. Inevitablemente, los pacientes evolucionan, lentamente, hasta la etapa final de insuficiencia renal. 17,18,19
Sospechar este síndrome es el paso inicial para establecer un diagnóstico correcto. La amenorrea primaria con genitales externos femeninos, junto con el diagnóstico de enfermedad renal, son los principales indicios de sospecha del síndrome de Frasier. Los antecedentes familiares deben alertar a a los médicos, aunque lo más habitual es que estos casos sean esporádicos. De acuerdo con la bibliografía revisada, algunos autores recomiendan la determinación de proteínas en orina a los familiares del paciente diagnosticado, para descartar la existencia de proteinuria y, con ello, una afectación familiar. 10
Enseguida de la sospecha diagnóstica debe solicitarse un estudio molecular del gen WT1 para confirmar el diagnóstico de síndrome de Frasier o síndrome de Denys-Drash. 2
El diagnóstico temprano de este síndrome es relevante porque permite una óptima atención y tratamiento. Un diagnóstico temprano y un control cuidadoso con medidas de apoyo permiten retrasar la evolución desfavorable de la nefropatía, que condiciona el pronóstico de la enfermedad. El seguimiento multidisciplinario por parte de nefrólogos, endocrinólogos y ginecólogos de manera periódica es decisivo. El objetivo es evaluar el correcto desarrollo y crecimiento, la necesidad de tratamiento sintomático, su correcta dosificación o posibles interacciones entre los fármacos y la prevención de efectos secundarios. 14 El primer escalón terapéutico es el inicio del tratamiento de la nefropatía de base (ciclofosfamida, tacrolimus, sirolimus y micofenolato) y prevenir los factores de avance hacia la insuficiencia renal crónica terminal. Enseguida, iniciar el tratamiento sustitutivo renal en los casos que lo requieran. 10 A continuación, el tratamiento sustitutivo de la función ovárica con estrógenos por vía oral o transdérmica, junto con la suplementación de calcio y vitamina D. Todo lo anterior acompañado de un asesoramiento genético y psicológico personal y familiar. 10
CONCLUSIONES
El diagnóstico, tratamiento y seguimiento de pacientes con una enfermedad tan rara, como el síndrome de Frasier, deben ir de la mano de un equipo interdisciplinario integrado por ginecólogos, nefrólogos, endocrinólogos, anatomopatólogos y genetistas. Su asociación con una enfermedad renal crónica, grave y progresiva, así como su alta tasa de prevalencia de neoplasias germinales, determina la importancia del diagnóstico temprano. Reportar estos casos clínicos es decisivo para mejorar el conocimiento de esta rara enfermedad y que cualquier clínico la sospeche ante un cuadro clínico similar.











 nueva página del texto (beta)
nueva página del texto (beta)


