INTRODUCCIÓN
La epidemia de diabetes mellitus representa un gran problema mundial para la salud pública, a pesar de los innumerables esfuerzos emprendidos desde la investigación básica, clínica y social. La Federación Internacional de Diabetes estima que 463 millones de adultos viven actualmente con diabetes y que, de ellos, más de la mitad son mujeres.1 En el 2020 se reportaron, en el ámbito mundial y en Cuba, cifras alarmantes de nacidos vivos afectados por hiperglucemia en el embarazo, derivada de diabetes gestacional o pregestacional. 1,2 Es de particular preocupación la disminución de la edad de inicio de la diabetes tipo 2 que afecta, directamente, a mujeres en edad fértil y, por tanto, futuras mujeres embarazadas. 3
La diabetes materna tiene importantes efectos adversos en la embriogénesis y el desarrollo fetal: causa múltiples anomalías congénitas y complicaciones médicas secundarias denominadas, colectivamente, embriopatía diabética. 4 Pese a los avances en los tratamientos clínicos para mujeres diabéticas embarazadas, el riesgo de malformaciones congénitas sigue siendo 3 a 5 veces mayor que en el embarazo no diabético. Las malformaciones ocurren en las primeras 10 semanas durante la organogénesis temprana por lo que puede afectarse cualquier sistema de órganos. Por lo general, se producen defectos en el cierre del tubo neural, médula espinal, síndrome de regresión caudal, defectos cardiacos y vasculares mayores, displasia esquelética y anomalías en los riñones y en el intestino.5,6,7
El efecto teratogénico de la diabetes se debe a la exposición del embrión o feto a hiperglucemias transitorias o permanentes, moderadas o severas. Las consecuencias del exceso de glucosa se asocian con alteraciones en varias vías de desarrollo en la descendencia, que conducen a condiciones intracelulares negativas: estrés oxidativo, estrés nitrosativo, estrés del retículo endoplasmático y estrés de hexosamina. Además, la apoptosis embrionaria acelerada y la autofagia reducida se han sugerido como componentes de la embriopatía diabética.4,5,7
En las últimas décadas, muchos investigadores han estudiado la gestación diabética a través de modelos experimentales que permiten comprender mecanismos fisiopatológicos y evaluar estrategias diagnósticas y terapéuticas que limiten el desarrollo de las complicaciones materno-feto-placentarias. 8,9 El modelo de inducción neonatal con estreptozotocina en ratas Wistar que provoca hiperglucemias moderadas en la adultez se ha utilizado en estudios de diabetes pregestacional y de la descendencia en etapa fetal. 10,11,12 No obstante, resultan escasas las investigaciones en etapa embrionaria para identificar las alteraciones en este periodo del desarrollo ocasionadas por concentraciones moderadas de hiperglucemias. Por tanto, el objetivo de este trabajo fue: determinar el efecto de las hiperglucemias moderadas en el rendimiento reproductivo materno, crecimiento, desarrollo y morfología embrionaria en ratas Wistar.
MATERIALES Y MÉTODOS
Estudio longitudinal, prospectivo y experimental efectuado en la Unidad de Investigaciones Biomédicas de la Universidad de Ciencias Médicas de Villa Clara, Cuba, en un modelo de diabetes moderada inducida neonatalmente a crías hembras de ratas Wistar de dos días de nacidas mediante la administración subcutánea de 100 mg/kg de peso corporal de estreptozotocina en dosis única. Los animales se manipularon conforme a la recomendación de la guía del Instituto Nacional de Salud (National Institutes of Health) para el trabajo con animales de experimentación13 y el Decreto-Ley No. 31 de Bienestar Animal de la República de Cuba. 14 Se utilizó la menor cantidad de animales posible y se minimizó su sufrimiento.
Los padres y sus crías se mantuvieron en condiciones estrictamente controladas de temperatura (19-25 °C), humedad relativa (45-65 %) y luz (ciclos 12 h luz-oscuridad). Durante todo el experimento los animales se abastecieron con agua corriente y se alimentaron con dieta concentrada convencional todo propósito. Los animales de experimentación permanecieron con sus madres durante 21 días hasta el destete y, posteriormente, se colocaron cinco en cada caja. La investigación responde a un proyecto aprobado por el Comité de Ética de la institución.
Inducción de la diabetes
En el experimento se utilizaron 20 ratas hembra que se distribuyeron aleatoriamente en dos grupos experimentales de 10 animales cada uno: grupo diabético y grupo control. La diabetes se indujo en las crías hembra de dos días de nacidas mediante la administración subcutánea de 100 mg/kg de estreptozotocina (Aplichem) en dosis única. La estreptozotocina se disolvió en tampón citrato de 0.1 M (pH 4.5) helado para mantener su estabilidad y se inyectó inmediatamente de preparada la solución para evitar la degradación. Al grupo control se le administró el vehículo tampón citrato en similares condiciones.
Periodo de apareamiento y gestación
A los 120 días de nacidos, ambos grupos de experimentación se aparearon con machos sanos aproximadamente durante tres ciclos estrales (15 días) en proporción de tres ratas hembra por macho. El día cero de la gestación se consideró cuando en el frotis del contenido vaginal, tomado entre las 7 a 8 h de la mañana, se detectaron espermatozoides. Una vez diagnosticada la preñez todas las ratas se mantuvieron en cajas individuales. Las ratas no preñadas durante este periodo se consideraron infértiles y se excluyeron del experimento.
En la mañana de los días 0 y 11.5 de gestación, luego de 12 h de ayuno, se midió el peso corporal y se cuantificaron las concentraciones de glucosa en sangre, a partir de una gota de sangre tomada de la punta de la cola del animal, mediante el método de glucosa oxidasa, un glucómetro y biosensores SUMA.
Eutanasia, colección y procesamiento de muestras
El día 11.5 de gestación se practicó la cesárea bajo anestesia con 50-60 mg/kg de tiopental sódico (Farmahealth, India). Se extrajeron los ovarios y cuernos uterinos, se colocaron en una placa con solución salina fisiológica, se eliminó el exceso de grasa y tejido periuterino. El proceso de eutanasia se realizó por exsanguinación a través de una punción intracardiaca.
Ambos ovarios se separaron de los cuernos uterinos y se analizaron con un microscopio estereoscópico BMS (Estados Unidos) para contar los cuerpos lúteos gravídicos de los ovarios derecho e izquierdo de forma independiente. Cada cuerpo lúteo (indicador de la cantidad de óvulos fecundados) se identificó como una hinchazón discreta, redonda, ligeramente rosada en la superficie del ovario. Inmediatamente los cuernos uterinos se pesaron en una balanza digital Yamato y se abrieron a lo largo de la curvatura mayor. Los sitios de implantación se numeraron consecutivamente desde el extremo ovárico derecho hacia el cuello uterino y desde este hasta el extremo ovárico izquierdo. Cada sitio de implantación se describió y clasificó de acuerdo con las modificaciones efectuadas a los criterios establecidos por York y colaboradores15 como un saco gestacional que contenía un embrión o una reabsorción temprana.
Los embriones se extrajeron cuidadosamente del saco gestacional y se observaron al microscopio. Se determinó la longitud cráneo-caudal (talla), la cantidad de somitas y se identificaron las posibles alteraciones de la morfología. Se tomaron microfotografías de cada embrión con una cámara digital Cannon Power Shot G11. Los embriones se clasificaron según los percentiles de la talla y cantidad de somitas determinadas en el grupo control de acuerdo con la modificación de la clasificación efectuada por Soulimane y colaboradores16 para el peso fetal. La clasificación consistió en talla o cantidad de somitas adecuadas para la edad gestacional, talla o cantidad de somitas inferior al percentil 5 y, talla o cantidad de somitas superior al percentil 95.
A partir de los registros obtenidos del estudio del peso materno, los ovarios y cuernos uterinos se determinaron los indicadores del rendimiento reproductivo materno. Se calculó la ganancia de peso durante la gestación a través de la diferencia entre el peso de la rata preñada el día 11.5 y el peso del día 0. Se calcularon los porcentajes de eficiencia de implantación a través de la relación entre la cantidad de sitios de implantación y la cantidad de cuerpos lúteos, de pérdidas preimplantación a través de la relación entre la diferencia entre la cantidad de cuerpos lúteos y la de sitios de implantación entre la cantidad de cuerpos lúteos y el porcentaje de reabsorciones a través de la relación entre la cantidad de reabsorciones y la de sitios de implantación. 17
Análisis estadístico
El procesamiento estadístico de los datos obtenidos se hizo con el paquete estadístico SPSS versión 20 para Windows. En todos los casos se verificaron los supuestos de normalidad y homogeneidad de varianza. En congruencia con los desenlaces se efectuaron pruebas no paramétricas (U de Mann Whitney) para las comparaciones cuantitativas, en cuyo caso las hipótesis se basan en rangos, mediana y frecuencia de datos. Los resultados se presentaron en cuadros y figuras como la media ± error estándar de la media. La prueba de χ2 se utilizó para la comparación de proporciones y los datos se expusieron en valores absolutos y porcientos. Se empleó el coeficiente de correlación de Spearman para establecer correlaciones entre variables de interés. En todas las pruebas las diferencias se consideran significativas con valores de p < 0.05.
RESULTADOS
Los indicadores del rendimiento reproductivo materno en los grupos estudiados se muestran en el Cuadro 1. A pesar de que no se comprobó la significación estadística en la mayor parte de las variables, sí se evidenció la significación biológica en relación con la disminución de la ganancia de peso durante la gestación, así como del peso del útero en las ratas diabéticas respecto de las ratas controles. No se identificaron diferencias en los cuerpos lúteos. El análisis, desde el punto de vista biológico de los procesos de implantación, demostró que la diabetes moderada afectó la implantación exitosa del ovocito fecundado en el endometrio, y provocó un aumento de las reabsorciones. Las hiperglucemias moderadas disminuyeron la eficiencia de implantación e incrementaron las pérdidas preimplantación en el grupo diabético respecto del grupo control, ambos indicadores con significación estadística.
Cuadro 1 Rendimiento reproductivo materno en los grupos diabético y control
| Indicadores de rendimiento reproductivo | Grupo diabético | Grupo control |
| Ganancia de peso durante la gestación | 7.77 ± 4.291 | 8.31 ± 3.923 |
| Peso de los cuernos uterinos (g) | 1.98 ± 0.210 | 2.54 ± 0.226 |
| Cuerpos lúteos | 13.70 ± 0.716 | 13.33 ± 0.707 |
| Sitios de implantación | 9.50 ± 1.004 | 11.11 ± 1.006 |
| Porcentaje de reabsorciones (%) | 12.66 ± 5.727 | 7.16 ± 1.937 |
| Pérdidas preimplantación (%) | 32.94 ± 7.865 * | 17.01 ± 5.268 |
| Eficiencia de implantación (%) | 67.02 ± 7.865 * | 82.98 ± 5.268 |
Los valores están representados como media ± EEM. Prueba U de Mann-Whitney (*p < 0.05).
En el Cuadro 2 se presentan los indicadores de crecimiento y desarrollo embrionario. Los embriones descendientes de las ratas con hiperglucemias moderadas mostraron una disminución significativa de la talla respecto de los embriones descendientes de ratas sanas. En la cantidad de somitas no se detectaron diferencias entre los grupos de estudio. Ambos indicadores mostraron una correlación positiva y muy significativa (coeficiente de correlación de Spearman (Rho) = 0.350; p = 0.000).
Cuadro 2 Indicadores de crecimiento y desarrollo embrionario en los grupos diabético y control
| Indicadores de crecimiento y desarrollo | Grupo diabético | Grupo control |
| Talla (mm) | 3.46 ± 0.080 * | 3.70 ± 0.085 |
| Cantidad de somitas | 21.04 ± 0.221 | 21.11 ± 0.247 |
Los valores están representados como media ± EEM. Prueba U de Mann-Whitney (*p < 0.05).
La clasificación de los embriones según la talla y cantidad de somitas en los grupos estudiados se muestra en la Figura 1. En la descendencia de ratas diabéticas se observó casi el doble de embriones clasificados con talla inferior al percentil 5 y un porcentaje menor de embriones clasificados con talla adecuada o superior al percentil 95 respecto del grupo control (Figura 1A). En relación con la clasificación según la cantidad de somitas se detectó más del 50% de embriones del grupo diabético con una cantidad de somitas inferior al percentil 5 respecto del grupo control. Ningún embrión descendiente de ratas diabéticas tuvo una cantidad de somitas superior al percentil 95 (Figura 1B).
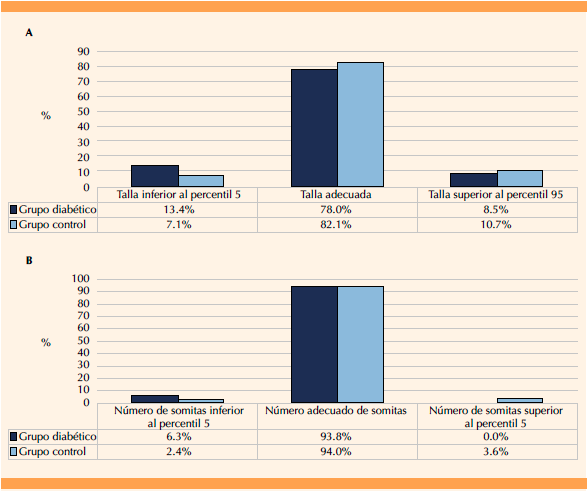
Figura 1 Clasificación de los embriones según la talla (A) y cantidad de somitas (B) en los grupos diabético y control. Prueba de la χ2 para la comparación de proporciones. Prueba exacta de Fisher (p > 0.05).
En el estudio de la morfología embrionaria, correspondiente con la edad gestacional de 11.5 días, se encontraron alteraciones morfológicas en el sistema nervioso central en tres embriones descendientes de las ratas del grupo diabético. En el Cuadro 3 se muestra la cantidad de embriones malformados según el tipo de malformación, región y sistema afectado. En el grupo control no se detectaron embriones con alteraciones morfológicas externas (Figura 2A). En un embrión se observaron dos malformaciones: defecto de cierre del tubo neural en la región caudal y ausencia de la morfología esperada para este tiempo en las vesículas cerebrales (Figura 2B). En otros dos embriones también se detectaron alteraciones en la morfología normal de la curvatura del mesencéfalo. Figuras 2 C, D y E
Cuadro 3 Cantidad de embriones de ratas diabéticas según el tipo de malformación, región y sistema afectado
| Tipo de malformación | Embriones afectados | Región (sistema afectados) |
| Defecto de cierre de tubo neural caudal | 1 | Caudal (sistema nervioso) |
| Alteraciones en vesículas cerebrales | 1 | Cefálica (sistema nervioso) |
| Alteraciones en curvatura mesencefálica | 2 | Cefálica (sistema nervioso) |
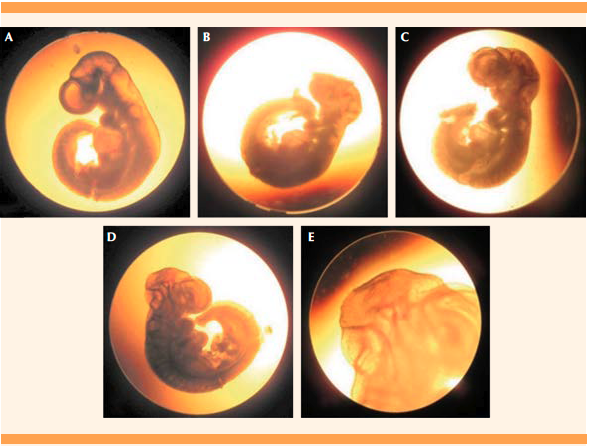
Figura 2 Imágenes de embriones de ratas de 11.5 días de gestación A: embrión morfológicamente normal descendiente de rata control. B, C, D y E: embriones malformados descendientes de ratas diabéticas. B: embrión con defecto de cierre del tubo neural en la región caudal y vesículas cerebrales malformadas; C y D: embriones con alteración en la curvatura mesencefálica; E: ampliación de la región cefálica del embrión.
DISCUSIÓN
La inducción química con estreptozotocina en el periodo neonatal la han utilizado varios equipos de investigación para estudiar las consecuencias de la diabetes con hiperglucemias moderadas en la madre y su descendencia, con desenlaces clínicos similares al embarazo diabético humano. 9,18 En investigaciones previas del modelo experimental estudiado se reportaron alteraciones metabólicas y reproductivas maternas, malformaciones y trastornos en el crecimiento de la descendencia en etapa fetal.10,11,12 Sin embargo, no existen antecedentes de investigaciones que exploren las malformaciones y alteraciones en el crecimiento intrauterino de la descendencia en etapa embrionaria en ratas con diabetes moderada.
Está demostrado que las ratas gestadas, con diabetes moderada, tienen hiperglucemias e hipoinsulinemias moderadas, respuesta alterada a la prueba de tolerancia a la glucosa oral, aumento de la hemoglobina glucosilada y alteración del perfil lipídico. 9,10 Con base en estos trastornos metabólicos en las ratas diabéticas gestadas, y según la teoría de Freinkel, son lógicas las alteraciones detectadas en el rendimiento reproductivo materno de esta investigación. Esta teoría apoya una compleja interacción en el ambiente intrauterino de modo que la glucosa, los aminoácidos y los lípidos juegan, todos, un papel relevante en la organogénesis y en la fisiopatología del desarrollo embrio-fetal. 19
En este estudio, a pesar de la hiperlipemia reportada en las ratas gestadas diabéticas y la hiperfagia descrita por algunos autores a inicios de la gestación, 20 en las ratas del grupo diabético se apreció, desde el punto de vista biológico, disminución en la ganancia de peso y peso del útero respecto a las sanas, en concordancia con lo reportado en estudios similares. 10,21 La hiperglucemia moderada provocó reducción de los sitios de implantación, aumento de las pérdidas preimplantación y de las reabsorciones, así como restricción del crecimiento intrauterino. Estos trastornos influyeron en la disminución del peso del útero, con repercusión en la menor ganancia materna de peso.
Del análisis de los resultados relacionados con el proceso de implantación se deriva que en este experimento la totalidad de los ovocitos no se implantó exitosamente. La implantación del embrión requiere una comunicación funcional entre el blastocito y el endometrio receptivo durante un breve periodo (ventana de implantación). Estos dos eventos están regulados con precisión por las hormonas maternas, en particular, el estrógeno ovárico y la progesterona. Algunas investigaciones han reportado una disminución en la sensibilidad a los esteroides ováricos en mujeres hiperglucémicas que podría causar falla en la implantación del embrión, lo que explicaría el incremento en las pérdidas preimplantación encontrado en las ratas diabéticas. 22
Además de varias complicaciones durante la ventana de implantación, la hiperglucemia se asocia con alteraciones en la estructura de los embriones preimplantados. Esta situación, sumada al estrés oxidativo materno y otros cambios metabólicos, conduce a un deterioro de la estructura morfológica y, más tarde, de su crecimiento y desarrollo. Todo esto conduce al aumento de las muertes embrionarias o reabsorciones, equivalentes a los abortos espontáneos en la diabetes humana. 9,23 En el embarazo diabético, el hecho de que los embriones logren implantarse no es garantía de que tendrán un desarrollo adecuado, aun cuando sean viables pueden tener restricción del crecimiento y malformaciones que lleguen a provocar la muerte del embrión. 23
El desarrollo del producto de la concepción no solo depende de la disponibilidad suficiente de oxígeno y nutrición suministrados por la placenta, sino que está organizado por un grupo de factores de crecimiento, en interacción con factores genéticos y con el ambiente intrauterino materno. Cualquier variación en la glucemia intrauterina, aunque pequeña y transitoria, puede causar alteraciones, algunas incluso la muerte embrionaria temprana, o impedir el adecuado desarrollo.19,24 En este estudio, de acuerdo con la distribución de los embriones en percentiles según la talla y cantidad de somitas, se observó que la descendencia expuesta a un ambiente intrauterino hiperglucémico tuvo retraso en el crecimiento y desarrollo, similar a lo encontrado en la descendencia en etapa fetal en este modelo de diabetes. 10 Además, en una investigación en la etapa embrionaria, en un modelo de diabetes severa, se encontró retardo en el crecimiento y desarrollo, evidenciado por la disminución en el contenido proteico embrionario, la talla y la cantidad de somitas en los embriones de ratas diabéticas. 25
En modelos animales existen evidencias de que la exposición del ovocito preovulatorio al ambiente diabético puede influir en la expresión de genes involucrados en la organogénesis adecuada, tanto del embrión como de la placenta, antes de que estos genes puedan ser inducidos. La apoptosis de una cantidad limitada de células del blastocito puede producir retardo en el crecimiento, pero la pérdida de una masa crítica de células progenitoras por parte de un órgano o estructura de nueva formación dará lugar a un defecto de nacimiento,23,26,27 lo que podría explicar los trastornos embrionarios observados en este estudio.
Los defectos congénitos, o malformaciones congénitas, son anomalías estructurales o funcionales en el momento del nacimiento, que pueden ser clínicamente evidentes o no y producir discapacidad o muerte, a corto o largo plazo. Si bien muchas son compatibles con la vida, algunas requieren de importantes intervenciones médicas antes o después del nacimiento. Estos defectos se manifiestan en una gran variedad de formas y asociaciones, que van desde alteraciones simples que afectan a una sola estructura, hasta grotescas deformidades que pueden afectar a una región corporal completa. La génesis de los defectos congénitos puede contemplarse como una interacción entre el aporte genético que recibe el embrión y el ambiente en que se desarrolla. 27
El exceso de glucosa en los tejidos embrionarios incrementa el metabolismo oxidativo y el consumo de oxígeno, por lo que la hipoxia generada excede los límites fisiológicos que caracterizan al desarrollo normal. Los genes que codifican para las enzimas antioxidantes no se expresan hasta el final del embarazo, lo que hace todo el periodo embrio-fetal vulnerable a las especies reactivas del oxígeno. En estas condiciones se estimula la producción mitocondrial del radical superóxido que conduce a un estado de estrés oxidativo con marcado efecto embriotóxico.19,23,26
El estrés oxidativo y el estado hipóxico, característicos del ambiente intrauterino hiperglucémico, condicionan la aparición de cambios epigenéticos. En particular, la disminución de la expresión del gen del factor de transcripción Pax 3 afecta negativamente la regulación del gen p53 que controla los eventos apoptósicos que definen la correcta formación de estructuras embrionarias. 19,23
En la diabetes pregestacional, en humanos y en modelos experimentales, los efectos más reconocidos de la teratogenicidad radiocan en la migración incorrecta de las células caudales que afectan, además del cierre del tubo neural, la formación del corazón y los grandes vasos. 19,23 Estas células se forman en los extremos de los pliegues neurales e intervienen en el cierre adecuado del tubo neural y, posteriormente, migran y proliferan formando los tabiques cardiacos, estructuras de la cara y el cráneo. En ratas, al igual que en humanos, el proceso de neurulación ocurre mediante la formación del tubo neural (el día 9.5 de gestación) que representa la manifestación morfológica de los primeros estadios en la formación del sistema nervioso; la porción caudal de la médula espinal se forma durante la neurulación secundaria. 7,27
La frecuencia de malformaciones neurológicas es hasta seis veces más alta en la diabetes que en la población general. Las alteraciones en el sistema nervioso central, encontradas en la etapa embrionaria, en dependencia de su localización y del grado de severidad, pueden generar defectos por fusión interhemisférica del cerebro en la línea media, microcefalia, anencefalia, exencefalia, acrania, espina bífida e, incluso, afecciones del neurodesarrollo.5,28,29 Con base en lo analizado, el adecuado control glucémico materno, previo y durante la gestación, constituye un reto necesario para los profesionales de la salud. Es fundamental evitar en la descendencia de mujeres diabéticas, además de las malformaciones, las limitaciones en la vida postnatal relacionadas con el sistema nervioso central.











 nueva página del texto (beta)
nueva página del texto (beta)


