INTRODUCCIÓN
El embarazo se caracteriza por cambios hemodinámicos, hematológicos, pulmonares, del sistema nervioso autónomo y hormonal asociados con la regulación del flujo sanguíneo.1 A pesar de ello, la manifestación de cardiopatía durante el periparto es poco común y supone un riesgo para la vida de la paciente.2
La insuficiencia cardiaca congestiva se ha estudiado y reportado pocas veces;3,4 previamente se relacionó con las modificaciones fisiológicas del periparto.5 Las cardiopatías idiopáticas asociadas con el embarazo sobrevienen durante el periparto o en los últimos meses del embarazo, sin ninguna cardiopatía previa relacionada y con modificación de la fracción de eyección ventricular izquierda (FEVI) menor del 45%.6 En Estados Unidos la incidencia es de 1 caso por cada 4000 pacientes durante el puerperio, en Sudáfrica de 1 caso por cada 1000 embarazos y en Haití de 1 por cada 300 pacientes.7,8
Los pocos datos fisiológicos asociados con las cardiopatías periparto incluyen: cambios en la concentración de prolactina, catepsina D y el fragmento de prolactina de 16 kDa, como parte de la cascada de cambios oxidativos.9
Enseguida se describen el procedimiento diagnóstico y de tratamiento de un caso excepcional de cardiopatía congestiva puerperal, que posterior al protocolo de estudio permitió establecer el diagnóstico de miocardiopatía periparto.
CASO CLÍNICO
Paciente de 26 años, en curso de las 35.4 semanas del segundo embarazo, establecidas en la ultrasonografía, con inicio abrupto de disnea de pequeños esfuerzos, tos no productiva en accesos e hipertensión (170-110 mmHg); sin datos de encefalopatía hipertensiva ni pérdidas transvaginales o actividad uterina. Al momento de la evaluación contaba con esquema de maduración pulmonar (6 mg de dexametasona por vía intramuscular cada 12 horas), administrado a las 32 semanas. Dentro de sus antecedentes personales patológicos refirió: rinitis alérgica, asma y apendicectomía a los 12 años.
Durante la exploración clínica se advirtieron, en las bases pulmonares, estertores crepitantes, finos, bilaterales; edema de los miembros pélvicos grado 3, sin actividad uterina; tensión arterial elevada (160-120 mmHg), frecuencia cardiaca de 98 latidos por minuto y polipnea (32 respiraciones por minuto).
Los estudios de laboratorio reportaron: leucocitos 12.32, neutrófilos 7.8, hemoglobina 14, hematocrito 41, plaquetas 227,000, examen general de orina con proteinuria de 300 mg/dL, sangre 200 mg/dL, DHL 443 u/L, TGP 96 u/L, TGO 101 u/L; creatinina 1.03 mg/dL, glucosa 96 mg/dL y urea 34 mg/dL; tipo y Rh A+; VDRL negativo y VIH no reactivo.
Se integró diagnóstico de preeclampsia con criterios de severidad. Se activó el código mater y se ingresó al área de tococirugía para completar el protocolo de estudio, lograr la estabilización hemodinámica y finalizar el embarazo. Para el tratamiento se recurrió al protocolo de preeclampsia, con sulfato de magnesio, doble esquema antihipertensivo por vía oral (500 mg de alfametildopa cada 6 horas y 50 mg de hidralazina cada 6 horas), sin lograr las metas terapéuticas. Se decidió agregar un tercer antihipertensivo: 30 mg de nifedipino por vía oral cada 12 horas y 5 mg de hidralazina por vía intravenosa cada 15 minutos. La paciente requirió dos bolos para alcanzar las metas de control de las cifras tensionales.
En el transcurso de la primera hora de hospitalización tuvo deterioro súbito del bienestar materno, con disnea en reposo e intolerancia al decúbito, y exacerbación de la tos. En la exploración se observaron: anasarca, esfuerzo respiratorio y uso de músculos accesorios; estertores gruesos de ambas bases pulmonares, saturación de oxígeno de 74%, con administración de oxígeno suplementario a 5 litros por minuto.
Se sospechó edema agudo de pulmón y se corroboró el diagnóstico; se le prescribieron 60 mg de furosemida por vía intravenosa, en dosis única, y se cambió a oxígeno por mascarilla a 10 litros por minuto. Posterior al inicio del tratamiento del edema agudo de pulmón se documentó la alteración del bienestar fetal, con registro cardiotocográfico categoría 2 de la ACOG por variabilidad mínima y aceleraciones ausentes. Se decidió la interrupción inmediata del embarazo por cesárea; se obtuvo una recién nacida de 2400 g, con Apgar 8-9, de 36 semanas de gestación por Capurro. La cesárea fue de urgencia, con anestesia general balanceada. La hemorragia obstétrica fue de aproximadamente 700 cc, secundaria a la inversión uterina por probable placenta acreta y atonía uterina, complicaciones que se trataron de forma conservadora, con uterotónicos y curetaje uterino. Enseguida del evento obstétrico la paciente se trasladó a la unidad de cuidados intensivos para atención multidisciplinaria y completar el protocolo de estudio y tratamiento.
Al ingreso a cuidados intensivos se sospechó el edema agudo de pulmón, de origen cardiogénico, secundario a una urgencia hipertensiva. Los estudios de laboratorio posparto informaron: leucocitos 24.62 kg/mcL, neutrófilos 18.58 kg/mcL, hemoglobina 12.5 g/dL, hematocrito 37.5 g/dL, plaquetas 238 k/dl, Ca 8, P 5.0, au 7, BUN 15, creatinina 0.97, glucosa 176, urea 32, Na 143, K 3.4, Cl 113 y péptido natriurético auricular tipo B (PNB) 1101.07 pg/mL. Se documentó leucocitosis con desviación a la izquierda (propia del puerperio), leve disminución de la hemoglobina con relación a su ingreso y PNB significativamente aumentado. Además, se sospechó insuficiencia cardiaca congestiva aguda, secundaria a urgencia hipertensiva, por lo que se decidió practicar una cardioscopia, efectuada por un médico intensivista que encontró datos de disfunción sistólica, con hipocinesia generalizada, fracción de acortamiento del 19%, líneas B pulmonares; a considerar: miocardiopatía peripato como primer diagnóstico diferencial. Se solicitó la interconsulta con el cardiólogo y se continuó con el tratamiento antihipertensivo y diurético. A las 24 horas se documentó insuficiencia renal aguda AKIN I y desequilibrio hidroelectrolítico; se le administró solución Hartmann y furosemida hasta lograr su corrección. A las 48 horas de su ingreso y al cumplir con los criterios para la misma, se logró la extubación con éxito.
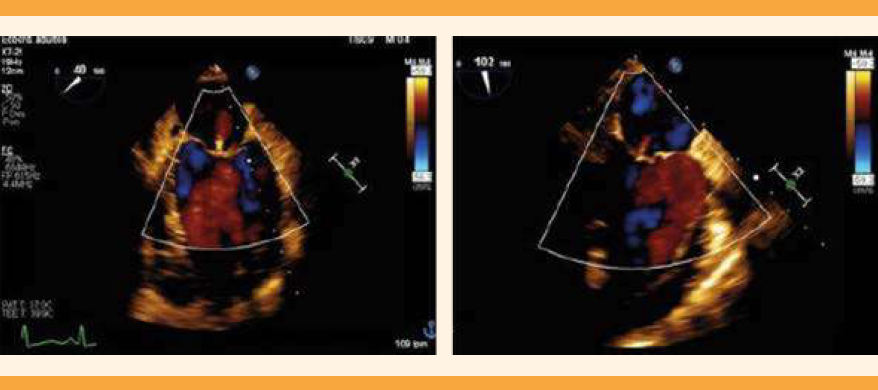
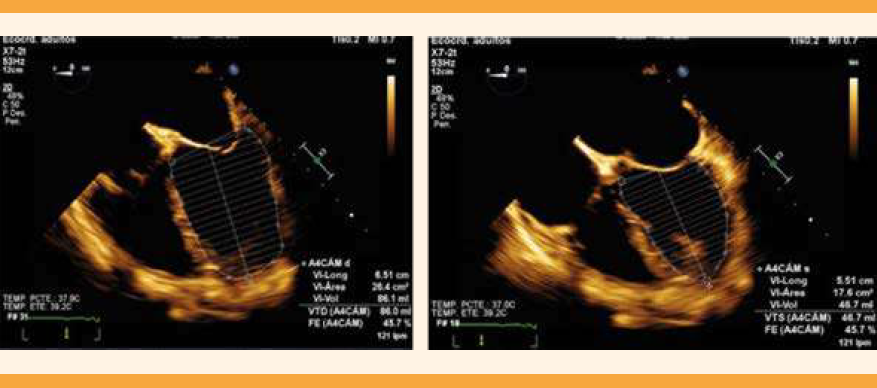
En la valoración cardiológica se encontraron campos pulmonares con estertores crepitantes, gruesos, bilaterales, de predominio basal y medio, saturación sin oxígeno suplementario de 85% y con puntas nasales a 5 litros por minuto a 94%. En la radiografía de tórax se advirtieron la cardiomegalia grado 2, cefalización de flujo e hipodensidad parahiliar derecha. El ecocardiograma transtorácico reportó: ventrículo izquierdo dilatado, fracción de eyección disminuida, con hipocinesia por el método de Simpson de 24.3%, geometría hipertrófica excéntrica, movilidad global y segmentaria con hipocinesia global, y disfunción diastólica grado II. Además de Strain global longitudinal -9.38%, insuficiencia valvular mitral severa estadio D por el American College of Cardiology-American Heart Association (ACC/AHA), insuficiencia valvular tricúspidea leve estadio B ACC/AHA, auricular izquierda dilatada, hipertensión pulmonar moderada con presión sistólica arterial pulmonar 48 mmHg, sin derrame pericárdico. Figuras 1a, 1b y 2a, 2b
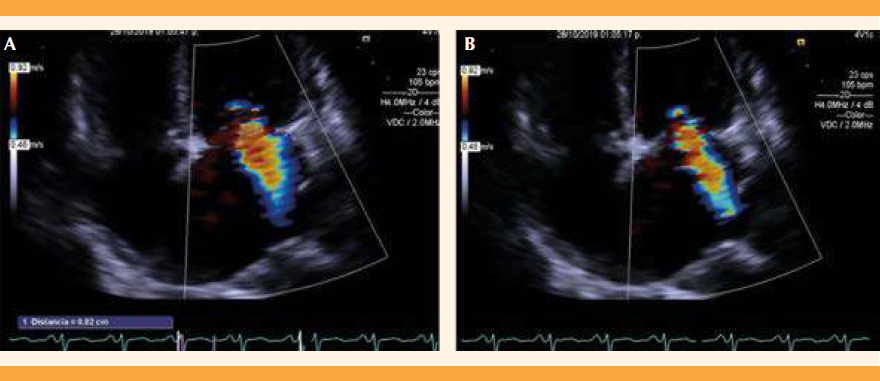
Figura 1a y 1b. Ecocardiograma transtorácico: proyección en 4C, que evidencia la insuficiencia valvular mitral severa.
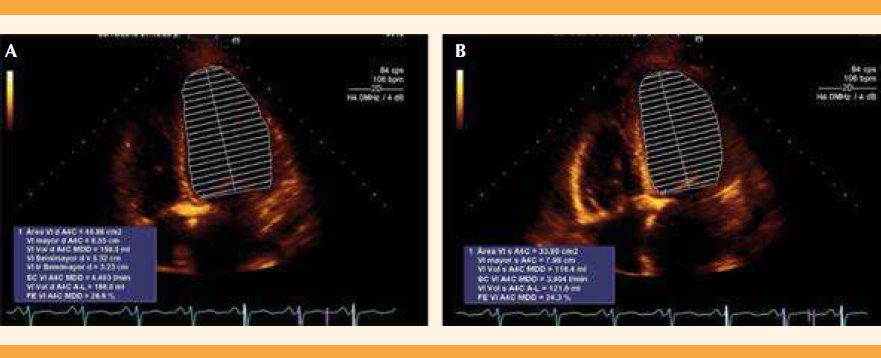
Figura 2a y 2b. Ecocardiograma transtorácico que muestra la disfunción sistólica del ventrículo izquierdo; fracción de eyección del ventrículo izquierdo disminuida (24.3%).
En el electrocardiograma no se encontraron datos de isquemia ni lesión o infarto. Los exámenes de laboratorio a las 48 horas reportaron: procalcitonina 0.7 mg/dL y PNB en 586,30 pg/dL, hemocultivo negativo, gasometría arterial normal y sin alteración de líquidos y electrolitos.
Se integró el diagnóstico cardiológico de insuficiencia cardiaca congestiva, secundaria a miocardiopatía periparto, misma que condicionó la disfunción valvular mitral y tricúspidea, cuadro derivado de la urgencia hipertensiva. El tratamiento se inició con 40 mg de telmisartán y 25 mg de espironolactona, ambos por vía oral, cada 24 horas y 40 mg de furosemida por vía intravenosa en dosis única.
Al cuarto día de estancia hospitalaria se le indicaron 80 mg de gentamicina por vía intravenosa cada 8 horas, como segundo antibiótico junto con ceftriaxona, a fin de evitar la endocarditis o las vegetaciones valvulares. Seis días después de su ingreso se otorgó el alta hospitalaria, por mejoría clínica y analítica; los últimos dos perfiles totémicos y los análisis de laboratorio de control previos a su egreso se reportaron dentro de los parámetros normales.
La paciente continuó en tratamiento ambulatorio, con especialistas en Medicina Materno-Fetal y Cardiología. Acudió a dos citas de seguimiento durante el puerperio, en las que se documentó adecuada recuperación posquirúrgica, con cifras tensionales en los parámetros de referencia. La evolución clínica del neonato continuó sin complicaciones.
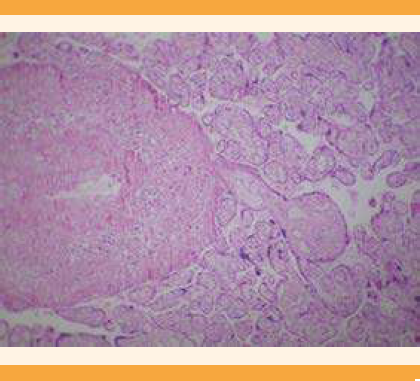
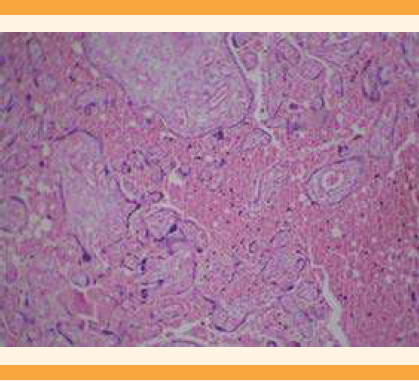
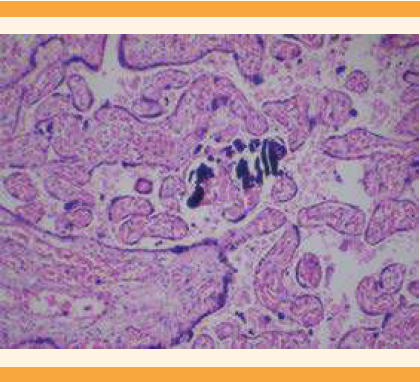
El reporte de Patología de la placenta fue: disco placentario con múltiples áreas focales de necrosis coagulativa-infarto (Figura 3), acompañadas de extensas áreas de hemorragia reciente (Figura 4) y escasas microcalcificaciones (Figura 5); con vellosidades coriónicas maduras y notable congestión vascular, algunas de ellas con incremento en la cantidad de vasos capilares y bandas de fibrina-colágeno en la periferia que, a su vez, alternaban con zonas de notable atrofia de las vellosidades. Las membranas fetales (corión-amnios) se encontraron con discreto edema, pero sin evidencia de infiltrado inflamatorio o proceso infeccioso. El cordón umbilical trivascular (2 arterias y 1 vena) sin evidencia de funisitis. No se lograron identificar microorganismos ni datos sugerentes de malignidad.
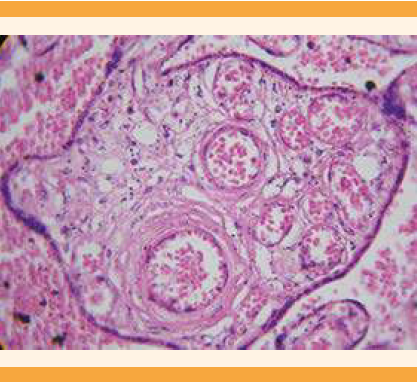
Los hallazgos histopatológicos descritos fueron compatibles con un proceso de corangiosis (Figura 6) y corangiomatosis segmentaria-focal (Figuras 5 y 6). Con base en el reporte histopatológico se descartó el acretismo placentario y se integró el diagnóstico de corangiosis y corangiomatosis placentaria.
Las dos citas de control cardiológico posteriores, al mes y tres meses, no documentaron datos patológicos; la paciente permanecía asintomática, con adecuada respuesta clínica al tratamiento médico.
Se indicó ecocardiograma transtorácico de seguimiento para determinar la conducta a seguir en relación con el tratamiento de las valvulopatías, diez meses posteriores al cuadro de insuficiencia cardiaca congestiva con el siguiente reporte: ventrículo izquierdo de tamaño y geometría normales, movilidad global y segmentaria con hipocinesia en la región anterior, anterolateral y anteroseptal. Función sistólica disminuida (fracción de eyección del ventrículo izquierdo del 46%), función diastólica normal, Strain global longitudinal -15.9%. Insuficiencia mitral leve estadio B ACC/AHA. Ventrículo derecho de tamaño normal, con función sistólica conservada, sin datos de hipertensión pulmonar y PSAP de 12 mmHg, sin derrame pericárdico. Figura 7
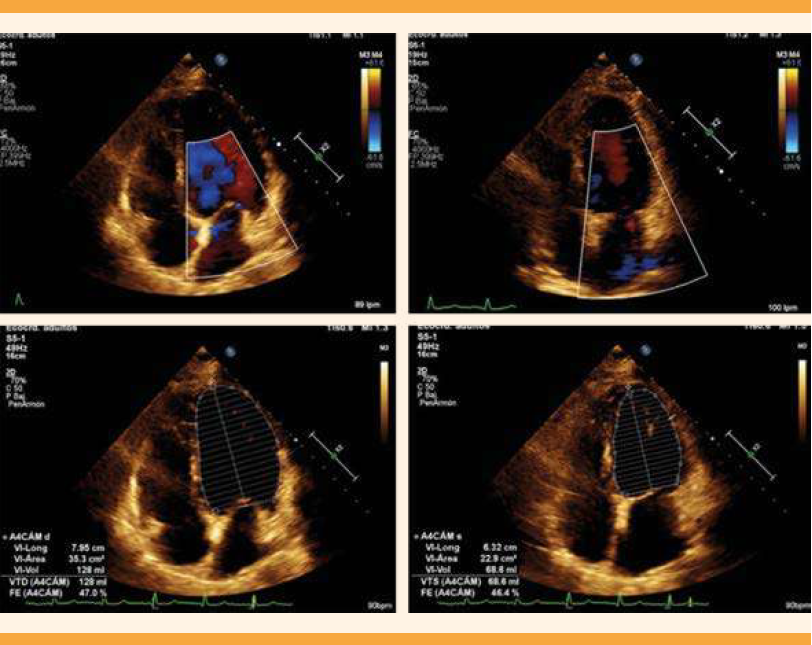
Figura 7 Ecocardiograma transtorácico de seguimiento, donde se observa una marcada disminución de la insuficiencia valvular mitral, con recuperación de la función ventricular izquierda (46%).
Previo al tercer ecocardiograma transtorácico (Figura 7) se planteó la necesidad de recambio de valvula mitral como tratamiento quirúrgico definitivo para la insuficiencia mitral severa, por sospecha de una lesión preexistente no conocida; sin embargo, después del estudio se observó mejoría de la función valvular, de la fracción de eyección del ventrículo izquierdo y de la presión pulmonar, por lo que se consideró una valvulopatía secundaria a miocardiopatía periparto y se descartó la teoría antes comentada.
Para complementar el estudio, personal del servicio de Cardiología decidieron efectuar un ecocardiograma transtorácico adicional, a los 12 meses del cuadro agudo, que reportó insuficiencia mitral leve, fracción de eyección del ventrículo izquierdo del 46%, y Strain global longitudinal menor del 15.9%. Figuras 8 y 9
En el ecocardiograma transesofágico se realizó la restructuración en 3D de la válvula mitral, donde se observó estructuralmente normal. El Doppler color documentó insuficiencia valvular leve (Figura 10); descenso del PNB en relación con evolución clínica favorable de la insuficiencia cardiaca de la paciente. Figura 11
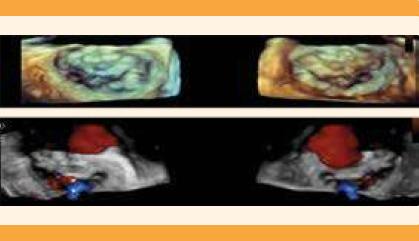
Figura 10 Válvula mitral en vista auricular y ventricular. Se aprecia estructuralmente normal. Al Doppler color se observa insuficiencia valvular leve.

Figura 11 Comportamiento del péptido natriurético auricular seriado, según los días de evolución del cuadro clínico.
Debido a la mejoría clínica, paraclínica y ecocardiográfica de la paciente se continuó el tratamiento con sacuvitril-valsartan (50 mg cada 24 horas) y bisoprolol (5 mg cada 24 horas), con seguimiento ecocardiográfico anual.
DISCUSIÓN
Las pacientes con cardiopatías periparto expresan síntomas clínicos similares a los de otras cardiopatías: edema de miembros pélvicos, disnea, ortopnea, disnea paroxística nocturna y tos persistente. A lo anterior se agregan dolor precordial y palpitaciones conforme se incrementa la congestión pulmonar y hepática,9 como sucedió en la paciente del caso aquí expuesto.
Pocos estudios han señalado que las complicaciones cardiológicas periparto, en especial las congestivas, se relacionan directamente con las alteraciones hipertensivas, con daño al corazón.10-12
La determinación del péptido natriurético auricular es la prueba de referencia, y suele elevarse por arriba de 1000 pg/mL (Cuadro 1). La electrocardiografía permite identificar cambios en el voltaje o la hipertrofia.12
Cuadro 1 Seguimiento ecocardiográfico
| Ecografía | FEVI | SGL | Válvulas | PSAP |
|---|---|---|---|---|
| 1. Cardioscopia (puerperio inmediato) | Disfunción sistólica, con hipocinesia generalizada, fracción de acortamiento del 19%, líneas B pulmonares a considerar miocardiopatía periparto | |||
| 2. Ecocardiograma transtorácico (puerperio mediato) | 24.3% | -9.38% | Insuficiencia valvular mitral severa Estadio D ACC/AHA, Insuficiencia valvular tricuspidea Leve estadio B ACC/AHA | 48 mmHg |
| 3. Ecocardiograma transtorácico (a los 10 meses) | 46% | -15.9% | Insuficiencia mitral leve Estadio B ACC/AHA. | 12 mmHg |
| 4. Ecocardiograma transesofágico (a los 12 meses) | 46% | -15.9% | Insuficiencia mitral leve Estadio B ACC/AHA | 12 mmHg |
FEVI: fracción de eyección del ventrículo izquierdo; SGL: Strain Global Longitudinal; PSAP: presión sistólica de la arteria pulmonar.
La ecografía y resonancia magnética son estudios de imagen complementarios efectivos para evaluar las modificaciones en el volumen de las cámaras cardiacas.9
En la paciente del caso se encontró miocardiopatía periparto, con manifestación principal de insuficiencia cardiaca aguda, secundaria a la disfunción valvular. Se trata de uno de los diagnósticos diferenciales de cardiopatía periparto, en especial con características congestivas. Ésta se caracteriza, de forma particular, por incremento del péptido natriurético y de la estenosis o regurgitación valvular, que principalmente se identifica por ecografía cardiaca y requiere cambio prostético valvular.13Pese a que en el primer ecocardiograma se documentaron datos de insuficiencia mitral severa e insuficiencia tricúspidea moderada, en el seguimiento ecocardiográfico se evidenció mejoría de la función valvular y se descartaron los daños estructurales y funcionales previos. Con base en los hallazgos se decidió no practicar la valvulopatía, como causa de insuficiencia cardiaca congestiva, y se integró el diagnóstico de miocardiopatía periparto. Mediante el seguimiento ecográfico adecuado se evidenció que los cambios valvulares encontrados en el segundo estudio eran secundarios a los cambios fisiológicos del embarazo y a la propia fisiopatología de la miocardiopatía periparto per se. Cuadro 1
CONCLUSIONES
El tratamiento de la paciente del caso aquí reportado fue adecuado y quedó de manifiesto en su recuperación. Pese a ello, aún es difícil saber cómo deben identificarse tempranamente estos casos, antes de que sobrevenga el cuadro clínico o los síntomas que puedan poner en riesgo la vida de las pacientes.











 nueva página del texto (beta)
nueva página del texto (beta)