INTRODUCCIÓN
La enfermedad de Castleman se caracteriza por el crecimiento del tejido linfoide (hiperplasia gigante de ganglios linfáticos). La primera descripción fue de Benjamin Castleman en el decenio de 1950. Este autor encontró un nódulo linfático mediastinal caracterizado por múltiples folículos linfoides, con un centro germinal involucionado y proliferación capilar importante.1
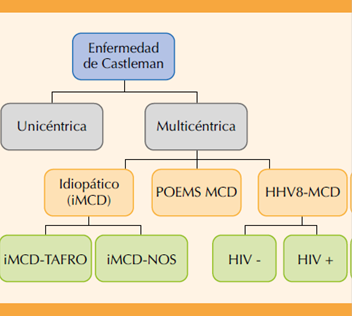
De acuerdo con los hallazgos histopatológicos, la enfermedad se clasifica en hialina vascular, de células plasmáticas o de tipo mixto. En el 2017 se propuso una nueva clasificación en virtud de la dificultad para observar los hallazgos histopatológicos específicos en cada grupo. La nueva clasificación la divide en unicéntrica y multicéntrica, según la cantidad de regiones afectadas. La variante multicéntrica, a su vez, se divide en idiopática (iMCD), asociada con herpes virus 8 (HHV8-MCD) y las que tienen manifestaciones de polineuropatía, organomegalia, endocrinopatía y cambios en la piel (POEMS-MCD). De la variante idiopática se han descrito algunas características clínicas (trombocitopenia, ascitis, disfunción renal, organomegalia) que, a su vez, la subdividen en trombocitopenia, anasarca, fiebre, fibrosis reticulínica y organomegalia (TAFRO) y en las que no cumplen con los criterio s específicos iMCD-NOS.1 Figura 1
Enseguida se comunica el caso de una paciente de 19 años que acudió a consulta debido a la aparición de un nódulo en la mama derecha, con adenomegalias en la izquierda, fijas a planos profundos, con aumento de vascularidad en el Doppler.
CASO CLÍNICO
Paciente de 19 años, que acudió a revisión ginecológica debido a la aparición de un nódulo palpable en la mama derecha, carente de síntomas. En la exploración física se palparon nódulos en la mama derecha, en el cuadrante inferior externo y adenomegalias en la axila izquierda, fijas a planos profundos. En el ultrasonido mamario y axilar se encontraron fibroadenomas mamarios bilaterales y adenomegalias en el lado izquierdo, con alta vascularidad. Se catalogó como BIRADS 3. Figura 2
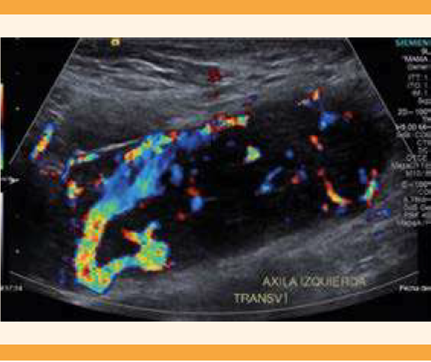
Figura 2 Ganglio axilar izquierdo hipoecoico aumentado de tamaño y con pérdida de su hilio graso localizado en la axila izquierda (40 x 4 mm).
La resonancia magnética contrastada reportó nódulos sólidos bilaterales, sugerentes de fibroadenomas y adenopatías axilares en el lado izquierdo, que se clasificaron con BIRADS 4. Por lo anterior, se decidió la toma de una biopsia con aguja de corte de ganglio axilar izquierda, con reporte histopatológico de: proliferación linfoide atípica. La inmunohistoquímica reportó positividad en: CD20, CD3, CD21 en células dendríticas interfoliculares, Ki-67 y negatividad para HHV-8 en centros germinales residuales. Figura 3

Figura 3 Nivel 1 de la región axilar izquierda. Se observa una adenopatía con importante realce, posterior a la administración de gadolinio.
Descripción histopatológica
Los cortes con tinción de hematoxilina y eosina evidenciaron la proliferación de grandes centros germinales de tamaño y forma variable, distribuidos más allá de la zona cortical ganglionar. Los folículos linfoides son hiperplásicos, con marcada proliferación vascular y áreas de hialinización (Figuras 4 y 5). El componente citológico de los centros germinales era heterogéneo, predominantemente compuesto por centrocitos y células dendríticas foliculares de forma difusa. Destacaron el engrosamiento y la marcada delimitación de forma concéntrica de la zona del manto, reconocida como una capa de células predominantemente basófilas respecto de la afinidad tintorial del centro germinal, dispuesta en un patrón en “capas de cebolla”.

Figura 4 Centrocitos con escaso citoplasma y núcleos basófilos redondos, mezclados con células dendríticas foliculares. Destaca el aspecto estrellado que rodea la zona del manto engrosada, con células en patrón de “capas de cebolla” (flecha). El estroma interfolicular y el centro germinal muestran vasos hiperplásicos con paredes gruesas y hialinizadas.
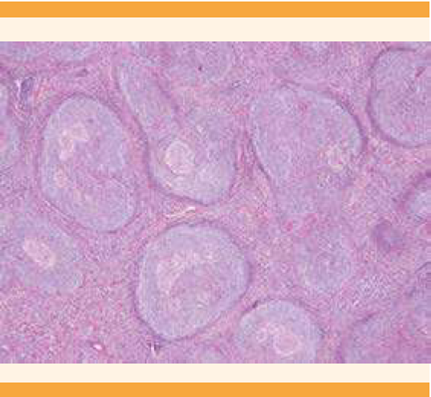
Figura 5 Centros germinales hiperplásicos, de tamaño y forma heterogénea que sobrepasan la zona cortical del ganglio linfático. Se aprecia un marcado engrosamiento de la zona del manto (zona basófila que rodea al centro germinal). El estroma interfolicular se observa prominente, con vasos postcapilares elongados y hialinizados.
El estroma interfolicular es prominente, con importante componente proliferativo de vasos poscapilares hialinizados y elongados, mezclados con células plasmáticas, células dendríticas foliculares y linfocitos T. No hay sinusoides o están colapsados.
El reporte histopatológico de la exéresis del ganglio axilar izquierdo confirmó el diagnóstico de enfermedad de Castleman hialino-vascular, negativa a HHV-8.
DISCUSIÓN
La enfermedad de Castleman es de baja incidencia y prevalencia, de ahí el poco interés en su estudio. La incidencia es un poco mayor en la población masculina, con la variante multicéntrica, a diferencia de la unicéntrica que no tiene predominio por género. La edad a la aparición más frecuente es la cuarta década; de ahí la “rareza” del caso aquí reportado. Uno de los pocos factores de riesgo asociados con este padecimiento es la infección con el virus de la inmunodeficiencia humana (VIH).1
La mayoría de las pacientes con afectación unicéntrica permanecen asintomáticas. Es común que la adenomegalia se diagnostique durante una exploración de rutina o por alguna otra causa. El diagnóstico definitivo se establece con base en el reporte histopatológico posterior a la extirpación del ganglio que es, además, un procedimiento diagnóstico-terapéutico que no requiere ninguno otro posterior. Si bien se ha comunicado recurrencia de esta enfermedad no se ha reportado una progresión a la multicentricidad.2
La variante asociada con el herpes virus tipo 8 es multicéntrica y suele originar manifestaciones sistémicas: hepatoesplenomegalia, síntomas constitucionales, retención hídrica, tormenta de citocinas que conduce a la insuficiencia orgánica múltiple. El herpes virus tipo 8 se asocia estrechamente en pacientes con VIH o con alguna otra causa de inmunodeficiencia que permite la pérdida de control inmunológico en el huésped. Las células B son las más afectadas en esta variante y se asocian con algún antígeno nuclear-1.3
La variante POEMS es paraneoplásica atípica, con frecuencia asociada con mieloma osteoesclerótico. Los pacientes que resultan con neuropatía periférica, gammapatía monoclonal, lesiones óseas escleróticas, aumento en la síntesis de factor de crecimiento endotelial es porque hay una elevación en la producción de citocinas de células plasmáticas monoclonales.4,5
El tratamiento de elección para la variante unicéntrica es la exéresis de la lesión. Cuando la exéresis es completa el tratamiento es exitoso, siempre que las manifestaciones clínicas y de laboratorio regresen a la normalidad.
En pacientes en quienes la cirugía no es posible, las alternativas a las que puede recurrirse son: radiaciones, embolización o terapia neoadyuvante con rituximab o siltuximab-tocilizumab.6
Para la variante multicéntrica es necesario considerar la severidad de los síntomas. Todos los pacientes con la variante multicéntrica deben recibir tratamiento con siltuximab, que es un anticuerpo anti-IL6. En el Cuadro 1 se enlistan los tratamientos propuestos para pacientes con esta variedad.1,7
CONCLUSIÓN
La enfermedad de Castleman comprende un grupo heterogéneo de trastornos que comparten similitudes patológicas con diversas manifestaciones clínicas. Los signos clínicos y las complicaciones específicas, como el pénfigo paraneoplásico, la neuropatía periférica, la trombocitopenia, anasarca, fiebre, fibrosis reticulínica y organomegalia (TAFRO) y POEMS (polirradiculoneuropatía, organomegalia, endocrinopatía, trastorno monoclonal de células plasmáticas, cambios en la piel), o la infección por el virus del herpes humano 8 (HHV8), son características importantes del espectro clínico de la enfermedad de Castleman que deben reconocerse e identificarse. La extirpación quirúrgica de una masa unicéntrica de tipo hialino-vascular-plasmático es curativa. La evaluación de pacientes con sospecha de esta enfermedad debe incluir, además de la evaluación patológica con inmunotinción, estudios de laboratorio y de imágenes sistémicas con PET-TAC para determinar la extensión de la enfermedad (unicéntrica o multicéntrica) y para los marcadores de seguimiento.











 nueva página del texto (beta)
nueva página del texto (beta)