ANTECEDENTES
La atención obstétrica, en el contexto de la COVID-19, debe sustentarse en las mejores prácticas clínicas y la evidencia científica disponible más reciente; por lo tanto, los procedimientos propuestos deben fundamentarse en la investigación clínica, con la finalidad de establecer políticas y prácticas que reduzcan el riesgo de contagio y la propagación de la enfermedad.1 La actualización de estos procedimientos1 está dirigida a profesionales de la salud, quienes deberán aplicar su criterio médico porque, como tales, no son lineamentos de carácter obligatorio y deben adaptarse al contexto de los distintos centros hospitalarios de México y otros países donde se utilice.1,2,3
JUSTIFICACIÓN
La COVID-19 tiene antecedentes muy recientes; por tanto, sin ensayos suficientes que en verdad permitan, a partir de ellos, emitir recomendaciones. Si bien este documento tiene un antecedente muy reciente1 las circunstancias hacen necesario actualizarlo periódicamente, con base en las nuevas experiencias que van reuniéndose y que sugieren que la mujer embarazada e infectada con SARS-CoV-2 debe considerarse parte del grupo de alto riesgo de padecer las formas graves de la COVID-19; por lo tanto, deben reforzarse las medidas preventivas e identificar oportunamente los casos positivos, determinar la etapa de la enfermedad que cursa la paciente y sus factores de riesgo de padecer enfermedad grave, con la finalidad de iniciar una vigilancia y seguimiento perinatal idóneo y óptimo. La aparición de las nuevas variantes del virus va marcando diferencias en las conductas de atención a la embarazada infectada y, poco a poco, van conociéndose y reportándose las repercusiones de la pandemia en el feto y en el neonato, sin que hasta ahora sea posible emitir recomendaciones, solo sugerencias basadas en lo que en diferentes frentes se ha experimentado.
OBJETIVO
Por lo anterior, el objetivo de este documento es, simplemente, actualizar los procedimientos de todas las acciones que es necesario implementar para la adecuada prevención, diagnóstico y atención de las pacientes embarazadas e infectadas por el SARS-CoV-2 con base en la mejor evidencia científica disponible.
METODOLOGÍA
Revisión narrativa de la bibliografía sustentada en la búsqueda bibliográfica efectuada en las bases de datos de Cochrane, MEDLINE y PubMed con los MeSH (Medical Subject Headings [Títulos de Temas Médicos]): Pregnancy and COVID, SARS-CoV-2, 2019-nCoV, novel coronavirus, Coronavirus, COVID-19 y prenatal care, pregnancy care, vertical transmission. Debido a la demanda urgente de información al respecto, en realidad son pocas las publicaciones con suficiente evidencia científica que cumplan con un diseño metodológico adecuado, que represente un riesgo bajo de sesgo, inconsistencia o imprecisión.
Diagnóstico y atención de la paciente infectada por SARS-CoV-2
El triage en la paciente obstétrica tiene tres puntos fundamentales:
Identificar a la paciente con sospecha.
Determinar el riesgo obstétrico, hacer una evaluación inicial y establecer el diagnóstico oportuno, de preferencia en un centro de referencia COVID.
Clasificar a la paciente según la gravedad de su enfermedad.
La pandemia de COVID-19 no solo ha repercutido directamente en los desenlaces perinatales de las mujeres embarazadas sino también en las modificaciones de los procedimientos de atención médica debidos a cambios en la movilidad de la población, redistribución del personal de salud, saturación de los servicios de urgencias y agotamiento de recursos. Por lo que se refiere a la atención obstétrica destaca la importancia de la optimización del control prenatal para evitar que su carencia se refleje en incremento de los desenlaces perinatales adversos, que no se incremente la mortalidad materna ni la depresión perinatal.2 Los reportes también sugieren disminuir el acompañamiento durante el trabajo de parto y la anestesia general durante las cesáreas de urgencia. Para el puerperio se propone la implementación de programas de atención virtual o remota con el propósito de reducir la estancia intrahospitalaria.3
De acuerdo con la Organización Mundial de la Salud hasta septiembre del 2021 se habían reportado 223,022,538 de casos de infección por SARS-CoV-2 y 4,602,882 millones de fallecimientos por COVID-19 en el mundo. En México se han registrado 3,465,171 casos y 265,420 muertes por COVID-19.4
Solo en México, durante la pandemia de la COVID-19, hasta el 1 de agosto del 2021 se habían estudiado 73,785 mujeres con embarazo-puerperio como casos sospechosos. De éstas, 20,329 (27.6%) resultaron positivas a SARS-CoV-2 con 389 defunciones, con una mortalidad acumulada de 1.91%. La razón de mortalidad materna asociada con COVID-19 es de 16.4 por cada 10,000 recién nacidos vivos.5 De acuerdo con las estadísticas nacionales, la COVID-19 ha sido la principal causa de muerte materna, por encima de la hemorragia obstétrica y los trastornos hipertensivos del embarazo.6
Al principio se pensó que las mujeres embarazadas podrían tener un factor protector de complicaciones por COVID-19. Sin embargo, los CDC (Centers for Disease Control and Prevention) de Estados Unidos reportaron, en una cohorte de 23,434 mujeres sintomáticas que el embarazo tiene mayor riesgo de mortalidad (razón de riesgo ajustada [aRR]: 1.7; IC95%: 1.2-2.4) e ingreso a cuidados intensivos con un riesgo ajustado de: 3.0; (IC95%: 2.6-3.4) y ventilación invasiva con un riesgo ajustado de: 2.4 (IC95%: 1.5-4.0).7
Se estima que existe una cantidad desconocida de mujeres embarazadas que quizá se hayan infectado con el virus SARS-CoV-2 y que una proporción de ellas haya tenido manifestaciones clínicas graves. Todo indica que la mortalidad materna se incrementó en un 60% y el 25.4% de las muertes maternas se relacionaron con COVID-19.8
Al comienzo de la pandemia la información del comportamiento epidemiológico se basó, principalmente, en series de casos y extrapolación de la experiencia con virus respiratorios previos en países de altos ingresos. En la actualidad se reconoce, en todo el mundo, a las mujeres embarazadas como un grupo vulnerable y en mayor riesgo de morbilidad y mortalidad por infección por SARS-CoV-2, sobre todo a las sintomáticas.
Los registros recientes de embarazadas con infección por SARS-CoV-2 de dos grandes cohortes de Estados unidos y el Reino Unido reportaron una mayor proporción de parto pretérmino. Con base en sus desenlaces exhortan a la comunidad internacional a fortalecer las medidas preventivas que permitan disminuir el riesgo de infección por SARS-CoV-2 durante el embarazo, incluida la vacunación en este grupo etario y en la población en edad fértil.9
Después de tener en cuenta las diferencias en los factores de riesgo de referencia para COVID-19 grave entre embarazadas y no embarazadas, el embarazo en sí funge como un factor de riesgo de muerte, neumonía e ingreso a cuidados intensivos de pacientes infectadas con SARS-CoV-2.
Las mujeres embarazadas tienen una condición de inmunomodulación única que aumenta su susceptibilidad a patógenos virales. La progesterona y los estrógenos inducen cambios respiratorios que incrementan el líquido pulmonar intersticial y disminuyen el volumen pulmonar residual; además, inducen un estado de hipercoagulabilidad que incrementa la posibilidad de trombosis vascular.10 México es el país con mayor mortalidad materna por COVID-19 en el mundo. En una cohorte de mujeres mexicanas, las embarazadas destacaron por su mayor probabilidad de muerte (OR 1.84; IC95%: 1.26-2.69), por neumonía (OR 1.86; IC95%: 1.60-2.16) o ingreso a cuidados intensivos (OR 1.86; IC95%: 1.41-2.45) en comparación con mujeres no embarazadas. En esta cohorte se encontró que la probabilidad requerir cuidados de alta especialidad por la afección respiratoria fue similar en ambas poblaciones (OR 0.93; IC95%: 0.70-1.25).11 En una cohorte prospectiva de población mexicana se encontró que los principales factores de riesgo de mortalidad materna fueron: la edad mayor de 35 años, la diabetes mellitus, la obesidad y el asma.12
Los factores de riesgo relacionados con complicaciones graves en la madre son: ingreso a cuidados intensivos, tratamiento ventilatorio invasivo, oxigenación mediante membrana, edad avanzada (OR 1.83; IC 95%: 1.27-2.63), índice de masa corporal aumentado (OR 2.37; IC95%: 1.83-3.07), comorbilidades preexistentes (OR 1.81; IC95%: 4.49-2.20) como la hipertensión arterial crónica (OR 2.0; IC95%: 1.14-3.48), diabetes gestacional (OR 2.12; IC95%: 1.62-2.78) o preeclampsia (OR 4.21; IC95%: 1.27-14.0).13
En comparación con pacientes sin COVID-19, las infectadas tienen mayor riesgo de: muerte materna (OR 2.85; IC 95%: 1.08-7.52), requerir atención en cuidados intensivos (OR 18.58; IC95%: 7.53-45.82) y que su hijo también requiera atención en cuidados intensivos (OR 4.89; IC95%: 1.87-12.81).13 Además, se asocia con mayor riesgo de parto prematuro antes de las 32 semanas (RR 1.6; IC95%: 1.4-1.9), parto prematuro antes de las 37 semanas (RR 1.4; IC95%: 1.3-1.4). Esta relación de riesgo se observó, sobre todo, en pacientes con comorbilidades.14
El daño celular mediado por el virus, la disfunción del sistema renina-angiotensina-aldosterona ocasionado por la ocupación de los receptores ACE2 por el virus, el daño endotelial que pudiese ser incluso mayor ante comorbilidades crónicas preexistentes, la generación de microtrombos, la disfunción de la respuesta inmunitaria y la liberación de citocinas pudieran exacerbar este padecimiento y generar daño no solo pulmonar sino también en el sistema nervioso central, cardiaco, renal, gastrointestinal, cutáneo y placentario. Además, predisponer a la aparición de otras complicaciones: preeclampsia, sobre todo en las pacientes nulíparas (RR: 1.89; IC95%: 1.17-3.05) y parto pretérmino, etc.15-18
A lo largo de la pandemia se han identificado diversas variantes genéticas del SARS-CoV-2 que surgieron, naturalmente, de la replicación viral; algunas se asocian con mayor trasmisibilidad o gravedad y posible evasión inmunitaria. Estas variantes emergentes reemplazan rápidamente, en una población, los linajes virales anteriores.
La variante delta parece estar relacionada con una enfermedad más grave; 1 de cada 10 mujeres sintomáticas hospitalizadas con la variante alfa requirieron atención en cuidados intensivos mientras que con la variante delta solo 1 de cada 7 mujeres requirió este tipo de atención.19 En mujeres embarazadas, el comportamiento epidemiológico entre la primera y la última oleada parece sugerir un cambio en la patogenicidad. Aún faltan más estudios que documenten la verdadera repercusión de las nuevas variantes genéticas del SARS-CoV-2 en este grupo de población.20
Las pacientes embarazadas pueden permanecer asintomáticas en el 60 a 86% de los casos; esta condición es más frecuente en mujeres latinoamericanas.21,22 Las pacientes en etapa temprana del embarazo e infectadas con SARS-CoV-2 tienen menos probabilidades de tener síntomas (fiebre, tos, disnea y mialgias).13 Las manifestaciones clínicas más frecuentes en las pacientes sintomáticas son: fiebre (28-100%), síntomas respiratorios (20-79%), elevación de la proteína C reactiva (28-96%), linfopenia (34-80%) y neumonía evidente por estudios de imagen (7-99%).23
Control prenatal durante la pandemia de COVID-19
La pandemia de COVID-19 ha afectado considerablemente los sistemas de salud en todo el mundo. Lo más notorio es la disminución en la búsqueda de atención en los servicios de salud, circunstancia que puede contribuir al incremento de desenlaces perinatales adversos.3
El control prenatal, por sí mismo, no incrementa la posibilidad de que una embarazada se infecte con el SARS-CoV-2. Este control periódico no debe suspenderse porque las complicaciones perinatales son, a su vez, causa de morbilidad y mortalidad en las mujeres;24 por lo tanto, la atención prenatal óptima debe hacerse de manera presencial, con las debidas medidas de seguridad para evitar el contagio. Ese control debe inciarse a partir del primer trimestre, con la finalidad de identificar los factores de riesgo asociados. Es menester recordar que a mayor cantidad de semanas de embarazo mayor probabilidad de infección grave por SARS-CoV-2; de ahí la necesidad de fomentar las medidas preventivas pertinentes.
La evidencia documentada en países de ingresos bajos y medianos sugiere que menos de cinco visitas presenciales de control prenatal se asocian con mayor riesgo de mortalidad perinatal (RR 1.15; IC 95%: 1.01-1.32, tres ensayos).25 Lo recomendable son seis visitas prenatales presenciales.19 La mayoría de las agrupaciones médicas han sugerido modificar los procedimientos tradicionales de las visitas prenatales adaptándolas, según se trate, de pacientes de bajo o alto riesgo.
Entre los procedimientos para disminuir el riesgo de exposición durante las consultas de control están:
Hacer coincidir las citas de control con otras evaluaciones (ultrasonido fetal o estudios de laboratorio) para disminuir la necesidad de acudir a lugares concurridos.
Cuando las evaluaciones presenciales no se consideren estrictamente necesarias proponer las consultas virtuales.
Instruir a las pacientes para la correcta medición de la presión arterial en casa, conocer los límites normales y los de alarma ante los que deberá acudir a evaluación médica.26
A las pacientes con embarazo de alto riesgo debe advertírseles de la probabilidad de complicaciones al inicio del embarazo y la importancia de evitar el contagio con las medidas de distanciamiento social, uso de cubrebocas y aplicación regular de gel antibacteriano en las manos.
Concientizar a las mujeres mayores de 35 años, con IMC mayor de 30 kg/m2 o con afecciones médicas subyacentes de su mayor riesgo de enfermarse de COVID-19.19
Asegurarse que todas las embarazadas reciban la información correcta y suficiente para la adecuada orientación de la vacunación contra COVID-19.
Ofrecer, al menos, una evaluación ecográfica por trimestre de embarazo, a partir de las 11 a 14 semanas. En caso de amenaza de aborto o sospecha de embarazo ectópico se considerará la necesidad de evaluaciones más tempranas.
Ante la sospecha de factores de riesgo de cardiopatía congénita solicitar, en el segundo trimestre (20 a 22 semanas), una ecocardiografía fetal. Con base en su reporte se normará la vigilancia del crecimiento. En las pacientes con comorbilidades o complicaciones maternas o fetales la vigilancia deberá individualizarse según el caso.27 A las pacientes sin factores de riesgo identificables deberá practicárseles un tamizaje entre las 34 a 36 semanas de embarazo, con especial atención en la revaloración del crecimiento, presentación fetal, riesgo de preeclampsia de aparición tardía y otras posibles complicaciones perinatales.
Los proveedores de atención médica deben concientizarse del mayor riesgo de violencia intrafamiliar durante el embarazo y la consecuente ansiedad y otros problemas de salud mental en las mujeres embarazadas en comparación con la población general durante la pandemia. Por esto no deberán omitirse las preguntas necesarias para conocer el estado de salud mental en cada contacto.19De acuerdo con el informe de la ENCOVID 2021, en su última revisión (marzo de 2021), 1 de cada 3 mexicanos tiene síntomas severos de ansiedad; los del nivel socioeconómico bajo son los más afectados (40%) y de ellos, las mujeres lo son aún más (36%).28 Cuadro 1
Cuadro 1 Control prenatal en pacientes de bajo riesgo29
| Semanas de embarazo | Tipo de consulta | Ultrasonido | Comentarios |
|---|---|---|---|
| 12 | En persona | Tamizaje de primer trimestre | Historia clínica detallada, laboratorios prenatales, evaluación del riesgo y comorbilidades relevantes para COVID-19, fomentar medidas preventivas para COVID-19, síntomas relevantes y datos de alarma |
| 16 | Telemedicina | - | - |
| 20 | En persona | Tamizaje del segundo trimestre (evaluación estructural) | - |
| 24 | Telemedicina | - | Considerar tomar la presión arterial en casa o de forma ambulatoria, tamizaje para diabetes gestacional (CTOG) |
| 28 | En persona | Evaluación del crecimiento en población de alto riesgo para alteraciones de crecimiento | Control prenatal, anti-D en pacientes Rh(-) |
| 30 | Telemedicina | - | Considerar la toma de la presión arterial en casa o de forma ambulatoria |
| 32 | En persona | Evaluación del crecimiento | Control prenatal de rutina |
| 34 | Telemedicina | - | Considerar la toma de la presión arterial en casa o de forma ambulatoria |
| 36 | En persona | Tamizaje del tercer trimestre (evaluación del crecimiento, presentación, líquido amniótico y factores de riesgo para preeclampsia y otras complicaciones perinatales potenciales) | Control prenatal de rutina, cultivo para estreptococo del grupo B |
| 37-41 | En persona | - | Control prenatal de rutina |
| Puerperio | Telemedicina | - | Excepto en situaciones específicas |
Procedimiento
Se sugiere continuar el control prenatal de manera habitual con medidas preventivas para minimizar la exposición de pacientes y personal de salud.29
CIRUGÍA FETAL
Casi todos los tratamientos fetales son sensibles al tiempo y no pueden posponerse. No deben ofrecerse procedimientos sin evidencia contundente de beneficio. Todo procedimiento invasivo en pacientes confirmadas con SARS-CoV-2 implica un riesgo teórico de trasmisión vertical. Ésta no ha podido confirmarse en procedimientos invasivos como la amniocentesis o fetoscopia por lo que deberán ofrecerse si están indicados. Es necesario evitar el paso trasplacentario que incrementa el riesgo de sangrado intraamniótico y la rotura de la barrera feto-materna. Puede preferirse la amniocentesis en vez de la biopsia de vellosidades coriales. En la cirugía fetal abierta, el riesgo de trasmisión feto-materna es mayor que con la aguja o fetoscopia porque el feto se expone a la sangre materna y hay pérdida de la integridad cutánea. La propuesta, entonces, es posponer estos procedimientos hasta que la paciente haya depurado el virus (2 a 3 semanas).30 Cuadro 2
Cuadro 2 Procedimientos diagnósticos y terapéuticos fetales30
| Procedimiento | Beneficio feto-materno | Riesgo teórico de transmisión vertical | Riesgo al personal de salud | Necesidad de ingreso a UCI | Uso de recursos | Recomendación |
|---|---|---|---|---|---|---|
| Biopsia de vellosidades coriales | Alto | Moderado | Bajo | Poco probable | Mínimo | Ofrecer en pacientes negativas a SARS-CoV-2, retrasar la amniocentesis en pacientes positivas a SARS-CoV-2 |
| Amniocentesis | Alto | Bajo | Bajo | Poco probable | Mínimo | Ofrecer a pacientes negativas a SARS-CoV-2 y asintomáticas, en las positivas retrasar si es posible hasta que se haya depurado el virus |
| Transfusión al feto | Alto | Moderado | Bajo | Poco probable | Moderado | Ofrecer a pacientes negativas a SARS-CoV-2 y asintomáticas, en las positivas individualizar si no puede retrasarse el procedimiento |
| Procedimientos cardiacos fetales | Desconocido | Moderado | Bajo | Poco probable | Moderado | Considere no ofrecer tamizaje |
| Shunt toraco-amniótico | Alto | Moderado-alto | Bajo | Poco probable | Moderado | Ofrecer a pacientes negativas a SARS-CoV-2 y asintomáticas, en las positivas a SARS-CoV-2 individualizar si no puede posponerse el procedimiento |
| Terapia láser para síndrome de transfusión feto-feto | Alto | Bajo | Bajo | Poco probable | Moderado | Ofrecer a pacientes negativas a SARS-CoV-2 y asintomáticas, en las positivas individualizar si no puede postergarse el procedimiento |
| Shunt vesico-amniótico | Bajo | Moderado-alto | Bajo | Poco probable | Moderado | Considere no ofrecer tamizaje |
| Cistoscopia fetal | Desconocido | Moderado-alto | Bajo | Poco probable | Moderado | Considere no ofrecer tamizaje |
| Feticidio selectivo en monocoriales gemelares | Variable | Bajo | Bajo | Poco probable | Moderado | Ofrezca tamizaje a pacientes asintomáticas, individualice en las positivas |
| Feto en hernia diafragmática | Desconocido | Bajo | Bajo | Poco probable | Moderado | Considere no ofrecer tamizaje |
| Cierre de espina bífida | Alto | Alto | Moderado-alto | Bajo | Alto | Retrase si la edad gestacional lo permite, si no, ofrezca solo a pacientes negativas a SARS-CoV-2 si los recursos locales disponibles son suficientes. |
PREVENCIÓN
Las medidas de prevención se basan, sobre todo, en información obtenida de las rutas de trasmisión, estabilidad viral en el medio ambiente y su persistencia en las superficies contaminadas. El distanciamiento social, uso de cubrebocas, higiene de manos y la vacunación son las medidas más importantes para la población en general.31
VACUNAS
De acuerdo con la Organización Mundial de la Salud, a la fecha (septiembre 2021) hay 117 vacunas en etapa clínica y 194 en etapa preclínica. Por lo que se refiere a su mecanismo de acción en etapa clínica, el 35% utilizan una subunidad proteica, 16% ARN, 15% vector viral no replicante, 14% virus inactivos, 9% ADN, 4% una partícula viral similar, 2% un vector viral replicante, 2% un vector viral replicante más una célula presentadora de antígeno, 2% virus vivos atenuados, 1% un vector viral no replicante más una célula presentadora de antígeno.32 En la actualidad se recomienda que el personal de salud aconseje la vacunación contra SARS-CoV-2 a pacientes embarazadas, mujeres en edad fértil que deseen embarazarse, puérperas en lactancia o que planeen dar lactancia, siempre respetando los principios éticos de autonomía, precaución y beneficencia.33
Las vacunas que se administran en México contra la COVID-19 son de ARNm o vector viral no replicante, sin paso al feto a través de la placenta.34 La aceptación de la vacuna entre las mujeres embarazadas tiene variaciones de un país a otro. El predictor más sólido de la aceptación de la vacuna es la confianza en su eficacia e inocuidad. La repercusión de las campañas de vacunación debería ayudar a acelerar su administración en este grupo de población.35 Los hallazgos preliminares en relación con la seguridad de la aplicación de la vacuna de ARNm contra la COVID-19 demuestran que durante el embarazo no altera los desenlaces perinatales.36
En una cohorte, emparejada por puntuación de propensión, la comparación con mujeres embarazadas no vacunadas y las que sí recibieron al menos una dosis de la vacuna tuvieron tasas similares de desenlaces adversos del embarazo, muerte fetal, anomalías fetales, fiebre intraparto, hemorragia posparto, nacimiento por cesárea, peso bajo para la edad gestacional e ingreso a cuidados intensivos maternos o neonatales. Aún hace falta más trabajo de comunicación para concientizar a las mujeres embarazadas y a los profesionales de la salud acerca de la necesidad de la vacunación en este grupo y el seguimiento a largo plazo de los recién nacidos.37 Además, conocer los títulos de anticuerpos y la respuesta al bloqueo específico del receptor T del linfocito materno, posterior a la aplicación de vacunas de ARNm contra COVID-19 durante el embarazo y la lactancia. Los anticuerpos generados por la vacuna también pueden encontrarse en el cordón umbilical y leche humana.38
Inicialmente se mencionaba que no había vacunas aprobadas para prevenir COVID-19 durante el embarazo;39 sin embargo, el Colegio Real de Obstetricia y Ginecología (RCOG) recomienda la vacunación contra COVID-19 durante el embarazo, que debe administrarse al mismo tiempo que a la población general en función de la edad y riesgo clínico. Está reportada la eficacia de 98% de la vacuna en mujeres hospitalizadas y las complicaciones en las infectadas sin vacuna.19 Es importante que el personal de salud oriente respecto de todas las vacunas disponibles que han demostrado su utilidad para disminuir la gravedad de los cuadros infecciosos y el riesgo de muerte. Los efectos secundarios que han manifestado las mujeres embarazadas vacunadas contra la COVID-19 muestran patrones similares de notificación que los de la población no obstétrica, y todos ellos menores. La trombosis y la trombocitopenia inducidas por las vacunas de Astra-Zeneca y Janssen han sido realmente excepcionales y no se ha demostrado que las embarazadas o en posparto tengan mayor riesgo.19
Existe un formulario de vacunación contra COVID-19 que permite recopilar datos de eventos adversos en mujeres vacunadas durante el embarazo que pueden resultarles útiles a las autoridades sanitarias para tomar mejores decisiones y medidas. https://es.surveymonkey.com/r/VacunasembarazoIRN Cuadro 3
Cuadro 3 Equipo de protección personal para los trabajadores de la salud que valoran pacientes con COVID-19 durante el embarazo.39
| Riesgo | Contacto clínico en Obstetricia | Recomendación de EPP |
|---|---|---|
| Bajo | Encuentro transitorio mayor de 2 metros | Las convencionales y mascarilla quirúrgica. |
| Moderado | Examen obstétrico (incluido el vaginal)Ecografía (incluida la exploración vaginal)Parto o cesárea | Gorro quirúrgicoGuantesGafas o gogglesN-95 |
| Alto | Administración de oxígeno durante el trabajo de parto; catéter nasal, mascarilla facial, mascarilla con reservorio.Colapso materno; reanimación cardiopulmonar e intubación endotraqueal | Gorro quirúrgicoGuantesGafas o gogglesBata N-95 o PAPR con filtros HEPA(Considere si la propia trabajadora de la salud está embarazada) |
*EPP: Equipo de protección personal *PAPR: Purificador de aire *HEPA: Partículas de aire de alta eficiencia.
PACIENTE SOSPECHOSA
La sospecha de infección puede darse por dos motivos: síntomas y contacto.
Sospecha por cuadro clínico
La actualización de la definición operacional de caso sospechoso de enfermedad respiratoria viral, oficial a partir del 25 de agosto del 2020, implica que en los últimos 10 días un individuo haya tenido, al menos, uno de los siguientes signos y síntomas mayores: tos, fiebre, disnea (dato de gravedad) o cefalea acompañados de al menos uno menor: mialgias, artralgias, odinofagia, escalofríos, rinorrea, anosmia, disgeusia, conjuntivitis o dolor torácico.40
Sospecha por contacto
Las medidas de rastreo de contactos suelen ser factibles cuando hay uno o un grupo de casos pero puede no ser así cuando se notifican cientos o miles de casos al día. Este rastreo y la investigación de casos y fuentes es decisiva para controlar la trasmisión y fortalecer medidas de mitigación (distancia física en lugares públicos, evitar reuniones grandes, limitar salidas, usar cubreboca, lavado de manos frecuente y limpieza rutinaria de superficies de alto contacto). La sospecha por contacto se da cuando una persona ha estado en contacto con otra infectada (probable o confirmada) en cualquier momento durante el periodo infeccioso hasta encontrarse aislada o al final de éste (dos días antes del inicio de la enfermedad en pacientes sintomáticos o dos días antes de la muestra positiva) que permaneció a menos de 2 metros de distancia del infectado durante al menos 15 minutos en un lapso de 24 horas a partir del segundo día del inicio de la enfermedad o hasta el momento en que se aísla al paciente.
El rastreo de contactos consiste en el proceso de notificación de la exposición, revisión y respuesta a sus inquietudes, tomar pruebas de SARS-CoV-2, fomentar el autoaislamiento y brindar orientación, identificar a los contactos mediante la vigilancia de síntomas, evaluar la necesidad de servicios de salud y apoyo durante los últimos 14 días a partir de la última exposición. La infección es menos probable en quienes tienen el esquema de vacunación completo o en los recuperados de una infección previa de SARS-CoV-2 en los últimos tres meses.41
Si bien se ha observado una diminución en la incidencia general de parto pretérmino atribuible a las medidas de aislamiento social, las mujeres embarazadas infectadas por COVID-19 han tenido una mayor proporción de parto pretérmino. El acortamiento cervical y la amenaza de parto pretérmino en ausencia de otros factores etiológicos deben hacer sospechar la infección por SARS-CoV-2.20,23,42
Diagnóstico de SARS-CoV-2 en una paciente embarazada
Por su carácter de paciente de riesgo, a todas las embarazadas que cumplan con los criterios de sospecha debe practicárseles una prueba diagnóstica. El patrón de referencia es la reacción en cadena de la polimerasa con transcriptasa inversa (RT-PCR) tomada mediante hisopado nasofaríngeo profundo.42,43 De acuerdo con el lineamiento técnico nacional se recomienda que la toma de la muestra no exceda los 5 días posteriores al inicio de los síntomas en pacientes ambulatorios (lo ideal es en las primeras 72 horas); en las pacientes graves no deben sobrepasarse los siete días después del inicio de los síntomas. En caso de defunción se recomienda la biopsia del parénquima pulmonar (2.0 cm), incluso después de siete días del inicio de los síntomas.44
En México está aprobada la prueba de antígeno SARS-CoV-2.45 El desenlace positivo se considera confirmatorio, no así el negativo que requiere prueba de confirmación con PCR. En pacientes embarazadas esta prueba ha demostrado sensibilidad del 55.6% y especificidad del 100%.46 Se recomienda su práctica en pacientes con 0 a 7 días de evolución.44
El beneficio potencial de las pruebas universales aún genera controversia en virtud de la alta proporción de pacientes asintomáticas; sin embargo, podría considerarse a fin de proporcionar información de la diseminación viral y prevenir la trasmisión ulterior. Esto, desde luego, dependerá de la disponibilidad de las pruebas diagnósticas.47,48
El diagnóstico de neumonía por SARS-CoV-2 en mujeres embarazadas es particularmente desafiante. La exposición a la radiación de la tomografía computada o la radiografía simple es fundamental para evaluar el estado clínico de una mujer embarazada con infección por SARS-CoV-2. Si bien se han descrito efectos secundarios en el feto (restricción del crecimiento fetal, microcefalia y discapacidad intelectual) relacionados con radiaciones altas (más de 610 mGy) el American College of Radiology y el American College of Obstetricians and Gynecologists reportan que la radiación de una radiografía de tórax al feto es de 0.0005 a 0.01 mGy (mínima) y la de la exposición a una tomografía de tórax 0.01 a 0.66 mGy.42,49 Figura 1 La tomografía de tórax sigue siendo el patrón de referencia para las enfermedades pulmonares y no está contraindicada durante el embarazo y sí incrementa la eficiencia diagnóstica del estudio molecular.39 Además, es una herramienta primaria en el proceso diagnóstico cuando se observan opacidades difusas en vidrio despulido de predominio periférico y basal que pueden evolucionar a un patrón de consolidación en 1 a 3 semanas.50-53 En las embarazadas debe obtenerse el consentimiento informado y aplicar un escudo protector de radiación.29 Figura 2
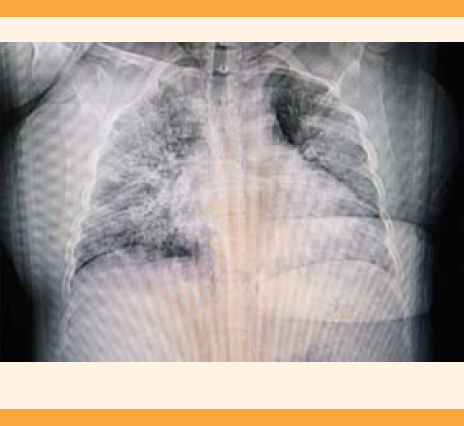
Figura 1 Radiografía simple de tórax de paciente embarazada con prueba de laboratorio confirmatoria para COVID-19 donde se evidencian infiltrados difusos bilaterales.
El ultrasonido pulmonar es un método diagnóstico para detectar afecciones pulmonares y pleurales periféricas con alta precisión (sensibilidad mayor de 90% y especificidad del 95%).54,55,56.Esta herramienta ha demostrado su influencia en el tratamiento de pacientes asintomáticas en quienes la tomografía no se consideró de inicio; en quienes tienen síntomas leves que no otorgan su consentimiento para una tomografía; en pacientes asintomáticas con tomografía inicial no patológica y en el seguimiento de la respuesta al tratamiento en pacientes sintomáticas.57 El ultrasonido pulmonar se sugiere como un método confiable, disponible en muchas instalaciones y preciso para la evaluación inicial. El ultrasonido pulmonar puede mostrar signos específicos de neumonía intersticial. Se requiere un transductor lineal o convexo, de preferencia. El ultrasonido pulmonar suele practicarse en posición sentada, lateral o supina. El hemitórax se divide en seis regiones, con la ayuda de líneas axilares anteriores y posteriores: 2 anteriores, 2 laterales y 2 posteriores por cada hemitórax; cada región se examina con cortes sagital y axial.58 Figuras 3 y 4
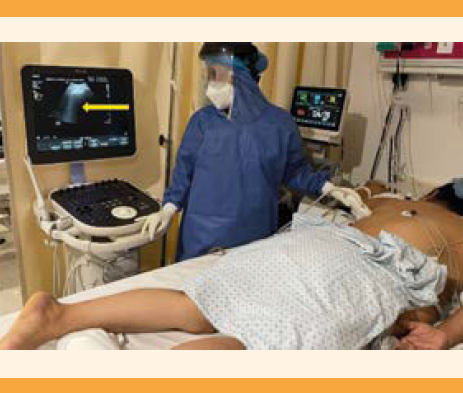
Figura 3 Ultrasonido pulmonar. Procedimiento para el ultrasonido pulmonar en paciente en puerperio quirúrgico con estrategia ventilatoria en decúbito prono por COVID-19. Cuidados Críticos Obstétricos en área COVID-19 del Hospital General Dr. Miguel Silva, Morelia, Michoacán, México. En la flecha señalan las líneas B (artefactos subpleurales). Cortesía: Dr. Luis Alberto Ruiz Marines.
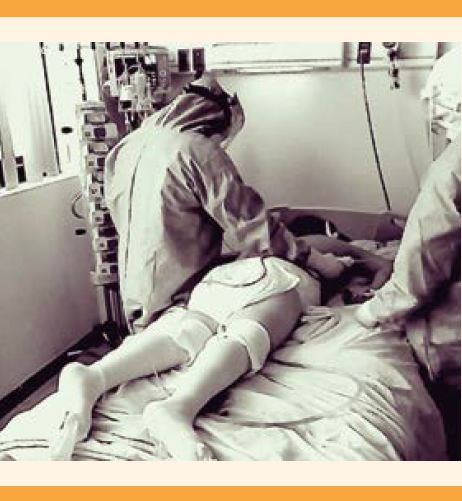
Figura 4 Ultrasonido pulmonar. Procedimiento para el ultrasonido pulmonar en paciente en puerperio quirúrgico con estrategia ventilatoria en decúbito prono por COVID-19. Cuidados Críticos Obstétricos en área COVID-19 del Hospital IMIEM Estado de México. Cortesía Dr. Christian Alberto Herrera Venegas.
Identificación de síntomas leves, moderados y graves de COVID-1947 (Cuadro 4)
Cuadro 4 Escala de gravedad de COVID-19
|
Asintomática: Prueba
diagnóstica positiva a SARS-CoV-2 en una paciente SIN
síntomas. Leve: Síntomas similares a los de la gripe: fiebre, tos, mialgias y anosmia pero SIN disnea NI dificultad respiratoria NI estudios de imagen de tórax anormales. Moderada: Evidencia de enfermedad respiratoria baja por evaluación clínica (disnea, estudios de imagen compatible con neumonía, gasometría anormal; fiebre ≥39.0 ° C resistente a paracetamol pero con una saturación de oxígeno > 93% sin oxígeno suplementario al nivel del mar). Severa: Taquipnea > 30 por minuto, saturación de oxígeno ≤ 93%, relación de la presión parcial arterial de oxígeno y fracción de oxígeno inspirado (Pao2/Fi02) < 300; > 50% de afectación pulmonar en los estudios de imagen de tórax. Crítica: Disfunción orgánica múltiple, choque o insuficiencia respiratoria que requiera ventilación mecánica o cánula nasal de alto flujo. |
Procedimientos
A toda paciente embarazada, con síntomas respiratorios, en época de pandemia, debe practicársele RT-PCR para SARS-CoV2.
Si la prueba de detección es negativa pero coexisten síntomas, la paciente debe permanecer en aislamiento durante 14 días a partir de la última exposición al SARS-CoV-2. Si los síntomas no disminuyen es posible que deba practicarse otra prueba. Si se agravan deberá recibir atención médica de urgencia en un centro con experiencia y recursos para la atención interdisciplinaria de pacientes obstétricas con COVID-19.
Pasos seguir en la evaluación inicial
Las manifestaciones fisiológicas del embarazo pueden enmascarar la gravedad de la enfermedad clínica hasta que se agotan las reservas clínicas.59 Se requiere un seguimiento estrecho e, incluso, el ingreso a observación posterior y valoración más extensa. Además, identificar la fase clínica en la que se encuentra la paciente.
La etapa inicial se caracteriza por un periodo de replicación viral (2-14 días), una fase sintomática viral que ocurre en los primeros siete días de la exposición, una fase inflamatoria temprana que se inicia a partir de la segunda semana, una fase inflamatoria secundaria que da comienzo a partir de la tercera semana y una fase inflamatoria multisistémica a partir de la cuarta semana.60
La mayoría de las pacientes obstétricas tendrán síntomas leves, pero sin una vigilancia estrecha puede subestimarse la rápida evolución a un cuadro grave o crítico. Por lo tanto, se sugiere que toda mujer con COVID-19 cuente con una valoración temprana por los especialistas en Medicina Materno Fetal y en Cuidados Críticos, independientemente de la gravedad de los síntomas al momento de su diagnóstico.61
El panorama de riesgo obstétrico debe considerarse prioritario. La disminución de los movimientos fetales, el sangrado transvaginal, la cefalea intensa y persistente, el nistagmo, la ruptura de membranas, los fosfenos, las contracciones uterinas dolorosas y frecuentes, el edema súbito e importante en las extremidades inferiores y la hipertensión arterial se consideran datos de alarma y ameritan evaluación inmediata por parte del obstetra.
La valoración inicial engloba procedimientos basados en estudios epidemiológicos, características clínicas y predictores clínicos de evolución a enfermedad grave, que incluyen:
Profilaxis, por alto riesgo de preeclampsia preexistente, en pacientes con diagnóstico reciente de SARS-CoV-2
Es indiscutible el beneficio del ácido acetilsalicilico indicado antes de las 16 semanas de embarazo a pacientes con alto riesgo de preeclampsia, previa valoración de éste por el especialista en Medicina Materno Fetal durante el tamizaje del primer trimestre. En la actualidad no se recomienda la indicación generalizada a todas las embarazadas.62 Ante el diagnóstico de SARS-CoV-2 se aconseja suspender el ácido acetilsalicílico porque su efecto, al inhibir de forma irreversible la ciclooxigenasa plaquetaria, persiste durante 7 a 10 días. Si bien la infección por SARS-CoV-2 incrementa el tiempo de complicaciones asociadas con la trombosis, el ácido acetilsalicílico no está indicado como profilaxis en el tratamiento de las complicaciones tromboembólicas porque puede asociarse con COVID-19 severo e incremento del riesgo de hemorragia en pacientes con trombocitopenia severa. Por esto se sugiere suspenderlo al momento del diagnóstico y mientras siga la enfermedad y reanudarlo (si está indicado) tan pronto se haya recuperado la paciente del cuadro infeccioso, sobre todo durante el tercer trimestre.63
Evaluación de la gravedad
La implementación exitosa del sistema de alerta materna requiere aceptación y coordinación multidisciplinaria. Un método propuesto para reducir la mortalidad y morbilidad materna es el uso de herramientas clínicas que permitan identificar, tempranamente, a pacientes que pudieran beneficiarse de intervenciones más agresivas y del traslado a un hospital de tercer nivel de atención.64,65 Estas herramientas de alerta temprana (MEOWS, MERC, MEWC y MEWT) se diseñaron para facilitar un reconocimiento temprano, el diagnóstico y tratamiento de pacientes que pudieran estar en evolución a un cuadro crítico. La evidencia de desenlaces de los sistemas de alerta temprana es alentadora. La “Maternal Early Warning Trigger” se desarrolló en Estados Unidos, proveniente del análisis de implementación de este sistema de activación de alarma obstétrica. Con su aplicación se consiguió una reducción significativa de la morbilidad materna posterior; su sensibilidad es del 96.9%, especificidad del 99.9%, VPP 12 y VPN del 99.9% para ingreso a cuidados intensivos 66,67 Cuadro 5
Cuadro 5 Herramienta diagnóstica Maternal Early Warning Trigger (MEWT). Los parámetros amarillo (2) y rojo (1) requieren que se active la alerta
| Parámetro | Amarillo (2) | Rojo (1) |
|---|---|---|
| Presión arterial sistólica (mmHg) | <80 o 156-160 | >160 |
| Presión arterial diastólica (mmHg) | <45 o 106-110 | >110 |
| Presión arterial media | <55 mm Hg | |
| Frecuencia cardiaca por minuto | <50 o 111-130 | >130 |
| Frecuencia respiratoria por minuto | <12 o 25-30 | >30 |
| Temperatura | ≤36ºC | ≥38ºC |
| SO2 sin oxígeno suplementario | 90-93% | <90% |
| Estado de alerta alterado | Presente |
Estos parámetros deben mantenerse por 20 minutos para considerarse gatillos.
Conducta y seguimiento ante una paciente no grave
La paciente no grave puede tratarse de manera ambulatoria. Los principios fundamentales son: el control de los síntomas, la prevención de la propagación y la vigilancia continua de la evolución de la enfermedad.
Aislamiento: durante 14 días.
Medidas generales: hidratación con líquidos claros, reposo relativo, higiene frecuente, etiqueta respiratoria.
Tratamiento farmacológico: 500 mg de paracetamol cada 4 a 6 horas, sin exceder 4 g al día.
Autoevaluación: del avance de la enfermedad con herramientas de automonitoreo que permitan su análisis objetivo.
Seguimiento epidemiológico remoto: interrogatorio de signos y síntomas efectuado por el personal de vigilancia epidemiológica cada 24 a 48 horas, conforme a los lineamientos gubernamentales.
Seguimiento obstétrico remoto: teleasistencia por parte de personal capacitado para evaluar el panorama de riesgo obstétrico y la necesidad de una consulta presencial. Deberá llevarse a cabo los días 7 y 14 del aislamiento.
Si se requiere que el control prenatal sea presencial o es necesario un ultrasonido deberán considerarse las medidas de aislamiento necesarias para disminuir el contagio del personal de salud y encargar los procedimientos a personal experimentado para disminuir el tiempo de exposición.
Conducta y seguimiento de una paciente grave
La paciente grave deberá recibir atención intrahospitalaria en un área obstétrica designada y adecuada para la atención de pacientes COVID, de preferencia en un cuarto aislado con presión negativa, con equipo de procedimientos para parto y atención neonatal. La paciente debe ser atendida por personal de salud con equipo de protección personal completo. Lo ideal es tomar una prueba PCR para influenza y SARS-CoV-2 y evaluar la severidad del cuadro mediante la rápida cuantificación de la insuficiencia orgánica secuencial, conocida por sus siglas en inglés como qSOFA. (Cuadro 6) Un puntaje mayor o igual a 2 identifica a la paciente que amerita atención intrahospitalaria en un área de cuidados intensivos.68 La paciente apta para recibir atención en cuidados intensivos deberá ser valorada oportunamente por un equipo multidisciplinario, obtener cultivos para estreptococo del grupo B, valorar la anticoagulación y el beneficio del esteroide o terapia anti IL-6 (según corresponda). Además, contar con un ultrasonido que corrobore la frecuencia cardiaca fetal, la presentación del feto, el peso estimado de éste y la cantidad máxima de líquido amniótico y localización de la placenta.69
Cuadro 6 Escala qSOFA modificada para obstetricia
| Parámetros | Puntos (0) | Puntos (1) |
|---|---|---|
| Presión arterial sistólica | >90 mmHg | <90mmHg |
| Frecuencia respiratoria | <25 respiraciones por minuto | ≥25 respiraciones por minuto |
| Alteración del estado mental | Alerta | No alerta |
*qSOFA: puntuación de la evaluación secuencial rápida (relacionada con la sepsis) de insuficiencia orgánica. Un puntaje ≥ 2 puntos tiene una validez predictiva para identificar a los pacientes con un riesgo incrementado de mortalidad hospitalaria.70
VIGILANCIA DE LA MADRE
Monitoreo respiratorio y de signos vitales
El análisis de los cambios respiratorios permite conocer si el consumo de oxígeno se incrementa en 20 a 40% en la paciente obstétrica, consecuencia de una disminución de la reserva materna de oxígeno, que contribuye a la susceptibilidad en situaciones de estrés. Los cambios respiratorios propios del embarazo incrementan el volumen-minuto. Esto conduce a una disminución del dióxido de carbono basal en comparación con el existente antes del embarazo. El límite normal de PCO2 durante el embarazo es de 28 a 32 mmHg.70 La medición de los gases arteriales demuestra una alcalosis respiratoria levemente compensada, con disminución de la PaCO2 y del bicarbonato sérico (HCO3) de 18 a 21 mEq/L. Cuadros 7 y 8
Cuadro 7 Valores de gases en sangre en mujeres embarazadas y no embarazadas.71
| Valores de gases en sangre | No embarazada | Trimestre | ||
|---|---|---|---|---|
| 1 ° | 2 ° | 3 ° | ||
| pH | 7.40 | 7.44 | 7.44 | 7.44 |
| PaO2 (mmHg) | 100 | 107 | 105 | 103 |
| PaCO2 (mmHg) | 40 | 30 | 30 | 30 |
| Bicarbonato sérico (HCO3) (mmol/L) | 24 | 21 | 20 | 20 |
Cuadro 8 Capacidades pulmonares y volúmenes durante el embarazo.71
| Parámetro | Definición | Cambio durante el embarazo |
|---|---|---|
| Frecuencia respiratoria | Respiraciones por minuto | Sin cambio |
| Capacitad vital | Volumen máximo de aire que se exhala de forma forzada tras una inspiración máxima | Sin cambio |
| Capacitad inspiratoria | Volumen máximo de aire que puede inhalarse de una espiración normal | Incremento 5-10% |
| Volumen tidal | Volumen de aire inspirado y expirado en una respiración normal | Incremento 30-40% |
| Volumen de reserva inspiratoria | Volumen máximo de aire que puede ser inspirado al final de una inspiración normal | Sin cambio |
| Capacidad funcional residual | Volumen de aire contenido en los pulmones al final de una espiración normal | Disminución en un 20% |
| Volumen de reserva espiratoria | Máximo volumen de aire que puede ser exhalado del final de una espiración normal | Disminución en un 15-20% |
| Volumen residual | Volumen de aire pulmonar después de una expiración máxima | Disminución en un 20-25% |
| Capacidad pulmonar total | Total de volumen aéreo pulmonar tras una expiración máxima | Disminución 5% |
| Espacio muerto | Volumen ventilado de aire que no participa en el intercambio de gases | Incrementa |
| Ventilación minuto | Producto de la frecuencia respiratoria y el volumen tidal | Incrementa 45% |
| Ventilación alveolar | Volumen total de aire fresco que entra al alveolo por minuto | Incrementa 45% |
| Bienestar de la pared torácica | Relación entre la presión transmural a través de la pared del tórax y el volumen de la cavidad torácica | Disminuye |
Cuando en la madre se documenta hipoxemia secundaria a infección por COVID-19 está indicado administrar oxígeno complementario a través de los dispositivos de suministro de uso común para dar soporte vital y evitar la fatiga de los músculos respiratorios y mantener metas de presión de oxígeno.71,72 Cuadro 9
Cuadro 9 Dispositivos convencionales de oxígeno suplementario
| Dispositivos convencionales de oxígeno suplementario | |||
|---|---|---|---|
| Dispositivo | Flujo de oxígeno | Concentración de oxígeno | Observaciones |
| Cánula nasal convencional | 1-6 L / min. | 24%-40%. | |
| Mascarilla convencional | 5-10 L / min. | 40%. | Evite un flujo de oxígeno más bajo, porque esto puede resultar en reinhalación de dióxido de carbono. |
| Máscara Venturi | 10 L/ min. | 24%-50% | Puede proporcionar una fracción de oxígeno inspirado más controlada. (Elegido por el operador). |
| Mascarilla reservorio de reinhalación parcial | 10 L/ min. | 60%-70% | |
| Mascarilla reservorio sin reinhalación | 10 L/ min. | 80% | |
| Mascarilla nasal de alto flujo | Hasta 60 L / min. | Hasta 100% | Aire caliente y humidificado, titulación de precisión de fracción de oxígeno inspirado. |
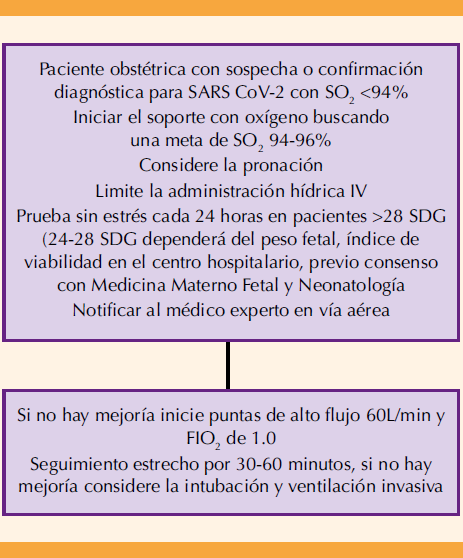
Para asegurar una correcta perfusión de oxígeno se recomienda mantener una saturación periférica de oxígeno (SpO2) entre 94 a 98%, además de evitar la hiperoxemia (PaO2 mayor de 120 mmHg) para no contribuir a la generación de radicales superóxido.73
Cánulas nasales de alto flujo
La evidencia actual sugiere que la cánula nasal de alto flujo es superior a la terapia convencional de oxígeno. Las pacientes con indicación para esta terapia de soporte deberán reunir los requisitos indispensables de: estabilidad hemodinámica, estado mental óptimo, reflejo de tos y control adecuado de secreciones. En relación con su efectividad existen algunos reportes de la necesidad de evitar la intubación endotraqueal. Es necesario tomar en cuenta que algunas de esas conclusiones son ambiguas en virtud de que esos estudios pocas veces incluyen a pacientes obstétricas74 pero seguirán siendo útiles en lugares con recursos limitados. En pacientes con deterioro respiratorio nunca debe retrasarse la aplicación de las medidas primarias que puedan evitar la necesidad de llegar, irremediablemente, al soporte mecánico invasivo.71,72,73
Posición prona
La estrategia en decúbito prono despierto es una técnica segura, sencilla y rentable que mejora la oxigenación al incrementar la uniformidad de la ventilación, disminuir la compresión e incrementar el reclutamiento alveolar de la porción dorsal de los pulmones para un mayor intercambio gaseoso, mejorar la distribución de gases hacia la porción ventral y paradiafragmática pulmonar 75,76,77 Esto tiene una repercusión positiva en la oxemia y es factible en pacientes embarazadas o en el puerperio inmediato.78,79 Para colocar correctamente a la paciente se recomienda usar dispositivos de apoyo: almohadas y sábanas alineadas de manera adecuada para evitar la presión excesiva sobre el útero grávido.78 En un estudio retrospectivo, observacional y multicéntrico llevado a cabo en México y Ecuador se concluyó que la posición en decúbito prono de pacientes hospitalizados despiertos, con COVID-19, se asocia con un riesgo menor de intubación y muerte.80
El aspecto más importante de esta maniobra es asegurar que el tubo endotraqueal permanezca en su lugar y proteger las salientes óseas. La posición adecuada del útero gestante permite la monitorización cardiotocográfica fetal.71,72 Si la paciente no muestra mejoría en 10 a 15 minutos habrá deterioro hemodinámico. Si la frecuencia cardiaca fetal no puede monitorizarse de manera satisfactoria deberá suspenderse la pronación.
Las indicaciones para esta posición son: requerimiento de más de 2 L/minuto de oxígeno para mantener una saturación de oxígeno más o menos mayor del 95% o una frecuencia respiratoria mayor de 30 latidos por minuto. Las contraindicaciones absolutas para la pronación son: inestabilidad espinal, fracturas faciales o pélvicas y heridas abiertas de abdomen. Las contraindicaciones relativas son: confusión o incapacidad para cambiar de posición de forma independiente.78
TROMBOPROFILAXIS
El embarazo es un factor de riesgo de trombosis, sobre todo en el tercer trimestre y en el posparto inmediato. La enfermedad grave por COVID-19 aumenta el riesgo de eventos tromboembólicos. A las pacientes obstétricas críticamente enfermas, o con ventilación mecánica, debe indicárseles heparina profiláctica no fraccionada o heparina de bajo peso molecular siempre y cuando no tengan contraindicaciones para recibirlas.
Si están indicadas las dosis profilácticas, la heparina de bajo peso molecular es la de preferencia debido a que se administra una vez al día y limita la exposición del personal de atención médica.81 Cuadro 10
Cuadro 10 Tromboprofilaxis farmacológica en COVID-19 y embarazo.19,59
| Estrategias para la prevención del tromboembolismo venoso | ||
|---|---|---|
| Fármaco | Indicaciones clínicas | Seguimiento posparto y administración |
| Heparina 5,000 UIsubcutánea cada 8 h | Paciente internada anteparto sin enfermedad crítica | Verificar tiempo parcial de tromboplastina (PTT) previo a la anestesia neuroaxial |
| Enoxaparina40 mg subcutáneos cada 24 h | Pacientes con requerimiento de oxígeno. Posibilidad de anestesia neuroaxial 12 h después de la última dosis | 2 semanas de profilaxis o más dependiendo de la gravedad del cuadro |
| Posparto con factores de riesgo con o sin enfermedad grave | Considere 2 semanas para las pacientes con parto 6 semanas para las de cesárea (enfermedad grave) | |
| Enoxaparina40 mg subcutáneos cada 12 h | Dosis en enfermedad crítica no intubada con función renal normal | Considere la heparina 7,500 UI cada 8 h si CrCl <30 mL/Min |
| Enoxaparina0.5 mg/kg subcutáneos cada 12 h | Dosis en enfermedad crítica con IMC > 40 kg/m2 sin hemorragia obstétrica activa o insuficiencia renal | Monitorear niveles de anti-Xa0,2- 0.5 μ / mL 6 h después a su aplicación |
Para las pacientes con COVID-19 leve o asintomática, hospitalizadas por indicaciones obstétricas, no se recomienda la tromboprofilaxis; para las personas embarazadas o en posparto, hospitalizadas y con neumonía, la deambulación suele ser limitada debido a la fatiga y al requerimiento de oxígeno suplementario. En pacientes con COVID-19 grave o crítica, la profilaxis puede proporcionarse con heparina de bajo peso molecular o heparina no fraccionada. Si el diagnóstico de COVID-19 se establece en el trascurso de las 6 semanas posparto debe indicarse la tromboprofilaxis durante todo el tiempo de estancia hospitalaria y hasta los 10 días posteriores al alta. En pacientes con contraindicación de anticoagulación farmacológica o ante trombocitopenia deberá optarse por medidas de compresión neumática intermitente: menos de 50,000/L.
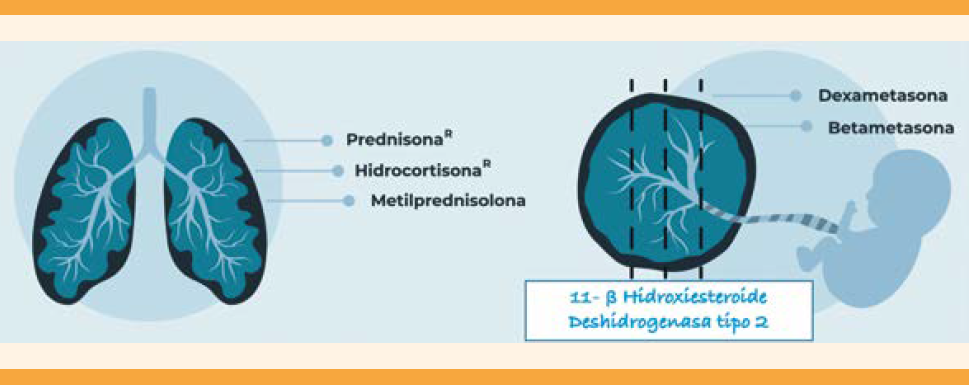
Esteroides, COVID-19 y embarazo
La indicación de corticosteroides a pacientes con COVID-19 tiene dos opciones precisas: favorecer la inducción de la maduración pulmonar fetal ante un alto riesgo de nacimiento pretérmino inminente (próximos 7 días) y como tratamiento para casos graves. Es importante ser precisos ante la decisión de recurrir a esta intervención. La administración de corticosteroides durante un lapso prolongado está contraindicada porque reduce los movimientos corporales y respiratorios del feto. Además, puede propiciar la restricción del crecimiento fetal, bajo peso al nacimiento, hipoglucemia fetal, aumento de la incidencia de sepsis neonatal y mayor riesgo de trastornos de conducta y mentales en la edad pediátrica.82,83,84 Los glucocorticoides activan múltiples mecanismos que favorecen la diferenciación tisular, con influencia en la programación fetal con repercusiones fisiológicas hepáticas, pulmonares, suprarrenales, intestinales, renales, cerebrales y en el tejido adiposo que favorecen la aparición de enfermedades crónicas del adulto.85,86 Figura 6
En caso de riesgo de parto prematuro inminente (menos de 34 semanas, más de 3 cm de dilatación cervical o borramiento) se indica la administración de un ciclo corto de dexametasona o betametasona para acelerar la maduración pulmonar fetal. En caso de COVID-19 grave los desenlaces del síndrome respiratorio agudo mejoran con la terapia prolongada con esteroides en dosis bajas.87,88 El estudio RECOVERY demostró que la administración de dexametasona se asocia con menor riesgo de mortalidad entre las personas que requieren oxígeno suplementario (en el caso de las pacientes embrazadas iniciar ante SpO2 < 94%) y cuando requieran ventilación mecánica por COVID-19. Con un esquema de 6 mg por vía oral o intravenosa cada 24 horas, durante un máximo de 10 días.81,89,90 Cuadro 11
Cuadro 11 Sugerencias para la indicación de corticosteroides en COVID-19 y embarazo
| Esteroides COVID y embarazo | |
|---|---|
| SFMF (Medicine, 2021) | Esquema de madurez pulmonar fetal: dexametasona 6 mg IM c/ 12 h durante 48 h (4 dosis) seguido de 6 mg VO / IV cada 24 h hasta completar un total de 10 días. Sin esquema de madurez pulmonar fetal: 6 mg VO / IV cada 24 h por 10 días. |
| ACOG (87) | Esquema de madurez pulmonar fetal: dexametasona 6 mg IM c/ 12 h durante 48 h (4 dosis) seguido de Metilprednisolona 32 mg VO / IV cada 24 h hasta completar un total de 10 días. Sin esquema de madurez pulmonar fetal: metilprednisolona 32 mg VO / IV cada 24 h hasta completar un total de 10 días. |
| RCOG /RECOVERY trial19 | Esquema de madurez pulmonar fetal: dexametasona 6 mg IM c/ 12 h durante 48 h (4 dosis) seguido de prednisolona 40 mg VO / IV cada 24 h o hidrocortisona 80 mg VO / IV cada 12 h hasta completar un total de 10 días. Sin esquema de madurez pulmonar fetal: prednisolona 40 mg VO / IV cada 24 h o hidrocortisona 80 mg VO / IV cada 12 h hasta completar un total de 10 días. |
*Esquema de madurez pulmonar en ≤34 semanas de gestación.
ANTIBIÓTICOS DE RUTINA
La prescripción de antibióticos solo está indicada en caso de sospecha de una coinfección, sobre todo por neumonía adquirida en la comunidad. Antes de indicarlos deben obtenerse cultivos, de preferencia antes del inicio y, posteriormente, a la administración empírica que, enseguida, deberá ajustarse conforme al reporte del antibiograma.81
La inclusión equitativa de mujeres embarazadas y lactantes a la investigación biomédica es casi nula; por lo tanto, se desconocen los posibles beneficios y daños de las intervenciones farmacológicas.
Tocilizumab
Está demostrado que tocilizumab (antagonista del receptor de interleucina-6) mejora los desenlaces, incluida la supervivencia, en pacientes hospitalizadas con hipoxia y evidencia de inflamación sistémica (proteína C reactiva igual o superior a 75 mg/L). Si bien los informes para la indicación de tocilizumab en el embarazo son limitados, tampoco hay evidencia de que sea teratogénico o fetotóxico.91 Para mujeres que cumplen con los criterios anteriores (hipoxia con inflamación sistémica), tocilizumab debe considerarse solo si las ventajas superan los riesgos.19,90
Procedimiento
En pacientes con COVID-19 crítico, en tratamiento con un corticosteroide que no hayan recibido previamente tratamiento con otro inmunomodulador, que no tengan contraindicación de terapia anti IL-6, previo descarte de sobreinfección bacteriana y que además cuenten con una proteína C reactiva mayor de 75 mg/L puede considerarse la indicación de 8 mg/kg por vía intravenosa de tocilizumab y repetir a las 24 a 48 horas o 400 mg por vía intravenosa de sarilumab y repetir a las 24 a 28 horas (previo descarte de infección por Citomegalovirus, VIH, hepatitis B o C) y donde se cuente con un servicio de Infectología y procedimientos necesarios para la atención y tratamiento de pacientes con aspergilosis pulmonar. 19 , 92
Remdesivir
En la actualidad se carece de datos que valoren la repercusión perinatal de esta intervención farmacológica. Los organismos internacionales de regulación incluyen al remdesivir en el tratamiento de pacientes hospitalizadas con COVID-19 que cumplan con los criterios, aunque ningún ensayo clínico ha demostrado eficacia en esta población.93,112 Las últimas actualizaciones han informado que el remdesivir tuvo poco o ningún efecto en la mortalidad general, el inicio de la ventilación y la duración de la estancia hospitalaria.93,112
El equipo multidisciplinario debe considerar, de forma individual, su indicación en pacientes en las que se ha informado un beneficio (hospitalizadas que requieren oxígeno complementario en el inicio temprano del curso de la enfermedad, y no en pacientes que son ventilados mecánicamente).19,92 No es claro el papel de este fármaco en la organogénesis, en la trasmisión vertical y en su farmacocinética ajustada en el embarazo. Es importante destacar que existen muy pocos datos de la exposición al remdesivir en el primer trimestre, cuando ocurre la organogénesis.93 En caso de optar por su indicación en casos con COVID-19 severo, con oxígeno suplementario pero sin requerir ventilación mecánica, se sugiere indicar 200 mg por vía intravenosa en el primer día y continuar con 100 mg, por la misma vía, durante cinco días.90
Otras terapias
Hace poco, la FDA emitió una autorización de uso de emergencia del anticuerpo monoclonal anti-SARS-CoV-2; casirivimab más imdevimab como agente destinado a la prevención posterior a la exposición; para pacientes seleccionados con alto riesgo de evolucionar a COVID-19 grave. Otras terapias blanco actualmente en estudio son el tofacitinib y baricitinib; sin embargo, no hay consenso en relación con su indicación a pacientes embarazadas o en lactancia. Están por determinarse si las ventajas de esta intervención superan los riesgos potenciales.94 El favipiravir está contraindicado en las embarazadas por el riesgo teratogénico.90
Vigilancia fetal
El registro cardiotocográfico se basa en la premisa de que la frecuencia cardiaca de un feto no acidótico ni neurológicamente deprimido tendrá ascensos con el movimiento fetal. La reactividad fetal es un buen indicador de una función autonómica normal. La pérdida de la reactividad se asocia con el ciclo sueño-vigilia pero también puede deberse a depresión del sistema nervioso central, incluida la acidemia fetal.95
Es importante la vigilancia del bienestar de la madre y el feto. La vigilancia del feto en pacientes hospitalizadas se efectúa con monitoreo electrónico durante 20 minutos en búsqueda de datos ominosos cuando se considera al feto como viable en el centro hospitalario de atención.
La infección materna por SARS-CoV-2 puede causar cambios que pueden observarse en el registro tococardiográfico debido a la hipoxia, tormenta de citocinas, irritabilidad uterina, pirexia y trombosis intervellosa de la placenta, que disminuye el intercambio de oxígeno.
Además, se ha propuesto que esta infección puede disociar la oxihemoglobina, la carboxihemoglobina y la hemoglobina glucosilada, lo que intensifica la duración de la hipoxia y favorece la dificultad respiratoria y la desaturación de oxígeno. Como resultado del aumento de la eritropoyetina hay un estado de hipercoagulabilidad que favorece la reducción de la transferencia de oxígeno en el útero placentario.96
La infección por SARS-COV-2 se asocia con cambios en el registro cardiotocográfico, independientemente de la gravedad. El aumento en la línea de base es el cambio más frecuente, como resultado del paso transplacentario de las interleucinas y citocinas y la acción directa de éstas en el miocardio del feto. También se han observado desaceleraciones tardías, como consecuencia de la insuficiencia útero-placentaria debido a la respuesta inflamatoria. La mayoría de esos casos tuvo desenlaces perinatales satisfactorios. El procedimiento consiste en mejorar el entorno materno para corregir la hipoxemia y la hipertermia en la madre para rectificar estos cambios antes de considerar cualquier intervención.96
Los trazos tococardiográficos alterados (categoría 2 y 3) no han demostrado relación directa con la gravedad de la enfermedad por COVID-19.97
La monitorización fetal continua, por cardiotocografía durante el trabajo de parto, no está indicada en pacientes asintomáticas con prueba positiva para SARS CoV-2, salvo que exista otra indicación para monitorización. Las pacientes con síntomas deberán permanecer en vigilancia al menos cada 24 horas y en caso de trabajo de parto de forma continua.19
Soporte ventilatorio en la mujer embarazada
La ventilación mecánica no es exclusiva de los servicios de terapia intensiva, sino un requerimiento en cualquier paciente grave que pueda beneficiarse con esta intervención. El obstetra encargado de atender a una embarazada intubada debe familiarizarse con los principios subyacentes de la oxigenación y el soporte ventilatorio en casos de síndrome respiratorio agudo y embarazo. Hasta ahora no existe consenso de ventilación mecánica invasiva en pacientes obstétricas. Sin embargo, los cambios fisiológicos relacionados con el embarazo aumentan el riesgo de insuficiencia respiratoria aguda y la necesidad de apoyo ventilatorio hospitalario. La ventilación mecánica en mujeres embarazadas plantea muchos desafíos.61 Existen consideraciones, como la fracción de oxígeno inspirado, la presión positiva al final de la espiración y el volumen corriente, que son de suma importancia para ofrecer una ventilación protectora que evite el daño inducido por el ventilador mecánico (VALI), reducir los hallazgos fetales adversos y la mortalidad materna.71,72
Las indicaciones de cuidados avanzados de la vía aérea y de inicio de la ventilación mecánica invasiva son exactamente los mismas. Se trata de una vía aérea difícil hasta que se demuestre lo contrario, por el aumento de edema en la orofaringe y mayor riesgo de aspiración. Debido a su alta demanda de oxígeno tendrá poca tolerancia a la hipoxia, por lo que el proveedor con más experiencia debe llevar a cabo la intubación para disminuir el riesgo de múltiples intentos o fallas.59 Al colocar a una paciente embarazada para la intubación, el desplazamiento uterino debe hacerse durante el procedimiento si el útero está a la altura del ombligo para evitar la compresión aorto-cava, con hipotensión supina o inestabilidad hemodinámica secundarias durante la secuencia rápida de la intubación.71
Ante situaciones como: menor distensibilidad de la pared torácica, aumento de peso de la amdre, interacción de las presiones intrabdominal y torácica a expensas del crecimiento uterino es necesario el monitoreo estricto de las metas de protección pulmonar. En el tercer trimestre del embarazo aumenta el riesgo de atelectasias y edema pulmonar71 aunado a las estrategias ventilatorias en pacientes con síndrome respiratorio agudo y concentraciones de presión positiva al final de la espiración más allá de 10 cm de H20; se sugiere un seguimiento continuo del estado fetal considerando la potencial repercusión en las necesidades fetoplacentarias de gasto cardiaco.61,98 Cuadro 12
Cuadro 12 Parámetros de ventilación mecánica recomendados para pacientes embarazadas y con síndrome respiratorio agudo. 2020 71,72,99
| Ventilación mecánica y estrategias de manejo recomendadas para pacientes embarazadas con síndrome respiratorio agudo | ||
|---|---|---|
| Parámetro | Descripción | Meta en sdra |
| Volumen tidal (VT) | Volumen administrado por el ventilador con cada respiración | 4-6 mL/kg de peso predicho Fórmula de peso predicho: [Tamaño (cm) - 152,4) × 0,91] +45 |
| Frecuencia respiratoria | Respiraciones por minuto administradas por el ventilador | 18-22 por minuto. Relacionada al volumen minuto aumentado en el embarazo, la necesaria para un CO2 normal en el embarazo (28-32 mmHg). |
| Presión meseta (Pplat) | Generada por la distribución del aire dentro del pulmón, es un intento de medir la presión alveolar. Se mide al final de una pausa inspiratoria de 0.3-3 seg con flujo de aire de 0 | Pplat ≤ 27 cm a 30 cm de H2O en el embarazo. (hipotéticamente influida en parte por la presión del útero grávido) |
| Presión positiva al final de la espiración | Presión aplicada para evitar el colapso alveolar al final de la espiración | Presión positiva al final de la espiración 10-12 cm H2O se recomienda inicialmente,(Considerar la presión intrabdominal secundaria al útero grávido y el SDRA que impactan en la capacidad funcional residual y el volumen residual) |
| Fracción de oxígeno inspirado | Porcentaje de oxígeno en el aire suministrado por el ventilador | Fracción de oxígeno inspirado necesaria para lograr la oxigenación deseada de PaO2 70-100 mm Hg o SpO2 >94% |
| Presión inspiratoria pico (PIP) | Presión máxima generada en la vía aérea | PIP ≤ 35 cm to 30 cm H2O en el embarazo. (hipotéticamente influida en parte por la presión del útero grávido) |
Consideraciones de la ventilación mecánica en la paciente obstétrica grave
La mecánica de la ventilación tiene como propósito apoyar la oxigenación para la madre y su feto. La programación adecuada permite minimizar el riesgo de lesiones provocadas por el ventilador mecánico y contribuir al soporte de esta función vital hasta que se lleve a cabo la recuperación pulmonar. Las consideraciones adicionales para la paciente embarazada con ventilación mecánica incluyen: ventilación de bajo volumen tidal establecidos inicialmente de 4 a 8 mL/kg de peso predicho, con posterior ajuste dependiendo de la mecánica pulmonar y las presiones de distensión que generen. Con esto se aportará una ventilación mecánica protectora. La presión positiva al final de la espiración debe iniciarse de 8 a 10 cm de H2O y ajustarse para lograr las mesetas de saturación de oxígeno, aunque por las condiciones propias del síndrome respiratorio agudo podría aumentarse aún más.59
La sedación, analgesia y los neurobloqueadores musculares son seguros durante el embarazo; sin embargo, se recomienda indicarlos durante el mínimo tiempo posible y la mínima dosis necesaria, para limitar los efectos adversos a la madre y a su hijo.99,100 Cuadro 13
Cuadro 13 Sedantes, analgésicos y bloqueadores neuromusculares utilizados en la Unidad de Cuidados Intensivos.71, 99-101
| Sedantes, analgésicos y bloqueadores neuromusculares | ||
|---|---|---|
| Agentes | Dosis | Comentarios |
| Fentanilo | 1-3 µg/kg IV para inducción sedación 50-100 µg IV anestesia 0.7-10 µg/kg/h Infusión continua | Liberación mínima de histamina. Los bolos de dosis alta pueden provocar rigidez del pecho. Considere en el contexto de hipotensión o insuficiencia renal. FDA C102 |
| Etomidato | 0.2-0.6 mg/kg IV para inducción 5-20 µg/kg/ min IV de mantenimiento | Hipnótico, estabilidad hemodinámica y respiratoria, no analgésico, reduce el consumo de oxígeno cerebral, la PIO y PIC. FDA C (103) |
| Remifentanilo | 0.5 mg/kg en bolo seguido de infusión a 0.5-2 mg/kg/min | Vida media de 3 minutos metabolizado por esterasas plasmáticas. FDA C104 |
| Midazolam | 0.05-0.1 mg/kg para sedación consciente 0.1-0.3 kg para intravenosa. Por infusión de 0.04-0.4 mg/kg/h | Metabolitos activos, evitar en enfermedad renal. El consumo prolongado puede causar síndrome de abstinencia. FDA D105 |
| Propofol | 1.5 a 2 mg/kg IV Inducción en infusión de 1 a 5 mg/kg/h | Provoca vasodilatación y disminución del gasto cardíaco. Las dosis altas conducen al síndrome de infusión de propofol. El consumo prolongado puede causar síndrome de abstinencia. FDA B106 |
| Dexmedetomidina | 0.2 a 0.7 µg/kg/h | Sin depresión respiratoria. Evitar en el entorno de hipotensión de bradicardia. Menor incidencia de delirio. FDA C107 |
| Vecuronio | Bolo de 0.1 mg/kg seguido por de 0.18-1.7 µg/kg/h | Evitar en insuficiencia renal o hepática. FDA C108 |
| Cisatracurio | 0.2 mg/kg en bolo e infusión de 0.18 µg/kg/h | Propiedades antiinflamatorias intrínsecas. FDA B109 |
La oxigenación por medio de una membrana extracorpórea es una opción factible para mujeres embarazadas con hipoxemia resistente. Pese a que los datos pudieran no ser suficientes, el equipo multidisciplinario deberá trabajar en estrecha coordinación para ofrecer una atención óptima. En mujeres embarazadas en quienes el fondo uterino está a la altura del ombligo, la compresión de las venas ilíacas y otras venas pélvicas puede entorpecer el flujo sanguíneo, lo que hace que usar las extremidades inferiores para oxigenación por medio de una membrana extracorpórea sea un desafío a considerar. Podría considerarse instalar un catéter único con un lumen doble que puede colocarse en la vena yugular interna derecha, para evitar la necesidad de canulación de la extremidad inferior.59 Los desenlaces a largo plazo de las madres y los fetos siguen estudiándose.101-110 El embarazo no es una contraindicación para oxigenación por medio de una membrana extracorpórea. Para ofrecer este tipo de atención debe contarse con un equipo sumamente capacitado y multidisciplinario que pueda analizar los posibles riesgos y beneficios para la madre y su hijo.81
Progresión de la enfermedad
Los primeros signos de advertencia de una enfermedad grave incluyen: 1) aumento de la sensación de disnea o trabajo respiratorio, 2) incapacidad para mantener una saturación de oxígeno adecuada, 3) fiebre persistente y 4) empeoramiento de las mialgias.47
El sistema modificado de alarma obstétrica temprana es una herramienta práctica y sencilla que guía a todo el personal de salud en el análisis de parámetros clínicos que permiten reconocer la severidad de la enfermedad o el deterioro de la paciente grave con COVID-19.99 Mediante un análisis efectuado cada 4 horas y un puntaje de 5 o más, resultado de la suma de parámetros verdes (1 punto) y amarillos (2 puntos), o la coexistencia de 1 parámetro rojo (3 puntos) se logra que una valoración por especialistas en Medicina crítica y el oportuno ingreso a la unidad de cuidados intensivos, mejore las posibilidades de recuperación de la paciente. Cuadro 14
Cuadro 14 Herramienta diagnóstica Modified early obstetric warning system (MEOWS) 1 parámetro rojo o parámetro 2 amarillo que requieren activar la alerta
| Parámetro fisiológico | Alerta amarilla | Alerta roja |
|---|---|---|
| Frecuencia respiratoria | 21-30 | <10 o >30 |
| Saturación de oxígeno (%) | <95 | |
| Temperatura (°C) | 35-36 | <35 o >38 |
| Sangre sistólica Presión (mmHg) | 150-160 o 90-100 | <90 o >160 |
| Sangre diastólica Presión (mmHg) | 90-100 | > 100 |
| Frecuencia cardiaca | 100-120 o 40-50 | > 120 o <40 |
| Respuesta neurológica | A la voz | Sin respuesta al estímulo doloroso |
La mujer embarazada y con COVID-19 tiene un riesgo aumentado de padecer preeclampsia. Cuanto más grave es la infección por SARS-CoV-2, mayor es el riesgo de preeclampsia. La enfermedad por SARS-CoV-2 puede, de manera independiente, originar disfunción endotelial, inflamación intravascular, proteinuria, activación de la trombina e hipertensión, que son todas características de preeclampsia. Por tanto, debe considerarse una relación causal, sobre todo en mujeres nulíparas.111 No parece haber una relación con la severidad. Las mujeres con preeclampsia deben considerarse un grupo particularmente vulnerable con respecto a los riesgos planteados por COVID-19.17
Procedimientos
La atención de la paciente obstétrica con infección por SARS-CoV-2 grave debe efectuarla un grupo multidisciplario en un hospital COVID, con vigilancia materno-fetal estrecha.
La vigilancia de los parámetros clínicos de la madre y el feto cada 4 horas permite reconocer oportunamente el deterioro de la paciente grave.
TRASMISIÓN VERTICAL
Existe poca evidencia acerca de la posibilidad de trasmisión de SARS-CoV-2 de la madre al feto.81 Si bien se han descrito casos de infección perinatal, no está claro si ésta ocurrió por vía trasplacentaria, transcervical o por trasmisión horizontal.87,88,89,93,94,112. En marzo se presentó el primer caso que demostró trasmisión trasplacentaria de SARS-CoV2 con manifestación clínica en el recién nacido, caracterizada por síntomas neurológicos debidos a vasculitis cerebral.97 Sin embargo, las revisiones sistemáticas de informes de casos, series de casos y estudios de cohorte permiten considerar un riesgo de trasmisión vertical bajo, con una tasa del 0.09 a 3.2% y es más frecuente en el tercer trimestre.113 Lo anterior pudiera atribuirse a la expresión creciente de receptores de angiotensina 2 (AT2) en la placenta (citotrofoblasto, sincitiotrofoblasto, endotelio y músculo liso perivascular de las vellosidades primarias y secundarias) así como por la carga viral y la expresión de TMPRSS2, que al coexpresarse con los receptores de AT2 puede favorecer la infección; sin embargo, se requieren más estudios para confirmar estos desenlaces.97,114,115
Finalización del embarazo
En el tercer trimestre, la presión del útero disminuye el volumen de reserva espiratoria y la capacidad residual funcional, condiciones que pueden aumentar el riesgo de hipoxemia severa.116 En casos de COVID-19 la prematurez se incrementa, sobre todo por indicación iatrogénica debido al riesgo que corren tanto la madre como su hijo.117 De acuerdo con los reportes, más del 60% de las mujeres finalizan el embarazo por cesárea, lo que representa un incremento de tres veces.23
COVID LEVE-MODERADO
La finalización del embarazo en pacientes asintomáticas, o levemente sintomáticas, no es una indicación de rutina y deberá reservarse a indicaciones estrictamente obstétricas. Se recomienda no postergar el embarazo más allá de las 39 semanas.81
COVID GRAVE
La decisión de finalizar el embarazo en una paciente con COVID-19 crítico es compleja porque exige establecer el riesgo-beneficio entre la condición materna y el estado del feto. La admisión de la paciente embarazada con COVID-19 a una unidad de cuidados intensivos, por sí misma, no es indicación absoluta de interrupción del embarazo.69 La guía de referencia para la atención de pacientes embarazadas y en puerperio con COVID-19, en su última versión del 7 de octubre del 2020, estipula que en la paciente grave deberá valorarse finalizar el embarazo para preservar el bienestar de la madre.24 En pacientes COVID-19 crítico el nacimiento pretérmino alcanza frecuencias del 88% y 94% de estos son por cesárea.118,119 Hacen falta más estudios para catalogar que la descompresión uterina tiene una repercusión real en el estado respiratorio.120 En pacientes con COVID-19 crítico las recomendaciones del American College of Obstetricians and Gynecologists (ACOG) y de la Society for Maternal-Fetal Medicine son que el nacimiento debe considerarse luego de valorar los riesgos fetales con el hipotético beneficio respiratorio de la madre. El estudio PRIORITY determinó que los desenlaces neonatales de madres con COVID-19 dependen de las semanas de embarazo al nacimiento.121 La mayor parte de las complicaciones sobrevienen por la prematurez iatrogénica en vez de que sea por la infección por SARS CoV-2.
Ante la falta de evidencia que muestre el camino correcto, la finalización del embarazo por indicación asociada con SARS-CoV-2 dependerá, exclusivamente, de las características propias de cada paciente, las semanas de embarazo y las capacidades del hospital.
El criterio para definir hipoxemia resistente es: PaO2 menor de 60 mmHg con fracción de oxígeno inspirado de 1 o PaO2 y fracción de oxígeno inspirado menor de 150 que no mejora con incremento de la presión positiva al final de la espiración, medidas de reclutamiento alveolar, posicionamiento prono o sedación profunda.122 Ante estos criterios o presión positiva al final de la espiración más o menos mayor de 10 cm de H2O o necesidad de oxigenación por medio de una membrana extracorpórea se deberá indicar un esquema de madurez pulmonar y neuroprotección fetal según sea el caso y valorar la finalización del embarazo. Si la oxigenación de la madre no mejora deberá finalizarse el embarazo, independientemente del esquema de madurez pulmonar.
Conducta obstétrica ante la paciente con COVID-19 crítico69
En todo escenario de paciente obstétrica que ingresa a la unidad de cuidados intensivos, ante la posibilidad de deterioro, el caso debe exponerse y discutirse en un grupo interdisciplinario integrado por Medicina Crítica, Obstetricia, Medicina Maternofetal, Infectología, Anestesiología y Neonatología.
Menos de 24 semanas (previable): evaluar la frecuencia cardiaca fetal cada 24 horas y revalorar en caso de deterioro clínico de la madre. El embarazo solo se finaliza ante hipoxemia resistente (PaO2 menor de 60 mmHg con fracción de oxígeno inspirado de 1 o PaO2 y fracción de oxígeno inspirado menor de 150 que no mejora con el incremento de la presión positiva al final de la espiración, medidas de reclutamiento alveolar, posición prona o sedación profunda, presión positiva al final de la espiración mayor de 10 cm de H2O o necesidad de oxigenación por medio de una membrana extracorpórea, insuficiencia orgánica múltiple, choque séptico) o paro cardiorrespiratorio materno a partir de las 20 semanas de embarazo.
En las 24 a 31.6 semanas de embarazo: evaluar el bienestar fetal cada 24 horas cuando la condición de la madre se encuentre estable. Si se torna inestable valorar la monitorización fetal continua. Valorar el uso óptimo del esquema de madurez pulmonar (debe considerarse el esquema de rescate si se indicó previamente con un intervalo más o menos mayor a 7 días) cuando exista una alta probabilidad de nacimiento.123 Debe valorarse la neuroprotección fetal con sulfato de magnesio si la diuresis de la madre es más o menos mayor de 30 mL/h.124 Si en la madre hay hipoxemia resistente, choque séptico o insuficiencia orgánica múltiple o inestabilidad materna o fetal (estado fetal no tranquilizador) no debe esperarse la latencia del esquema de madurez pulmonar ni de neuroprotección fetal. La vía de nacimiento dependerá de las condiciones obstétricas.
En las 32-33.6 semanas de embarazo: evaluar el bienestar fetal cada 24 horas. Debe considerarse el nacimiento a las 48 horas del esquema de madurez pulmonar si la presión positiva al final de la espiración es más o menos mayor de 10 cm de H2O o hay necesidad de oxigenación por medio de una membrana extracorpórea. Si la madre tiene hipoxemia resistente, choque séptico o insuficiencia orgánica múltiple o inestabilidad materna o fetal (estado fetal no tranquilizador) no debe esperarse a la latencia del esquema de madurez pulmonar. La vía de nacimiento dependerá de las condiciones obstétricas. Es importante considerar la inducción del trabajo de parto si la paciente es idónea para ello y se encuentra hemodinámicamente estable.
En las 34 semanas de embarazo: si en la madre o el feto coexisten: hipoxemia resistente, choque séptico o insuficiencia orgánica múltiple o inestabilidad o estado fetal no tranquilizador conviene considerar la finalización del embarazo, cuya vía dependerá de las condiciones obstétricas. Vale la pena considerar la inducción del trabajo de parto si la paciente es apta para ello y se encuentra hemodinámicamente estable.
En caso de optar por el parto, debe administrarse la analgesia obstétrica oportuna. Optar por la cesárea si hay deterioro de la condición de la madre (hipoxemia resistente, insuficiencia orgánica múltiple o choque séptico, estado fetal no tranquilizador ante un feto viable o si existe indicación obstétrica).
Debe minimizarse la cantidad de miembros del personal que ingresan a la sala y las unidades. Se recomienda que cada centro hospitalario desarrolle una política local que especifique el personal esencial para situaciones de urgencia.
A las mujeres con COVID-19 sintomático sospechado o confirmado debe practicárseles el pinzamiento tardío del cordón y el contacto piel a piel con el recién nacido, si la condición de la madre y el niño lo permite. Mantener medidas para prevenir el contagio horizontal: aislamiento, lavado frecuente de manos, uso de cubrebocas.
Consideraciones acerca del cuidado posparto
La duración específica de la estancia hospitalaria posparto de pacientes con COVID-19 dependerá de la gravedad de sus síntomas. Las pacientes asintomáticas, presintomáticas o con síntomas leves sin comorbilidades pueden recuperarse en casa. Las pacientes con enfermedades graves o críticas requieren hospitalización continua. La decisión con respecto a la hospitalización en curso por diagnóstico moderado debe individualizarse.
En las pacientes ambulatorias debe hacerse hincapié en la posibilidad de empeorar clínicamente; de ser así deben darse las indicaciones pertinentes para trasladarlas de inmediato al hospìtal.
Atención del recién nacido de madre con COVID-19
La reanimación neonatal debe practicarse siguiendo las políticas establecidas en cada hospital, cumpliendo las debidas precauciones de contacto y la administración de gotas al recién nacido hasta descartar la infección. Esto incluye el uso de bata, guantes, mascarilla quirúrgica, protección ocular con careta o gafas. En caso de ventilación con presión positiva o el uso de cualquier dispositivo con el potencial de generar aerosoles de la vía aérea, se sugiere agregar protección con mascarilla respiratoria N95. A pesar del bajo riesgo de infección perinatal, es necesario descartar la infección por SARS-CoV-2 en el recién nacido mediante una prueba de PCR en tiempo real tomada a las 24 y 48 horas después del nacimiento (o una sola prueba a las 24 a 48 h) de hisopado nasofaríngeo, orofaríngeo o nasal.125
LACTANCIA
El riesgo de trasmisión del SARS-CoV-2 por ingestión de leche humana parece ser muy bajo. En su mayoría el virus no se ha detectado en muestras de leche humana, solo en pequeñas series de casos se ha reportado la existencia de material genético viral (12 de 183 pacientes de 48 estudios)126 sin que esto demuestre viabilidad y replicación del virus, por lo que la lactancia materna no debe suspenderse en caso de infección materna por COVID-19.
Si se requiere la separación temporal de la madre y su hijo, la extracción de leche humana, siguiendo un protocolo adecuado de higiene, será necesaria para mantener el suministro nutricional del neonato. En caso de alojamiento conjunto se recomienda el uso adecuado de una mascarilla y practicar la higiene de manos antes de cada toma y durante el contacto con el recién nacido.81 Se recomienda mantener estos cuidados durante el contacto con el recién nacido, hasta que finalice el aislamiento, debido a que la trasferencia trasplacentaria pasiva de anticuerpos maternos contra el SARS-CoV-2 puede no proteger al recién nacido de la infección materna.127
La vacunación contra COVID-19 no requiere la suspensión de la lactancia. No hay evidencia que sugiera que las vacunas contra COVID-19 afecten la fertilidad. Las mujeres que planean un embarazo o un tratamiento de fertilidad pueden recibir una vacuna COVID-19 y no es necesario retrasar la concepción.19
Identificación y tratamiento de la depresión posparto
La salud mental, en el contexto de la paciente embarazada durante la pandemia, es decisiva. Está descrito que durante la pandemia, la salud mental de la embarazada disminuye, con mayores puntajes en la Escala de Depresión de Edimburgo.2 La pandemia de COVID-19 ha favorecido, potenciado y perpetuado síntomas de depresión y ansiedad. En un estudio transversal, multicéntrico, llevado a cabo en México, se encontró que 17.5% de las pacientes embarazadas durante la pandemia tenían síntomas sugerentes de depresión y el 33.2% niveles altos de estrés.128 Los factores de riesgo aditivos del embarazo y el puerperio pueden potenciar estos síntomas. Una manera de contrarrestarlos es la práctica diaria de ejercicio, la alimentación equilibrada y la ocupación en actividades de recreación.19,81
Seguimiento de la paciente embarazada con SARS-CoV-2 resuelto
La embarazada recuperada de la enfermedad causada por SARS-CoV-2 se enfrenta a un escenario desconocido de posibles complicaciones en el futuro, teóricamente posibles, no solo en los órganos con receptores ACE2 sino, también, ante la posibilidad de preeclampsia en pacientes asintomáticas o sintomáticas. En las pacientes sintomáticas esa posibilidad es mayor, sobre todo antes de las 32 semanas, con una media de 3.79 semanas de diferencia respecto de la infección por SARS-CoV-2.17,129 Además, la posibilidad de restricción del crecimiento fetal con la consecuente repercusión en el recién nacido. Esta es la razón por la que el seguimiento estrecho de la madre y el feto es muy importante. En virtud de los hallazgos histopatológicos placentarios reportados en pacientes con SARS-CoV-2 se sugiere el análisis de la placenta.17,73,110,130
Para las mujeres que requirieron hospitalización por COVID-19 confirmado (con cuadro grave o crítico) se recomienda la evaluación del crecimiento fetal alrededor de los 14 días posteriores a la desaparición de la infección aguda o si han trascurrido más de 21 días después de la última fetometría.131
Si bien hasta ahora no hay evidencia de que la restricción del crecimiento fetal sea un riesgo de COVID-19, dos tercios de los embarazos con SARS se vieron afectados con restricción del crecimiento fetal y desprendimiento de placenta en un caso de MERS, el seguimiento ecográfico parece prudente.132 También se sugiere la exploración minuciosa del sistema nervioso central como probable órgano fetal diana de la hipoxemia materna.133
Procedimiento
Ante la falta de evidencia contundente se sugiere continuar con el control prenatal establecido, con especial insistencia en la afectación post-COVID-19, vigilancia del patrón de crecimiento fetal y la aparición de preeclampsia.
El síndrome post-COVID-19 agudo es la enfermedad que se extiende más allá de las tres semanas a partir del inicio de los síntomas y crónico el que dura más de 12 semanas.134 Estos síndromes se manifiestan en 10 a 35% de las infectadas134,135 y hasta en el 80% de las pacientes que ameritaron hospitalización.136 Entre los síntomas más frecuentes están: disnea, fatiga, dolor articular, dolor torácico, tos, disgeusia o anosmia. Y entre los menos frecuentes: insomnio, fiebre de bajo grado, dificultades neurocognitivas, cefalea, mialgias y debilidad, síntomas gastrointestinales, prurito y depresión.134,137-141 Cuadro 15
Cuadro 15 Secuelas de COVID-19134,137-141
|
Pulmonar Persistencia de enfermedad pulmonar instersticial, neumonía-cavitación, infarto pulmonar, disminución de la función pulmonar, complicaciones de la intubación-ventilación |
Cardiovascular Infarto de miocardio, pericarditis, miocarditis, arritmias, insuficiencia cardiaca, tromboembolismo venoso, choque cardiogénico, síndrome de Takotsubo. |
Neurológico-neuropsíquico
Evento vascular cerebral, alteraciones cognitivas, epilepsia, encefalopatía, mielitis, ataxia, síndrome de encefalopatía atípica reversible postparto, miopatía-neuropatía, síndrome de Guillain-Barret, desmielinización neuronal, deterioro cognitivo, psicosis, depresión, ansiedad, síndrome de estrés postraumático |
|
Hematológicas Anemia, tromboembolismo, estado hipercoagulable, CID, endotelitis |
Reumatológico Síndrome postviral similar al síndrome de fatiga crónica, psoriasis, lupus eritematoso sistémico, vasculitis, dermatomiositis, enfermedad de Kawazaki, artritis reumatoide |
Endocrino Deterioro del control glucémico en pacientes con diabetes, osteoporosis por inmovilización prolongada, disfunción tiroidea |
|
Síndrome postraumático
Disnea, ansiedad, depresión, dolor prolongado, disminución de la función física y de la calidad de vida. |
Otros Disfunción hepática o renal, Pérdida de la audición Úlceras por presión, eritema cutáneo |
Gastrointestinal Malnutrición por vómito-diarrea-disnea-pérdida del apetito, reflujo gastroesofágico, estreñimiento, cambios en la flora intestinal, disbiosis de la microbiota, disfunción de los metabolitos intestinales |
Por lo anterior se recomienda realizar tomografía de tórax y pruebas de funcionamiento pulmonar a las 12 semanas de la enfermedad aguda en pacientes que ameritaron hospitalización por complicaciones respiratorias.142 El seguimiento y abordaje dependerá de las necesidades individuales de la paciente considerando las comorbilidades persistentes.143 En pacientes hospitalizadas por COVID-19 severo se recomienda retomar las actividades cotidianas y el ejercicio de leve a moderado (si las condiciones obstétricas lo permiten) en las primeras 6 a 8 semanas del egreso hospitalario. Valorar el estado físico y emocional a las 6-8 semanas del egreso hospitalario y evaluar la función respiratoria y capacidad de ejercicio. Estas pacientes deben enviarse a rehabilitación pulmonar y general y fortalecimiento muscular, valoración nutricional y psicológica.144 Las pacientes deben recibir retroalimentación para su proceso de rehabilitación y estrategias para alcanzar la recuperación.137
ANTICONCEPCIÓN EN MUJERES PUÉRPERAS CON ANTECEDENTE DE COVID RESUELTO
La pandemia de SARS-CoV-2 ha impactado tanto en la elección como en el alcance de los métodos anticonceptivos.
Debido a la necesidad de los trabajadores de salud en las primeras líneas de atención, el miedo a la exposición al virus, la distancia social y las restricciones actuales, se ha roto la accesibilidad a los servicios de salud que no sean considerados vitales.145
Debido al cambio en el modelo de atención prenatal se ha demostrado que las pacientes finalizan el embarazo sin tener un plan anticonceptivo para el futuro inmediato y a largo plazo.146
En cuanto a la anticoncepción posparto, la consejería debe efectuarse durante el control prenatal o antes del egreso hospitalario, con ello se reduce la necesidad de visitas al servicio de salud. Los dispositivos intrauterinos son una opción viable por su efectividad y larga duración.147
En cuanto a la elección del método anticonceptivo para pacientes con infección por COVID-19 y que se encuentran en período de puerperio, sin importar la vía de finalización del embarazo, debe considerarse la asociación entre tromboembolismo, embarazo y puerperio, y la coexistente entre COVID-19 y tromboembolismo, por lo que se recomienda optar por un método sin hormonales o de progestina sola, siempre considerando los criterios de elegibilidad para cada paciente.148
ANTICONCEPCIÓN EN TIEMPOS DE COVID-19
Se calculó que a nivel global una reducción del 10% en los servicios de salud sexual y reproductiva debido a la pandemia implicará un aumento, promedio, de 15.4 millones de embarazos no planeados, 3.3 millones de abortos no seguros y 28 mil muertes maternas.147
En cuanto a la anticoncepción, se está optando por el modelo de autocuidado, el cual es definido por la OMS como “la habilidad de los individuos, familias y comunidades de promover y mantener la salud, prevenir enfermedades, y afrontar la enfermedad y discapacidad con o sin el apoyo del personal de salud”. En el tema de salud sexual y reproductiva se incluye la autoadministración de condones, anticonceptivos orales, parches, anillo vaginal, inyecciones, entre otras. El autocuidado reconoce la vulnerabilidad de los sistemas de salud por la situación actual y por ello apela hacia la autonomía, el proveer información y recursos para empoderar a los individuos para el cuidado de su propia salud. 145
Es de suma importancia continuar con la consejería en temas de salud sexual y reproductiva sobre todo en tiempos de pandemia, ya que se ha visto una repercusión significativa debida a la enfermedad por COVID durante el embarazo, así como el impacto económico que ha propiciado en la sociedad. 147
Para brindar consejería se sugiere dividir según las necesidades de cada mujer según:
A. Requiere visita al centro de salud
Por la pandemia se han suspendido las visitas de prevención a la salud y consejería de anticoncepción. Los centros de atención deben implementar una modalidad de telemedicina donde se pueda:
Brindar opciones de anticoncepción, señalar el riesgo del embarazo no planeado y conocer el deseo de inicio de paridad.
Orientar acerca de los posibles síntomas relacionados con el método, si requiere visita para exploración por sangrado transvaginal excesivo, dolor pélvico severo, revisión del DIU.
Orientación para la elección del método basada en la historia clínica
B. Sin necesidad de asistir al centro de salud
La telemedicina permite la orientación desde una zona remota sin necesidad de acudir al centro de salud, así mismo es de utilidad para tener mayor cobertura en sitios marginados y de difícil acceso.
Consulta por telemedicina para el inicio de un método anticonceptivo y su continuidad:
Calcular riesgo de embarazo: Se recomienda el realizar una historia clínica completa, siempre considerando la fecha de última menstruación, prueba de embarazo en orina a todas las pacientes en su hogar. Para las pacientes que tengan la seguridad de no estar embarazadas se puede iniciar el anticonceptivo de elección de forma inmediata. Las que no tengan la seguridad de no estar embarazadas se puede solicitar además de la prueba de embarazo en sangre, un ultrasonido pélvico.
Provisión de anticonceptivo de emergencia: Con acetato de ulipristal, levonorgestrel, recordar el tiempo ideal sobre la efectividad de estos métodos, siendo el de mayor ventana la colocación del DIU de cobre.
-
Prescripción de pastillas anticonceptivas, anillo vaginal, parche transdérmico: Basado en la historia clínica de cada paciente, búsqueda de contraindicaciones y uso de otros medicamentos. Se sugiere prescribir el uso del método elegido durante un año. Para los métodos que contengan estrógenos (anticonceptivos orales combinados, anillo vaginal, parche transdérmico) se recomienda la medición de la presión arterial antes de su inicio y anualmente durante su mantenimiento. Durante la pandemia SARS CoV-2 no se recomienda limitar el uso de métodos que contengan estrógenos si es que son elegibles para dichos métodos, excepto si tienen cifras de tensión arterial (TA) alteradas. Para dichas pacientes recomendamos lo siguiente:
Revisar las cifras de la tensión arterial en el domicilio si tiene el equipo o en una farmacia que cuente con ese servicio y que informe al médico estos valores.
Si la mujer no tiene acceso a una revisión de la tensión arterial, y no tiene antecedente confirmado de elevación de la tensión arterial, se puede iniciar, siempre informando los riesgos asociados con hipertensión y uso de métodos con estrógenos como infarto cerebral, infarto al miocardio, y recomendar la vigilancia periódica de la tensión arterial con su médico.
Consejería previa a la colocación o retiro de un DIU o implante: De forma inicial la telemedicina puede ser útil para reconocer contraindicaciones en el método, alternativas de métodos, y hablar sobre el consentimiento informado. Este paso previo confirma que realmente la mujer es candidata y si requiere ir a una visita.
Evaluación de efectos secundarios de los anticonceptivos: Las mujeres con síntomas debidos a cólicos provocados por el DIU, sangrado uterino abundante secundario a los hormonales, pueden ser atendidas mediante telemedicina si no hay sospecha de embarazo. Las pacientes con riesgo de embarazo por síntomas o cambios en el patrón de sangrado deben hacerse una prueba casera de embarazo. Si no hay sospecha de embarazo se puede emitir una receta para el tratamiento.
C. Procedimientos para visita al centro de salud incluyendo colocación de DIU e implante
Algunos anticonceptivos requieren intervenciones médicas, por ello los proveedores de salud deberán usar todo el equipo y medidas de protección.
Las siguientes son situaciones que requieren visita presencial:
Iniciación de anticoncepción a base de DIU o implante: Se recomienda una cita previa mediante telemedicina para agilizar la colocación del método y que la mujer y el personal de salud estén lo menos expuestos posible.
Ante la sospecha de expulsión del DIU o un implante no palpable considerar la anticoncepción de emergencia y proponer a la paciente otro método: preservativo o pastillas anticonceptivas hasta poder realizar la cita presencial. Los síntomas agudos requieren visita inmediata. Los síntomas leves, que su atención puede esperar (como no palpar el implante, expulsión de DIU) pueden atenderse posteriormente solo si no hay preocupación por embarazo, y la paciente accede a utilizar otro método.
Síntomas sugestivos de embarazo ectópico: Una paciente con DIU in situ con prueba de embarazo positiva que se acompañe de dolor pélvico, sangrado transvaginal, deberá asistir a una visita presencial inmediata para exploración física, laboratorios y ultrasonido si lo amerita.
Pacientes que deseen medroxiprogesterona de depósito (AMPD): La administración de AMPD subcutánea puede ser administrada por la paciente si hay disponible. Si es candidata a AMPD intramuscular, valorar inicialmente por telemedicina para consejería, consentimiento. Los intervalos son de 15 semanas, por lo que no se puede posponer la colocación.
D. Procedimientos para retiro o reinserción de DIU o implante:
Tener oportunidad para el retiro de estos métodos se debe mantener durante la pandemia con el fin de respetar la autonomía de la mujer. Sin embargo, vale la pena tener una consulta previa por telemedicina para evitar exposición y múltiples visitas al centro de salud con el fin de interrogar motivos del retiro y brindar alternativas de métodos. Se sugiere el siguiente abordaje:
Pacientes que no deseen seguir con el método y quieran el retiro inmediato, otorgar una cita con horario destinado.
Para pacientes que soliciten un retiro y reinserción, brindar información sobre extensión del uso del anticonceptivo: (DIU de cobre:12 años, DIU de levonorgestrel-52: 7 años, implante con etonogestrel: 5 años).
Si la paciente desea retiro del DIU o implante por deseo de embarazo, se debe informar sobre los riesgos y efectos del COVID-19 en el embarazo. Esta no es una razón para no retirar el método si así la paciente lo desea, y se debe iniciar suplementación con ácido fólico.
E. Anticoncepción irreversible y otros métodos que requieran quirófano:
En el contexto de paciente fuera del posparto:
Valorar las condiciones regionales e institucionales en cuanto al estatus de la pandemia:
Prevalencia del COVID-19
Disponibilidad de equipos de protección
Estrategias institucionales para priorizar procedimientos quirúrgicos
Accesibilidad a otros métodos, barreras legales en caso de solicitar interrupción del embarazo
Brindar métodos con buena efectividad, como los de larga duración, para evitar exposición del personal de salud y de la paciente a un ambiente con COVID-19.
En el contexto de paciente en el posparto:
Pacientes que deseen un método irreversible en el puerperio, se recomienda realizar la oclusión tubaria bilateral (OTB) considerando los aspectos regionales e institucionales mencionados, sin importar la forma de nacimiento, rara vez la paciente requiere intubación. Si se realiza la OTB se contribuye a menores visitas en cuestión de anticoncepción.
F. Anticoncepción en pacientes con sospecha o confirmación de infección por COVID-19
Todas las pacientes se deben interrogar para detectar síntomas compatibles con COVID-19 antes de la visita al centro de salud. A su llegada al centro de salud, se deberá volver a interrogar. Pacientes asintomáticas deberán usar cubrebocas durante la cita.
Si una paciente tiene síntomas de tos y fiebre deberán indicársele los estudios pertinentes y posponer la cita hasta tener los resultados.
Las visitas que no sean de urgencia, como el reemplazo de implante o DIU, deberán posponerse. Considerar la indicación de otro método de corta duración (pastillas, parche, anillo, preservativo) hasta que la paciente mejore.
Recomendar que busque atención relacionada relacionada con el cuadro y el aislamiento.
Solo deberá atenderse de forma urgente si la paciente tiene síntomas de dolor pélvico intenso, hemorragia vaginal, y alta sospecha de embarazo ectópico. La visita se efectuará conforme a los protocolos de cada institución: triage, sala de urgencias.
G. Consideraciones de métodos en pacientes con infección activa por COVID-19
Según se asienta en varios reportes, la infección severa por COVID-19 parece estar muy relacionada con tromboembolismo arterial y venoso.
La incidencia de tromboembolismo en pacientes en edad reproductiva y COVID-19 sintomático y asintomático se desconoce lo mismo que si los anticonceptivos hormonales combinados tienen repercusión en la incidencia. En virtud de la asociación establecida entre el uso de hormonales combinados y tromboembolismo, es importante considerar que la infección por COVID-19 puede incrementar, teóricamente, dicho riesgo.
Las pacientes que opten por los hormonales combinados deben recibir la información más amplia posible de sus riesgos y las otras opciones existentes. Se sugiere proceder de la siguiente manera:
Pacientes hospitalizadas por complicaciones asociadas con la COVID-19: Se recomienda descontinuar los anticonceptivos hormonales. Su reinicio podrá hacerse después de la recuperación completa de la enfermedad; sin embargo, deberán considerarse las comorbilidades, inmovilización y secuelas que podrán afectar posteriormente los criterios de elegibilidad para la indicación de hormonales. Las progestinas solas y métodos no hormonales podrán continuarse porque no confieren riesgo tromboembólico adicional.
Pacientes asintomáticas o con síntomas leves con infección por COVID-19 confirmada: La continuación de hormonales en este grupo puede considerarse viable. La paciente deberá recibir información del riesgo teórico de tromboembolismo y, en conjunto, tomar la decisión de continuar o no. Si la paciente desea descontinuar su uso, deberá proponérsele otro método con progestinas solas o algún otro método sin hormonales. 148
En cuanto a las vacunas contra COVID-19 no se ha demostrado que alguna de ellas afecte de alguna forma la fertilidad. 147











 nueva página del texto (beta)
nueva página del texto (beta)