ANTECEDENTES
Los tumores secretores de andrógenos son relevantes por sus síntomas y la diversidad de su causa. Pueden originarse en los ovarios o en las glándulas adrenales.1 Los tumores virilizantes de ovario constituyen menos del 0.2% de los casos de hiperandrogenismo2 y el 1% de los tumores funcionales del ovario. 3 Si bien la historia clínica y las concentraciones basales de andrógenos incrementan la sospecha clínica, la localización de estos tumores requiere otros métodos diagnósticos, incluida la evaluación dinámica de los ovarios y de las glándulas suprarrenales. 4
Los tumores virilizantes del ovario se originan de las células pluripotenciales del estroma ovárico, secretan 17-hidroxiprogesterona, testosterona y androstenediona, que desencadenan hiperandrogenismo. 3
Los tumores del ovario concomitantes con hiperandrogenismo incluyen la hipertecosis estromal ovárica, los tumores de células de Leydig, de células de Sertoli, de células esteroides y los tecomas de ovario. 5
La hipertecosis estromal ovárica es poco común, en la bibliografía solo se encuentran algunos reportes de casos y pequeñas series de estos. 6 Es más frecuentemente en pacientes de 60 a 80 años, en quienes se puede manifestar como hiperandrogenismo, carcinoma endometrial, obesidad, hipertensión e intolerancia a la glucosa. 7 De acuerdo con la clasificación de tumores ginecológicos del 2014 de la OMS, se ha encontrado en un tercio de los estudios de autopsia en mujeres mayores de 55 años. 8 En mujeres jóvenes los síntomas originados por este tipo de tumores suelen iniciarse rápidamente y manifestarse con hirsutismo, alopecia androgénica, acné, disfunción ovulatoria y en casos muy extremos en una severa masculinización. 9
El objetivo de este artículo es reportar un caso clínico de hipertecosis estromal ovárica, en una mujer joven con síntomas de androgenización y sangrado uterino anormal, y hacer una revisión de la literatura de esta patología.
Se efectuó una revisión detallada de la bibliografía del tema en las bases de datos de: Medline, PubMed, Scielo, Embase, Ovid-Hinari con los términos MeSH: theca cells, hyperandrogenism, hirsutism, virilis, sin límite de tiempo porque es poco frecuente. Se seleccionaron las publicaciones más directamente dirigidas al diagnóstico y tratamiento de la hipertecosis estromal ovárica.
CASO CLÍNICO
Paciente de 20 años, con un cuadro clínico de tres meses de evolución caracterizado por: sangrado vaginal continuo, escaso e hirsutismo. Antecedentes: menarquia a los 12 años y ciclos irregulares e infrecuentes. Sin más antecedentes médicos ni familiares relevantes.
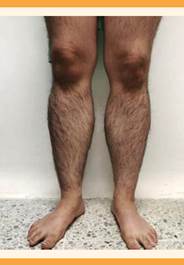
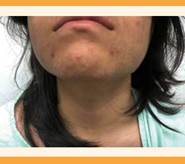
Estatura: 157 cm, peso: 65 kg (IMC: 26.3 kg/m2), tensión arterial: 110-90 mmHg, hirsutismo (brazos y piernas e implantación androide del vello púbico; vello facial grueso y oscuro en la zona del bigote y barba, y también en el abdomen (Figuras 1 a 3) correspondiente a una puntuación de 22-36 de la Escala de Ferriman-Gallway), acné y signos de androgenización: clitoromegalia y engrosamiento de la voz.
La ecografía pélvica reportó: ovario derecho aumentado de tamaño (63 x 30 x 42 mm, volumen de 42 cc), una lesión sólida en su interior de 29 x 27 mm; endometrio de 3 mm; ovario izquierdo y útero de características normales. Los reportes del laboratorio se resumen en el Cuadro 1. De los estudios de laboratorio llamaron la atención las altas concentraciones de testosterona libre y total y de la 17-hidroxiprogesterona. El resto de las pruebas hormonales, incluidas las concentraciones de cortisol sérico se reportaron normales; marcadores tumorales negativos.
Cuadro 1 Estudios de laboratorio en los que se fundamentó el diagnóstico
| Pruebas de laboratorio | Resultado | Rangos normales |
| 17-hidroxiprogesterona | 8.04 ng/mL | 17-hidroxiprogesterona basal: 4.0 ng/mL (normal fase folicular 0.2-2.6 ng/mL, fase lútea 0.3-4 ng/mL). |
| Testosterona libre | 10.58 pg/mL | 0.2-2.8 pg/mL |
| Hormona estimulante de tiroides | 1.85 mUI/L | 0.28-6.82 mUI/L |
| Cortisol | 8.7 mcg/dL | 5-23 mcg/dL |
| Prolactina | 6.21 ng/mL | 6.21 ng/mL |
| Testosterona total | 2.7 ng/mL | 0.2-0.95 ng/mL |
| Alfafetoproteína | 1.27 UI/mL | 0-8.5 UI/mL |
| Antígeno carcinoembrionario | 1.27 ng/mL | 0-5 ng/mL |
| Antígeno de cáncer 125 | 18.6 U/mL | 0-46 U/mL |
Con base en los hallazgos clínicos y paraclínicos se sospechó un tumor androgenizante del ovario derecho e hipertensión crónica secundaria. Se hicieron los estudios complementarios que descartaron el origen suprarrenal, que se corroboró con una TAC abdominopélvica. Con base en lo anterior se decidió la salpingo-oforectomia derecha, que transcurrió sin complicaciones. Hallazgos operatorios: ovario derecho aumentado de tamaño (Figura 4), con 200 cc de líquido cetrino en el fondo de saco. Figura 5
La evaluación histopatológica reveló la existencia de: parénquima ovárico con extensos nidos de células estromales luteinizadas, con citoplasma claro, rico en lípidos, sobre un fondo de hiperplasia estromal que reemplazaba, casi en su totalidad, al estroma ovárico. Puesto que no hubo evidencia de mitosis ni de atipia celular se descartó la malignidad y se estableció el diagnóstico de tumor de ovario compatible con hipertecosis estromal. Figura 6
DISCUSIÓN
La hipertecosis ovárica no es una neoplasia, sino la existencia de células luteinizadas que se dispersan individualmente en pequeños nidos o nódulos a través de un estroma ovárico hiperplásico, que da como consecuencia hiperandrogenismo. 10 Por lo general, se encuentra en mujeres posmenopáusicas y rara vez se observa en mujeres jóvenes. 11 La paciente del caso es una mujer joven, con un inicio rápido de los signos de androgenización, documentados claramente en el examen físico.
Desde el punto de vista clínico, en los casos más severos hay virilización que genera cuadros de hirsutismo debidos al incremento en la producción de andrógenos. 12 Algunos investigadores sugieren que el incremento en la secreción de andrógenos en la hipertecosis es consecuencia de los defectos enzimáticos. 13 En otro ensayo se ha demostrado que el hiperandrogenismo es más la consecuencia del aumento de volumen del tejido estromal que de una función bioquímica anormal del ovario. 14 En la mayoría de las mujeres con exceso de andrógenos se establece un diagnóstico subyacente de síndrome de ovario poliquístico. 15
Las características típicas de la hipertecosis son el hirsutismo y el acné. En casos más severos hay signos de acentuación de la voz, clitoromegalia y calvicie con patrón masculino. 16 Los casos de hipertecosis estromal más floridos se registran en mujeres en edad reproductiva y son más leves en quienes se encuentran en la posmenopausia. 17 En la paciente del caso se documentaron: androgenización severa y clitoromegalia.
La hipertecosis se caracteriza por hiperinsulinemia y resistencia a la insulina; 15 por tanto, con aumento del riesgo de diabetes mellitus tipo 2 y de enfermedades cardiovasculares. 16 Por estas características se menciona que la hipertecosis es la variante más grave del síndrome de ovario poliquístico en virtud del parecido de los síntomas. 18
Para poder establecer el diagnóstico de hipertecosis debe iniciarse por la debida integración de la historia clínica y un examen físico completo en busca de hallazgos de virilización, acné, obesidad abdominal, pérdida de cabello, alteración de la frecuencia y regularidad del ciclo menstrual e infertilidad durante los años reproductivos. 15 El grado de virilización se relaciona con la producción de testosterona, aunque hay pacientes con pocos signos de virilización. 19
En relación con las pruebas de laboratorio, la testosterona y dehidroepiandrosterona (DHEA-S) son las primeras hormonas que deben cuantificarse. 20 Las concentraciones de testosterona total se encontraron igual de altas que en los tumores secretores de andrógenos (200 ng/dL); 15 la mayor parte de las veces son superiores al límite de normalidad (30-40 ng/dL) en mujeres premenopáusicas y 20-30 ng/dL en las postmenopáusicas21 y son superiores a las concentraciones observadas en el síndrome de ovario poliquístico. 22
Si las concentraciones de testosterona son mayores de 150 ng/dL y las de dehidroepiandrosterona son muy altas deben practicarse estudios de las glándulas suprarrenales con una tomografía computarizada o imágenes de resonancia magnética. 23,24 En la paciente del caso se encontraron concentraciones altas de testosterona libre, testosterona total y 17-hidroxiprogesterona y normales de cortisol sérico.
El examen de ultrasonido es el procedimiento de elección para el estudio de los ovarios en la evaluación de hiperandrogenismo; permite diferenciar un ovario de características multiquísticas de la existencia de tumores. Lo mejor es efectuarlo con una combinación de ecografía transabdominal y ultrasonografía transvaginal. 25 La resonancia magnética puede resultar útil para definir otras enfermedades: tumores suprarrenales y excluir las malignas en mujeres con concentraciones muy elevadas de testosterona. 15
Las características ecográficas de la hipertecosis son variables. Se han encontrado desde ovarios normales, ovarios ligeramente aumentados de tamaño hasta un pequeño porcentaje de mujeres con un patrón de ovario multiquístico coexistente. 26 Esto hace que el diagnóstico ecográfico de la hipertecosis sea complejo, aunque puede sospecharse al encontrar un aumento en el volumen del ovario sin incremento en la cantidad de folículos, diferente al síndrome de ovario poliquístico en donde se esperarían numerosos folículos pequeños. 26 En pacientes con hipertecosis también puede haber mayor frecuencia de fibrotecomas ováricos. 26En la paciente del caso se encontró un aumento importante en el volumen ovárico debido a un área sólida en su interior.
Los hallazgos macroscópicos del ovario con hipertecosis grave muestran una expansión bilateral del estroma ovárico, la superficie cortada suele ser más sólida, firme y homogénea, en algunos casos se suelen observar quistes. 6 En mujeres postmenopáusicas el aumento en el tamaño de los ovarios también es frecuente.
El examen microscópico puede encontrarse en expansión del compartimento estromal por la proliferación de células estromales ováricas intercaladas con una cantidad variable de células luteinizadas de la teca. 27 Las células de la teca luteinizadas pueden distribuirse escasamente en pequeños agregados, o en unos más prominentes que van desde grados leves de expansión estromal en una porción del ovario (hipertecosis focal) hasta una expansión más extensa del componente estromal (hipertecosis difusa), o nódulos confluentes de células estromales que se unen entre sí (hipertecosis nodular). 26
El tratamiento de la hipertecosis incluye la prescripción de fármacos para la supresión hormonal y el quirúrgico, como la resección en cuña o la ooforectomía. 28 En relación con este último y debido a las características sólidas del tumor, la laparotomía se ha convertido en el procedimiento más practicado tanto para la estadificación quirúrgica completa como para la cirugía preservadora de la fertilidad. 29 La laparoscopia se ha convertido en una nueva opción terapéutica debido a que es un método de mínimo acceso, con recuperación más rápida, respecto de la laparotomía. 29
Los agonistas de la hormona liberadora de gonadotrofina, como tratamiento a largo plazo en pacientes postmenopáusicas con múltiples comorbilidades e incremento del riesgo por la cirugía, están indicados cuando se ha descartado la malignidad. 30 En la paciente del caso, por tratarse de un tumor sólido y con estudios de extensión que descartaron el tumor de origen suprarrenal y la malignidad, se decidió la intervención quirúrgica por vía laparoscópica. Posterior a ésta es indispensable el seguimiento, que incluye la cuantificación de las concentraciones de hormonas sexuales, sobre todo cuando las concentraciones son elevadas antes de la cirugía. 31
CONCLUSIÓN
La hipertecosis estromal ovárica pertenece al grupo de tumores androgenizantes del ovario. Si bien es poco frecuente debe sospecharse ante la aparición de signos de virilización, alteración en la regularidad y frecuencia del ciclo menstrual, con concentraciones elevadas de andrógenos y una lesión tumoral ovárica en el estudio ecográfico. Hay unanimidad de criterios en cuanto a que en estos casos el tratamiento indicado es la resección quirúrgica del ovario afectado y ante su bajo potencial de malignidad puede considerarse el acceso laparoscópico.











 text new page (beta)
text new page (beta)