ANTECEDENTES
El acrónimo DRESS (Drug Reaction with Eosinophilia and Systemic Symptoms) lo acuñaron Bocquet y su grupo en 1966 para referirse a una reacción adversa a fármacos, concomitante con eosinofilia y síntomas sistémicos.1,2 Esta reacción es rara, grave y multiorgánica; en la mayoría de los casos suele asociarse con agentes antiepilépticos, carbamacepina (27%), fenobarbital (6%) y fenitoína (4%), alopurinol (11%), dapsona y sulfonamidas. 3,4
La incidencia estimada de síndrome de DRESS es de 1 a 1000 casos por cada 10,000 exposiciones farmacológicas o, bien, 0.4 casos por cada millón de habitantes en la población general. 4 La tasa de mortalidad es de 30%. El síndrome de DRESS se diferencia de otras reacciones farmacológicas en su inicio tardío, repercusión sistémica y curso prolongado. 3,5 Las manifestaciones graves se inician entre la segunda y sexta semanas de la administración del fármaco responsable, y pueden persistir o agravarse incluso después de suspender el medicamento. 6,7
CASO CLÍNICO
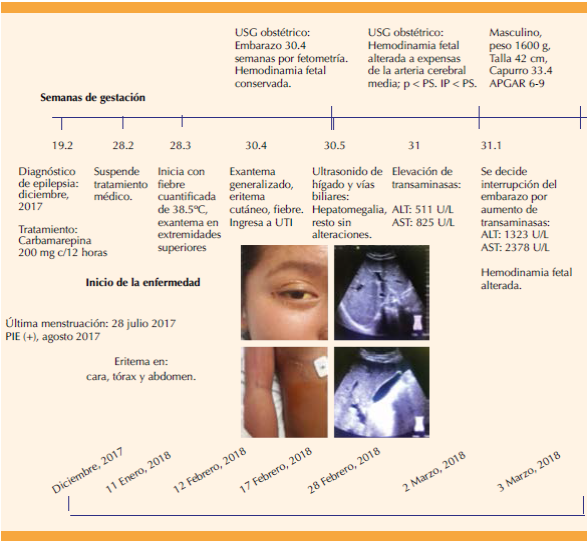
Paciente de 17 años, primigesta, sin antecedentes heredofamiliares de importancia para el padecimiento actual, diagnosticada con epilepsia del lóbulo frontal tres meses previos a su ingreso al servicio de Neurología del Hospital General de México, en tratamiento con 200 mg cada 12 h de carbamacepina por vía oral. Después de dos meses de haber iniciado el tratamiento le apareció exantema en las extremidades superiores, prurito y fiebre de 38.5 °C en dos ocasiones. La paciente suspendió el tratamiento por decisión propia. Acudió a otra unidad hospitalaria en donde le prescribieron antihistamínicos y paracetamol, sin mejoría del cuadro clínico. Se agregaron: eritema generalizado, placas hiperqueratósicas en la cara y el tronco, estomatitis y otitis media supurativa, por lo que fue enviada al servicio de Ginecología y Obstetricia, donde ingresó con 30 semanas y 4 días de embarazo, establecido por la fecha de la última menstruación; con feto único, vivo, sin trabajo de parto; dermatosis en estudio, con posible diagnóstico de síndrome de DRESS.
Los estudios de laboratorio reportaron leucocitosis, eosinofilia y altas concentraciones de transaminasas (Cuadro 1). En el tratamiento multidisciplinario participaron: neurólogo, dermatólogo, oftalmólogo y un especialista en Medicina Materno-fetal. La paciente registró 5 puntos en la escala RegisScar8 (Cuadro 2). Ante la falta de respuesta al tratamiento se cambió a 1 g cada 12 h de levetiracetam y 50 mg al día de prednisona, ambos por vía oral (dosis de 1 mg/kg/día) y emoliente tópico. La paciente continuó con elevada concentración de transaminasas y eosinofilia. Se estableció el diagnóstico de síndrome de DRESS. El ultrasonido obstétrico no mostró alteraciones, pero el de hígado y vía biliar reportó hepatomegalia, sin datos ecográficos de lesión focal ni difusa, y vesícula biliar normal. Permaneció en tratamiento con prednisona y se agregó ácido ursodesoxicólico (15 mg/kg/día). Ante la persistencia de la alta concentración de transaminasas y la alteración de la hemodinamia fetal (Figura 1) se decidió la interrupción del embarazo por cesárea, con la finalidad de mejorar el pronóstico de la madre y el feto. La atención obstétrica trascurrió sin complicaciones; nació un varón de 1600 g, talla 42 cm, Apgar 6 y 9 y Capurro de 33.4 semanas. En el puerperio continuó en tratamiento con el corticosteroide establecido y permaneció en vigilancia en el servicio de Medicina Materno-Fetal. La paciente evolucionó favorablemente. Se dio de alta del hospital dos semanas posteriores a su ingreso, con disminución de la concentración de transaminasas (Cuadro 1). Una semana después acudió a seguimiento en la consulta externa y no se reportaron complicaciones. En el puerperio tardío no se observaron alteraciones aparentes. El recién nacido se dio de alta del hospital.
Cuadro 1 Exámenes de laboratorio
|
Exámenes de laboratorio |
Ingreso | Día 1 | Día 2 | Día 3 | Día 4 | Día 8 | Día 9 | Día 10 | Egreso |
| Embarazo |
Puerperio inmediato |
Puerperio mediato |
|||||||
| Leucocitos | 15.3 x 103/µL | 11.9 x 103/µL | 11.3 x 103µL | 9.7 x 103/µL | 9.5 x 103/µL | 13.3 x 103/µL | 12.1 x 103/µL | 8.4 x 103/µL | 8.8 x 103/µL |
| Eosinófilos | 4.6% | 1% | 0.6% | 0.4% | 0.5% | - | 6% | 6.6% | 14.2% |
| Neutrófilos | 61.8% | 64.8% | 61.5% | 70% | 67.5% | 70.3% | 55.7 % | 53.2% | 49.5% |
| Hemoglobina | 10.9 g/dL | 10.6 g/dL | 10.1 g/dL | 9.4 g/dL | 10.2 g/dL | 9.4 g/dL | 8.8 g/dL | 8.9 g/dL | 9.1 g/dL |
| Plaquetas | 364 x 103/µL | 324 x 103/µL | 305 x 103/µL | 251 x 103/µL | 230 x 103/µL | 212 x 103/µL | 244 x 103/µL | 429 x 103/µL | 428 x 103/µL |
| Tiempo de protrombina |
10.8 seg. | 11.8 seg. | 11.3 seg. | 13.2 seg. | 12.5 seg. | 14.7 seg. | 12.2 seg. | 12.4 seg. | 12.5 seg. |
| Tiempo de trombina |
14.1 seg. | 16 seg. | 15.1 seg. | 21.9 seg. | 21.2 seg. | 23.9 seg. | 16.4 seg. | 20.6 seg. | 21.2 seg. |
| Tiempo parcial de tromboplastina activada |
21.3 seg. | 24.4 seg. | 22.2 seg. | 26.8 seg. | 24.3 seg. | 28.9 seg. | 25.4 seg. | 24.6 seg. | 23.6 seg. |
| Fibrinógeno | 396 mg/dL | 361 mg/dL | 401 mg/dL | 251 mg/dL | 231 mg/dL | 280 mg/dL | 378 mg/dL | 222 mg/dL | 235 mg/dL |
| Glucosa | 83 mg/dL | 97 mg/dL | 112 mg/dL | 88 mg/dL | 82 mg/dL | 91 mg/dL | 77 mg/dL | 124 mg/dL | 88 mg/dL |
| Urea | 16.2 mg/dL | 12.9 mg/dL | 11.3 mg/dL | 8.9 mg/dL | 11.3 mg/dL | 21.5 mg/dL | 14 mg/dL | 20 mg/dL | 35.4 mg/dL |
| Creatinina | 0.6 mg/dL | 0.5 mg/dL | 0.3 mg/dL | 0.4 mg/dL | 0.4 mg/dL | 0.4 mg/dL | 0.4 mg/dL | 0.4 mg/dL | 0.4 mg/dL |
| Bilirrubina directa |
1.5 mg/dL | 2.7 mg/dL | 4.3 mg/dL | 4.5 mg/dL | 1.5 mg/dL | 5.6 mg/dL | 4.9 mg/dL | 1.9mg/dL | 1.3 mg/dL |
| Bilirrubina indirecta |
0.79 mg/dL | 1.23mg/dL | 1.62 mg/dL | 2.04 mg/dL | 0.79 mg/dL | 2.5 mg/dL | 2.55 mg/dL | 1.71 mg/dL | 1.27 mg/dL |
| Alanina aminotransferasa (ALT) |
96 U/L | 203 U/L | 370 U/L | 457 U/L | 511 U/L | 1323 U/L | 944 U/L | 254 U/L | 158 U/L |
| Aspartato aminotransferasa (AST) |
198 U/L | 467 U/L | 684 U/L | 781 U/L | 825 U/L | 2378 U/L | 679 U/L | 58 U/L | 47 U/L |
| Deshidrogenasa láctica |
255 U/L | 572 U/L | 589 U/L | 474 U/L | 489 U/L | 1106 U/L | 397 U/L | 285 U/L | 310 U/L |
| Procalcitonina | 1.450 ng/mL | - | - | 1.670 ng/mL | 2.240 ng/mL | 2.430 mg/dL | - | - | 0.30 ng/mL |
Cuadro 2 Criterios de tres diferentes consensos para establecer el diagnóstico de síndrome de DRESS, según los hallazgos clínicos y de laboratorio de la paciente8
| Bocquet y colaboradores1 | RegiSCAR | J-SCAR | |||
| Criterio | Paciente | Criterio | Paciente | Criterio | Paciente |
| Erupción cutánea relacionada con fármacos* |
Erupción cutánea relacionada con fármacos. | Erupción cutánea aguda.* | Erupción cutánea aguda* que inicia en la cara, el tronco y el abdomen. |
Erupción maculopapular durante 3 semanas o más después de iniciar el tratamiento con algún fármaco. |
Exantema en la cara, el tronco y el abdomen dos meses posteriores a la ingestión de carbamacepina. |
| Anormalidades hematológicas:* concentración de eosinófilos mayor de 1.5 x109/L; linfocitos atípicos. |
Leucocitosis 15.3 x 103/µL. Neutrófilos 61.8% Eosinófilos 4.3%. |
Hospitalización. | Hospitalización. | Síntomas clínicos persistentes después de suspender el fármaco causal. |
Suspensión del tratamiento, pero continúa con exantema, eritema. |
| Afectacion sistémica:* adenopatías de 2 cm de diámetro; hepatitis con elevación de transaminasas dos veces de lo normal; nefritis intersticial; neumonitis intersticial; miocarditis. |
Hepatitis con elevación de transaminasas. Bilirrubina directa 5.6 mg/dL. Bilirrubina indirecta 2.5 mg/dL. Bilirrubina total 8.1 mg/dL. ALT* 1323 U/L. AST** 2378 U/L. |
Sospecha de reacción causada por fármacos.* Fiebre mayor de 38 ºC.** Crecimiento de ganglios linfáticos en más de dos sitios.** Afectación de dos o más órganos.** Anormalidades hematológicas:** linfocitosis o linfopenia, eosinofilia; trombocitopenia. |
Antecedente de ingestión de carbamacepina. Fiebre mayor de 38.5 ºC.Bilirrubina directa 5.6 mg/dL. Bilirrubina indirecta 2.5 mg/dL. Bilirrubina total 8.1 mg/dL. ALT 1323 U/L. AST 2378U/L. Leucitosis 15.3 x 103/µL. Neutrófilos 61.8%. Eosinófilos 4.3%. |
Fiebre mayor de 38 ºC. Anormalidades hepáticas (ALT > 100/L) o afectación de otros órganos. Anormalidades leucocitarias: leucocitos (mayor de 11 x 109/L); linfocitos atípicos (mayor de 5%): eosinofilia (mayor de 1.5x109/L). Linfadenopatías. Reactivación del Herpes virus-6. |
Fiebre mayor de 38.5 ºC. Bilirrubina directa 5.6mg/dL. Bilirrubina indirecta 2.5 mg/dL. Bilirrubina total 8.1 mg/dL. ALT 1323 U/L. AST 2378 U/L. Leucitosis 15.3 x 103/µL. Neutroófilos 61.8%. Eosinófilos 4.3%. |
* Alanina aminotransferasa. ** Aspartato aminotransferasa
DISCUSIÓN
La edad promedio de las pacientes con síndrome de DRESS es de 40.7 ± 20.9 años, con una proporción de 53% en hombres y 47% en mujeres. 4
Entre los factores de riesgo se incluyen: sexo femenino, raza negra, cursar con embarazo o lactancia, antecedente de alcoholismo crónico, consumo de fármacos hepatotóxicos, antecedentes personales o familiares de síndrome de DRESS, inmunodeficiencias primarias o adquiridas, y neoplasias. Los factores de riesgo asociados en la paciente de este estudio fueron: género femenino y en curso del embarazo. El único antecedente relacionado con el fármaco fue la prescripción de carbamacepina.
La patogenia de la enfermedad no se conoce con exactitud, pero quizá intervienen factores inmunológicos, metabólicos e inflamatorios. Los mecanismos de acción planteados incluyen:
Asociación con reactivaciones virales: la inmunosupresión es un factor de riesgo frecuentemente reportado en el síndrome de DRESS. Alteración en las concentraciones de linfocitos B e inmunoglobulinas en suero (IgG, IgA e IgM) que demuestra supresión inmunitaria, que puede reactivar diferentes tipos de virus (herpes, VIH, Epstein-Barr y citomegalovirus). 4
Farmacogenética: las teorías más aceptadas comprenden la deficiencia genética de enzimas desintoxicantes que facilitan el almacenamiento de metabolitos de los fármacos que se enlazan con macromoléculas celulares y desencadenan la muerte celular o inducen una respuesta inmunitaria secundaria. Los medicamentos más estudiados que provocan el síndrome de DRESS son los anticonvulsivos; éstos se metabolizan por la citocromo P450 y desactivan la función de las enzimas epóxido hidroxilasa o glutatión transferasa, con la subsiguiente producción de metabolitos reactivos, que se modifican y enlazan con proteínas celulares para inducir una respuesta inmunitaria.6,8-11
El eritema maculopapular suele ser pruriginoso y evoluciona a eritrodermia con descamación. La cara, el tronco y las extremidades superiores son los primeros sitios afectados y, posteriormente, las extremidades inferiores. Existen, además, manifestaciones graves de inicio tardío entre la segunda y sexta semanas de la administración del fármaco responsable, y todos sus componentes pueden persistir o agravar el síndrome, incluso después de suspender el fármaco. 4,11
El diagnóstico es difícil de establecer debido a las alteraciones clínicas y de laboratorio. Hasta la fecha no existen criterios de referencia para establecer el diagnóstico de síndrome de DRESS. Se han organizado diferentes consensos para normar el establecimiento del diagnóstico, el primero fue el de Bocquet y colaboradores, y los más recientes son los del Comité Japonés de Investigación de Reacciones Adversas Cutáneas Severas (J-SCAR; del inglés, Japanese Research Committee on Severe Cutaneous Adverse Reaction) y el del grupo de Registro de Reacción Adversa Cutánea (RegiSCAR). Con base en estos, se hace una comparación con los diferentes consensos y datos encontrados en la paciente del caso. 8 Cuadro 2
El diagnóstico diferencial se establece con otro tipo de reacciones cutáneas inducidas por fármacos, por ejemplo: síndrome de Stevens-Johnson, necrólisis epidérmica tóxica, pustulosis exantemática aguda generalizada, pseudolinfoma inducido por medicamentos, lupus eritematoso agudo e infecciones virales (parvovirus B19 y 6). 6,9,12
El primer paso en el tratamiento del síndrome de DRESS consiste en suspender el medicamento implicado en la reacción adversa. El control de los síntomas se consigue con la administración de antipiréticos, corticosteroides tópicos y soporte hidroelectrolítico. Los esteroides sistémicos representan el tratamiento de elección en el síndrome de DRESS. La dosis mínima de inicio es de 1 mg/kg/día de prednisona, o su equivalente, con reducción gradual durante 3 a 6 meses después de la estabilización clínica, con la finalidad de evitar recidivas.6,9,11-14 Los pacientes que no consiguen una reacción satisfactoria o en quienes se exacerban los síntomas con corticosteroides por vía oral o tienen afectación visceral significativa pueden recibir un ciclo de metilprednisolona pulsada, por vía intravenosa, en dosis de 30 mg/kg, durante 3 días. 14
Los pacientes con síndrome de DRESS suelen tener una evolución benigna después de suspender el fármaco responsable de la alteración y curación con corticosteroides sistémicos. En promedio, la fiebre cede después de 2 días y el eritema en 10 y la normalización de las pruebas de función hepática en 33. 4
CONCLUSIONES
El sindrome de DRESS es una toxicodermia grave, de tipo idiosincrático, subdiagnosticada y potencialmente mortal. Es importante el diagnóstico y tratamiento oportunos, con la participación de un equipo multidisciplinario para que la curación sea completa y sin complicaciones. El embarazo es un estado de inmunosupresión no exento del trastorno, por lo que el médico debe estar informado, con la intención de proceder de manera oportuna y mejorar el pronóstico de la madre y su hijo.











 nueva página del texto (beta)
nueva página del texto (beta)