Casos clínicos
Enfermedad de Pompe: detección de portadores en un estado del sureste
de México: reporte de un caso
Pompe disease: carrier detection in a southeastern state of Mexico:
a case report
Margarita Josefina Hernández-Morales1
Ever Domínguez-Morales2
Leonardo Ulises García-Pérez3
Clara Magdalena Martínez-Hernández4
1 Residente de cuarto año de Ginecología y
Obstetricia. Hospital Regional de Alta Especialidad de la Mujer, Villahermosa,
Tabasco, México.
2 Adscrito al Departamento de Genética Médica.
Hospital Regional de Alta Especialidad de la Mujer, Villahermosa, Tabasco,
México.
3 Jefe del servicio de Biología de la
Reproducción. Hospital Regional de Alta Especialidad de la Mujer, Villahermosa,
Tabasco, México.
4 Jefa de investigación. Hospital Regional de
Alta Especialidad de la Mujer, Villahermosa, Tabasco, México.
Resumen
ANTECEDENTES:
La enfermedad de Pompe es un padecimiento autosómico recesivo del
metabolismo del glucógeno causado por la deficiencia parcial o total de la
enzima lisosomal alfa-glucosidasa ácida (GAA). Su
incidencia es variable y depende de la región geográfica y el origen étnico.
OBJETIVO:
Reportar un caso de mutación previamente descrita en población mexicana
relacionada con enfermedad de Pompe.
CASO CLÍNICO:
Paciente de 21 años, llegó al servicio de Genética enviada de un centro de
salud por el antecedente de dos muertes perinatales. En la evaluación de la
pareja se encontraron antecedentes de importancia de consanguinidad (primos
hermanos) y ginecoobstétricos: dos embarazos, dos partos y dos muertes
perinatales por miocardiopatía de causa desconocida. Las ecografías de los
embarazos previos no reportaron alteraciones, tampoco en la exploración
física. Debido a los antecedentes se decidió la búsqueda de portadores de la
enfermedad de Pompe en la rama materna.
CONCLUSIÓN:
Se tomaron en consideración la detección y diagnóstico de portadores de
errores innatos del metabolismo debido a los antecedentes recopilados en la
historia clínica (muertes perinatales, consanguinidad). Se reporta una
mutación previamente descrita en población mexicana relacionada con la
enfermedad de Pompe.
PALABRAS CLAVE: Enfermedad de Pompe; glucógeno; lisosomal; alfa-glucosidasa ácida; etnicidad; mutación; muertes perinatales
Abstract
BACKGROUND:
Pompe’s disease is an autosomal recessive disease of glycogen metabolism;
caused by partial or total deficiency of the lysosomal enzyme
alpha-glucosidase acid (GAA). Its incidence is variable and
depends on the geographical region and ethnicity.
OBJECTIVE:
Report a case of previously described mutation in Mexican population related
to Pompe disease.
CLINICAL CASE:
A 21-year-old female who attends first-time genetics services, with
reference to a health center due to a history of two perinatal deaths. An
evaluation of the couple is performed, with a history of the importance of
consanguinity (first cousins), a gynecoobstetric history: pregnancy 2,
births 2. Two perinatal deaths due to cardiomyopathy of unknown cause.
Ultrasound findings of previous pregnancies, without report of alterations.
A physical examination of both patients, without phenotypic alteration. Due
to the aforementioned background, it is decided to search for carriers of
Pompe disease in the maternal branch.
CONCLUSION:
In this case the detection and diagnosis of carriers of inborn errors of
metabolism, the antecedents collected in the clinical history (perinatal
deaths, consanguinity) were taken into consideration. Publicizing a mutation
previously described in the Mexican population, which is related to Pompe
disease.
KEYWORDS: Pompe Disease; Glycogen; Lysosomal; Alpha Glucosidase Acid; Ethnicity; Mutation; Perinatal Deaths
ANTECEDENTES
La enfermedad de Pompe (glucogenosis tipo ll, deficiencia de maltasa ácida; OMIM
#232300)1,2es un padecimiento autosómico
recesivo del metabolismo del glucógeno causado por la deficiencia parcial o total de
la enzima lisosomal alfa-glucosidasa ácida (GAA) debida a
mutaciones del gen GAA, localizado en 17q25.3.3,4
La enfermedad de Pompe puede afectar de manera indistinta a mujeres y hombres. Su
incidencia es variable y dependiente de la región geográfica y del origen étnico. La
incidencia prevista, basada en la frecuencia de portadores es de 1 caso por cada
138,000 para la enfermedad infantil clásica y 1 en 57,000 para la enfermedad de
inicio tardío.5,6
El objetivo es: reportar un caso de mutación previamente descrita en población
mexicana relacionada con enfermedad de Pompe.
CASO CLÍNICO
Paciente de 21 años, con antecedentes heredofamiliares de diabetes mellitus por parte
de la abuela paterna, padre con hipertensión arterial crónica. Antecedentes
personales patológicos: hipertensión arterial crónica sin tratamiento establecido y
sobrepeso. Antecedentes ginecoobstétricos: menarquia a los 12 años, con ciclos
regulares de 6 días de duración; telarquia a los 12 años; inicio de la vida sexual
activa a los 16 años; dos embarazos y dos partos.
Ingresó al Hospital Regional de Alta Especialidad de la Mujer referida de un centro
de atención de segundo nivel debido al antecedente de dos muertes perinatales, con
datos de hipertrofia miocárdica e hipotonía. En la evaluación de la pareja, en el
interrogatorio directo, negaron antecedentes familiares de patología
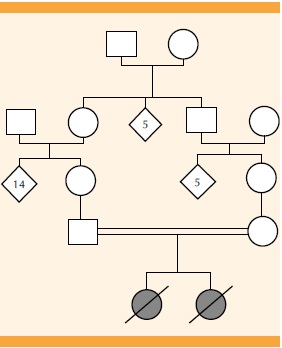
genética-reproductiva. Se corroboró el antecedente de consanguinidad positiva
(primos hermanos) (Figura 1). Los reportes
ecográficos de los embarazos previos no informaron alteraciones. En la exploración
física de ambos no se encontraron datos fenotípicos de importancia. Debido a los
antecedentes descritos se decidió que fueran evaluados por un equipo
multidisciplinario; se solicitaron pruebas bioquímicas para confirmar o descartar la
sospecha de portador de error innato del metabolismo.
De la muestra de gota en sangre seca de la paciente se reportó: alfa-glucosidasa
ácida: 1.13 µmol/L/h (más de 4.46); del hombre: alfa-glucosidasa ácida: 8.71
µmol/L/h. Debido a la baja actividad enzimática se llevó a cabo la secuenciación
para caracterizar el genotipo de la paciente (Cuadro
1). Ante la complejidad del caso se decidió la búsqueda de portadores de
enfermedad de Pompe en la rama materna (Cuadro
2). Con base en el reporte no se emprendió la búsqueda de portadores en
la rama paterna.
Cuadro 1 Reporte final de la secuenciación del gen GAA en la
paciente del caso clínico
| Clasificación |
Cigosidad |
Cambio de nucleótido |
Efecto de la proteína-cambio del
aminoácido |
Localización |
| Predictiva patogénica |
Heterocigoto |
C.1719c>a |
Asn573lys |
Exón 12 |
Cuadro 2 Actividad enzimática de la alfa-glucosidasa ácida en la familia
materna
| Parentesco |
Código |
Reporte |
Valor |
Unidades |
| Padre |
GAA |
6.93 |
> 4.46 |
µmol/L/h |
| Madre |
GAA |
4.94 |
> 4.46 |
µmol/L/h |
| Hermana |
GAA |
6.27 |
> 4.46 |
µmol/L/h |
DISCUSIÓN
La enfermedad de Pompe tiene un amplio espectro clínico porque deriva del depósito de
glucógeno en el tejido muscular y visceral. Es evidente que la función cardiaca, en
la variante de inicio temprano, tiene un daño considerable; aun así pueden
conseguirse desenlaces satisfactorios con la terapia de reemplazo enzimático, con la
que se consigue el remodelamiento del miocardio y de la función ventricular; por lo
tanto, disminución del grosor de la pared ventricular.7,8
Para la forma infantil, la edad promedio al momento del diagnóstico se encuentra
entre los 4.5-5.3 meses, en coincidencia con el inicio de los síntomas y el
fallecimiento de los recién nacidos aquí reportados debido a miocardiopatía
hipertrófica e hipotonía (fallecimiento a los 4 y 5 meses).9,10
La demostración de la reducción de la actividad de la enzima lisosomal
alfa-glucosidasa ácida (GAA) en una mancha de sangre seca o
leucocitos, seguida de la secuenciación del gen GAA, confirma la
enfermedad. Los ensayos de actividad enzimática que utilizan fibroblastos de la piel
o tejido muscular son alternativas a las pruebas genéticas para confirmar el
diagnóstico.9,11 En la población mexicana se han
descrito mutaciones previas del gen GAA;12,13 en nuestro caso comunicamos una mutación previa
(C.1719c>a), similar a la mencionada en la bibliografía.14
Luego de caracterizar genéticamente el caso índice se recomienda, en los familiares
en riesgo, la búsqueda y detección de portadores. En el caso aquí comunicado se
efectuó la búsqueda intencionada de portadores en familiares de la rama materna. La
identificación y clasificación de la mutación del gen GAA permitió
establecer el pronóstico desde el punto de vista reproductivo. 15
CONCLUSIÓN
El diagnóstico de portador de errores innatos del metabolismo se establece con base
en los antecedentes de la historia clínica (muertes perinatales, consanguinidad). La
aplicación del método clínico, junto con los hallazgos bioquímicos, es indispensable
para el diagnóstico de esta enfermedad genética. El reporte de la secuenciación del
gen GAA en la paciente fue previamente informado en la población
mexicana.
REFERENCIAS
1. Hirschhorn R, Reuser AJJ. Glycogen storage disease type II: (acid
maltase) deficiency. In: Valle D, et eds. The Online Metabolic and Molecular
Bases of Inherited Disease (OMMBID). New York: McGraw-Hill. Chap 135. Doi:
10.1036/ommbid.417.
[ Links ]
2. Tortorelli S, et al. Moonlighting newborn screening markers: the
incidental discovery of a second-tier test for Pompe disease. Genet Med. 2018;
20 (8): 840-46. https://doi.org/10.1038/gim.2017.190
[ Links ]
3. Moravej H, et al. A New mutation causing severe infantile-onset
pompe disease responsive to enzyme replacement therapy. Iran J Med Sci. 2018; 43
(2): 218-22. PMID: 29749992
[ Links ]
4. Löscher WN, et al. Pompe disease in Austria: clinical, genetic
and epidemiological aspects. J Neurol. 2018; 265 (1): 159-64.
https://doi.org/10.1007/s00415-017-8686-6
[ Links ]
5. Van den Hout H, et al. Recombinant human alpha-glucosidase from
rabbit milk in Pompe patients. Lancet 2000; 356 (9227): 397-8.
https://doi.org/10.1016/S0140-6736(00)02533-2
[ Links ]
6. Burton BK, et al. The Initial Evaluation of Patients After
Positive Newborn Screening: Recommended Algorithms Leading to a Confirmed
Diagnosis of Pompe Disease. Pediatrics 2017; 140 (Suppl 1): S14-S23.
https://doi.org/10.1542/peds.2016-0280D
[ Links ]
7. Howell RR, et al. Diagnostic challenges for Pompe disease: an
under-recognized cause of floppy baby syndrome. Genet Med 2006; 8 (5): 289-96.
https://doi.org/10.1097/01.gim.0000204462.42910.b8
[ Links ]
8. Chan J, et al. The emerging phenotype of late-onset Pompe
disease: A systematic literature review. Mol Genet Metab 2017; 120 (3): 163-72.
https://doi.org/10.1016/j.ymgme.2016.12.004
[ Links ]
9. Byrne BJ, et al. Pompe disease: design, methodology, and early
findings from the Pompe Registry. Mol Genet Metab 2011; 103 (1): 1-11.
https://doi.org/10.1016/j.ymgme.2011.02.004
[ Links ]
10. Capelle CI, et al. Childhood Pompe disease: clinical spectrum
and genotype in 31 patients. Orphanet J Rare Dis 2016; 65: 1-11.
https://doi.org/10.1186/s13023-016-0442-y
[ Links ]
11. Kishnani PS, et al. A retrospective, multinational, multicenter
study on the natural history of infantile-onset Pompe disease. J Pediatr 2006;
148 (5): 671-6. https://doi.org/10.1016/j.jpeds.2005.11.033
[ Links ]
12. Esmer C, et al. A novel homozygous mutation at the GAA gene in
Mexicans with early-onset Pompe disease. Acta Myol 2013; 32 (2): 95-99. PMID:
24399866
[ Links ]
13. Grijalva A, et al. Prevalence and ancestral origin of the
c.1987delC GAA gene mutation causing Pompe disease in Central Mexico. Meta Gene
2018; 15: 60-64. https://doi.org/10.1016/j.mgene.2017.11.005
[ Links ]
14. Bali DS, et al. Predicting cross-reactive immunological material
(CRIM) status in Pompe disease using GAA mutations: Lessons learned from 10
years of clinical laboratory testing experience. Am J Med Genet C Semin Med
Genet 2012; 160 (1): 40-49.
https://doi.org/10.1002/ajmg.c.31319
[ Links ]
15. Atherton AM, Salvatore D. The role of genetic counseling in
Pompe disease after patients are identified through newborn screening.
Pediatrics 2017; 140 (1): 46-50.
https://doi.org/10.1542/peds.2016-0280F
[ Links ]











 nova página do texto(beta)
nova página do texto(beta)