ANTECEDENTES
La enfermedad de Chagas es una zoonosis causada por Trypanosoma cruzi, un parásito endémico en 21 países del continente americano. Entre 70 y 80% de los infectados permanecen asintomáticos durante el resto de su vida, los demás evolucionan a la fase crónica de la enfermedad.1 El parásito se trasmite de diferentes maneras; la más común es a través de la picadura de los triatominos (insectos voladores, principales vectores del Trypanosoma cruzi); menos frecuente por trasfusiones de sangre, trasplante de órganos, trasmisión vertical2 y por la ingestión accidental de alimentos contaminados con el protozoo.
Se estima que en el mundo Trypanosoma cruzi infecta cada año a 8 millones de personas. 3La incidencia anual de la enfermedad de Chagas en América Latina es de 28,000 casos y causa, en promedio, aproximadamente 12,000 muertes. 1 En la misma región, la prevalencia de la enfermedad en mujeres embarazadas va de 5 a 40%, según la zona geográfica, 4 con una tasa de trasmisión congénita de 1%.1 La Organización Panamericana de la Salud estimó en 2010 para Colombia una tasa de incidencia de 1.14 casos de Chagas congénito por cada 1000 nacidos vivos. 5 Además, debido a la movilización de la población, la enfermedad se ha detectado en regiones no endémicas. 4,6
La mayor parte de las veces las embarazadas infectadas pasan por un proceso crónico y asintomático. 7 La probabilidad de trasmisión congénita depende de la respuesta inmunitaria materna, fetal y neonatal, de factores placentarios y de la virulencia del parásito. 8,9 La infección congénita por Trypanosoma cruzi se relaciona con parto prematuro, 8 bajo peso al nacer, hidrops fetal, 7 hepatoesplenomegalia, 9 trastornos neurológicos, lesiones cutáneas, ictericia, hidrocele, cuadros febriles, 10 insuficiencia respiratoria, meningoencefalitis, miocarditis, cardiomegalia, 11 y muerte neonatal, 7 pero puede ser asintomática incluso en 90% los casos. 11,12 Además, el tratamiento antichagásico está contraindicado durante el embarazo, 7 por la toxicidad de los medicamentos. 13
CASO CLÍNICO
Paciente indígena, de 32 años, procedente del área rural del occidente colombiano, analfabeta, con antecedente de 7 embarazos y 6 partos. El embarazo actual en las 29.5 semanas, determinadas en la ecografía del tercer trimestre, sin controles prenatales. Acudió a un centro de atención primaria debido a trabajo de parto pretérmino, con ruptura de membranas, sin foco infeccioso evidente. Fue remitida a un centro de atención terciaria, a donde ingresó hemodinámicamente estable, sin signos de respuesta inflamatoria sistémica. En el examen ginecológico se la encontró con las membranas rotas, líquido amniótico claro, sin leucorrea, ni sangrado. Los exámenes de laboratorio clínico se reportaron en límites de normalidad. Perfil infeccioso para VIH, sífilis, hepatitis B negativo y huella serológica para toxoplasmosis. La ecografía obstétrica de control se informó con oligohidramnios severo (ILA: 1.39), sin otros hallazgos.
La madre no evidenció signos de respuesta inflamatoria; monitoreo fetal categoría I. Recibió esquema de maduración pulmonar completo con betametasona (12 mg al día en 2 dosis), tratamiento antibiótico profiláctico (ampicilina más eritromicina). El embarazo finalizó por cesárea, sin complicaciones y sin alteraciones evidentes en la cavidad uterina o la placenta, con el nacimiento de una niña que pesó 1290 gramos.
La recién nacida mostró adecuada adaptación neonatal, Apgar 8 al minuto y 9 a los 5 minutos de vida. Las primeras horas las cursó con síndrome de dificultad respiratoria del recién nacido, con evolución satisfactoria. Al mes de vida extrauterina tuvo un cuadro de sepsis, con urocultivo positivo para Klebsiella pneumoniae, tratada con antibiótico de amplio espectro. A los 50 días de vida, de manera súbita, tuvo inestabilidad hemodinámica, dificultad respiratoria, palidez mucocutánea y fiebre con diagnóstico de sepsis de origen indeterminado. Los estudios de extensión reportaron: hemoglobina 7.5 mg/dL, parasitemia positiva por microhematocrito para Trypanosoma cruzi, con amastigotes en el líquido cefalorraquídeo. Se estableció el diagnóstico de meningoencefalitis chagásica y se inició tratamiento escalonado con benznidazol, con adecuada mejoría clínica y sin evidencia de toxicidad secundaria al tratamiento. El electrocardiograma y ecocardiograma de control se informaron sin signos de enfermedad cardiaca por Chagas.
En los estudios complementarios se encontró serología positiva para Trypanosoma cruzi, en ambos padres. A los 23 días de iniciado el tratamiento antiparasitario fue dada de alta del hospital y continuó con tratamiento ambulatorio con benznidazol, hasta completar 60 días. En el seguimiento clínico a los siete meses, el examen directo de sangre no evidenció amastigotes de Trypanosoma cruzi y la ecografía trasfontanelar sin evidencia de alteraciones.
La genotipificación del Trypanosoma cruzi mostró linaje Tc1 y en el estudio histopatológico de la placenta se reconoció infección intraamniótica ascendente, con reacción inflamatoria materna severa, con corioamnionitis aguda y subcorionitis. Evidencia de respuesta inflamatoria fetal con polimorfonucleares en la pared muscular y una de las arterias umbilicales (vasculitis umbilical); en el disco placentario se observó intervillitis y deciduitis plasmocítica, con amastigotes en el trofoblasto intermedio y en el plato basal. Figura 1
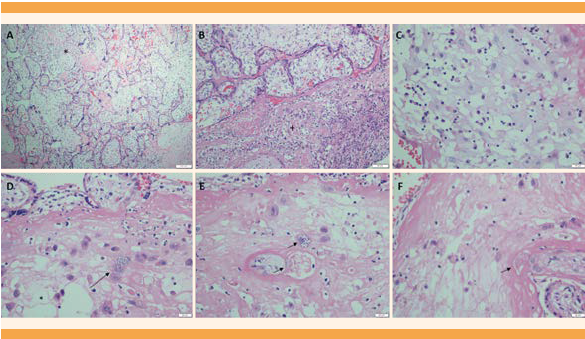
Figura 1 Imágenes histológicas del disco placentario. A. Coloración de hematoxilina-eosina e intervellositis plasmocítica (*). B. Deciduitis plasmocítica (+) C. Detalle histológico de las células plasmáticas. D, E y F. Las flechas señalan nidos de amastigotes en la decidua basal del disco placentario.
DISCUSIÓN
La enfermedad de Chagas es una enfermedad parasitaria, sistémica y crónica causada por Trypanosoma cruzi, un parásito intracelular obligado. 14 La describió Carlos Chagas en 1909. 15 Esta enfermedad se caracteriza por su alta carga de morbilidad y mortalidad: cerca de 80% de las personas infectadas de todo el mundo carecen de diagnóstico y tratamiento oportuno. 12 Sus factores de riesgo se asocian con condiciones socioeconómicas bajas. 1
La vía de trasmisión vertical del parásito es a través de la vellosidad coriónica, el sincitiotrofoblasto, el seno placentario marginal y el aparato genital durante el nacimiento, la primera es la más aceptada. 14
Durante la trasmisión congénita, los tripomastigotes de la sangre materna deben cruzar la barrera placentaria; en el espacio intervelloso pueden invadir las células que conforman las vellosidades (sincitiotrofoblasto, citotrofoblasto y estroma), en su interior los tripomastigotes se diferencian en amastigotes que conforman nidos, proliferan y, después de cierto número de replicaciones, los amastigotes se diferencian nuevamente en tripomastigotes que podrían invadir el capilar fetal e infectar al feto. La existencia de nidos de parásitos es decisiva para el diagnóstico. 13 Figura 2
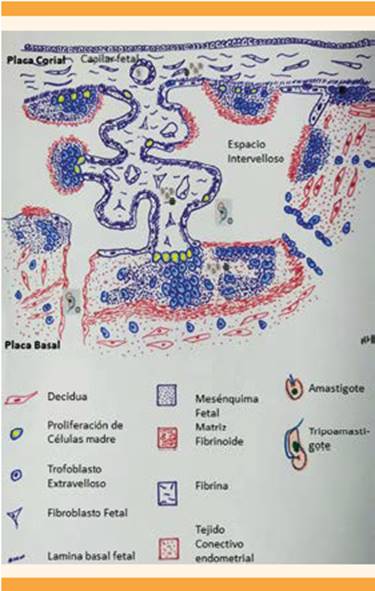
Figura 2 Mecanismo de trasmisión trasplacentaria del Chagas. La forma amastigote del Trypanosoma cruzi en la sangre materna pasa al espacio intervelloso donde entra en contacto con la superficie vellositaria-trofoblasto (). Luego de ingresar al tejido velloso se trasforma en amastigotes que conforman nidos o quistes () que proliferan hasta que se lleva a cabo la invasión del torrente sanguíneo fetal a través de los capilares fetales. Imagen adaptada de la referencia 16, capítulo 8, página 110.
En la mayor parte de los países endémicos las mujeres embarazadas, con infección crónica, trasmiten parásitos a sus fetos en 1-2% de los casos. En algunas regiones de Bolivia, Chile y Paraguay la tasa alcanza 5%.15
En la placenta de casos graves y mortales de enfermedad congénita de Chagas (abortos, mortinatos o recién nacidos prematuros que fallecen en el periodo neonatal) se evidencia inflamación severa, con grandes áreas de destrucción del trofoblasto y necrosis vellositaria; los amastigotes se encuentran en el trofoblasto velloso y células estromales. En la placenta de neonatos vivos con infección congénita leve por Trypanosoma cruzi, puede no haber inflamación o ser menos evidente. Los parásitos no se identifican fácilmente; se observan si se encuentran en el trofoblasto velloso y extravelloso. Puede asociarse con mayor frecuencia con corioamnionitis y funisitis, 9similar a lo observado en este caso.
Vivir durante el embarazo en áreas de alta densidad de vectores se asocia con alto riesgo de enfermedad de Chagas congénita más grave y mortal. 9 La paciente motivo de este reporte provenía de un área donde la trasmisión por el vector es endémica. 11
En un estudio llevado a cabo en un área endémica de Chile, la mayoría de las madres procedían del área rural, 77.3% eran multigestantes, 13.6% con alguna comorbilidad durante el embarazo: hipertensión y diabetes gestacional. En relación con los parámetros clínicos del recién nacido con Chagas congénito confirmado, la mayoría eran de término y 50% asintomáticos al nacer. En relación con la placenta, en 28 de 29 madres con la enfermedad parasitaria, los hallazgos histopatológicos mostraron: edema, necrosis, depósito fibrinoide y, en un caso, nidos de amastigotes, eritroblastosis e infiltración linfoplasmocitaria intensa. 17
En un estudio efectuado en Europa, en área no endémica, se incluyeron 122 mujeres embarazadas entre quienes se evidenciaron tres casos de Chagas congénito. Ninguna de las madres recibió tratamiento antes del embarazo y solo un neonato tuvo manifestaciones clínicas sugerentes de enfermedad de Chagas: hidropesía fetal, ascitis, inestabilidad hemodinámica, anemia. 18 En la bibliografía se menciona que alrededor de 50% de los recién nacidos prematuros hijos de madres con Chagas no superviven. 13 En este caso, se trató de un prematuro extremo, con meningoencefalitis chagásica, enfermedad menos frecuente en la presentación de esta parasitemia. 11
La enfermedad de Chagas congénita es una forma clínica especial de infección aguda por Trypanosoma cruzi que es curable, incluso, en 100% de los casos que se diagnostican y tratan antes del año de vida. 9 En Colombia existen estrategias de tamizaje sistemático de las embarazadas que habitan en las zonas con alta endemicidad o con otros factores de riesgo. 5 Durante el control prenatal obligatorio solo se incluye el tamizaje para VIH, toxoplasmosis, sífilis y hepatitis B, pero no para enfermedad de Chagas. 11
CONCLUSIÓN
La enfermedad de Chagas es una de las infecciones tropicales más desatendidas del mundo, la trasmisión vertical del Trypanosoma cruzi, en términos generales es baja, pero se considera un problema de salud pública porque la trasmisión congénita es la responsable de la progresiva globalización y urbanización de la enfermedad en zonas endémicas y no endémicas. Por lo anterior se considera importante incluir el tamizaje para esta infección en las embarazadas, como parte del conjunto de pruebas de control prenatal.











 nueva página del texto (beta)
nueva página del texto (beta)


