ANTECEDENTES
De acuerdo con reportes de la Organización Mundial de la Salud la incidencia anual de partos prematuros en todo el mundo es de 15 millones (11.1% de todos los nacimientos).1-3 En Colombia, según las cifras publicadas por el Departamento Administrativo Nacional de Estadística (DANE) de 2017, se registraron 131,287 partos pretérmino, que correspondieron a 20.27% del total de los nacimientos.4 El parto pretérmino es el nacimiento que ocurre antes de las 37 semanas de embarazo y se considera la principal causa de morbilidad y mortalidad en niños menores de 5 años.1,3 El parto pretérmino provoca diversas complicaciones que afectan la calidad de vida de la madre y del recién nacido. Si bien la causa no es del todo clara, se han descrito algunos eventos como posibles factores que provocan o incrementan el riesgo: inflamación secundaria a la infección, sobredistensión uterina, embarazo múltiple, polihidramnios, bajo índice de masa corporal materna y el origen geográfico.3,5
Los estudios que evalúan el microbioma vaginal de mujeres con parto pretérmino reportan una disminución significativa en la cantidad y diversidad de microorganismos vaginales, sobre todo Lactobacillus sp durante el primer y segundo trimestres del embarazo, lo que sugiere que el cambio ecológico es importante para favorecer la colonización de otros microorganismos.6,7
El parto pretérmino se relaciona con infecciones del conducto urogenital; se calcula que 25-40% de los partos prematuros se asocian con infección intrauterina,8,9 lo que incrementa 2.4 veces más el riesgo, debido a que la exposición materna a determinados microorganismos desencadena, inicialmente, un proceso inflamatorio.10 Después, la unión de ligandos bacterianos a receptores toll-like (TLRs) en el corion, amnios, decidua, células placentarias y cervicales induce la transcripción del factor Nf-kappa-B que provoca la respuesta inflamatoria fetal y materna. La respuesta producida por los TLR conduce al reclutamiento de neutrófilos, macrófagos activados y liberación de mediadores proinflamatorios, que incrementan la producción de prostaglandinas e inducen la expresión de ciclooxigenasa-2 en el amnios y la decidua, y bloquean simultáneamente la síntesis de 15-hidroxiprostaglandina deshidrogenasa, enzima que se encarga de metabolizar las prostaglandinas en el corion.11,12 Estas sustancias adelgazan el cuello uterino y aumentan la contractilidad uterina, con la consecuente necesidad de interrupción del embarazo antes de la semana 37.13,14
Los microorganismos asociados con riesgo de parto pretérmino por infección intrauterina son: Streptococcus agalactiae (grupo B), Chlamydia trachomatis, Neisseria gonorrhoeae, micoplasmas genitales, Gardnerella vaginalis y Mobiluncus sp.15-17
El AF Genital System-Liofilchem® permite la identificación rápida y presuntiva de agentes patógenos urogenitales obtenidos de muestras de hisopos vaginales, uretrales y líquido seminal.18,19 La bandeja del sistema contiene sustratos bioquímicos y antibióticos desecados, y las pruebas se interpretan según el cambio de color de los pozos. Las características operativas reportadas para el sistema son: sensibilidad de 92.7-100%, especificidad de 98.2-98.8, valor predictivo positivo de 91.6-95.5% y valor predictivo negativo de 98-100%.20
El objetivo de este estudio fue: identificar los microorganismos vaginales más frecuentes de pacientes en trabajo de parto pretérmino, mediante el AF Genital System-Liofilchem®.
MATERIALES Y MÉTODOS
Estudio descriptivo, prospectivo y transversal llevado a cabo en pacientes en trabajo de parto pretérmino atendidas en el servicio de Ginecología y Obstetricia de la Fundación Hospital Infantil Universitario de San José de Bogotá, entre julio de 2015 y febrero de 2016. Las participantes firmaron el consentimiento informado, previamente aprobado por el Comité de Ética en Investigación con Seres Humanos de la Fundación Hospital Infantil Universitario de San José y autorizaron la obtención de muestras y el registro de datos clínicos.
Criterios de inclusión: pacientes en trabajo de parto, antes de las 37 semanas de gestación, con evidencia clínica o no de infección intrauterina, definida con al menos dos criterios de Gibbs (temperatura materna mayor de 37.8° C, taquicardia materna mayor de 100 latidos por minuto, taquicardia fetal mayor de 160 latidos por minuto; olor fétido del líquido amniótico, hipersensibilidad uterina, leucocitosis materna [recuento mayor de 15000]), con o sin sospecha de corioamnionitis clínica. Criterios de exclusión: pacientes con diagnóstico de infecciones congénitas del grupo TORCH, sífilis, VIH positivo, sepsis de origen urinario, antecedentes poco claros de infección de vías urinarias.
Para el aislamiento de los microorganismos se obtuvo una muestra del flujo vaginal mediante la inserción de un hisopo en el introito vaginal, que se sumerge en la ampolla de solución fisiológica durante 5 minutos y se agita. Se transfieren 0.2 mL de la suspensión a cada pozo del panel del A.F. Genital System-Liofilchem®, y de acuerdo con las instrucciones del fabricante se cubren los pozos preestablecidos con vaselina. La identificación de Mycoplasma hominis se efectúa con la prueba de arginina y Ureaplasma urealyticum con la de urea. La determinación semicuantitativa de unidades formadoras de colonias (menos de 104, 104-105, más de 105 UFC/mL) de especies genitales de micoplasma en cada muestra se basa en la concentración de sulfato de magnesio en los pozos 1, 2 y 3. Las pruebas de susceptibilidad antimicrobiana siguen las normas de CLSI y el crecimiento o la inhibición de los microorganismos en los pozos que contienen antibiótico y un indicador del crecimiento que provoca el cambio de color amarillo se reporta sensible, anaranjado intermedio y rojo resistente. Los puntos de corte que indican resistencia (R) son: tetraciclina R ≥ 8; pefloxacina R ≥ 16; ofloxacina R ≥ 4; doxiciclina R ≥ 8; eritromicina R ≥1 6; claritromicina R ≥ 16; minomicina R ≥ 8; josamicina R ≥ 8 y clindamicina R ≥ 8.20
Cada panel se incuba a 37 °C, a las 24 horas se realiza la lectura y a las 48 horas se confirma la identificación de Mycoplasma hominis. Los paneles permiten la identificación simultánea de Staphylococcus aureus, Ureaplasma urealyticum, Pseudomonas spp, Enterococcus faecalis, Candida spp, Gardnerella vaginalis, Proteus spp-Providencia spp, Streptococcus agalactiae, Mycoplasma hominis, Escherichia coli, Trichomonas vaginalis y Neisseria gonorrhoeae, además de la determinación de la carga bacteriana y el perfil de susceptibilidad microbiana para las especies de micoplasmas genitales, por el cambio de color en cada uno de los pozos, de acuerdo con la cartilla del AF Genital System- Liofilchem®. Figura 1

Figura 1 Paneles del A.F. Genital System-Liofilchem®. A) Panel negativo para cultivo de frotis de flujo vaginal. B) Muestra positiva para M. hominis (pozo 4), U. urealyticum (pozo 5), Proteus spp (pozo 17), Pseudomonas spp (pozo 18), S. aureus (pozo 20).
Para el análisis de los datos se obtuvieron las historias clínicas y se entrevistó directamente a las pacientes. Se conformó una base de datos y se aplicó estadística descriptiva para las variables cuantitativas y proporciones para las cualitativas. Se implementó la prueba no paramétrica de Wilcoxon para la comparación de microorganismos por edad gestacional. Se utilizó el programa estadístico Stata v.13 (StataCorp)®.
RESULTADOS
Se registraron 46 pacientes; 28 de los 46 nacimientos ocurrieron entre las semanas 35 y 37 de gestación; 38 de 46 pacientes tenían entre 19 y 34 años. Solo se encontró 1 caso de corioamnionitis. 15 de 46 tenían antecedente de infección de vías urinarias y 8 de 46 de vaginosis bacteriana. Cuadro 1
Cuadro 1 Características de la población según las semanas de embarazo
| Variables | Semanas de embarazo | |||
| 28 | 28 a 32 | 33 a 34 | 35 a 37 | |
| Grupos de edad (años) | ||||
| Menor de 18 | - | - | 1 (2.17%) | 2 (4.34%) |
| De 19 a 34 | 3 (6.52%) | 6 (13.04%) | 4 (8.69%) | 24 (52.17%) |
| Más de 35 | 2 (4.34%) | 1 (2.17%) | 1 (2.17%) | 2 (4.34%) |
| Total | 5 (10.86%) | 7 (15.21%) | 6 (13.04%) | 28 (60.86%) |
| Corioamnionitis | 1 (2.17%) | - | - | - |
| Antecedente de infección de vías urinarias | 2 (4.34%) | 5 (10.86%) | 3 (6.52%) | 5 (10.86%) |
| Antecedente de vaginosis | - | 1 (2.17%) | 2 (4.34%) | 5 (10.86%) |
En cuanto a los cultivos, se observó positividad en 43 de 46 pacientes para al menos un microorganismo mediante el AF Genital System-Liofilchem®. El microorganismo aislado con mayor frecuencia fue Staphylococcus aureus (en 41 de 46 pacientes). En relación con las especies de micoplasmas genitales, Ureaplasma urealyticum se detectó en 21 de 46 mujeres y Mycoplasma hominis en 9 de 46 casos. Figura 2
Hubo infección polimicrobiana en 24 de 46 pacientes y mixta (entre bacterias y Candida sp) en 18 de 46 casos. Cuadro 2
Cuadro 2 Prevalencia de microorganismos
| Tipo de microorganismos | n = 46 | % | ||
| Ninguno | 3 | 6.5 | 6.5 | |
| Un agente | Bacteria | 24 | 52.2 | 52.2 |
| Trichomonas | - | - | - | |
| Candida sp | - | - | - | |
| Dos agentes | Bacteria + Trichomonas | 1 | 2.2 | 41.3 |
| Bacteria + Candida sp | 18 | 39.1 | - | |
| Trichomonas + Candida sp | - | - | - | |
| Múltiples agentes | Bacteria + Trichomonas + Candida | - | - | - |
| Total | 46 | - | 100 | |
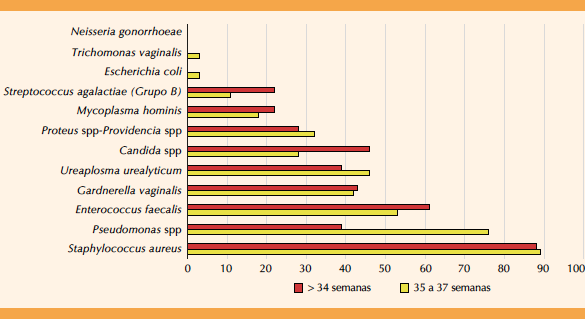
En pacientes con edad gestacional menor de 34 semanas (18 de 46), los microorganismos aislados con mayor frecuencia fueron: S. aureus (43 de 46) y E. faecalis (29 de 46) comparado con el segundo grupo: S. aureus (43 de 46) y Pseudomonas spp (34 de 46). (Figura 3) No se encontraron diferencias estadísticamente significativas al comparar la frecuencia de microorganismos en pacientes con edad gestacional menor de 34 versus 35-37 semanas de gestación (p = 0.8393).
La determinación de la carga bacteriana de especies de micoplasma permitió establecer si la paciente estaba colonizada (menos de 104 UFC/mL) o infectada (más de 104 UFC/mL).21 En las muestras positivas para Ureaplasma urealyticum y Mycoplasma hominis se estableció la carga bacteriana y se observó que 2 de 23 de las muestras tuvieron concentración menor de 104 UFC/mL 16 con concentración entre 104-105 UFC/mL (9/23) y 12 de 23 con concentración mayor de 105 UFC/mL.
El análisis de susceptibilidad a los antibióticos mostró que los microorganismos aislados de Ureaplasma urealyticum fueron resistentes a clindamicina (46 de 46), josamicina (36 de 46), minociclina (43 de 46) y claritromicina (3 de 46). Por su parte, los aislados de Mycoplasma hominis fueron resistentes a josamicina (15 de 46), eritromicina (46 de 46) y tetraciclina (15 de 46). En las pacientes con aislamientos mixtos de Mycoplasma hominis y Ureaplasma urealyticum, el antibiótico que no mostró resistencia fue minociclina. Figura 4
DISCUSIÓN
En la actualidad, el parto pretérmino es un problema de salud pública, con complicaciones para la madre y el neonato, que afecta los indicadores de morbilidad y mortalidad;2,22 por tanto, deben establecerse protocolos urgentes, con estrategias basadas en la promoción y prevención de la salud. En Colombia, la incidencia de parto pretérmino se ha incrementado año con año, de 11.76% en el año 2000 a 20.27% en 2016; con ello, el aumento de los partos antes de las 37 semanas de gestación se estimó en 0.5% por año.4
El parto pretérmino es un evento relacionado con infecciones intrauterinas; afecta a la madre y al feto, y provoca desenlaces poco favorables para ambos.17 Todos los microorganismos identificados en este estudio se encontraron en pacientes que finalizaron el embarazo antes de las 37 semanas, mediante estudios microbiológicos y moleculares en muestras de líquido amniótico.5,23
Las infecciones por Staphylococcus aureus han aumentado en mujeres durante el embarazo y posparto,24 y los recién nacidos muy prematuros y de muy bajo peso, hospitalizados en unidades de cuidados intensivos neonatales, tienen mayor riesgo de colonización y sepsis.25 El microorganismo aislado con mayor frecuencia en nuestro estudio fue Staphylococcus aureus (en 43 de 46). Top y su grupo27 evaluaron a 2702 pacientes durante el segundo trimestre del embarazo e identificaron la colonización recto-vaginal de S. aureus. Estimaron una prevalencia de 13% y concluyeron que la colonización se relacionó con el elevado riesgo de infección en la madre, pero no el hijo.26 Nadisauskiene y sus colaboradores encontraron asociación significativa entre la identificación de Staphylococcus aureus y parto prematuro, pues reportaron una frecuencia de 11.3% en pacientes con parto pretérmino y 1.6% en mujeres con embarazo a término.27 La elevada frecuencia reportada en nuestro estudio puede explicarse, eventualmente, por las características propias de la población (sociales, económicas, demográficas, susceptibilidad genética, entre otras), pero hasta la fecha no existen datos locales del microbioma vaginal de mujeres embarazadas.
Si bien S. aureus forma parte de la flora normal de las mucosas, es el segundo agente implicado en bacteriemias y sepsis neonatales. Kempley y sus coautores efectuaron un estudio retrospectivo en dos unidades de cuidados intensivos neonatales, donde establecieron que 90 neonatos con edad gestacional media de 27 semanas sufrieron bacteriemia por S. aureus; 44% tuvo complicaciones graves y 8% falleció.28 Sorano y colaboradores describieron un caso de corioamnionitis por S. aureus sin cambios en las membranas y bacteriemia del neonato.29 Doster y su grupo demostraron que S. aureus genera la formación de una biopelícula en la superficie coriodecidual de las membranas gestacionales humanas, que induce la producción de citocinas proinflamatorias, perturba la tolerancia materno-fetal durante el embarazo y contribuye a la ruptura temprana de membranas y nacimiento pretérmino.30 Estos hallazgos confirman la importancia de realizar el tamizaje de microorganismo en la población colombiana.
Los microorganismos asociados con especies de micoplasma genitales se han aislados de pacientes con corioamnionitis y con procesos inflamatorios de las membranas placentarias, incluso se consideran un factor de riesgo de parto pretérmino.31 En nuestro estudio, la prevalencia de Ureaplasma urealyticum (43.48%) y Mycoplasma hominis (19.57%) fue similar a la de diversas investigaciones: 9.14-90% para U. urealyticum y 2.5-75% para M. hominis en pacientes con parto prematuro.32,33,34
La sepsis neonatal es una causa importante de morbilidad y mortalidad neonatal temprana o tardía. La sepsis temprana ocurre en la primera semana de vida extrauterina y se origina por infecciones trasmitidas del conducto genital de la madre al feto antes o durante el parto. Entre estas, Streptococcus agalactiae y Escherichia coli son los microorganismos más frecuentes en pacientes con meningitis y septicemia neonatal.35 Seyyed y sus colaboradores reportaron una frecuencia de 39.1% para S. agalactiae en mujeres con parto pretérmino y de 20.2% en mujeres con embarazo de término.36 En Colombia se realiza el tamizaje de S. agalactiae para identificar a las pacientes colonizadas y prescribir el tratamiento adecuado, con la finalidad de evitar complicaciones neonatales.37 Desafortunadamente, ninguna de las mujeres de este estudio contaba con este reporte en su historia clínica. La prevalencia de S. agalactiae (15.22%) indica que la estrategia del tamizaje no es suficiente en el sistema de salud colombiano. En cuanto a la relación de S. agalactiae y edad gestacional se ha reportado una tasa de mortalidad por sepsis temprana de 20-30% en neonatos menores de 33 semanas de gestación.35 Los resultados evidencian una alta frecuencia de este microorganismo (22.2%) en las pacientes menores de 34 semanas de embazo; por esta razón se realizó la observación continua de los neonatos prematuros, para evitar el cuadro de sepsis.
En cuanto a la identificación de E. coli, Krohn y su grupo38 estimaron una prevalencia de 25% en mujeres con parto pretérmino (antes de la semana 36 de gestación) y la colonización vaginal se asoció estrechamente con el parto antes de las 34 semanas. Los autores concluyen que es importante evaluar y ofrecer tratamiento a las pacientes embarazadas para la colonización de E. coli en el conducto genital durante la atención prenatal.38
Por lo que se refiere a la identificación de otros microorganismos, se observó que en 41.3% de los casos se identificó Candida spp (39.1%), comparado con Gravett y sus colaboradores,39 quienes identificaron C. albicans en 11% de las mujeres con parto pretérmino; por su parte, Ali y sus coautores40 reportaron candidiasis invasiva en 22.2% de los prematuros colonizados, donde Candida albicans fue la especie más prevalente (77.7% de los casos), asociada con 12% de los casos de sepsis neonatales tardías. En Chile, Bustos y su grupo informaron infecciones invasoras en recién nacidos por especies de Candida no albicans.41
En cuanto a la carga bacteriana de especies de micoplasma genital, se observó que la mayoría de las pacientes tuvo infección con recuento bacteriano mayor de 104 UFC/mL (91.3%). De acuerdo con Kacerovsky y su quipo de trabajo,42 la alta carga bacteriana de especies de micoplasma genitales se relaciona con la intensidad de la reacción inflamatoria intrauterina de mujeres embarazadas y puede ocasionar la ruptura prematura de membranas y parto pretérmino. Las especies de micoplasma genitales muestran resistencia natural a los betalactámicos y glucopéptidos por la ausencia de su pared celular, que representa el sitio de acción de estos antimicrobianos. Si bien los macrólidos suelen ser los fármacos de elección para este tipo de infecciones, M. hominis es intrínsecamente resistente a los macrólidos C14 y C15 (eritromicina y azitromicina). Las especies de Ureaplasma también tienen resistencia natural a las lincosamidas (clindamicina). La resistencia de los macrólidos se asocia con mutaciones del gen 23S rARN y la de tetraciclinas con el elemento genético móvil tet(M).21,43 De acuerdo con las Guías de Práctica Clínica de Colombia el esquema de antibióticos recomendado para el tratamiento de corioamnionitis en pacientes con ruptura prematura de membranas consiste en la combinación de clindamicina y gentamicina;37 debe considerarse que la gentamicina no tiene efecto en las especies de micoplasma genitales (pues carecen de pared celular) y Ureaplasma urealyticum muestra resistencia intrínseca a la clindamicina; por tanto, existiría fracaso en el tratamiento.
Los gérmenes aislados de Ureaplasma urealyticum fueron resistentes a clindamicina en nuestro estudio (100%). Respecto a la eritromicina, la resistencia intrínseca se observó con M. hominis a diferencia de Ureaplasma urealyticum que fue sensible. Los microorganismos resistentes a eritromicina fueron Mycoplasma hominis (100%).
La mayor debilidad de este estudio fue el tamaño de la muestra que, en términos estrictos, no permitió establecer porcentajes reales que pudieran compararse con los de series mucho más grandes. Esta es la razón por la que los datos se presentaron en función de la cantidad máxima de pacientes. Es indudable que se requieren estudios con muestras de población mayores que permitan tener un panorama más preciso de la realidad colombiana.
CONCLUSIONES
Este estudio mostró un panorama parcial de la invasión microbiana del conducto genital femenino por microorganismos potencialmente capaces de desencadenar el parto pretérmino (antes de las 37 semanas de gestación) y provocar la resistencia de especies de micoplasma genitales a los antibióticos. Este estudio representa un punto de partida para profundizar en el conocimiento de los microorganismos vaginales en la salud pública de Colombia. Se requieren estudios que permitan establecer la identificación de los microorganismos como factores de riesgo, que podría ofrecer estrategias específicas para disminuir la incidencia de parto pretérmino y sus consecuencias para la madre y su hijo.











 nueva página del texto (beta)
nueva página del texto (beta)