ANTECEDENTES
Se estima que de 3 a 6% de las mujeres en edad reproductiva pueden tener episodios de hemorragia uterina anormal.1,2 Si bien el tratamiento farmacológico es efectivo en la mayoría de los casos, la histerectomía lo es en la totalidad.3,4 La hemorragia uterina anormal deteriora la calidad de vida de las mujeres porque altera su bienestar físico y emocional.5 La anemia es una complicación común y casi siempre severa susceptible de ser tratada con suplementos de hierro.
La deficiencia de hierro implica una insuficiente disponibilidad del mineral para satisfacer los requerimientos del organismo y puede manifestarse con o sin anemia.6,7,8 En 2013 el Global Burden of Diseases, Injuries and Risk Factors informó que la causa más común de anemia en el mundo era la deficiencia de hierro, las otras causas de anemia varían ampliamente por geografía, edad y género.9,10 La anemia causada por deficiencia de hierro se asocia con debilidad, fatiga, dificultad para concentrarse y disminución en la actividad física, lo que ocasiona un deterioro en la calidad de vida y en la productividad.11-14
La clave para el suministro de hierro sistémico y la homeostasis radica en la regulación de las concentraciones adecuadas de hierro plasmático. El hierro circula en el plasma enlazado a la glicoproteína transferrina, que tiene dos sitios de unión de alta afinidad para este mineral. La unión con la transferrina mantiene al hierro en una forma soluble, funciona como vehículo importante para su entrega a las células (vía el receptor de la transferrina, TfR1), y limita la generación de radicales tóxicos. La saturación de transferrina plasmática es de alrededor de 30%. La saturación menor de 16% indica deficiencia de hierro y la mayor de 45% es indicativa de sobrecarga.15
El hierro se libera a la circulación de enterocitos duodenales, que absorben 1-2 mg de hierro dietético por día, y de los macrófagos, que reciclan internamente 20-25 mg de hierro de eritrocitos senescentes. Los hepatocitos desempeñan un papel dual en el metabolismo sistémico del hierro: lugar más importante de su almacenamiento y secretan la hormona reguladora hepcidina.15
El tratamiento inicial de la anemia por deficiencia de hierro es el reemplazo por vía oral, opción conveniente en pacientes estables. Si bien las concentraciones de hemoglobina reaccionan rápidamente al tratamiento oral, la reposición de las reservas de hierro y la normalización de las concentraciones séricas de ferritina requieren de 3 a 6 meses de tratamiento. El esquema terapéutico a largo plazo de hierro por vía oral puede limitarse por la intolerancia asociada con el cambio de sentido del gusto o los síntomas gastrointestinales que suele desencadenar: náusea, vómito, estreñimiento y distensión abdominal.16,17
La alta incidencia de efectos gastrointestinales adversos es la causa del mal apego al tratamiento.18 En un metanálisis que comparó la suplementación oral versus la intravenosa de hierro, los efectos adversos gastrointestinales fueron 32% en los primeros y 13% en quienes recibieron tratamiento intravenoso.19
Ante el alto porcentaje de efectos adversos los investigadores desarrollaron preparaciones intravenosas de hierro para pacientes con mala tolerancia a la formulación oral. Las preparaciones intravenosas han incluido el hierro dextrán de alto o bajo peso molecular, gluconato de hierro, o hierro sacarosa y hierro carboxilmaltosa.
Los agentes de hierro intravenoso disponibles en la actualidad plantean importantes desafíos prácticos y de seguridad. La administración del hierro dextrán corre el riesgo de anafilaxia,20,21,22 por eso debe aplicarse una dosis de prueba. Ya se dispone de hierro intravenoso sin dextranos, pero sin aprobación por parte de la FDA.23
La sacarosa de hierro requiere múltiples consultas ambulatorias y el acceso intravenoso repetido para que los pacientes reciban el esquema de 1000 mg de hierro elemental. El dextrán de hierro puede administrarse en dosis única, pasada en un lapso de 4 a 6 horas. Los complejos de dextrán de hierro pueden causar reacciones anafilácticas fatales.24,25
Ahora se dispone de un nuevo agente de hierro intravenoso (hierro carboximaltosa) que no contiene dextrán, diseñado para administración en grandes dosis por vía intravenosa.26 La capacidad de inyectar con seguridad una dosis alta en poco tiempo, sin dosis de prueba, hace del hierro carboximaltosa una opción potencialmente ideal para tratar pacientes con anemia asociada con sangrado uterino intenso.27 Por lo que se refiere a los efectos adversos específicos, la carboxilmaltosa férrica se asocia con tasas más bajas de estreñimiento, diarrea, náuseas o vómitos que el hierro oral, pero las reacciones comparadas con otras preparaciones de hierro parenteral son mayores.
El objetivo de este estudio consistió en: evaluar la eficacia y seguridad de la administración de altas dosis de hierro carboximaltosa en el tratamiento de pacientes con anemia ferropénica secundaria a hemorragia uterina anormal.
MATERIALES Y MÉTODOS
Estudio cuasiexperimental de intervención, no controlado, con la variedad antes y después de un solo grupo (pretest-postest) efectuado en el Hospital Río de la Loza entre mayo de 2014 y septiembre de 2018. Criterios de inclusión: mujeres de 18 años o más con anemia (hemoglobina de 11.0 g/dL o menor) y hemorragia uterina anormal severa definida, por lo menos, con la coexistencia de uno de los siguientes criterios: incapacidad para controlar el sangrado transvaginal con tampones, uso de más de 12 toallas sanitarias por periodo o 4 tampones por día, pérdidas transvaginales de coágulos, persistencia del sangrado transvaginal mayor de 7 días. Criterios de exclusión: haber recibido transfusión de concentrados eritrocitarios o hierro parenteral en las 8 semanas previas al estudio, alteraciones en la eritropoyesis, hemocromatosis, terapia hormonal que pudiera afectar el sangrado uterino 8 semanas previas al estudio, haber consumido agentes estimuladores de eritropoyesis en las 12 semanas previas, pacientes posmenopáusicas sin biopsia endometrial tomada en los últimos 6 meses, malignidad, hiperplasia endometrial con atipia, terapia mielosupresiva, evidencia de infección viral crónica (antígeno de superficie de hepatitis B, anticuerpo de virus de hepatitis C, o virus de inmunodeficiencia humana), concentraciones de creatinina mayores de 2 mg/dL.
A todas las pacientes se les administró, por vía intravenosa, hierro carboximaltosa (Renegy® solución inyectable). Se clasificaron por grado de severidad de la anemia de los últimos 28 días previos de acuerdo con las cifras de hemoglobina (g/dL) en: leve (9.0 a 10.9), moderada 7.1 a 8.9 y severa menos de 7.
Los datos clínicos de las pacientes con anemia ferropénica que recibieron tratamiento suplementario con hierro por vía intravenosa se anotaron en sus expedientes clínicos en los que se consignaron los cambios en los 6 parámetros hematológicos basales y su comparación a los 30 días del tratamiento (hemoglobina, hematocrito, volumen corpuscular medio, concentración de hemoglobina corpuscular media, plaquetas y concentraciones séricas de ferritina y plaquetas). Todas las participantes firmaron el consentimiento informado. El estudio fue aprobado por el comité de ética de la institución y conducido conforme a las guías de buena práctica clínica y la declaración de Helsinki.
Los datos se analizaron de acuerdo con la cantidad de dosis (1, 2 o 3) recibidas de 500 mg cada una y los valores reportados al mes posterior y la evaluación de los parámetros hematológicos. Los reportes iniciales y finales a los 30 días se evaluaron comparativamente.
RESULTADOS
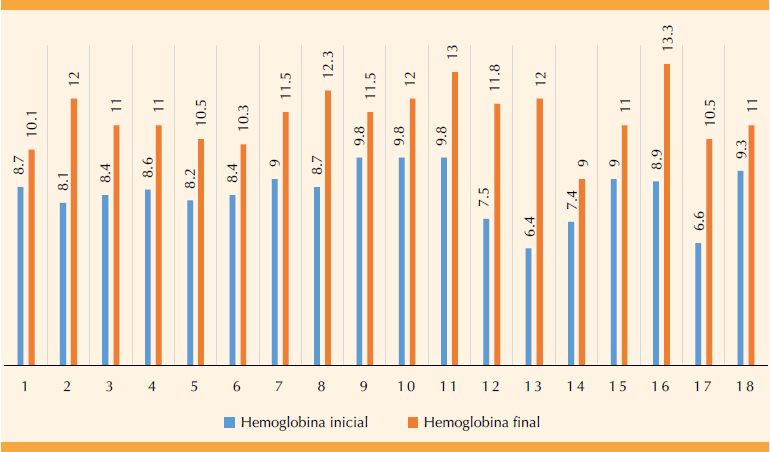
Se analizaron los datos de 18 pacientes con anemia ferropénica secundaria a hemorragia uterina anormal con edad media de 48.3 años (límites 33 y 73 años). Al inicio, la concentración media de hemoglobina fue de 8.45 g/dL, y de 6.23 mcg/L la de ferritina. La mayoría de las pacientes (17 de 18) alcanzó incrementos de hemoglobina de 1.5 g/dL después de 30 días de tratamiento con hierro intravenoso.
A los 30 días de la administración 6 de 18 pacientes tuvieron un incremento de 1 a 2 g/dL, 5 de 18 de 2 a 3 g/dL y 7 de 18 un incremento mayor de 3 g/dL.
El incremento fue dependiente de la dosis administrada, con 0.5 mg el incremento promedio fue de 1.96 g/dL, con 1 mg 3.18 g/dL y en la única paciente que recibió 1.5 mg el incremento fue de 4.4 g/dL.
El hematocrito tuvo un aumento de 9.7%: inicial promedio de 26% y final de 37%. El volumen corpuscular medio tuvo un aumento de 14.05 fL, inicial de 64.38 fL y final de 78.44 fL. La concentración de hemoglobina corpuscular media inicial fue de 20.83 g/dL, final de 26.94 g/dL con un aumento promedio de 6.11 g/dL. Hubo una disminución promedio de 73.88 103/mL , con un conteo inicial de 379.11 103/mL y final de 305.22 103/mL. La ferritina sérica final promedio fue de 33.44 mcg/L, inicial de 7.80 mcg/L, con aumento promedio de 25.63 mcg/L.
DISCUSIÓN
En pacientes con hemorragia uterina anormal, la deficiencia de hierro por pérdida de sangre debe compensarse movilizando el hierro de las reservas (medido por las concentraciones de ferritina sérica) para suministrar hierro adecuado para la eritropoyesis. La administración intravenosa de hierro en grandes dosis proporciona suficiente mineral no solo para corregir la anemia, sino para reponer sus reservas.
Los desenlaces de esta muestra de estudio pusieron de manifiesto que la anemia por deficiencia de hierro en mujeres con hemorragia uterina tienen un efecto positivo posterior al tratamiento con hierro carboximaltosa.
Al comparar la carboximaltosa férrica administrada por vía intravenosa con el hierro por vía oral el tiempo trascurrido para conseguir el incremento de la hemoglobina fue similar al de otros estudios, pero los resultados comparativos para el hierro oral fueron numéricamente inferiores. En las revisiones efectuadas en relación con el hierro oral no se encontró efecto en la ferritina. El tratamiento con hierro intravenoso es más efectivo que el hierro oral en producir una respuesta sostenida de aumento de hemo-globina lo que se traduce en menor necesidad de transfusiones sanguíneas.
El tratamiento con hierro carboximaltosa tuvo un incremento en las concentraciones de hemoglobina al día 30 de la aplicación. Este medicamento mejoró significativamente la hemoglobina y ferritina, la primera tuvo un incremento promedio de 2.84 mg/dL y final de 11.32 mg/dL (Figura 1) y la ferritina sérica experimentó un aumento promedio de 25.63 mcg/L y final de 33.44 mcg/L.
El hierro intravenoso no se asoció con aumento del riesgo de efectos adversos comparado con otros tipos de administración (oral, intramuscular o placebo). Con la aplicación de hierro carboximaltosa no se registró incremento en el riesgo de infección. Estos hallazgos refuerzan la seguridad de la administración de hierro intravenoso y lo colocan como una opción viable para la suplementación de hierro.
La limitante principal de este estudio es el tamaño de muestra que no permitió establecer conclusiones estadísticamente significativas. Nuestro grupo, u otros, seguramente irán acumulando experiencia hasta reunir una muestra más representativa y numerosa.
CONCLUSIONES
De acuerdo con lo encontrado en este estudio la administración intravenosa de altas dosis de hierro fue suficiente para corregir la anemia y restablecer los depósitos de este mineral. El hierro carboximaltosa no requiere dosis de prueba, es seguro, efectivo para corregir la anemia y restablecer los depósitos de hierro en pacientes con anemia ferropénica asociada con hemorragia uterina anormal.











 nueva página del texto (beta)
nueva página del texto (beta)