ANTECEDENTES
Se estima que a partir de la introducción de la fertilización in vitro (FIV) en 19781 se han obtenido más de cinco millones de nacimientos asociados con esta técnica. En la actualidad es una de las intervenciones efectuadas con mayor frecuencia en casos de infertilidad2 para optimizar el asesoramiento, selección de pacientes aptas y toma de decisiones. Con la intención de aumentar la probabilidad de éxito se desarrollaron modelos de predicción basados en diferentes biomarcadores.3
Para que un modelo predictor sea útil debe identificar las pruebas diagnósticas que garanticen la validez y confiabilidad adecuadas.4 Por desgracia, los factores predictivos analizados hasta la fecha no muestran resultados concluyentes.2 Para responder a la pregunta acerca de cuáles son las mediciones que mejor pueden ayudar a predecir éxito en ciclos de FIV se han incluido factores como: edad, paridad, hormona folículo estimulante (FSH), cuenta folicular antral, hormona antimülleriana, tiempo de infertilidad, causa de infertilidad, número de ovocitos capturados, método de fertilización, cantidad de embriones transferidos y la calidad del embrión. Por lo general, estos factores predictivos se solicitan de forma rutinaria como parte del protocolo de estudio de infertilidad en la pareja.5,6
La edad de la mujer es uno de los factores de predicción más importantes para el éxito de las técnicas de reproducción asistida. En fertilización in vitro la mayor edad se asocia con menores probabilidades de embarazo (razón de momios (RM) 0.95; IC95%: 0.94-0.96).7) La razón biológica de esto se explica fácilmente por la disminución de la reserva ovárica, que resulta en que los marcadores de reserva ovárica (cuenta folicular antral y hormona antimülleriana) se consideren también predictores del éxito. La asociación entre estas pruebas de reserva ovárica y respuesta a la estimulación está hoy debidamente establecida; sin embargo, su capacidad para predecir embarazo y recién nacido vivo posterior a una técnica de reproducción es limitada. Se reportan áreas bajo la curva para cuenta folicular antral de 0.76 y 0.78 para hormona antimülleriana; en la predicción para pobre respuesta ovárica son similares, pero mejores que para la edad (0.61).
La combinación de cuenta folicular antral y hormona antimülleriana no mejora la predicción de una pobre respuesta ovárica (0.80 p = 0.019); por lo tanto, el valor predictivo de la cuenta folicular antral, como único marcador, es comparable con los modelos multivariantes que incluyen: edad, FSH, volumen ovárico e inhibina B para predecir la respuesta ovárica.8
Brodin y sus colaboradores mostraron asociaciones positivas de embarazo y tasas de recién nacido vivo entre los marcadores de reserva ovárica (FSH, cuenta folicular antral y hormona antimülleriana) y con la respuesta ovárica posterior a un tratamiento de reproducción (FIV-ICSI).8,9 Este es el motivo por el que el objetivo de este estudio fue: evaluar la utilidad clínica de la cuenta folicular antral para predecir embarazo clínico y recién nacido vivo y optimizar los resultados reproductivos en el Instituto Nacional de Perinatología (INPer).
MATERIALES Y MÉTODOS
Estudio de cohorte, retrospectivo, efectuado en el servicio de Reproducción Asistida del Instituto Nacional de Perinatología Isidro Espinosa de los Reyes, en la Ciudad de México, entre 2011 y 2016. Mediante muestreo no probabilístico se incluyeron pacientes con diagnóstico de infertilidad a quienes se efectuó un procedimiento de fertilización in vitro con transferencia de embriones en fresco. Se excluyeron las pacientes con expediente incompleto, transferencia de embriones congelados y quienes no continuaron el control prenatal en el Instituto Nacional de Perinatología. Los valores de los marcadores de reserva ovárica no fueron un criterio para excluir a las pacientes del estudio.
El seguimiento folicular lo llevó a cabo un ginecoobstetra con especialidad en Biología de la reproducción humana, con un ultrasonido Philips HD II, un transductor transvaginal de 8 MHz. Los folículos antrales se midieron durante la fase folicular temprana (entre el día 2 y 3 del ciclo menstrual). Solo se tomaron en cuenta los folículos que midieron entre 3 y 8 mm, el tamaño se calculó a partir del diámetro interno del área anecogénica.
La estimulación ovárica se efectuó mediante protocolos con antagonista flexible GnRH y agonistas GnRH; la estimulación se inició con gonadotropinas el día 3 del ciclo. Se hizo una punción folicular guiada por ultrasonido entre 34 y 36 horas luego de aplicar la inyección única de hCG (Ovidrel® de 250 mcg; Merck-Serono) por vía subcutánea. La fertilización se llevó a cabo de 4 a 6 horas después de su recuperación (FIV-ICSI) y se evaluó 18 horas más tarde. En el día 3 y 5 del desarrollo embrionario se efectuó la transferencia con catéter blando de Cook (Echotip), mediante guía ultrasonográfica. La determinación de la subunidad beta de hCG se efectuó 14 días después de la transferencia. Se consideró positivo el valor mayor de 100 mUI/mL.
Para el análisis estadístico se utilizó el programa Statistic Package for Social Sciences (SPSS) de IBM versión 23. La estadística descriptiva se reportó mediante media, desviación estándar, mediana y rangos (dependiendo de la distribución). Las variables categóricas solo se reportaron en número y porcentajes. Prueba de Kolmogorov Smirnov para conocer la distribución de la población, prueba U de Mann Whitney para comparar entre grupos; para identificar el coeficiente de correlación se utilizó Rho de Spearman considerando un error alfa menor de 5% como estadísticamente significativo.
RESULTADOS
Se revisaron 1216 expedientes, pero se excluyeron 293 por no cumplir con los criterios de inclusión. El análisis del estudio se hizo con 923 ciclos (Cuadro 1). Las características demográficas (Cuadro 2) muestran una media de edad de 33.57 ± 3.63, FSH de 7.1 ± 4.3 y cuenta folicular antral de 9 ± 5. Del total de pacientes (923) hubo embarazo clínico en 31.4% (n = 290) y recién nacido vivo en 25.1% (n = 232). Al comparar (Cuadro 3) las variables estudiadas dependiendo de si hubo recién nacido vivo o no se observó significación estadística en la cuenta folicular antral (10 ± 5 p < 0.01), cantidad de folículos totales (16 ± 10 p < 0.03) y cantidad de ovocitos capturados (9 ± 6 p < 0.06).
Cuadro 2 Características demográficas
| Parámetros clínicos | Media | % n = 923 | ||
| Edad (años) | 33.57 ± 3.63 | |||
| IMC (kg/m2) | 25.411± 2.94 | |||
| CFA | 9 ± 5 | |||
| FSH basal (mUI/mL) | 7.108 ± 4.3 | |||
| Tipo de infertilidad | Primaria | 62.5% (577) | ||
| Secundaria | 37.5% (346) | |||
| Tiempo de infertilidad (años) | 6.5 ± 3.5 | |||
| Causa de infertilidad | Factor endocrino ovárico | 18.8% (167) | ||
| Factor tubo peritoneal | 24.3% (216) | |||
| Endometriosis III - IV | 2.8% (25) | |||
| Factor uterino | 2.8% (25) | |||
| Factor masculino | 3.5% (31) | |||
| Mixto | 46.0% (409) | |||
| Inexplicada | 1.9% (17) | |||
| Número de folículos totales al final de la estimulación | 15 ± 9 | |||
| Protocolo de estimulación | Antagonista | 82% (756) | ||
| Agonista largo | 7% (65) | |||
| Flare | 11% (102) | |||
| Folículos mayores de 18 mm | 5 ± 4 | |||
| Número de ovocitos capturados | 8 ± 6 | |||
| TRA utilizada | FIV | 54.9% (507) | ||
| ICSI | 45.1% (416) | |||
| Embarazo clínico (%) | 31.4% (290) | |||
| Recién nacido vivo (%) | 25.1% (232) | |||
IMC: índice de masa corporal, CFA: cuenta folicular antral, FSH: hormona folículo estimulante, TRA: técnica de reproducción asistida, FIV: fertilización in vitro, ICSI: inyección intracitoplasmática de espermatozoides.
Cuadro 3 Características demográficas de dos grupos (recién nacido)
| Recién nacido | Valor p | ||
| No (n = 691) | Si (n = 232) | ||
| Media | Media | ||
| Edad | 33.79 ± 3.67 | 32.91 ± 3.44 | 0.00 |
| IMC | 25.479 ± 3.03 | 25.209 ± 2.67 | 0.320 |
| CFA | 7 ± 5 | 8 ± 5 | 0.001 |
| FSH basal | 7.237 ± 4.68 | 6.723 ± 3.29 | 0.601 |
| Tiempo de infertilidad | 6.6 ± 3.6 | 6.2 ± 3.2 | 0.453 |
| Número de folículos totales | 14 ± 8 | 16 ± 10 | 0.003 |
| Folículos > 18 mm | 5 ± 4 | 5 ± 4 | 0.391 |
| Número de ovocitos capturados | 8 ± 5 | 9 ± 6 | 0.006 |
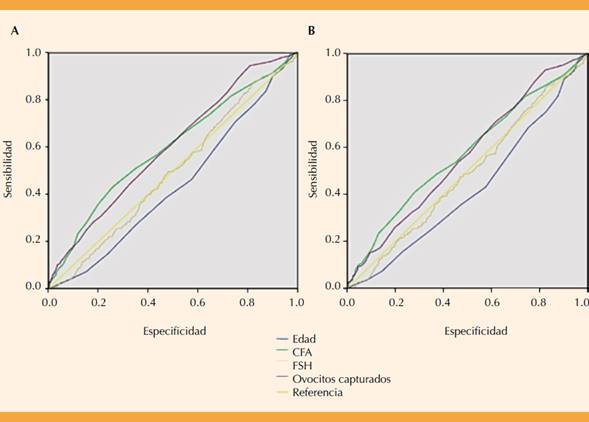
Para evaluar los valores predictivos de las variables seleccionadas para predicción de embarazo clínico y recién nacido vivo se realizó un análisis de curva ROC (receiver operating characteristic) (Figura 1). El análisis de la curva ROC (Cuadro 4) reportó que la cuenta folicular antral tiene una predicción más alta para detectar embarazo clínico (área bajo la curva (ABC) 0.59; IC95%: 0.55-0.63) en comparación con la edad (ABC 0.43; IC95%; 0.39-0.47) y FSH (ABC 0.49; IC95%: 0.45-0.53). Por lo que se refiere a recién nacido vivo (Cuadro 5), la cuenta folicular antral tiene una precisión más alta para predecir (ABC 0.57; IC95%: 0.53-0.61) en comparación con la edad (ABC 0.42; IC95%: 0.38-0.46), FSH (ABC 0.48; IC95%: 0.44-0.53) y número de ovocitos capturados (ABC 0.56; IC95%: 0.53-0.60). El valor de corte de la cuenta folicular antral para predicción de embarazo clínico y recién nacido con mayor sensibilidad y especificidad fue ≥ 8 folículos. Hubo mayor porcentaje de embarazo clínico (9%) y recién nacido vivo (10.4%) cuando la cuenta folicular antral fue ≥ 8 (Figura 2), y disminución en el porcentaje de embarazo clínico y recién nacido vivo (menos de 2.5%) cuando la cuenta folicular antral fue superior a 16 folículos antrales.
Cuadro 4 Área bajo la curva para embarazo clínico
| ABC | Valor p | IC95% | ||
| Edad | 0.438 | 0.003 | 0.399 | 0.477 |
| CFA | 0.596 | 0.000 | 0.556 | 0.637 |
| FSH basal | 0.495 | 0.821 | 0.456 | 0.535 |
| Número de ovocitos capturados | 0.599 | 0.000 | 0.561 | 0.638 |
Cuadro 5 Área bajo la curva para recién nacido vivo
| ABC | Valor p | IC95% | ||
| Edad | 0.423 | 0.000 | 0.381 | 0.465 |
| CFA | 0.575 | 0.001 | 0.531 | 0.618 |
| FSH basal | 0.489 | 0.600 | 0.446 | 0.531 |
| Ovocitos | 0.560 | 0.003 | 0.518 | 0.602 |

Figura 2 Porcentaje de embarazo clínico y recién nacido vivo dependiendo de la cuenta folicular antral.
Los coeficientes de correlación de Spearman (Figura 3) entre los marcadores de reserva ovárica mostraron una correlación de la cuenta folicular antral con FSH y edad, y correlación entre la cuenta folicular antral y el número de ovocitos capturados (p = 0.001). Al comparar las características demográficas (Cuadro 6) de dos grupos tomando en cuenta una cohorte folicular inferior o igual a siete folículos antrales y el otro grupo más o igual a ocho folículos antrales; ambos grupos mostraron significación estadística (p < 0.05) al comparar la edad (33.22 ± 3.61), FSH (25.51 ± 2.92) y cantidad de ovocitos capturados (10 ± 6) en el grupo de ≥ 8 folículos. Por lo que hace al embarazo clínico y recién nacido vivo se reporta una tasa de embarazo mayor cuando la cuenta folicular es superior superior a 8 folículos (35.8% para embarazo clínico y 28.1% para recién nacido vivo).

Figura 3 Diagramas de correlación (Spearman). A) FSH y correlación con CFA B) Edad y correlación con CFA C) Ovocitos capturados y correlación con cuenta folicular antral.
Cuadro 6 Características demográficas de dos grupos
| Variable | Cuenta de folículos antrales | ||||
| ≤ 7 | ≤ 8 | ||||
| Media | n = 393 (%) | Media | n = 530 (%) | ||
| Edad | 34.04a ± 3.57 | 33.22b ± 3.61 | |||
| IMC | 25.269a ± 2.97 | 25.517b ± 2.92 | |||
| FSH basal | 7.970a ± 5.371 | 6.46 b ± 3.32 | |||
| Folículos mayores de 18 mm | 4a ± 3 6b ± 4 | 6b ± 4 | |||
| Ovocitos capturados | 6a ± 4 | 10b ± 6 | |||
| Embarazo clínico | 100a (25.4%) | 190b (35.8%) | |||
| Recién nacido vivo | 83a (21.1%) | 149b (28.1%) | |||
Nota: los valores de la misma fila y subtabla que no comparten el mismo subíndice son significativamente diferentes en p< 0.05
El cálculo de riesgo dependiendo de la cuenta folicular antral (Cuadro 7) tuvo una disminución de 39% (RM 0.61; IC95%: 0.45-0.81) para embarazo clínico y de 32% (RM 0.68; IC95%: 0.50-0.93) para recién nacido vivo cuando la cuenta folicular antral fue inferior a 8 folículos antrales; cuando la cuenta folicular antral fue igual a 8 folículos hubo aumento de 63% (RM 1.63; IC95%: 1.22-2.18) para embarazo clínico y 46% (RM 1.46; IC95%: 1.07-1.98) para recién nacido vivo.
Cuadro 7 Riesgo estimado de embarazo clínico y recién nacido vivo dependiendo de la cuenta folicular antral
| Variable | RM | IC95% | |
| ≤ 7 CFA | |||
| Embarazo clínico | 0.611 | 0.458 | 0.815 |
| Recién nacido vivo | 0.685 | 0.503 | 0.931 |
| ≥8 CFA | |||
| Embarazo clínico | 1.637 | 1.227 | 2.184 |
| Recién nacido vivo | 1.461 | 1.074 | 1.986 |
Para controlar las otras variables independientes y predecir embarazo clínico y recién nacido se utilizó un modelo de regresión logística binario. La cuenta folicular antral fue la única variable con significación (p < 0.011) y razón de momios de 1.045 (IC95%: 1.010-1.081) para predecir embarazo clínico, el resto de las variables no mostró significación estadística (Cuadro 8). En cuanto a recién nacido vivo se aprecia que la cuenta folicular antral (p < 0.027) se predice con una razón de momios de 1.049 (IC95%: 1.005-1.094). Cuadro 9
Cuadro 8 Regresión logística para embarazo clínico
| Variable | Valor p | RM | IC95% | |
| Inferior | Superior | |||
| Edad | .170 | .972 | .934 | 1.012 |
| IMC | .311 | .975 | .929 | 1.024 |
| CFA | .011 | 1.045 | 1.010 | 1.081 |
| FSH basal | .799 | 1.005 | .970 | 1.040 |
| Tiempo de infertilidad | .106 | .966 | .926 | 1.007 |
| Folículos totales | .089 | 1.023 | .997 | 1.050 |
| Ovocitos > 18 mm | .886 | .997 | .957 | 1.039 |
| Ovocitos capturados | .435 | 1.015 | .978 | 1.054 |
Cuadro 9 Regresión logística para recién nacido
| Variable | Valor p | RM | IC95% | |
| Inferior | Superior | |||
| Edad | .019 | .958 | .925 | .993 |
| IMC | .235 | 1.032 | .980 | 1.087 |
| CFA | .027 | 1.049 | 1.005 | 1.094 |
| FSH basal | .548 | 1.012 | .973 | 1.052 |
| Tiempo de infertilidad | .118 | 1.037 | .991 | 1.085 |
| Folículos totales | .337 | .987 | .961 | 1.014 |
| Folículos > 18 mm | .163 | 1.032 | .987 | 1.079 |
| Ovocitos capturados | .675 | .991 | .953 | 1.032 |
DISCUSIÓN
Para optimizar el resultado exitoso de los ciclos de FIV es necesario hacer una evaluación adecuada de la reserva ovárica e identificar las estrategias de tratamiento para mejorar los resultados y las tasas de embarazo.10 En la actualidad, aún existe la pregunta de cuál de estos marcadores de reserva ovárica tiene el valor más poderoso para predecir embarazo clínico y recién nacido vivo. Por ahora no se dispone de un consenso para señalar los predictores clínicamente más relevantes y los factores en los que debe basarse la decisión de iniciar el tratamiento o no y el tipo de tratamiento.2
Tanto la hormona antimülleriana como la cuenta folicular antral tienen el mejor valor predictivo para respuesta ovárica y ovocitos capturados; por esto son indicadores de la posible tasa de embarazo y recién nacido vivo en mujeres que reciben técnicas de reproducción asistida.11 En este estudio se evaluó la cuenta folicular antral como predictor de embarazo clínico y recién nacido para poder normar conductas en comparación con otras variables identificadas.
El estudio mostró la importancia de la cuenta folicular antral para predecir embarazo clínico y el nacimiento vivo superior a otros marcadores de reserva ovárica, como la edad y FSH basal mediante el análisis de la curva ROC y el análisis de regresión logística binaria. El área bajo la curva de la cuenta folicular antral se reportó en 0.59 para embarazo clínico y 0.57 para recién nacido vivo, resultado similar a lo publicado por Lee y colaboradores y Broer donde ellos reportan un área bajo la curva de 0.65 y 0.50.2,3,4
Se identificó el valor de corte de la cuenta folicular antral con mayor porcentaje de embarazo clínico y recién nacido vivo superior a 8. El resultado está alineado con los estudios previos reportados en la bibliografía (criterios de Bologna) que revelaron el valor de corte de la cuenta folicular antral de menos de 5-711 para predecir baja respuesta ovárica. Cuando la cuenta folicular antral fue superior a 8, la probabilidad de conseguir un embarazo clínico fue superior a 63% y para recién nacido 46%.
Por lo que se refiere a la cuenta folicular antral y la respuesta ovárica existe una correlación con los ovocitos capturados, demostrada en el diagrama de Spearman (p = 0.001) donde se observa que a mayor cantidad de folículos antrales, mayor cantidad de ovocitos capturados posterior a la estimulación (Follicular Output Rate).12 El área bajo la curva de los ovocitos capturados (0.59) es similar a la cuenta folicular antral para predecir embarazo clínico. En el grupo de ≥ 8 folículos antrales la cantidad de ovocitos capturados fue mayor.
Sunkara y su grupo sugieren que la cantidad de ovocitos capturados para maximizar la tasa de nacido vivo es de 15 y que existe una disminución de la tasa cuando se tienen más de 20 ovocitos.13) Este valor de la cantidad de ovocitos ya había sido reportado en México en 2008 por Kably y colaboradores14 y en 2017 por López y sus coautores.15 En nuestro estudio no se evaluaron los ovocitos capturados pero se demostró que cuando se tiene una cuenta folicular antral superior a 16 folículos antrales, la tasa de embarazo clínico y recién nacido vivo disminuye.
Posterior a la regresión logística y controlar las otras variables independientes,16,17) la asociación significativa entre cuenta folicular antral y embarazo clínico se mantuvo (RM 1.045; IC95%: 1.010-1.081 p = 0.11) y en recién nacido se mantuvo la cuenta folicular antral (RM 1.049; IC95%: 1.005-1.094; p = 0.270) y la edad (RM 0.950; IC95%: .924-.993; p = 0.019).
La limitación de este estudio es su carácter retrospectivo y los diferentes protocolos de estimulación. Sin embargo, considerando que no se ha publicado ningún estudio en México acerca del papel de la cuenta folicular antral en la predicción de nacido vivo, el estudio es valioso en este campo. Además, el problema con la medición de la cuenta folicular antral y la variación entre observadores se redujo porque las mediciones las efectuaron médicos con especialidad en Medicina de la Reproducción.
CONCLUSIONES
El estudio demuestra que la cuenta folicular antral es útil para predecir embarazo clínico y recién nacido, superior a otros marcadores de reserva ovárica. Sin embargo, los niveles predictivos son, en general, bajos, y el valor predictivo de la cuenta folicular antral y la edad fueron similares para recién nacido. Se espera un porcentaje mayor de embarazo clínico y recién nacido vivo cuando la cuenta folicular antral es superior a 8 folículos. Esta información es decisiva durante el asesoramiento a mujeres que recibirán tratamiento de reproducción asistida y, también, es útil para predecir un pronóstico favorable y establecer una estrategia de tratamiento individualizado.











 nueva página del texto (beta)
nueva página del texto (beta)