Antecedentes
En casos de ruptura prematura membranas las complicaciones pueden ser maternas o fetales. Desde el punto de vista materno existe mayor riesgo de corioamnioitis clínica (13-60%),1,2 infección posparto (2-13%) y desprendimiento prematuro de placenta (4-12%); la sepsis materna es una complicación rara (1%).1,2 El neonato tiene mayor riesgo de dificultad respiratoria (complicación más frecuente), sepsis, hemorragia intraventricular, enterocolitis necrotizante y de compresión del cordón, en caso de anhidramnios. 1,2
El diagnóstico se establece con base en la historia clínica sugerente de ruptura prematura de membranas, junto con la visualización de la salida de líquido amniótico, que en 80-90% de los casos se evidencia enseguida de la colocación del espéculo.1,2 En cerca de 90% de los casos el diagnóstico se confirma con base en la historia clínica y el examen físico; a pesar de ello en el resto es dudoso.
Prueba de nitrazina: consiste en evaluar el pH de las paredes vaginales o fondo de saco posterior. La prueba de nitrazina es precisa en 90% de los casos; con resultados falsamente positivos en 17% de las pruebas.5,10 Para tener valor debe efectuarse en las siguientes cuatro horas a la ruptura de membranas, después de este tiempo disminuye su especificidad.3,4,5
La instilación intraamniótica de fluoresceína o de índigo carmín tiene una sensibilidad de 90.7% y especificidad de 77.2%.4,5 Si en la vagina se detecta fluoresceína a los 30-60 minutos, se confirma el diagnóstico de ruptura prematura de membranas. Se trata de una prueba invasiva con 1% de complicaciones.4,5
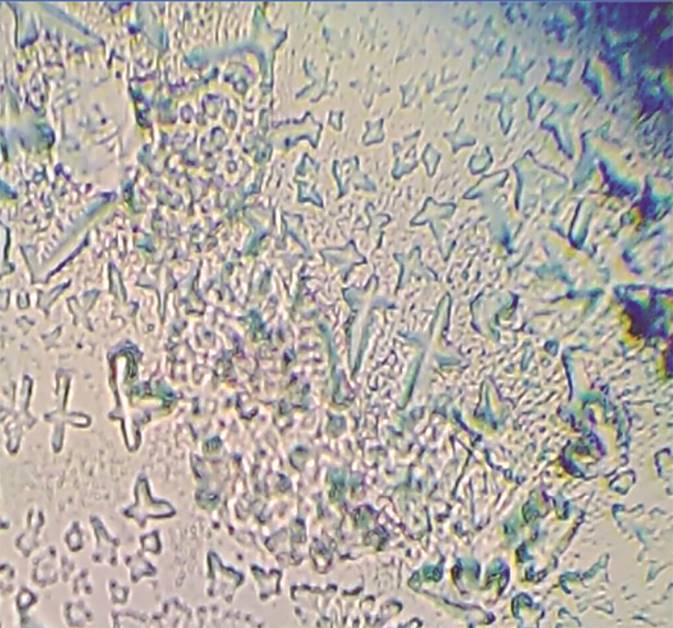
La cristalografía consiste en dejar secar el frotis vaginal, colocado en un portaobjetos que seca a temperatura ambiente. El líquido amniótico produce una cristalización microscópica en un patrón de “helecho” que se observa al microscopio. Este método tiene una sensibilidad de 87% y especificidad de 92%;2 confirma con toda precisión la ruptura prematura de membranas en 85 a 98% de los casos, con falsos negativos (5-10%) que pueden ocurrir por contaminación con sangre, semen o huellas digitales en la laminilla6 y resultados falsamente positivos si se recoge moco cervical, que también cristaliza “en helecho” pero normalmente lo hace en un patrón más “floral”. La prueba de cristalización no se afecta por meconio, cambios del pH vaginal y relaciones de sangre-líquido amniótico de hasta 1:5. Cuando el tiempo de latencia de la ruptura prematura de membranas es mayor de 4 horas, la prueba puede resultar falsa negativa.
Ecografía: para valorar la edad gestacional, el peso fetal, la presentación fetal e índice de líquido amniótico se establece una documentación ecográfica,7 con escasas sensibilidad y especificidad.8 Determinación de parámetros bioquímicos: La Insulin-like growth factor binding protein-1 (IGFBP-1; Actim PROM test Amnioquick): es una proteína sintetizada en el hígado del feto y en la decidua. Se encuentra en grandes concentraciones en el líquido amniótico y mínimas en la sangre materna. Su sensibilidad varía de 74-100% y su especificidad de 77-98%.9,10
La PAMG-1 (Placental alpha microglobulin 1; AmniSure®) es una glicoproteína de 34 kDa producida por la decidua. Su concentración en el líquido amniótico es de entre 2000 a 25000 ng/mL, mientras que en la sangre materna no supera los 2 ng/mL.11 En casos seleccionados, cuando el diagnóstico de ruptura prematura de membranas no es evidente, la bibliografía recomienda la prescripción de alfa microglobulina-1 placentaria porque proporciona información adicional para el tratamiento adecuado.2,12 Esta prueba tiene una sensibilidad de 98% y especificidad de 99%.13
El diagnóstico oportuno de la ruptura de membranas es fundamental para evitar complicaciones y mejorar el pronóstico de la madre y su feto. En algunos casos, el diagnóstico es difícil de documentar por las microrrupturas de membranas, cervicovaginitis o hidrorrera, por lo que es necesario recurrir a otros métodos diagnósticos complementarios a la clínica. Es decisivo identificar qué prueba es la más específica para ofrecer mejor calidad en la atención médica.
El objetivo de este estudio fue: comparar la eficacia de la prueba α-microglobulina-1 placentaria (AmniSure®) versus la cristalografía como método diagnóstico de ruptura de membranas en situaciones clínicas que modifican el resultado debido al gel lubricante, vaginosis bacteriana, sangre y escurrimiento genital anormal.
Materiales y métodos
Estudio prospectivo, cuasi experimental y exploratorio, efectuado en pacientes embarazadas atendidas en el Hospital General de México, con sospecha de ruptura prematura de membranas. El tamaño de la muestra se calculó con el programa estadístico GPower 3.0.10, aplicado para tablas de contingencia, con un tamaño del efecto de 0.8, un error alfa de 0.05, poder estadístico de 85%, con un estudio de muestra calculado de 20 pacientes.
Criterios de inclusión: pacientes embarazadas con sospecha de ruptura prematura de membranas, independientemente de la edad gestacional, pacientes con ruptura de membranas acompañada de sangrado, cervicovaginitis, hidrorrea y que fueron revisadas con gel lubricante y quienes tenían datos de corioamnioitis.
Criterios de exclusión: pacientes en quienes fue difícil la toma de las pruebas por trastornos psiquiátricos que impidieron la exploración vaginal, con sospecha de ruptura de membranas pero con emergencia obstétrica y quienes no aceptaron la realización de las pruebas.
Criterios de eliminación: pacientes con patología crítica una vez efectuadas las pruebas y que no fue posible complementar el estudio
En caso de no tener factores modificadores de resultado como sangrado o cervicovaginitis se tomó una cristalografía inicial y, posteriormente, se administró un factor modificador de efecto, con un gel lubricante en la exploración vaginal. La prueba de cristalografía se repitió y efectuó la de α-microglobulina-1 placentaria.
La toma inicial de la cristalografía solo se efectuó para el diagnóstico de la paciente; no se tomó en cuenta para el análisis estadístico. Luego de la terminación del embarazo se estableció si la paciente concluyó con ruptura prematura de membranas por ausencia de líquido amniótico durante el trabajo de parto.
El análisis estadístico se llevó a cabo con el programa SPSS; se usó estadística descriptiva (media, mediana, moda, rango, simetría, y curtosis) y se efectuó estadística inferencial con tablas de contingencia para determinar: sensibilidad, especificidad, valor predictivo positivo y valor predictivo negativo y cristalografía vs la prueba de α microglobulina-1 placentaria.
Resultados
Se efectuaron 20 pruebas con AmniSure® de las que se descartó una toma por deficiencia en la técnica. El total de la muestra fue de 19 pacientes; las medias fueron: edad 25.9 años, embarazos 2, edad gestacional 35.1 y del tiempo de ruptura 10 horas. Cuadro 1
Cuadro 1 Características generales
| n | Rango | Mínimo | Máximo | Media | Desviación estándar | Varianza | |
|---|---|---|---|---|---|---|---|
| Embarazos | 19 | 4 | 1 | 5 | 2.00 | 1.000 | 1.000 |
| Horas de ruptura prematura de membranas | 19 | 72 | 0 | 72 | 10.32 | 18.361 | 337.117 |
| Edad | 19 | 24 | 17 | 41 | 25.95 | 7.137 | 50.942 |
| Edad gestacional | 19 | 25 | 16 | 41 | 35.17 | 7.148 | 51.093 |
| N válido (por lista) | 19 |
El diagnóstico de ruptura se contrastó con el resultado de la prueba; para este propósito se construyeron tablas de contingencia para pruebas diagnósticas.
El diagnóstico de ruptura de membranas establecido mediante cristalografía versus la medición de α microglobulina-1 placentaria tuvo una sensibilidad de 85.7% (63.8-100.00), especificidad de 100% (90.0-100.0), índice de validez de 89.4% (73.0-100.0), valor predictivo positivo de 100% (95.83-100.0) y valor predictivo negativo de 71.4% (30.8-100.0). La cristalografía tuvo sensibilidad de 78.5% (53.5-100.0), especificidad de 100% (90.0-100.0), índice de validez de 84.2% (65.1-100.0), valor predictivo positivo de 100% (95.4-100.0) y valor predictivo negativo de 62.5% (22.7-100.0). Para ambos casos se obtuvo prueba exacta de Fisher, por el número de muestra para significación estadística (p = 0.0018).
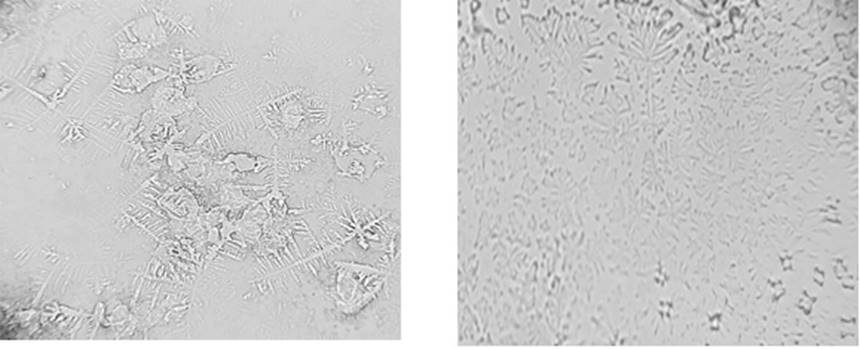
En la Figura 1 se muestra la comparación de los resultados de la cristalografía posterior al uso de jalea lubricante; en algunas muestras se observan helechos fragmentados. Se consideró muestra negativa en comparación con la de helechos bien formados (Figura 2), que se consideró positiva para nuestro estudio.
Se enumeran tres ejemplos de la medición de α-microglobulina-1 placentaria. En la Figura 3 se advierte la positividad de la prueba, con dos líneas (una de control y otra que reporta positividad). La Figura 4 muestra que las líneas se colorean de un color tenue y se cataloga positiva y en la Figura 5 solo se colorea la línea de control de la prueba, por eso se cataloga negativa.

Figura 4 Medición de α-microglobulina-1 placentaria con resultado tenue que debe clasificarse positivo.
Discusión
La α-microglobulina-1 placentaria se aisló en 1975, a partir de líquido amniótico por D. Petrunin y se denominó, originalmente, alfa-1 globulina específica de la placenta.14 La α-microglobulina-1 placentaria (PAMG-1) se encuentra en la sangre, en el líquido amniótico y flujo cervicovaginal de las mujeres embarazadas. La concentración es de varios miles de magnitudes más alta que la que se encuentra en el flujo vaginal en mujeres embarazadas cuando la membrana fetal está intacta. La PAMG-1 se encuentra en el líquido amniótico a lo largo de los tres trimestres del embarazo.15
Según los datos publicados AmniSure® tiene un límite de detección de la PAMG-1 de 5 ng/mL, con sensibilidad reportada entre 99% de exactitud2,3,4,5,6,7,8,9,10,11,12,13,14,15,16 porque detecta cantidades minúsculas de líquido amniótico en el flujo vaginal,17 con una especificidad que varía de 87-100%.9,18 Algunas investigaciones han demostrado que la coexistencia de sangre, semen y orina no altera los resultados de esta prueba.6 Su gran ventaja es que los resultados se valoran en minutos y sirve para el diagnóstico de casos difíciles, como las microrrupturas. No se necesitan materiales extras como: equipos, reactivos adicionales o el uso de un espéculo vaginal para poder realizarla, además de que es la primera prueba de inmunoensayo para ruptura prematura de membranas aprobada por la FDA.19,20
El diagnóstico de ruptura de membranas es de gran importancia médica porque cuando es adecuado es indicación de hospitalización para determinar el plan terapéutico, que dependerá de la edad gestacional a la que se diagnostica. Un resultado falso positivo puede dar lugar a tratamientos innecesarios: esteroides, antibióticos, hospitalización o la inducción de trabajo de parto. Muchas de las pruebas mencionadas tienen limitaciones, son invasivas o su costo es elevado, circunstancias que dificultan su aplicación en muchos hospitales, además de que son operador-dependientes y es necesario tener experiencia para su interpretación.
AmniSure® es una prueba rápida, no invasiva, que ayuda al diagnóstico de ruptura prematura de membranas en caso de sospecha. Establece un diagnóstico fácil de interpretar, exacto y a tiempo que permite que el médico tome las medidas adecuadas para evitar complicaciones.21
La medición de α-microglobulina-1 placentaria no requiere otro equipo extra para poder efectuar el examen. Se requiere un hisopo o una torunda estéril que se introduce 5 a 7 cm en la vagina, se carga la muestra de líquido amniótico en el algodón y se introduce en un amortiguador, donde son liberadas las proteínas y, posteriormente, se coloca una tira reactiva, que da el resultado en cuestión de minutos. Productos como ROM Plus® y Actim PROM® probaron la proteína de unión al factor de crecimiento similar a la insulina (IGFBP-1). La precisión global se mejoró en comparación con nitrazina, la cristalografía y otros métodos de prueba; sin embargo, los resultados falsos positivos y falsos negativos siguen siendo una preocupación. AmniSure® utiliza los principios de inmunocromatografía para detectar la proteína PAMG-1 humana que se encuentra en el líquido amniótico. Con 99% de precisión, AmniSure® representa un refinamiento adicional de las pruebas de biomarcadores no invasivos para la ruptura prematura de membranas.
En este ensayo se encontró que AmniSure® tiene mayor sensibilidad para el diagnóstico de ruptura de membranas en pacientes con diagnóstico incierto, por lo que se considera una muy buena prueba en relación con la cristalografía. Otros trabajos han concluido que ambas pruebas tienen buena sensibilidad y pudieran ser una alternativa fácil, sencilla y no invasiva para el diagnóstico.
En virtud del alto rendimiento de la prueba debiera considerarse la inicial ante la duda de ruptura de membranas, sobre todo en embarazos pretérmino, por su alto valor predictivo positivo. Es indudable que el tamaño de muestra de este estudio es limitado; aun a pesar de ello los resultados indican que de haber tenido más casos las ventajas hubieran sido mayores porque disminuyen los innumerables exámenes de control de pacientes sin certeza de integridad de las membranas amnióticas.
Conclusiones
En la actualidad, a pesar de la amplia gama de pruebas complementarias para detectar la posible ruptura prematura de membranas, todas tienen limitaciones. Por esto, elegir la más accesible, rápida y efectiva en una sola prueba es imprescindible para la atención médica. Al comparar la efectividad de α-microglobulina-1 placentaria versus la cristalografía se encontró mayor sensibilidad con la primera. Por tanto, es un método con mayor efectividad para detectar ruptura de membranas, independientemente de la edad gestacional o la coexistencia de factores que modifican el resultado. Ambas pruebas reportaron 100% de especificidad.











 nova página do texto(beta)
nova página do texto(beta)