ANTECEDENTES
La displasia mesenquimatosa es una enfermedad vascular de la placenta de muy baja frecuencia que originalmente la describieron Moscoso y su grupo en 1991.1 Se caracteriza por placentomegalia y vesículas en forma de racimo de uvas.2 La incidencia es de 0.02% de todos los embarazos.3 El diagnóstico de confirmación es anatomopatológico2 y, por su similitud ecográfica, el diagnóstico diferencial se establece con la mola parcial.4 Sus efectos adversos en el embarazo son restricción del crecimiento intrauterino, muerte intrauterina, parto pretérmino e hipertensión gestacional.4 Por esto es necesaria la vigilancia obstétrica estrecha e inducir el parto en la semana 37 o antes si fuera necesario.
CASO CLÍNICO
Paciente de 31 años, ansiosa tratada con lorazepan desde hacía siete años; cuando se enteró que estaba embarazada dejó ese fármaco. Declaró no tener antecedentes quirúrgicos ni alérgicos ni tomar otros medicamentos. Era fumadora de 10 cigarrillos al día y no ingería alcohol.
Antecedentes ginecoobstétricos: dos embarazos con un parto eutócico, a término. La analítica del primer trimestre del actual embarazo fue normal con serologías negativas, excepto rubéola inmune (IgM negativa e IgG positiva). En la ecografía de la semana 12 se evidenció una imagen de 14 x 20 mm con múltiples imágenes econegativas en su interior, con escasa captación de doppler color, sospechándose mola parcial o displasia mesenquimatosa de placenta. Figura 1.
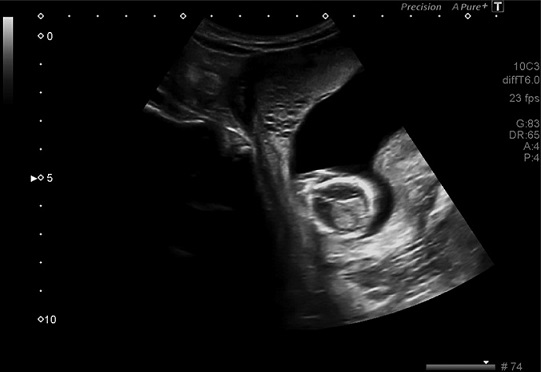
Figura 1 Ecografía de las 12 semanas; revela una imagen que mide 14 x 20 mm y múltiples imágenes anecoicas en su interior.
En la semana 16+4 se decidió realizar amniocentesis para estudio de cariotipo fetal y biopsia corial de dicha zona para estudio anatomopatológico y cariotipo de la placenta. La amniocentesis fue informada como cariotipo femenino normal: 46XX. El cariotipo de la placenta fue informado como patrón compatible con una disomía uniparental-duplicación paterna de la región 11p15.5, mediante estudio genómico de la misma. En ningún momento se hizo estudio genético de los progenitores.
El estudio patológico se informó como displasia mesenquimatosa placentaria. En la ecografía de la semana 20 se apreció un feto normal, sin anomalías aparentes, sin visceromegalias. Se seguía apreciando el área de ecogenicidad mixta de 20 x 40 mm sin aumento de la vascularización, congruente con la displasia mesenquimatosa. (Figura 2) La analítica del segundo trimestre de embarazo fue normal.

Figura 2 Ecografía de las 20 semanas de gestación; queda de manifiesto el área de ecogenicidad mixta con diámetro de 20 x 40 mm.
Debido a las complicaciones obstétricas descritas (restricción del crecimiento intrauterino, muerte intrauterina, parto pretérmino e hipertensión gestacional) con esta patología placentaria, se decidieron realizar, por tanto, controles ecográficos cada dos semanas a partir de las 24 semanas. Desde la semana 33 de gestación se evidenció un feto con restricción del crecimiento intrauterino con pruebas de bienestar fetal y doppler normales y disminución del tamaño de la formación placentaria previamente descrita hasta hacerse indetectable en la semana 36 de gestación.
El parto se indujo a las 37 semanas, con auxilio de una ventosa metálica para aliviar la expulsión del feto femenino que pesó 2800 g, con Apgar 9-9. En la actualidad el recién nacido permanece sano.
DISCUSIÓN
La displasia mesenquimatosa placentaria es una anomalía vascular de la placenta que se caracteriza por placentomegalia y vesículas en forma de racimo de uvas.2
La incidencia es de 0.02% de las gestaciones, con una relación mujer-hombre de 2:3.3 Sin embargo, la verdadera incidencia es difícil de determinar debido a que la mayor parte de las placentas que se analizan solo son las que tuvieron alguna complicación del embarazo en la que se sospecha alguna anomalía placentaria y, además, no todos los anatomopatólogos reconocen una displasia mesenquimatosa.4
Hay varias teorías etiopatogénicas que tratan de explicar la displasia mesenquimatosa placentaria, como la malformación congénita del mesodermo,5 alteración molecular de los genes del cromosoma 11p15.5 asociado con el síndrome de Beckwith-Wiedemann y mosaicismo androgenético-biparental que fue el que presentaba nuestra paciente.6 Recientemente, Kaiser-Rogers y colaboradores propusieron un mosaicismo androgenético-biparental como factor etiológico de displasia mesenquimatosa placentaria.6 Este fenómeno resulta de la falla en la replicación del genoma materno antes de la primera división mitótica, con duplicación normal y segregación del genoma paterno, resultando en dos células hijas, una con genes biparentales normales (diploide) y la otra solo con genes paternos (haploide), que posteriormente, mediante un proceso de endorreduplicación, produce una línea celular diploide androgenética que simula parcialmente lo que acontece en la mola hidatiforme completa. Aparentemente esta línea celular participaría en el desarrollo del mesodermo6,7 lo que explicaría las alteraciones del mesénquima placentario y los hamartomas en el feto. Dado que la línea celular 46 YY androgénica es incompatible con la vida, el fenómeno de mosaicismo también puede explicar el predominio de recién nacidos de sexo femenino asociado con displasia mesenquimatosa placentaria.
Los resultados obstétricos van desde un feto sano con una gestación de curso normal (9%) a complicaciones maternas o fetales.2,4,8 Se ha descrito asociación con el síndrome de Beckwith-Wiedemann (macrosomía, macroglosia, onfalocele, visceromegalia interna, placentomegalia y aumento de la susceptibilidad a tumores) en 23% de los casos9 de tumores mesenquimatosos hepáticos10 y anemia (por la hipervascularización) y trombopenia (por la coagulopatía de consumo) que pueden llegar a causar hemorragias fetales, como la cerebelar.8,11 Otras complicaciones descritas son restricción del crecimiento uterino en 33%, muerte intrauterina en 13%, parto pretérmino en 33% e hipertensión gestacional en 9%.4 Lo más probable es que esto se deba a la inapropiada circulación de la sangre fetal en las malformaciones vasculares y a una hipoxia crónica como resultado de la trombosis de los vasos de las vellosidades coriales y a una reducción de de su capacidad funcional.2
Los hallazgos ultrasonográficos más comunes son: placenta aumentada de tamaño (50%) y quística (80%) con vasos coriónicos dilatados.4 No obstante, el diagnóstico de confirmación es anatomopatológico después del parto o a través de biopsia corial, tal y como realizamos nosotros. En la anatomía patológica se apreciaría, por tanto, hiperplasia mesenquimatosa y edema de las vellosidades coriales que contienen vasos con paredes engrosadas. Lo más característico es la ausencia de hiperplasia del trofoblasto que es fundamental para el diagnóstico diferencial de mola parcial y pseudomola.2,11
Lo más frecuente es que la AFP se encuentre elevada2,4 y la HCG en rango normal, aunque se ha documentado que ésta última puede estar elevada en 38% de los casos.4 La razón por la que la AFP se encuentra aumentada en la sangre materna se debe al aumento del tamaño de la placenta y a la alteración de la pared de los vasos sanguíneos que se encuentran en las vellosidades coriales.2
El diagnóstico diferencial es amplio y debe hacerse con la mola parcial (más frecuente), mola completa coexistente con un feto sano, corioangioma, hematoma subcoriónico y aborto espontáneo con cambios hidrópicos.2,4
Debe practicarse una amniocentesis o una biopsia corial para confirmar un cariotipo normal y, así, poder excluir una mola parcial que se mostraría con una triploidia, muy raro en la displasia mesenquimatosa placentaria porque lo más frecuente es que ésta tenga un cariotipo normal.4
La atención médica de esta displasia debe incluir la monitorización continua del bienestar del feto que garantice que no habrá más adversidades, con ecografías prenatales con control del peso fetal y doppler fetal cada dos semanas a partir de la semana 24.12,13,14
CONCLUSIONES
El diagnóstico de la displasia mesenquimatosa placentaria requiere seguimiento estrecho del embarazo e inducir su finalización entre las semanas 37-38 para aminorar las complicaciones perinatales. La displasia mesenquimatosa se relaciona con resultados obstétricos adversos. El diagnóstico se sospecha cuando en la ecografía se advierte placentomegalia con áreas quísticas y una AFP elevada. Además, se debe obtener un cariotipo para poder descartar una mola parcial que es el principal diagnóstico diferencial de esta entidad, que cursa con triploidias. Además, es preciso el estudio detallado de la anatomía fetal para descartar visceromegalias. Por último, la placenta debe enviarse para estudio anatomopatológico después del nacimiento.











 nueva página del texto (beta)
nueva página del texto (beta)


